La prophylaxie préexposition (PrEP) du virus de l’immunodéficience humaine (VIH) consiste en l’utilisation, à titre préventif, de médicaments antirétroviraux par une personne non infectée par le VIH mais à risque de contracter cette infection. Au même titre que d’autres interventions de prévention, traitement antirétroviral des personnes infectées par le VIH (TasP ; undetectable = untransmittable), traitement postexposition (TPE), utilisation de préservatifs, dépistage et traitement des infections sexuellement transmissibles (IST), la PrEP s’inscrit dans une stratégie globale de prévention diversifiée dont elle représente aujourd’hui un outil majeur.1
En termes d’efficacité, la PrEP obtient d’excellents résultats
Plusieurs essais cliniques randomisés ont démontré l’efficacité de la combinaison antirétrovirale fumarate de ténofovir disoproxil-emtricitabine (TDF-FTC, Truvada), utilisée dans le cadre de la PrEP avec d’excellents résultats, atteignant jusqu’à 86 % de réduction de l’incidence de l’infection à VIH dans des populations clés, à haut risque d’exposition.2-4
De récentes données, issues d’une étude en cours menée en Île-de-France sur plus de 3 000 personnes, ont validé l’efficacité et la bonne tolérance en « vie réelle » de la PrEP, avec une incidence du VIH à 22 mois de 1,1/1 000 participants-années (étude Prévenir, de l’Agence nationale de recherches sur le sida et les hépatites virales [ANRS]).5
De récentes données, issues d’une étude en cours menée en Île-de-France sur plus de 3 000 personnes, ont validé l’efficacité et la bonne tolérance en « vie réelle » de la PrEP, avec une incidence du VIH à 22 mois de 1,1/1 000 participants-années (étude Prévenir, de l’Agence nationale de recherches sur le sida et les hépatites virales [ANRS]).5
La PrEP est-elle coût-efficace ?
Parallèlement aux essais cliniques d’efficacité de la PrEP, des études médico-économiques ont été menées et ont démontré un réel bénéfice en termes de rapport coût/efficacité. Très rapidement en France, les autorités sanitaires ont rendu la PrEP disponible en recommandation temporaire d’utilisation (RTU, janvier 2016) puis ont accordé une extension de son autorisation de mise sur le marché dans cette indication (AMM, mars 2017). Dès lors, les assurés sociaux ainsi que les personnes étrangères bénéficiant de l’aide médicale d’État (AME) bénéficient d’un remboursement intégral du médicament. La mise sur le marché de génériques TDF-FTC améliore d’autant plus les résultats des études coût/efficacité que leur prix mensuel est d’environ 176 euros (versus 346 euros pour le médicament princeps).
Quelles sont les populations ciblées ?
La PrEP s’adresse aux adultes et adolescents de plus de 15 ans exposés à un haut risque de contracter le VIH. Les populations concernées sont majoritairement des hommes ayant des rapports sexuels avec des hommes (HSH), des personnes transgenres et, dans une moindre proportion, des personnes en situation de prostitution exposées à des rapports sexuels non protégés ou des personnes en situation de vulnérabilité.
Ces indications sont actuellement discutées, avec comme objectif leur élargissement à des populations moins à risque. En revanche, la PrEP n’est pas indiquée pour les couples stables au sein desquels le ou la partenaire est infecté(e) par le VIH et dont la charge virale est indétectable (ARN plasmatique du VIH inférieur à 50 copies/mL).
Ces indications sont actuellement discutées, avec comme objectif leur élargissement à des populations moins à risque. En revanche, la PrEP n’est pas indiquée pour les couples stables au sein desquels le ou la partenaire est infecté(e) par le VIH et dont la charge virale est indétectable (ARN plasmatique du VIH inférieur à 50 copies/mL).
Qui est sous PrEP ?
En France, plus de 32 000 personnes ont pu bénéficier de ce dispositif depuis 2016.6 Néanmoins, son utilisation sur le territoire national demeure inégale, avec un accès facilité dans les grandes villes, au détriment de plus petites agglomérations ou encore des territoires d’outre-mer.
Comment prescrire et surveiller la PrEP ?
Le bilan biologique préalable à toute initiation de la PrEP doit inclure le dépistage du VIH, des hépatites A, B et C et des autres IST (syphilis, recherche par PCR de gonocoque et Chlamydia trachomatis), ainsi qu’un contrôle de la fonction rénale.
La consultation médicale initiale sera l’occasion de discuter de l’indication de la PrEP, de traiter les IST dépistées par le bilan sanguin et de mettre à jour les vaccinations (contre l’hépatite A, l’hépatite B et les papillomavirus pour les plus jeunes). Toute suspicion de primo-infection à VIH doit être écartée, la sérologie du VIH doit être négative et la fonction rénale normale.
La primoprescription est réalisée pour un mois. Le médecin vérifiera la bonne tolérance et l’observance aux traitements administrés, puis reverra le patient tous les trois mois, avec un nouveau bilan au décours duquel il renouvellera son ordonnance. Chacune de ces consultations sera l’occasion de favoriser la discussion autour de la sexualité et de la prévention, de rechercher de potentielles interactions médicamenteuses (par exemple anti-inflammatoires non stéroïdiens [AINS] et ténofovir), de veiller à la bonne observance des traitements, de vérifier la négativité de la sérologie VIH, enfin de dépister et traiter de potentielles nouvelles IST.
À toutes fins utiles, plusieurs plateformes de formation médicale en ligne sont disponibles (https://www.formaprep.org/).
La consultation médicale initiale sera l’occasion de discuter de l’indication de la PrEP, de traiter les IST dépistées par le bilan sanguin et de mettre à jour les vaccinations (contre l’hépatite A, l’hépatite B et les papillomavirus pour les plus jeunes). Toute suspicion de primo-infection à VIH doit être écartée, la sérologie du VIH doit être négative et la fonction rénale normale.
La primoprescription est réalisée pour un mois. Le médecin vérifiera la bonne tolérance et l’observance aux traitements administrés, puis reverra le patient tous les trois mois, avec un nouveau bilan au décours duquel il renouvellera son ordonnance. Chacune de ces consultations sera l’occasion de favoriser la discussion autour de la sexualité et de la prévention, de rechercher de potentielles interactions médicamenteuses (par exemple anti-inflammatoires non stéroïdiens [AINS] et ténofovir), de veiller à la bonne observance des traitements, de vérifier la négativité de la sérologie VIH, enfin de dépister et traiter de potentielles nouvelles IST.
À toutes fins utiles, plusieurs plateformes de formation médicale en ligne sont disponibles (https://www.formaprep.org/).
Différentes modalités de prescription
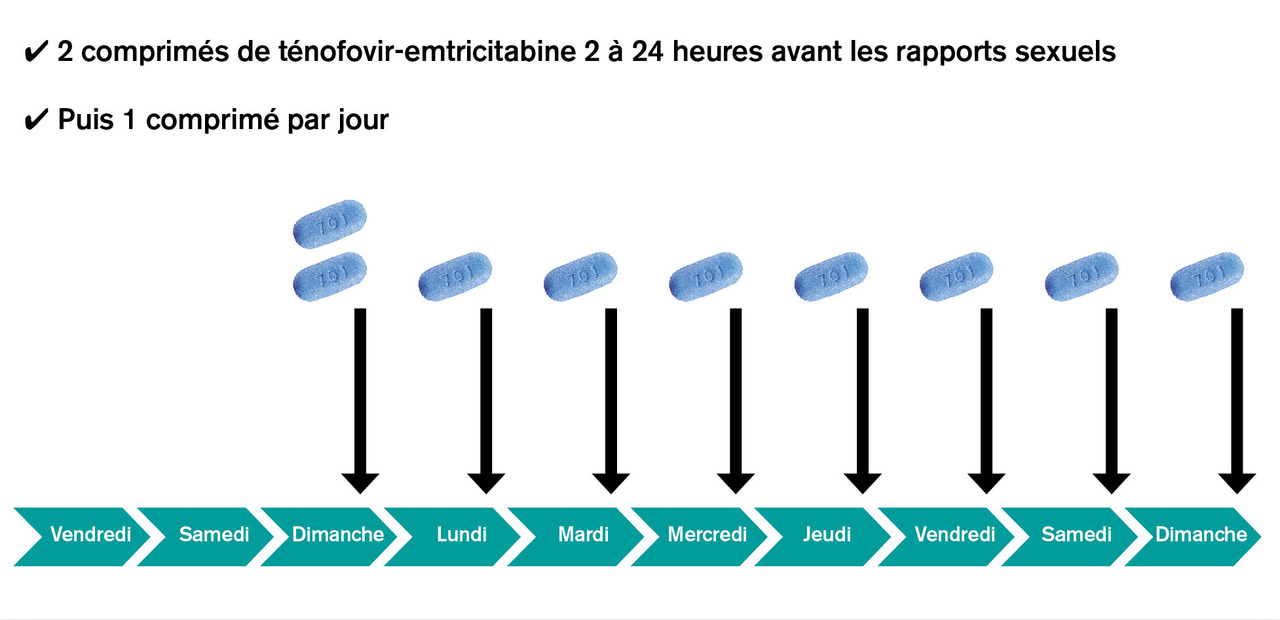
La PrEP peut être administrée selon deux schémas, à suivre scrupuleusement pour qu’elle soit efficace. Le schéma en continu (fig. 1) comporte 2 comprimés en une prise de ténofovir-emtricitabine le premier jour, 2 à 24 heures avant tout rapport sexuel, puis 1 comprimé par jour à heure fixe.2
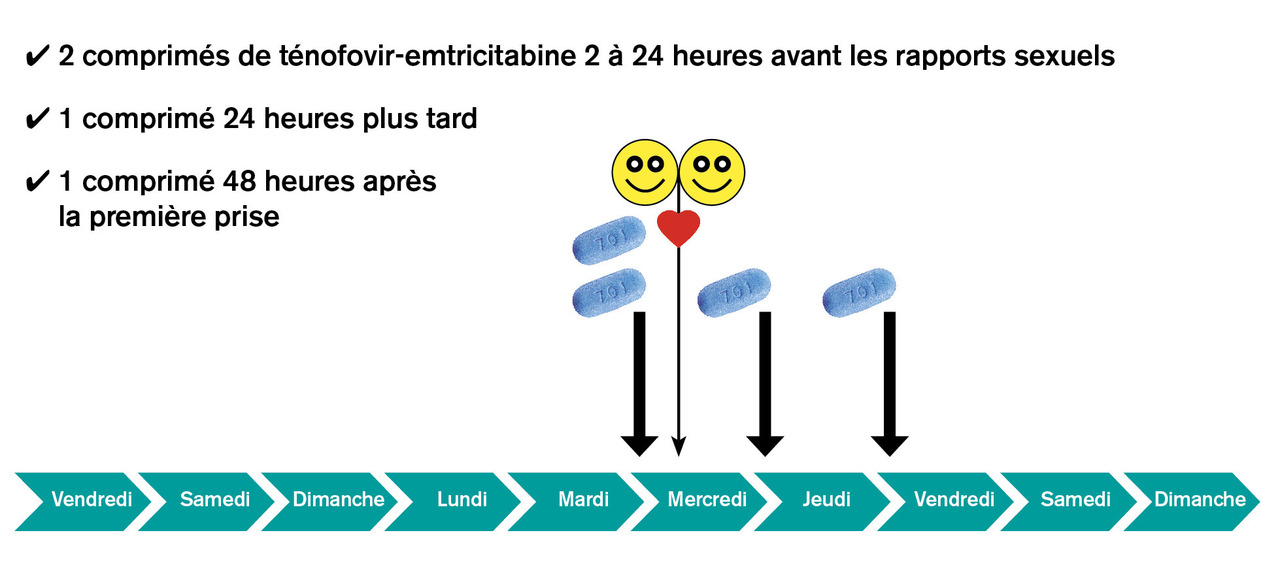
Le schéma dit « à la demande », ou « intermittent » (fig. 2), consiste en l’administration de 2 comprimés en une prise de ténofovir-emtricitabine le premier jour, 2 à 24 heures avant tout rapport sexuel à risque, puis de 1 comprimé à 24 heures et 1 comprimé à 48 heures.4 Ce schéma n’est pas recommandé chez les femmes (la pénétration des composants actifs dans le tractus génital féminin est plus lente, nécessitant une exposition au TDF-FTC plus longue afin d’obtenir une concentration efficace) et est contre-indiqué chez les personnes porteuses d’une hépatite B chronique (le TDF étant un médicament actif contre l’hépatite B, l’arrêt du TDF-FTC expose au risque de rebond viral).
L’usager pourra choisir avec son médecin le schéma le plus adapté à son activité sexuelle.
Le schéma dit « à la demande », ou « intermittent » (fig. 2), consiste en l’administration de 2 comprimés en une prise de ténofovir-emtricitabine le premier jour, 2 à 24 heures avant tout rapport sexuel à risque, puis de 1 comprimé à 24 heures et 1 comprimé à 48 heures.4 Ce schéma n’est pas recommandé chez les femmes (la pénétration des composants actifs dans le tractus génital féminin est plus lente, nécessitant une exposition au TDF-FTC plus longue afin d’obtenir une concentration efficace) et est contre-indiqué chez les personnes porteuses d’une hépatite B chronique (le TDF étant un médicament actif contre l’hépatite B, l’arrêt du TDF-FTC expose au risque de rebond viral).
L’usager pourra choisir avec son médecin le schéma le plus adapté à son activité sexuelle.
La PrEP en continu expose-t-elle à des effets indésirables ?
Prise en continu, la PrEP (TDF-FTC) expose à des risques d’altération de la fonction rénale ou de diminution, réversible à l’arrêt du traitement, de la densité minérale osseuse. C’est la raison pour laquelle un suivi méwdical et biologique est nécessaire, afin de surveiller la fonction rénale, par dosage de la créatininémie et de la phosphorémie (une hypophosphatémie témoigne d’une atteinte rénale tubulaire) et dépistage du rare syndrome de Fanconi. Les effets indésirables les plus fréquemment rapportés par les usagers de la PrEP sont les nausées et la sensation de faiblesse. Enfin, la plupart des essais cliniques n’ont pas montré de résistance associée à l’emtricitabine ou au TDF. En revanche, il est important de dépister régulièrement les patients et d’adapter le traitement antirétroviral en cas de séroconversion au VIH.
Quelles perspectives ?
Initialement réservée aux médecins hospitaliers, la primoprescription de la PrEP en France est dorénavant accessible à TOUS les médecins en exercice. Cette mesure devrait permettre d’améliorer l’accès à la PrEP des publics cibles, en particulier les populations migrantes et les jeunes.
De nouvelles molécules à longue durée d’action, sous forme injectable (en intramusculaire),7 de patchs, d’implants ou d’anneaux vaginaux sont actuellement en développement. Elles pourront assurer une protection de deux à six mois. Deux grands essais s’adressant aux HSH, aux femmes transgenres et aux femmes cisgenres (HPTN 083 et HPTN 084) sont en cours dans le monde et comparent la PrEP orale (TDF-FTC) à une PrEP par voie injectable de longue durée d’action (cabotégravir long acting). Les premiers résultats à 3 ans montrent une diminution de l’incidence de l’infection à VIH, bien supérieure pour la PrEP injectable comparée à la PrEP orale, et sont extrêmement prometteurs en termes de prévention du risque d’infection par le VIH. Ces nouvelles molécules offrent le double avantage de favoriser l’observance et d’être plus discrètes. Avec des modes d’administration diversifiés, elles mettent en perspective de nouvelles modalités de prévention, adaptées à chaque individu.
De nouvelles molécules à longue durée d’action, sous forme injectable (en intramusculaire),7 de patchs, d’implants ou d’anneaux vaginaux sont actuellement en développement. Elles pourront assurer une protection de deux à six mois. Deux grands essais s’adressant aux HSH, aux femmes transgenres et aux femmes cisgenres (HPTN 083 et HPTN 084) sont en cours dans le monde et comparent la PrEP orale (TDF-FTC) à une PrEP par voie injectable de longue durée d’action (cabotégravir long acting). Les premiers résultats à 3 ans montrent une diminution de l’incidence de l’infection à VIH, bien supérieure pour la PrEP injectable comparée à la PrEP orale, et sont extrêmement prometteurs en termes de prévention du risque d’infection par le VIH. Ces nouvelles molécules offrent le double avantage de favoriser l’observance et d’être plus discrètes. Avec des modes d’administration diversifiés, elles mettent en perspective de nouvelles modalités de prévention, adaptées à chaque individu.
Encadre
La PrEP dans le monde
L’utilisation de la PrEP dans le monde a considérablement augmenté ces dernières années ; 120 pays sur 180 ont adopté à un niveau national les recommandations de l’Organisation mondiale de la santé : en 2019, plus de 600 000 personnes de 77 pays ont pu bénéficier de ce dispositif, dont 41,6 % aux États-Unis et 34 % en Afrique. Néanmoins, le déploiement mondial de programmes de PrEP reste insuffisant, comparativement aux chiffres toujours trop élevés de nouvelles infections par le VIH.8
Références
1. CNS. Recommandation du groupe d’experts. Prise en charge médicale des personnes vivant avec le VIH. Prévention et dépistage. 2018. Disponible sur : https://cns.sante.fr/wp-content/uploads/2018/04/experts-vih_prevention-depistage.pdf
2. Delaugerre C, Gatey C, Chaix ML, Molina JM. La prévention pré-exposition au VIH-1 par les antirétroviraux, la PrEP. Virologie (Montrouge) 2016;20(3):147-57.
3. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016;387(10013):53-60.
4. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med 2015;373(23):2237-46.
5. Molina JM, Ghosn J, Delaugerre C, Pialoux G, Katlama C, Slama L, et al, ANRS Prevenir study group. Incidence of HIV-infection with daily or on demand oral PrEP with TDF/FTC in France. CROI 2021.
6. EPI-PHARE. Suivi de l’utilisation du Truvada ou génériques pour une prophylaxie pré-exposition (PrEP) au VIH à partir des données du Système national des données de santé (SNDS). 2020. Disponible sur : https://www.epi-phare.fr/rapports-detudes-et-publications/prep-vih-2020/
7. Gulick RM, Flexner C. Long-Acting HIV Drugs for Treatment and Prevention. Annu Rev Med 2019;70:137-50.
8. Schaefer R, Schmidt HA, Ravasi G, Mozalevskis A, Rewari BB, Lule F, et al. Adoption of guidelines on and use of oral pre-exposure prophylaxis: a global summary and forecasting study. Lancet HIV 2021;8(8):e502-e10.
2. Delaugerre C, Gatey C, Chaix ML, Molina JM. La prévention pré-exposition au VIH-1 par les antirétroviraux, la PrEP. Virologie (Montrouge) 2016;20(3):147-57.
3. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016;387(10013):53-60.
4. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med 2015;373(23):2237-46.
5. Molina JM, Ghosn J, Delaugerre C, Pialoux G, Katlama C, Slama L, et al, ANRS Prevenir study group. Incidence of HIV-infection with daily or on demand oral PrEP with TDF/FTC in France. CROI 2021.
6. EPI-PHARE. Suivi de l’utilisation du Truvada ou génériques pour une prophylaxie pré-exposition (PrEP) au VIH à partir des données du Système national des données de santé (SNDS). 2020. Disponible sur : https://www.epi-phare.fr/rapports-detudes-et-publications/prep-vih-2020/
7. Gulick RM, Flexner C. Long-Acting HIV Drugs for Treatment and Prevention. Annu Rev Med 2019;70:137-50.
8. Schaefer R, Schmidt HA, Ravasi G, Mozalevskis A, Rewari BB, Lule F, et al. Adoption of guidelines on and use of oral pre-exposure prophylaxis: a global summary and forecasting study. Lancet HIV 2021;8(8):e502-e10.

 Encadrés
Encadrés