La primo-infection par le VIH correspond aux manifestations cliniques et biologiques qui suivent la contamination par le virus de l’immunodéficience humaine. Il s’agit d’un moment très particulier dans l’histoire naturelle de la maladie, au cours duquel des dégâts immunologiques irréversibles surviennent rapidement et au cours duquel la réplication virale est la plus forte.1 Cet impact immunologique et virologique a des conséquences individuelles (altération durable des fonctions immunitaires et donc augmentation de la morbidité liée à l’infection) et des conséquences collectives (risque majeur de transmission du virus à d’autres personnes, en particulier par voie sexuelle). Aussi, il s’agit d’une urgence diagnostique et thérapeutique.
Une dissémination très rapide du virus dans l’organisme
Au moment de l’infection, le virus se trouve le plus souvent au contact d’une muqueuse. Il atteint rapidement les ganglions proximaux, proches de ce point d’entrée, et envahit progressivement tout l’organisme. Cette infection se généralise en quelques jours et s’étend à tous les tissus lymphoïdes, le tissu digestif, le cerveau, la rate, le poumon, le foie et les reins. Dès la primo-infection, le VIH s’intègre dans le génome des cellules cibles (essentiellement des lymphocytes CD4) qui deviennent des cellules contenant un provirus intégré. Une large majorité de ces cellules est activée, et produit une très grande quantité de virus, eux-mêmes à l’origine de nouvelles infections cellulaires. L’organisme fait face à une septicémie virale, largement entretenue par un haut niveau d’inflammation.
L’infection latente… est active
L’infection latente s’installe progressivement, constituant un réservoir de cellules productives qui entretiennent la réplication virale et la destruction progressive des lymphocytes CD4. Ces cellules incluent non seulement les lymphocytes CD4, mais aussi les monocytes/macrophages, les précurseurs hématopoïétiques, les thymocytes et les astrocytes. En plus de la destruction quantitative du pool de lymphocytes CD4, la réplication virale entraîne une destruction du répertoire immunitaire, avec pour conséquences des réponses immunitaires de qualité bien inférieure. Enfin, l’intégration du virus dans des cellules immunitaires non activées, quiescentes, constitue un réservoir durable pour l’infection et un obstacle majeur à l’éradication du VIH.
Poser le diagnostic au plus vite malgré des symptômes inconstants et non spécifiques
Le diagnostic clinique et biologique de l’infection aiguë par le VIH est complexe. En effet, les manifestations cliniques sont transitoires et très peu spécifiques, et les tests habituellement utilisés pour le dépistage peuvent être en défaut au tout début de l’infection.1
Les signes cliniques de la primo-infection et les stigmates biologiques que l’on peut observer sur un bilan « standard », sont résumés dans letableau . Ils sont les conséquences de l’activation immunitaire et de l’inflammation massive propres à ce moment de l’infection. Ces signes apparaissent en général dans les deux semaines qui suivent la contamination, et peuvent persister plusieurs semaines (en l’absence de traitement antirétroviral). Ils s’apparentent le plus souvent à un syndrome pseudo-grippal : la fièvre est présente dans 90 % des cas et les symptômes les plus fréquemment associés sont la dysphagie, les myalgies, les céphalées, l’asthénie avec amaigrissement.
Certaines primo-infections très sévères s’accompagnent d’une diminution rapide et profonde du nombre des lymphocytes CD4 et peuvent entraîner d’authentiques infections opportunistes, comme la pneumocystose pulmonaire. Toutefois, il faut souligner que de nombreuses primo-infections sont asymptomatiques ou pauci-symptomatiques : plusieurs études rapportent que près de 70 % des personnes pourraient n’avoir aucun symptôme.2 C’est pourquoi il est très important de ne pas suspecter une primo-infection uniquement en cas de manifestations clinico-biologiques évocatrices, mais dès que le contexte est en faveur (forte exposition sexuelle notamment).
Les signes cliniques de la primo-infection et les stigmates biologiques que l’on peut observer sur un bilan « standard », sont résumés dans le
Certaines primo-infections très sévères s’accompagnent d’une diminution rapide et profonde du nombre des lymphocytes CD4 et peuvent entraîner d’authentiques infections opportunistes, comme la pneumocystose pulmonaire. Toutefois, il faut souligner que de nombreuses primo-infections sont asymptomatiques ou pauci-symptomatiques : plusieurs études rapportent que près de 70 % des personnes pourraient n’avoir aucun symptôme.2 C’est pourquoi il est très important de ne pas suspecter une primo-infection uniquement en cas de manifestations clinico-biologiques évocatrices, mais dès que le contexte est en faveur (forte exposition sexuelle notamment).
Connaître la cinétique des marqueurs de diagnostic virologique
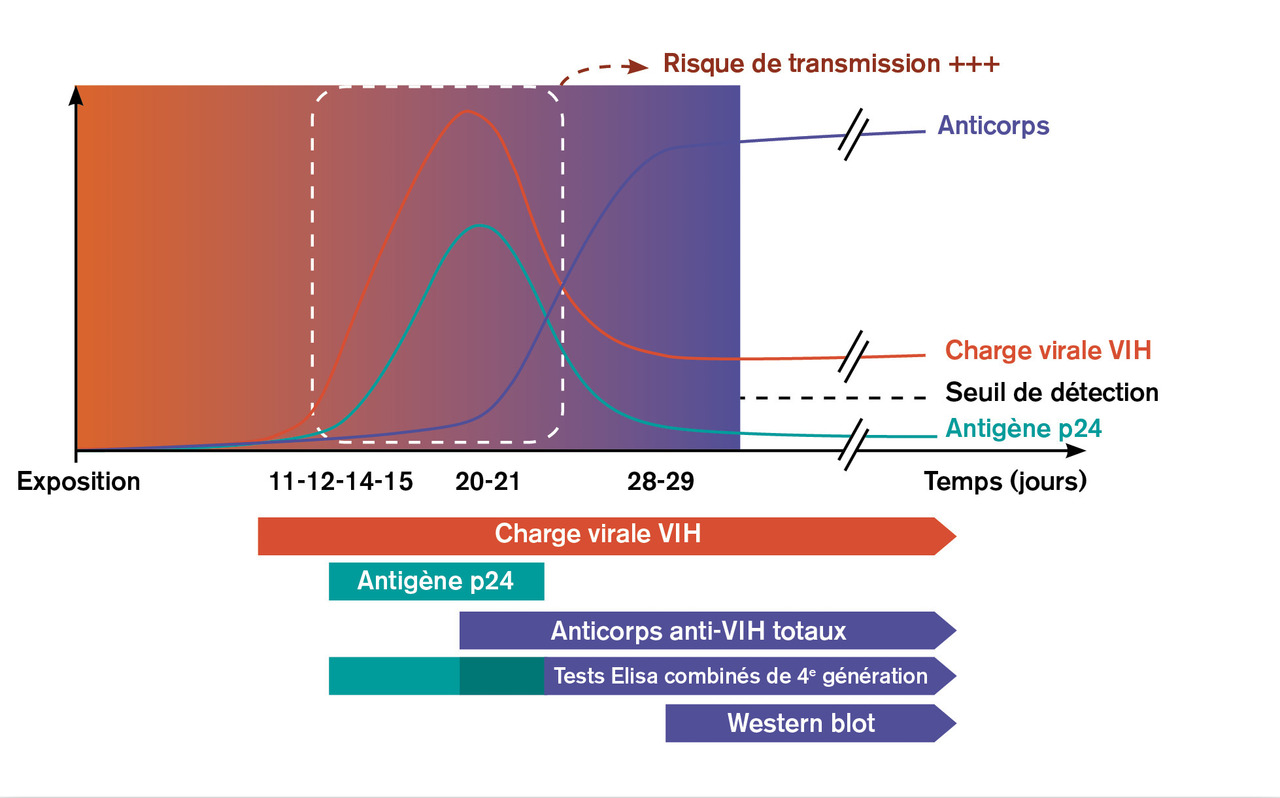
Le diagnostic virologique de l’infection par le VIH repose sur plusieurs marqueurs. Il convient d’en connaître la cinétique de positivation après la contamination, pour savoir lesquels peuvent être négatifs alors que le sujet testé est réellement infecté (figure ). En France, les tests de dépistage sérologiques classiques sont des tests Elisa de quatrième génération, qui détectent les anticorps anti-VIH totaux ainsi que l’antigène viral p24. Ils peuvent se positiver à partir de la deuxième semaine, mais peuvent rester négatifs plus longtemps ; en cas de test négatif, la fenêtre d’incertitude (« fenêtre sérologique ») est estimée à 6 semaines. Les sérologies par western-blot permettent de confirmer une infection, en détectant des anticorps anti-VIH spécifiques, mais ne permettent pas de diminuer cette fenêtre sérologique. Seule la recherche directe du virus, par amplification de l’ARN viral par RT-PCR (« charge virale VIH ») peut raccourcir cette fenêtre, car ce marqueur se positive après une dizaine de jours. La charge virale est habituellement le marqueur de suivi de l’infection à VIH traitée par antirétroviraux, mais elle peut (et doit) être utilisée pour le diagnostic précoce, dès lors qu’une primo-infection est suspectée.
Traiter sans délai
En primo-infection, chaque jour qui passe entraîne des conséquences délétères pour l’organisme. Dans les semaines qui suivent, en l’absence de traitement antirétroviral, les signes cliniques, quand ils étaient présents, disparaissent spontanément. Longtemps, ce retour à un état clinique normal a justifié de ne pas débuter de traitement, ce d’autant qu’il induisait des effets indésirables. On sait désormais que différer le traitement au cours de la primo-infection induit une réelle perte de chance pour le patient et ses éventuel(le)s partenaires. Les études menées en primo-infection ont apporté de nombreux arguments immuno-virologiques montrant qu’un traitement devait être démarré sans délai, avec un impact d’autant plus bénéfique qu’il est instauré le plus tôt possible après la contamination.
Limiter au maximum la constitution des réservoirs viraux
Chez les patients symptomatiques, le traitement antirétroviral permet de diminuer l’intensité et la durée des symptômes, mais le bénéfice individuel attendu est surtout immuno-virologique. En effet, il s’agit de limiter au maximum la constitution des réservoirs viraux cellulaires et tissulaires, de conserver la qualité du pool de lymphocytes T mémoires, de limiter l’activation immunitaire précoce et de préserver la barrière intestinale (la muqueuse étant fortement impactée par l’infection du tissu lymphoïde digestif). D’une part, le blocage de la réplication virale par les antirétroviraux est particulièrement efficace à ce stade. Ils empêchent l’extension de l’infection à de nouvelles cellules et bloquent la production de protéines virales, ce qui réduit considérablement l’activation immunitaire et l’inflammation. Les antirétroviraux protègent également l’immunité innée, qui joue un rôle important à ce stade. D’autre part, le traitement antirétroviral débuté pendant la primo-infection a un impact important sur la mise en place des réservoirs viraux, tant quantitativement que qualitativement. La décroissance des cellules réservoirs est beaucoup plus rapide en primo-infection qu’en phase chronique de l’infection.3
Enfin, la contagiosité est maximale au cours de la primo-infection ; instaurer le traitement lors de cette phase permet donc d’éviter des contaminations en série.
Enfin, la contagiosité est maximale au cours de la primo-infection ; instaurer le traitement lors de cette phase permet donc d’éviter des contaminations en série.
Quel traitement antirétroviral choisir ?
Dans le domaine de la recherche contre le VIH, les progrès thérapeutiques, constants, permettent aujourd’hui de proposer des traitements simples, très bien tolérés, ce qui constitue un point très important pour leur initiation, en particulier dans ce contexte d’urgence thérapeutique, qui demande une adhésion rapide du patient.
La prescription doit comporter une combinaison de deux inhibiteurs nucléosidiques de la transcriptase inverse (INTI), prioritairement du ténofovir, associée à un troisième agent. Les recommandations actuelles privilégient pour ce troisième agent un inhibiteur de l’intégrase (INI), comme le dolutégravir ou le bictégravir, ou, en alternative, un inhibiteur de protéase (IP) comme le darunavir potentialisé par le ritonavir.4 En France, les comprimés uniques comprenant les trois molécules (trithérapie) ne sont pas disponibles pour les IP, alors qu’ils le sont pour certains INI. La tolérance des INI est en général meilleure que celle des IP et leur puissance virologique est supérieure, assurant un contrôle plus rapide de la réplication virale. À noter qu’en cas de primo-infection chez la femme enceinte, le traitement antirétroviral doit être compatible avec la grossesse (les molécules recommandées sont le darunavir et le raltégravir). Dans tous les cas, un avis en milieu spécialisé s’impose en urgence. Intensifier le traitement (pentathérapie plutôt que trithérapie) n’apporte pas de bénéfice immuno-virologique supplémentaire.5
Le taux de résistance primaire (infection avec un virus résistant d’emblée à certaines familles antirétrovirales) est d’environ 10 % pour les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), 5 % pour les INI et 2 % pour les IP. Ceci explique en grande partie pourquoi les INNTI ne sont pas des choix privilégiés pour débuter un traitement antirétroviral en primo-infection.
La prescription doit comporter une combinaison de deux inhibiteurs nucléosidiques de la transcriptase inverse (INTI), prioritairement du ténofovir, associée à un troisième agent. Les recommandations actuelles privilégient pour ce troisième agent un inhibiteur de l’intégrase (INI), comme le dolutégravir ou le bictégravir, ou, en alternative, un inhibiteur de protéase (IP) comme le darunavir potentialisé par le ritonavir.4 En France, les comprimés uniques comprenant les trois molécules (trithérapie) ne sont pas disponibles pour les IP, alors qu’ils le sont pour certains INI. La tolérance des INI est en général meilleure que celle des IP et leur puissance virologique est supérieure, assurant un contrôle plus rapide de la réplication virale. À noter qu’en cas de primo-infection chez la femme enceinte, le traitement antirétroviral doit être compatible avec la grossesse (les molécules recommandées sont le darunavir et le raltégravir). Dans tous les cas, un avis en milieu spécialisé s’impose en urgence. Intensifier le traitement (pentathérapie plutôt que trithérapie) n’apporte pas de bénéfice immuno-virologique supplémentaire.5
Le taux de résistance primaire (infection avec un virus résistant d’emblée à certaines familles antirétrovirales) est d’environ 10 % pour les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), 5 % pour les INI et 2 % pour les IP. Ceci explique en grande partie pourquoi les INNTI ne sont pas des choix privilégiés pour débuter un traitement antirétroviral en primo-infection.
Des modalités de suivi habituelles
Après l’initiation du traitement antirétroviral, le suivi clinique et immuno-virologique est le même que celui qui est proposé habituellement, avec un point à M1, M3 et M6, puis tous les six mois, et des bilans de synthèse réguliers, à adapter en fonction du terrain de chaque patient. Dans ce contexte de prise en charge en urgence d’une pathologie virale chronique, non guérissable, il est primordial d’évaluer les besoins en mesures complémentaires pour aider au mieux le patient dès le début de son parcours de soins (soutien psychologique, démarches sociales, éducation thérapeutique).
Un bénéfice individuel et collectif
Débuter un traitement dès la primo-infection par le VIH est donc une urgence, pour limiter à la fois les phénomènes immunologiques délétères chez le patient et le risque de transmission à d’autres personnes. La pharmacopée actuelle permet des traitements simples (possiblement un comprimé une fois par jour), très bien tolérés. Débuter le traitement suppose de repérer et de diagnostiquer correctement et au plus vite la primo-infection, ce qui n’est pas simple car les signes clinico-biologiques sont inconstants et non spécifiques. Utiliser la charge virale du VIH comme outil diagnostique permet d’optimiser la prise en charge.
Références
1. Cohen MS, Shaw GM, McMichael AJ, Haynes BF. Acute HIV-1 infection. N Engl J Med 2011;364:1943-54.
2. Ganesan A, Chattopadhyay PK, Brodie TM, Qin J, Gu W, Mascola JR, et al. Infectious Disease Clinical Research Program HIV Working Group. Immunologic and virologic events in early HIV infection predict subsequent rate of progression. J Infect Dis 2010;201:272-84.
3. Avettand-Fènoël V, Hocqueloux L, Ghosn J, Cheret A, Frange P, Melard A, et al. Total HIV-1 DNA, a marker of viral reservoir dynamics with clinical implications. Clin Microbiol Rev 2016;29:859-80.
4. AIDS Clinical Society (EACS). Guidelines, v. 10.1 [Internet]. 2020. Disponible sur : www.eacsociety.org/media/guidelines-10.1_30032021_1.pdf.
5. Cheret A, Nembot G, Melard A, Lascoux C, Slama L, Miailhes P, et al. OPTIPRIM ANRS Study Group. Intensive five-drug antiretroviral therapy regimen versus standard triple-drug therapy during primary HIV-1 infection (OPTIPRIM-ANRS 147): A randomised, open-label, phase 3 trial. Lancet Infect Dis 2015;15:387-96.
2. Ganesan A, Chattopadhyay PK, Brodie TM, Qin J, Gu W, Mascola JR, et al. Infectious Disease Clinical Research Program HIV Working Group. Immunologic and virologic events in early HIV infection predict subsequent rate of progression. J Infect Dis 2010;201:272-84.
3. Avettand-Fènoël V, Hocqueloux L, Ghosn J, Cheret A, Frange P, Melard A, et al. Total HIV-1 DNA, a marker of viral reservoir dynamics with clinical implications. Clin Microbiol Rev 2016;29:859-80.
4. AIDS Clinical Society (EACS). Guidelines, v. 10.1 [Internet]. 2020. Disponible sur : www.eacsociety.org/media/guidelines-10.1_30032021_1.pdf.
5. Cheret A, Nembot G, Melard A, Lascoux C, Slama L, Miailhes P, et al. OPTIPRIM ANRS Study Group. Intensive five-drug antiretroviral therapy regimen versus standard triple-drug therapy during primary HIV-1 infection (OPTIPRIM-ANRS 147): A randomised, open-label, phase 3 trial. Lancet Infect Dis 2015;15:387-96.