Le VRS, un virus respiratoire pas comme les autres
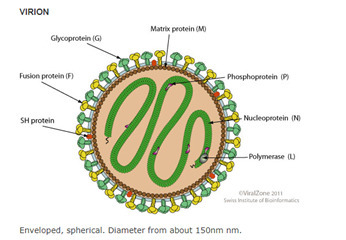
Le VRS est un virus ubiquitaire identifié de longue date. Il a été isolé la toute première fois en 1956 aux États-Unis dans le laboratoire du Walter Reed Army Institute of Research à partir des sécrétions respiratoires de jeunes chimpanzés, puis l’année suivante par Robert M. Chanock à partir de deux enfants présentant des tableaux de bronchiolite et pneumonie. C’est sa capacité à fusionner des cellules infectées en cellules géantes multinucléées (syncytia) qui lui a donné son nom de virus respiratoire syncytial. Ce virus est actuellement classé dans le genre Orthopneumovirus, et fait partie avec le métapneumovirus (appartenant, lui, au genre Metapneumovirus) de la famille des Pneumoviridæ. Son génome est un acide ribonucléique (ARN) simple brin de polarité négative de 15 kb codant pour 11 protéines à partir de 10 gènes. Le génome est protégé par une capside protéique de symétrie hélicoïdale, elle-même enveloppée d’une bicouche lipidique dans laquelle s’insèrent les deux principales protéines de surface (G et F) [figure]. Cette structure constitue le virion qui se présente sous forme sphérique ou filamenteuse (1).
La protéine d’attachement G (pour glycoprotéine) joue un rôle majeur dans l’attachement aux cellules respiratoires. Cette glycoprotéine transmembranaire de type II présente dans sa partie extracellulaire un domaine d’attachement (nommé CCD) reconnaissant les récepteurs cellulaires (glycoaminoglycanes sulfatés, héparanes, CX3CR1). Ce domaine très conservé est flanqué de deux domaines très glycosylés et variables (mucin-like domains) qui empêchent la fixation des anticorps neutralisants. Cette protéine joue également un rôle majeur dans l’immunomodulation. Elle est produite sous forme circulante dans le sang comme leurre du système immunitaire. La séquence du gène de la protéine G sert actuellement à classer le VRS au sein des deux sous-groupes antigéniques (A et B) et des différents génotypes (A ON1 et B BA 9 étant les plus fréquents actuellement) [2].
La protéine F (pour fusion) permet de fusionner l’enveloppe du virus avec celle de la cellule, déclenchant ainsi l’entrée et l’infection cellulaire. Comparée à la protéine G, elle est très stable du point de vue génétique et antigénique, ce qui en fait une cible thérapeutique de choix. Lors de l’étape de fusion, elle passe d’une structure pré-fusion (pré-F) dite « métastable » à une structure post-fusion (post-F) très stable. La localisation et l’accessibilité des sites antigéniques (désignés Ø, I à V, VIII) varient entre ces deux conformations. Le site II reconnu par le palivuzimab et le site IV reconnu par le MK-1654 sont présents sur les deux conformations. Le site antigénique Ø, reconnu par le nirsevimab, et le site V sont présents uniquement sur la conformation pré-F. La description de cette structure pré-F est très récente et a ouvert la voie au développement de nouvelles molécules (2).
De l’infection virale aiguë à la bronchiolite
Le VRS se transmet principalement par voie aéroportée courte via l’inhalation de larges gouttelettes (> 5 µM) disséminées sur une courte distance (< 2 m) [short range airborne transmission] et produites au cours d’un effort de toux ou l’éternuement d’un patient infecté. La survie du virus dans l’environnement est estimée à quelques heures sur les surfaces inertes et à une trentaine de minutes sur la peau. Une transmission directe par contact avec une personne infectée (manuportée) ou indirecte via une surface est donc possible (3). Une fois au contact de la muqueuse nasale ou conjonctivale, le VRS infecte les cellules épithéliales de l’appareil respiratoire supérieur. La réplication virale entraîne une apoptose et une desquamation des cellules infectées, favorise la différenciation des cellules basales en cellules caliciformes, augmentant ainsi la production de mucus, réduit la fréquence des battements de l’épithélium cilié, ce qui diminue le transport mucociliaire et, enfin, favorise une réponse immunitaire pro-inflammatoire. La réponse immunitaire et l’apoptose des cellules infectées conduisent à la clairance virale dans un délai de trois à sept jours. La régénération de l’épithélium est assez rapide mais la récupération de la fonction mucociliaire n’est complète qu’après plusieurs semaines. Ceci explique la persistance de la toux résiduelle et la sensibilité accrue de l’épithélium à d’autres infections respiratoires dans les suites de la bronchiolite. L’infection n’est pas protectrice, probablement parce que le virus interfère avec la mémoire immunologique, ce qui conduit à des réinfections tout au long de la vie (4).
L’extension de l’infection vers l’appareil respiratoire bas est probablement liée à l’aspiration des cellules infectées desquamées qui transportent le virus vers les cellules ciliées de l’épithélium des bronchioles et les pneumocytes de type 1 de l’alvéole. À ce niveau, l’accumulation des cellules nécrotiques desquamées, des sécrétions séromuqueuses et de l’exsudat sérofibrineux va constituer un bouchon muqueux qui va obstruer la lumière des bronchioles. À cette obstruction endoluminale s’ajoute une obstruction murale liée à un épaississement de la paroi pariétale d’origine inflammatoire. Pendant l’inspiration, la pression intrapleurale négative permet à l’air de passer mais, pendant l’expiration, les pressions positives majorent l’obstruction à l’origine des sibilants et wheezing entendus. Ce phénomène favorise la distension pulmonaire et la création d’atélectasie. Cette physiopathologie explique donc le tableau clinique de la bronchiolite (4).
Plusieurs études rapportent une gravité majorée lors du premier épisode de bronchiolite chez les jeunes nourrissons naïfs de toute exposition au VRS. Cette susceptibilité aux formes graves s’explique principalement par les caractéristiques anatomiques du nourrisson (diamètre réduit de la lumière bronchique) et par l’immaturité du système immunitaire (cellule immunitaire immature, altération des fonctions présentatrices d’antigène, faible activation des lymphocytes T régulateurs). La conséquence de cette immaturité est l’orientation de la réponse immunitaire adaptative vers le profil allergique Th2 (hyperéosinophilie, augmentation de sécrétion du mucus et hyperréactivité bronchique) au détriment du profil antiviral Th1 (lymphocyte T CD8). C’est cette réponse inappropriée du système immunitaire, plus que le caractère apoptotique du virus, qui serait la principale cause de l’obstruction pulmonaire. Les enfants prématurés présentent également une gravité majorée lors de l’infection à VRS, que l’on explique par une diminution du transfert des anticorps maternels protecteurs à la naissance et la présence de comorbidité spécifique comme la dysplasie bronchopulmonaire (2).
Le VRS, bien plus que le simple agent de la bronchiolite
Il est maintenant établi que la quasi-totalité des enfants sont infectés à l’âge de 3 ans et que les réinfections sont très fréquentes les premières années de vie. Après une incubation de trois à huit jours, l’infection à VRS se traduit le plus souvent par une rhinopharyngite peu ou pas fébrile. La complication de loin la plus fréquente est l’otite moyenne aiguë (compliquant 50 % des infections communautaires à VRS dans une cohorte d’enfants finlandais d’après Heikkinen T et al.)[5]. Le VRS, qui semble avoir un tropisme particulier pour l’oreille moyenne est en effet le principal virus détecté dans les otites séromuqueuses. Les autres complications infectieuses sont plus rarement la sinusite et la pneumonie (4 % d’après [5]). Les infections à VRS sont donc une cause très fréquente de prescription d’antibiotiques dans ce groupe d’âge (54 % d’après [5]). La crise d’asthme est également une complication respiratoire fréquemment associée au VRS (9 % entre 2 et 13 ans d’après [5]). Au regard de ce dernier point il est toujours difficile de savoir si l’infection à VRS est un vrai facteur de risque ou un marqueur de prédisposition à la maladie asthmatique (6).
L’infection respiratoire basse survient généralement dans les suites de la rhinopharyngite et se présente comme un tableau de bronchiolite aiguë (17 % pour les moins de 2 ans d’après [5]). Les complications immédiates de la bronchiolite sont principalement respiratoires et digestives. L’atteinte respiratoire peut être suffisamment sévère pour entraîner une détresse respiratoire aiguë notamment dans la population des enfants à risque, et les difficultés alimentaires associées peuvent se compliquer de déshydratation. La pneumopathie bactérienne est une complication possible de l’infection à VRS mais semble assez rare à la phase aiguë d’un tableau de bronchiolite classique (7). Des complications neurologiques sont également rapportées sous la forme le plus souvent de convulsions fébriles et exceptionnellement d’encéphalite aiguë (fréquence de ces complications estimées entre 1 et 7 % dans la population des enfants hospitalisés pour VRS) [8]. Le décès, bien que rare dans les pays industrialisés, est possible et survient le plus souvent dans une population à risque (prématuré, pathologie pulmonaire ou cardiaque sous-jacente) [9].
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel de Sanofi, sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
1. Collins PL, Fearns R, Graham BS. Respiratory syncytial virus: virology, reverse genetics, and pathogenesis of disease. Curr Top Microbiol Immunol. 2013;372:3-38. doi: 10.1007/978-3- 642-38919-1_1. PMID: 24362682; PMCID: PMC4794264. Une revue complète sur le virus avec une belle iconographie disponible au lien suivant : https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC4794264
2. Taleb SA, Al Thani AA, Al Ansari K, Yassine HM. Human respiratory syncytial virus: pathogenesis, immune responses, and current vaccine approaches. Eur J Clin Microbiol Infect Dis. 2018;37(10):1817-27. doi:10.1007/s10096-018- 3289-4 Une très bonne revue, assez synthétique sur la partie virologie et prenant soin de présenter la pathologie du VRS au regard de la triade virus-hôte-réponse immunitaire. À lire également pour sa description très claire des premiers essais (et échecs vaccinaux) avec le VRS ayant conduit dans les années 1960 aux décès de deux enfants. Un événement qui aujourd‘hui encore influence les stratégies de vaccination, le design des études, les champs de recherche sur le VRS. En anglais mais disponible au lien suivant : https://link.springer.com/article/10.1007/ s10096-018-3289-4
3. Kutter JS, Spronken MI, Fraaij PL, Fouchier RA, Herfst S. Transmission routes of respiratory viruses among humans. Curr Opin Virol. 2018 Feb;28:142-51. doi: 10.1016/j.coviro.2018.01.001. Epub 2018 Jan 17. PMID: 29452994; PMCID: PMC7102683. Une très bonne revue sur les données expérimentales disponibles sur la transmission des virus respiratoires: https:// www.ncbi.nlm.nih.gov/pmc/articles/ PMC7102683/
4. Meissner HC. Viral bronchiolitis in children. N Engl J Med. 2016 Jan 7;374(1):62-72. doi: 10.1056/ NEJMra1413456. PMID: 26735994. Une revue de référence sur la bronchiolite. Un peu datée mais superbement illustrée sur la partie physiopathologie de la bronchiolite.
5. Heikkinen T, Ojala E, Waris M. Clinical and socioeconomic burden of respiratory syncytial virus infection in children. J Infect Dis. 2017 Jan 1;215(1):17-23. doi: 10.1093/infdis/jiw475. Epub 2016 Oct 12. PMID: 27738052. Une étude suivant une cohorte d’enfants finlandais pendant deux saisons de VRS et faisant encore référence sur le sujet. Particulièrement intéressante pour son estimation d’un point de vue communautaire de la fréquence des principales complications de l’infection à VRS et de l’impact sur les parents (arrêts de travail).
6. Driscoll AJ, Arshad SH, Bont L, Brunwasser SM, Cherian T, Englund JA et al. Does respiratory syncytial virus lower respiratory illness in early life cause recurrent wheeze of early childhood and asthma? Critical review of the evidence and guidance for future studies from a World Health Organization-sponsored meeting. Vaccine. 2020;38(11):2435-48. doi:10.1016/j. vaccine.2020.01.020
7. Luginbuhl LM, Newman TB, Pantell RH, Finch SA, Wasserman RC. Office-based treatment and outcomes for febrile infants with clinically diagnosed bronchiolitis. Pediatrics. 2008 Nov;122(5):947-54. doi: 10.1542/peds.2007- 3206. PMID: 18977972.
8. Saravanos GL, King CL, Deng L, Dinsmore N, Ramos I, Takashima M, et al. Respiratory syncytial virus-associated neurologic complications in children: A systematic review and aggregated case series. J Pediatr. 2021 Dec;239:39-49.e9. doi: 10.1016/j.jpeds.2021.06.045. Epub 2021 Jun 25. PMID: 34181989.
9. Geoghegan S, Erviti A, Caballero MT, Vallone F, Zanone SM, Losada JV, et al. Mortality due to respiratory syncytial virus. Burden and risk factors. Am J Respir Crit Care Med. 2017 Jan 1;195(1):96-103. doi: 10.1164/rccm.201603- 0658OC. PMID: 27331632.
En collaboration avec :