2018 : un prix Nobel
Le 1er octobre 2018 tombe un communiqué de presse : « le comité Nobel de l’institut Karolinska a attribué conjointement le prix Nobel de physiologie ou médecine 2018 à James P. Allison et Tasuku Honjo pour leur découverte d’un traitement du cancer par inhibition de l’immunorégulation négative » a. L’expression est un peu obscure. On n’y trouve pas la notion, non moins obscure, de « checkpoint » qui la remplace bientôt.
Les lauréats, explique le résumé qui accompagne ce communiqué, ont conçu un principe totalement nouveau d’immunothérapie des cancers. Allison et Honjo ont l’un étudié, l’autre identifié deux molécules exprimées par des cellules immunitaires qui se comportent comme des « freins ». Ils ont alors élaboré des stratégies thérapeutiques fondées sur l’idée que des anticorps qui empêcheraient ces freins de fonctionner pourraient libérer les cellules immunitaires et leur permettre de détruire les cellules tumorales. Ces « inhibiteurs du contrôle immunitaireb » (ICI) ont révolutionné l’oncologie en rendant accessibles au traitement des cancers auparavant sans espoir de guérison.
Ce progrès spectaculaire n’est pas apparu par hasard. Il survient après une longue histoire, qui commence à la fin du XIXe siècle. L’histoire de l’immunothérapie des cancers débute en effet dès les premières vaccinations, et, avec ses vicissitudes, elle accompagne celle de cette nouvelle science de l’immunité qui se développe au XXe siècle. Elle est marquée par une série de ruptures qui conduisent à l’élaboration, dans les années 1960, d’un système immunitaire, et sa transformation en un système de défense qui prend place parmi les grands systèmes physiologiques dévolus à d’autres fonctions essentielles à la vie.
Nous examinerons ici comment les idées nouvelles qui ont peu à peu façonné l’immunologie ont été à l’origine de nouvelles tentatives d’utiliser l’immunité pour lutter contre le cancer, jusqu’à l’émergence des inhibiteurs du contrôle immunitaire. Nous décrirons les mécanismes par lesquels ceux-ci exercent leurs effets thérapeutiques. Nous discuterons enfin le progrès qu’ils représentent en immuno-oncologie, et leurs limites, ainsi que les défis qu’ils doivent relever aujourd’hui.
Les lauréats, explique le résumé qui accompagne ce communiqué, ont conçu un principe totalement nouveau d’immunothérapie des cancers. Allison et Honjo ont l’un étudié, l’autre identifié deux molécules exprimées par des cellules immunitaires qui se comportent comme des « freins ». Ils ont alors élaboré des stratégies thérapeutiques fondées sur l’idée que des anticorps qui empêcheraient ces freins de fonctionner pourraient libérer les cellules immunitaires et leur permettre de détruire les cellules tumorales. Ces « inhibiteurs du contrôle immunitaireb » (ICI) ont révolutionné l’oncologie en rendant accessibles au traitement des cancers auparavant sans espoir de guérison.
Ce progrès spectaculaire n’est pas apparu par hasard. Il survient après une longue histoire, qui commence à la fin du XIXe siècle. L’histoire de l’immunothérapie des cancers débute en effet dès les premières vaccinations, et, avec ses vicissitudes, elle accompagne celle de cette nouvelle science de l’immunité qui se développe au XXe siècle. Elle est marquée par une série de ruptures qui conduisent à l’élaboration, dans les années 1960, d’un système immunitaire, et sa transformation en un système de défense qui prend place parmi les grands systèmes physiologiques dévolus à d’autres fonctions essentielles à la vie.
Nous examinerons ici comment les idées nouvelles qui ont peu à peu façonné l’immunologie ont été à l’origine de nouvelles tentatives d’utiliser l’immunité pour lutter contre le cancer, jusqu’à l’émergence des inhibiteurs du contrôle immunitaire. Nous décrirons les mécanismes par lesquels ceux-ci exercent leurs effets thérapeutiques. Nous discuterons enfin le progrès qu’ils représentent en immuno-oncologie, et leurs limites, ainsi que les défis qu’ils doivent relever aujourd’hui.
Le cancer comme une maladie infectieuse
Au commencement était l’immunité, ce privilègec inné ou acquis dont bénéficient certains de ne pas être malades lorsque les autres le sont et en meurent parfois. Une première rupture survient lorsque, un siècle après la « vaccination » jennérienne, Louis Pasteur fait de ce privilège la chose du monde la mieux partagée. Il suffit désormais à tout un chacun de s’immuniser contre un germe atténué pour être protégé contre le même germe virulent.
Il ne faut pas attendre longtemps pour qu’on tente d’appliquer au cancer cette manœuvre empirique qui traite le mal par le mal mais qui est si efficace pour prévenir les maladies infectieuses. Les premières tentatives de vaccination contre des tumeurs expérimentales sont faites chez des souris immunisées par des extraits tumoraux, au tout début du XXe siècle.1 Sans grand succès. Les cellules cancéreuses ne sont pas des microbes.
Mais l’idée d’un lien entre cancers et microbes n’est pas abandonnée pour autant. Car on n’a pas oublié les résultats troublants de William Coley, ce chirurgien new-yorkais qui, après avoir observé la régression d’un ostéosarcome chez un patient atteint d’érysipèle, entreprend de traiter ses patients porteurs de tumeurs similaires par l’injection de streptocoques vivants.2 Les effets sur le cancer sont encourageants (fig. 1 ). Malheureusement, les patients meurent de septicémie.
Il ne faut pas attendre longtemps pour qu’on tente d’appliquer au cancer cette manœuvre empirique qui traite le mal par le mal mais qui est si efficace pour prévenir les maladies infectieuses. Les premières tentatives de vaccination contre des tumeurs expérimentales sont faites chez des souris immunisées par des extraits tumoraux, au tout début du XXe siècle.1 Sans grand succès. Les cellules cancéreuses ne sont pas des microbes.
Mais l’idée d’un lien entre cancers et microbes n’est pas abandonnée pour autant. Car on n’a pas oublié les résultats troublants de William Coley, ce chirurgien new-yorkais qui, après avoir observé la régression d’un ostéosarcome chez un patient atteint d’érysipèle, entreprend de traiter ses patients porteurs de tumeurs similaires par l’injection de streptocoques vivants.2 Les effets sur le cancer sont encourageants (
La surveillance immunitaire et ses limites
Une deuxième rupture se produit lorsque, avec Paul Ehrlich, Jules Bordet, Karl Landsteiner et quelques autres, l’immunité s’émancipe des microbes, et l’immunologie de la microbiologie. L’immunité concerne des molécules biologiques, pas seulement des toxines ; elle concerne aussi des globules rouges et des cellules d’autres espèces, pas seulement des micro-organismes. Une immunité peut alors être pensée contre des cellules cancéreuses, fondée sur des bases expérimentales.
La question est désormais celle de la reconnaissance des cellules tumorales. Celles-ci, en effet, ne sont pas, comme les microbes, des cellules étrangères. Certes, elles sont « transformées » mais elles restent des cellules du « soi ». Or, Peter B. Medawar et Frank Macfarlane Burnet nous l’ont appris, les cellules autologues n’induisent pas de réponse immunitaire. Il faut attendre les années 1950 pour qu’il soit démontré que les tumeurs expérimentales induisent des anticorps qui reconnaissent les cellules cancéreuses, et qu’elles sont rejetées lorsqu’elles sont transplantées.3 Bientôt, des antigènes tumoraux sont reconnus par des anticorps sur les cellules cancéreuses humaines. Il existe bien une immunité anticancer.
Ce résultat rappelle à Macfarlane Burnet une hypothèse proposée par Paul Ehrlich un demi-siècle plus tôt, selon laquelle l’organisme élimine les cellules anormales qui pourraient se former. Il reprend cette hypothèse et l’applique au cancer : une « surveillance immunitaire », dit-il, est là, qui guette l’apparition de cellules transformées et les élimine avant qu’elles ne s’expriment cliniquement.4 La surveillance immunitaire des cancers reste longtemps une hypothèse ; jusqu’à ce qu’il soit reconnu qu’un déficit immunitaire augmente la fréquence des cancersd. À l’évidence, cependant, il arrive à cette surveillance immunitaire de faillir à sa mission, puisque des cancers finissent par survenir. Parce qu’elle est insuffisante ? Parce qu’elle s’affaiblit avec l’âge ?
On cherche alors à la renforcer par différentes manœuvres. Georges Mathé n’a pas oublié Coley et ses « toxines »e controversées. Comme lui, il utilise des bactéries, le bacille de Calmette et Guérin (BCG), pour stimuler les réactions anticancer du système immunitaire. Encourageants chez la souris, les résultats ne le sont guère chez les patients. À une exception près, les cancers de la vessie, et, aujourd’hui encore, le BCG est indiqué dans cette pathologie. On utilise alors des cytokines, qui stimulent les cellules immunitaires, l’interféron d’abord, comme le suggère Ion Gresser, l’interleukine 2 ensuite, comme le promeut Steven A. Rosenberg,5 mais, là encore, les effets thérapeutiques sont plus convaincants chez l’animal que chez l’homme, ou alors ils s’accompagnent d’effets secondaires inacceptables.
La question est désormais celle de la reconnaissance des cellules tumorales. Celles-ci, en effet, ne sont pas, comme les microbes, des cellules étrangères. Certes, elles sont « transformées » mais elles restent des cellules du « soi ». Or, Peter B. Medawar et Frank Macfarlane Burnet nous l’ont appris, les cellules autologues n’induisent pas de réponse immunitaire. Il faut attendre les années 1950 pour qu’il soit démontré que les tumeurs expérimentales induisent des anticorps qui reconnaissent les cellules cancéreuses, et qu’elles sont rejetées lorsqu’elles sont transplantées.3 Bientôt, des antigènes tumoraux sont reconnus par des anticorps sur les cellules cancéreuses humaines. Il existe bien une immunité anticancer.
Ce résultat rappelle à Macfarlane Burnet une hypothèse proposée par Paul Ehrlich un demi-siècle plus tôt, selon laquelle l’organisme élimine les cellules anormales qui pourraient se former. Il reprend cette hypothèse et l’applique au cancer : une « surveillance immunitaire », dit-il, est là, qui guette l’apparition de cellules transformées et les élimine avant qu’elles ne s’expriment cliniquement.4 La surveillance immunitaire des cancers reste longtemps une hypothèse ; jusqu’à ce qu’il soit reconnu qu’un déficit immunitaire augmente la fréquence des cancersd. À l’évidence, cependant, il arrive à cette surveillance immunitaire de faillir à sa mission, puisque des cancers finissent par survenir. Parce qu’elle est insuffisante ? Parce qu’elle s’affaiblit avec l’âge ?
On cherche alors à la renforcer par différentes manœuvres. Georges Mathé n’a pas oublié Coley et ses « toxines »e controversées. Comme lui, il utilise des bactéries, le bacille de Calmette et Guérin (BCG), pour stimuler les réactions anticancer du système immunitaire. Encourageants chez la souris, les résultats ne le sont guère chez les patients. À une exception près, les cancers de la vessie, et, aujourd’hui encore, le BCG est indiqué dans cette pathologie. On utilise alors des cytokines, qui stimulent les cellules immunitaires, l’interféron d’abord, comme le suggère Ion Gresser, l’interleukine 2 ensuite, comme le promeut Steven A. Rosenberg,5 mais, là encore, les effets thérapeutiques sont plus convaincants chez l’animal que chez l’homme, ou alors ils s’accompagnent d’effets secondaires inacceptables.
Des effecteurs immunitaires artificiels
On sait en effet depuis longtemps que l’immunité ne protège pas toujours, qu’elle peut être pathogène, et que parfois elle tue. Cinq ans à peine après les funérailles nationales de Pasteur, Charles Richet montre que l’immunité peut aussi bien protéger contre une infection mortelle par un pathogène que rendre mortelle l’injection d’une dose inoffensive de toxine. Allergies et autres hypersensibilités, maladie hémolytique du nouveau-né et, après beaucoup d’années de réflexion et de réticences, maladies auto-immunitaires, les exemples s’ajoutent à cette « anaphylaxie »f, d’une immunité pathogène. On découvre la face sombre de l’immunité. On commence à parler d’« immunopathologie ». On en élucide les mécanismes, on identifie les molécules et les cellules responsables des effets pathogènes.
Car la réponse immunitaire s’est considérablement complexifiée, surtout depuis qu’on a compris que nous n’avons pas un système immunitaire, comme on avait fini par le penser, mais deux, un système immunitaire inné et un système immunitaire adaptatif, et qu’ils coopèrent. Pour le meilleur et pour le pire. On essaie d’adapter les approches vaccinales du cancer aux nouvelles connaissances, on essaie d’induire de préférence une immunité cellulaire, mais à nouveau les résultats sont décevants : ces systèmes immunitaires ne font pas ce qu’on attend d’eux. Puisqu’on n’arrive pas à concevoir un vaccin anticancer efficace, on essaie alors d’administrer aux patients des effecteurs immunitaires tout faits : on leur donne soit des anticorps, soit des cellules anticancer fabriqués au laboratoire.
On donne donc au patient des anticorps monoclonaux qui reconnaissent des antigènes exprimés par les cellules tumorales. Le rituximab en est le prototype. Approuvé en 1997 pour les leucémies lymphoïdes B, cet anticorps anti-CD20g s’est également révélé efficace dans des maladies auto-immunitaires.6 D’autres anticorps, comme le trastuzumab (Herceptin) qui reconnaît des récepteurs exprimés par les cellules de certains cancers du sein, confirment l’efficacité des anticorps thérapeutiques en cancérologie. Ils sont nombreux aujourd’hui, humanisés pour ne pas induire de réponse immunitaire, et optimisés pour être plus efficaces. Une immunothérapie des cancers est enfin possible.
Ces résultats encourageants incitent à donner au patient des cellules cytotoxiques qui sont spécifiques de son propre cancer. Les cellules T du patient sont prélevées, purifiées, et modifiées génétiquement, de sorte qu’elles expriment un récepteur d’antigène chimérique dont le domaine extracellulaire est constitué par un fragment d’anticorps monoclonal spécifique d’un antigène de la tumeur du patient, et le domaine intracellulaire par l’appareil de signalisation des récepteurs pour l’antigène des cellules T. Ces cellules CAR-T (chimeric antigen receptor T-cells) sont alors amplifiées in vitro et injectées au patient. Elles se révèlent efficaces dans différents cancers des cellules hématopoïétiques, mais elles ne sont pas dénuées d’effets indésirables.7 Ces thérapies cellulaires personnalisées sont aussi très onéreuses.
Car la réponse immunitaire s’est considérablement complexifiée, surtout depuis qu’on a compris que nous n’avons pas un système immunitaire, comme on avait fini par le penser, mais deux, un système immunitaire inné et un système immunitaire adaptatif, et qu’ils coopèrent. Pour le meilleur et pour le pire. On essaie d’adapter les approches vaccinales du cancer aux nouvelles connaissances, on essaie d’induire de préférence une immunité cellulaire, mais à nouveau les résultats sont décevants : ces systèmes immunitaires ne font pas ce qu’on attend d’eux. Puisqu’on n’arrive pas à concevoir un vaccin anticancer efficace, on essaie alors d’administrer aux patients des effecteurs immunitaires tout faits : on leur donne soit des anticorps, soit des cellules anticancer fabriqués au laboratoire.
On donne donc au patient des anticorps monoclonaux qui reconnaissent des antigènes exprimés par les cellules tumorales. Le rituximab en est le prototype. Approuvé en 1997 pour les leucémies lymphoïdes B, cet anticorps anti-CD20g s’est également révélé efficace dans des maladies auto-immunitaires.6 D’autres anticorps, comme le trastuzumab (Herceptin) qui reconnaît des récepteurs exprimés par les cellules de certains cancers du sein, confirment l’efficacité des anticorps thérapeutiques en cancérologie. Ils sont nombreux aujourd’hui, humanisés pour ne pas induire de réponse immunitaire, et optimisés pour être plus efficaces. Une immunothérapie des cancers est enfin possible.
Ces résultats encourageants incitent à donner au patient des cellules cytotoxiques qui sont spécifiques de son propre cancer. Les cellules T du patient sont prélevées, purifiées, et modifiées génétiquement, de sorte qu’elles expriment un récepteur d’antigène chimérique dont le domaine extracellulaire est constitué par un fragment d’anticorps monoclonal spécifique d’un antigène de la tumeur du patient, et le domaine intracellulaire par l’appareil de signalisation des récepteurs pour l’antigène des cellules T. Ces cellules CAR-T (chimeric antigen receptor T-cells) sont alors amplifiées in vitro et injectées au patient. Elles se révèlent efficaces dans différents cancers des cellules hématopoïétiques, mais elles ne sont pas dénuées d’effets indésirables.7 Ces thérapies cellulaires personnalisées sont aussi très onéreuses.
L’immunité anticancer libérée
Une troisième rupture survient lorsqu’on comprend que l’immunité est fondamentalement ambivalente. Comme la plupart des autres cellules, les cellules immunitaires ne font pas seulement ce qu’elles font en permanence, qui leur est nécessaire pour vivre, elles mettent en œuvre d’autres activités qu’elles sont capables de faire, mais qu’elles font seulement lorsqu’elles en reçoivent le signal, lorsqu’elles sont activées. L’activation des cellules immunitaires dépend de récepteurs qui les induisent à entrer dans le cycle cellulaire et à se diviser, et/ou à exprimer des gènes qui ne l’étaient pas auparavant, des gènes de cytokines, par exemple.
Au début des années 1990, on se rend compte qu’à côté de ces récepteurs activateurs, il existe des récepteurs inhibiteurs. L’engagement simultané des deux types de récepteurs sur une même cellule engendre un mélange de signaux d’activation et de signaux d’inhibition dont l’intégration détermine l’intensité de la réponse cellulaire. De même qu’un mouvement peut être contrôlé avec une extrême précision par la contraction de muscles fléchisseurs et de muscles extenseurs, l’activation des cellules immunitaires est étroitement contrôlée par des mécanismes antagonistes.8 Elle l’est si bien qu’Allison et Honjo se demandent si les récepteurs inhibiteurs n’empêchent pas les cellules immunitaires de détruire les cellules cancéreuses, et donc de protéger contre le cancer.
Allison travaille sur CTLA4 (cytotoxic T-lymphocyte associated protein 4), une molécule identifiée par Pierre Golstein sur les lymphocytes T cytotoxiques,9 Honjo sur PD-1 (programmed cell death 1), une molécule qu’il a identifiée sur les mêmes cellules.10 Ils montrent que l’injection d’anticorps anti-CTLA411 ou d’anticorps anti-PD-112 à des souris porteuses de tumeurs permet à celles-ci de rejeter leurs tumeurs. Sur la base de ces résultats, des essais cliniques sont entrepris chez des patients atteints de mélanomes métastatiques. Les résultats sont presque aussi spectaculaires que chez les souris, au moins chez certains patients. Surtout, ils sont durables : les récidives sont notablement plus rares qu’après les traitements habituels.
On comprend alors que si la surveillance immunitaire ne suffit pas à prévenir la survenue des cancers, ce n’est pas parce que l’immunité anticancer naturelle en est incapable, c’est parce qu’elle est contrainte par des mécanismes de régulation qui empêchent les effecteurs immunitaires d’être pathogènes. On comprend ainsi pourquoi les approches d’immunothérapie qui cherchent à renforcer l’immunité anticancer ne sont pas efficaces. Accélérer ne fait pas avancer plus vite une voiture dont les freins sont serrés. On comprend surtout qu’il suffit de lever l’inhibition qui les contraint pour libérer les effecteurs de l’immunité anticancer. Les inhibiteurs du contrôle immunitaire révolutionnent la cancérologie.
Au début des années 1990, on se rend compte qu’à côté de ces récepteurs activateurs, il existe des récepteurs inhibiteurs. L’engagement simultané des deux types de récepteurs sur une même cellule engendre un mélange de signaux d’activation et de signaux d’inhibition dont l’intégration détermine l’intensité de la réponse cellulaire. De même qu’un mouvement peut être contrôlé avec une extrême précision par la contraction de muscles fléchisseurs et de muscles extenseurs, l’activation des cellules immunitaires est étroitement contrôlée par des mécanismes antagonistes.8 Elle l’est si bien qu’Allison et Honjo se demandent si les récepteurs inhibiteurs n’empêchent pas les cellules immunitaires de détruire les cellules cancéreuses, et donc de protéger contre le cancer.
Allison travaille sur CTLA4 (cytotoxic T-lymphocyte associated protein 4), une molécule identifiée par Pierre Golstein sur les lymphocytes T cytotoxiques,9 Honjo sur PD-1 (programmed cell death 1), une molécule qu’il a identifiée sur les mêmes cellules.10 Ils montrent que l’injection d’anticorps anti-CTLA411 ou d’anticorps anti-PD-112 à des souris porteuses de tumeurs permet à celles-ci de rejeter leurs tumeurs. Sur la base de ces résultats, des essais cliniques sont entrepris chez des patients atteints de mélanomes métastatiques. Les résultats sont presque aussi spectaculaires que chez les souris, au moins chez certains patients. Surtout, ils sont durables : les récidives sont notablement plus rares qu’après les traitements habituels.
On comprend alors que si la surveillance immunitaire ne suffit pas à prévenir la survenue des cancers, ce n’est pas parce que l’immunité anticancer naturelle en est incapable, c’est parce qu’elle est contrainte par des mécanismes de régulation qui empêchent les effecteurs immunitaires d’être pathogènes. On comprend ainsi pourquoi les approches d’immunothérapie qui cherchent à renforcer l’immunité anticancer ne sont pas efficaces. Accélérer ne fait pas avancer plus vite une voiture dont les freins sont serrés. On comprend surtout qu’il suffit de lever l’inhibition qui les contraint pour libérer les effecteurs de l’immunité anticancer. Les inhibiteurs du contrôle immunitaire révolutionnent la cancérologie.
Les ICI, et maintenant ?
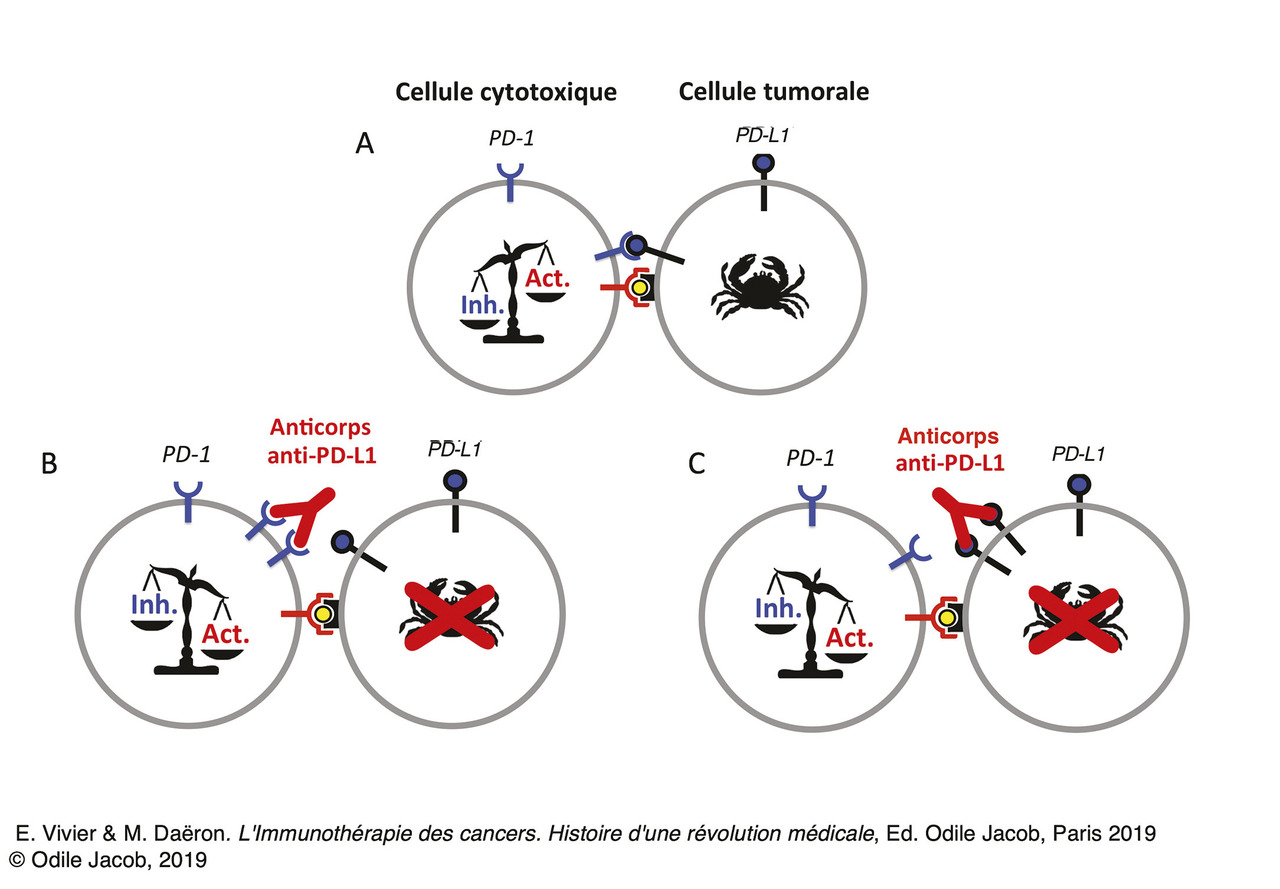
Les inhibiteurs du contrôle immunitaire sont des anticorps monoclonaux qui bloquent l’interaction des récepteurs inhibiteurs avec leurs ligands. Ces anticorps peuvent être dirigés soit contre le récepteur soit contre le ligand. Les ICI utilisés en oncologie comprennent des anticorps anti-CTLA4, des anticorps anti-PD-1 et des anticorps anti-PD-L1 (fig. 2 ).
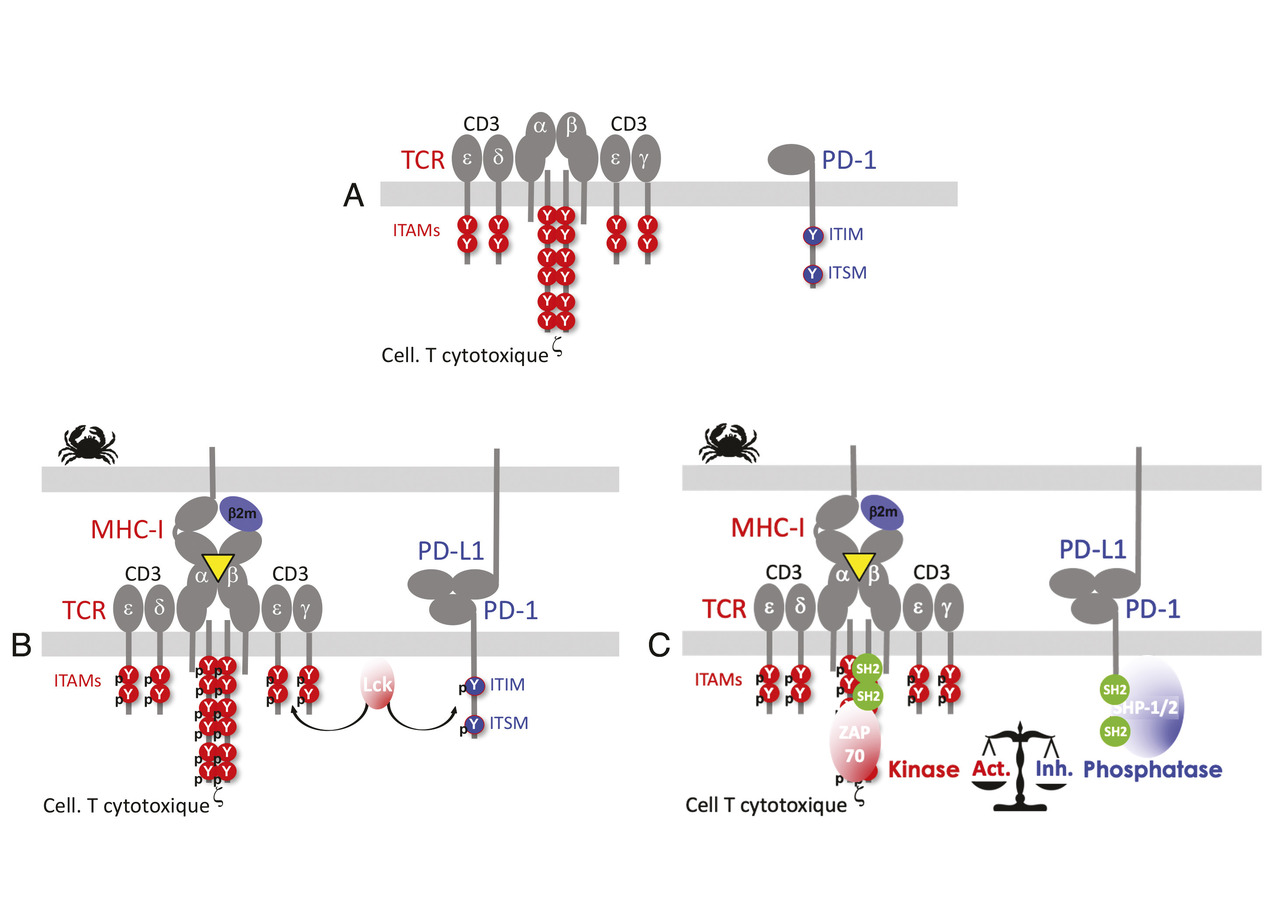
CTLA4 et PD-1 ne fonctionnent pas de la même façon. On connaît moins bien les mécanismes moléculaires utilisés par CTLA4 pour inhiber l’activation des cellules T que ceux qu’utilise PD-1. PD-1 possède dans son domaine intracytoplasmique deux motifs d’inhibition dont un appartient à la famille des immunoreceptor tyrosine-based inhibition motifs (ITIM). L’engagement de récepteurs à ITIM avec des récepteurs activateurs induit la phosphorylation des ITIM par des tyrosine-kinases de la famille Src. L’ITIM ainsi phosphorylé permet le recrutement de phosphatases qui déphosphorylent des molécules de signalisation et arrêtent ainsi l’activation cellulaire (fig. 3 ).13
Il existe beaucoup d’autres récepteurs à ITIM, et un grand nombre d’entre eux sont exprimés par les cellules impliquées dans les réponses immunitaires. Dans un travail antérieur, nous avons identifié les gènes de plus de 600 molécules à ITIM potentiels dans le génome humain.14 Toutes ces molécules sont autant de cibles possibles pour de nouveaux inhibiteurs du contrôle immunitaire. Après cette première vague d’immunothérapie centrée sur la manipulation des lymphocytes T, une deuxième génération d’agents immunothérapeutiques est donc attendue. Dans ce cadre, la manipulation de l’immunité innée tient une place centrale, car s’il est acquis que les lymphocytes T jouent un rôle déterminant dans le contrôle des cancers, des décennies d’immunologie nous ont enseigné que les lymphocytes T ne sont pas autonomes dans la mise en place de leurs fonctions antitumorales, mais nécessitent les divers types de cellules de l’immunité innée, à commencer par la présentation des antigènes tumoraux par les cellules dendritiques, mais aussi par la sécrétion des cytokines et chimiokines qui façonnent l’activité des lymphocytes T.15 On assiste donc à une multiplication des programmes précliniques et des essais cliniques visant à manipuler l’articulation entre le système immunitaire inné et la réponse adaptative T.
CTLA4 et PD-1 ne fonctionnent pas de la même façon. On connaît moins bien les mécanismes moléculaires utilisés par CTLA4 pour inhiber l’activation des cellules T que ceux qu’utilise PD-1. PD-1 possède dans son domaine intracytoplasmique deux motifs d’inhibition dont un appartient à la famille des immunoreceptor tyrosine-based inhibition motifs (ITIM). L’engagement de récepteurs à ITIM avec des récepteurs activateurs induit la phosphorylation des ITIM par des tyrosine-kinases de la famille Src. L’ITIM ainsi phosphorylé permet le recrutement de phosphatases qui déphosphorylent des molécules de signalisation et arrêtent ainsi l’activation cellulaire (
Il existe beaucoup d’autres récepteurs à ITIM, et un grand nombre d’entre eux sont exprimés par les cellules impliquées dans les réponses immunitaires. Dans un travail antérieur, nous avons identifié les gènes de plus de 600 molécules à ITIM potentiels dans le génome humain.14 Toutes ces molécules sont autant de cibles possibles pour de nouveaux inhibiteurs du contrôle immunitaire. Après cette première vague d’immunothérapie centrée sur la manipulation des lymphocytes T, une deuxième génération d’agents immunothérapeutiques est donc attendue. Dans ce cadre, la manipulation de l’immunité innée tient une place centrale, car s’il est acquis que les lymphocytes T jouent un rôle déterminant dans le contrôle des cancers, des décennies d’immunologie nous ont enseigné que les lymphocytes T ne sont pas autonomes dans la mise en place de leurs fonctions antitumorales, mais nécessitent les divers types de cellules de l’immunité innée, à commencer par la présentation des antigènes tumoraux par les cellules dendritiques, mais aussi par la sécrétion des cytokines et chimiokines qui façonnent l’activité des lymphocytes T.15 On assiste donc à une multiplication des programmes précliniques et des essais cliniques visant à manipuler l’articulation entre le système immunitaire inné et la réponse adaptative T.
Des milliers d’essais cliniques en cours
L’immunothérapie des cancers englobe deux catégories de traitements : les thérapies cellulaires avec en particulier les cellules CAR-T, et les thérapies à base d’anticorps monoclonaux avec les inhibiteurs du contrôle immunitaire. Malgré les progrès indéniables dans la prise en charge des cancers dus à l’immunothérapie, il reste que des résistances primaires ou secondaires à ces traitements se développent dans la majorité des cas. Par ailleurs, les toxicités limitent l’utilisation à la fois des inhibiteurs de contrôle immunitaire et des cellules CAR-T. Ces difficultés n’ont pas empêché les nouvelles approches d’immunothérapie de se multiplier de façon spectaculaire.
Le nombre de médicaments d’immunothérapie en cours de développement en 2020 est passé à 4 720, un nombre colossal, soit une augmentation de 22 % et 233 % par rapport à 2019 et à 2017 respectivement. L’examen de la croissance des principaux types d’immunothérapie révèle que des centaines de nouvelles thérapies cellulaires ont été ajoutées chaque année, conduisant à un quadruplement de cette approche thérapeutique depuis 2017. Le nombre d’agents d’immunothérapie ciblant d’autres types de cellules que les lymphocytes T (lymphocytes NK et B) a augmenté d’année en année, plus que ceux ciblant les lymphocytes T. L’examen du site ClinicalTrials.gov permet d’identifier 6 281 essais cliniques actifs testant des agents d’immunothérapie, ce qui représente une croissance de 14 % par rapport à 2019. Ces chiffres témoignent à la fois de l’effort sans précédent développé en immunothérapie des cancers et des progrès qui restent à faire dans ce domaine. La révolution que représentent les nouvelles immunothérapies du cancer, et notamment les inhibiteurs du contrôle immunitaire, ne fait que commencer.
Le nombre de médicaments d’immunothérapie en cours de développement en 2020 est passé à 4 720, un nombre colossal, soit une augmentation de 22 % et 233 % par rapport à 2019 et à 2017 respectivement. L’examen de la croissance des principaux types d’immunothérapie révèle que des centaines de nouvelles thérapies cellulaires ont été ajoutées chaque année, conduisant à un quadruplement de cette approche thérapeutique depuis 2017. Le nombre d’agents d’immunothérapie ciblant d’autres types de cellules que les lymphocytes T (lymphocytes NK et B) a augmenté d’année en année, plus que ceux ciblant les lymphocytes T. L’examen du site ClinicalTrials.gov permet d’identifier 6 281 essais cliniques actifs testant des agents d’immunothérapie, ce qui représente une croissance de 14 % par rapport à 2019. Ces chiffres témoignent à la fois de l’effort sans précédent développé en immunothérapie des cancers et des progrès qui restent à faire dans ce domaine. La révolution que représentent les nouvelles immunothérapies du cancer, et notamment les inhibiteurs du contrôle immunitaire, ne fait que commencer.
a. “For their discovery of cancer therapy by inhibition of negative immune regulation” https://www.nobelprize.org/prizes/medicine/2018/press-release/b. « Immune checkpoint inhibitors (ICI) ». Plutôt quel’anglicisme inhibiteurs de checkpoints » dans lequel on ne sait pas très bien qui inhibe quoi (« checkpoint » implique l’arrêt d’un processus) et où « immune » a été perdu (sans doute parce qu’on se demande s’il s’applique à « checkpoint » ou à « inhibitors »), nous proposons « inhibiteurs de contrôle immunitaire » qui est plus explicite. c. « Immunité » signifie « exemption de charge » (munus en latin). C’est à l’origine un terme juridique. Avant de protéger contre la maladie infectieuse, l’immunité a longtemps été un privilège accordé à certains de ne pas être assujetti à l’impôt ou de ne pas devoir porter les armes.d. Chez des patients infectés par le VIH-1, chez les patients greffés soumis à un traitement immunosuppresseur et chez des souris génétiquement modifiées sans système immunitaire. e. Les « toxines de Coley », comme on les appelle, ne sont pas des toxines, mais des bactéries.f. Littéralement le contraire de la prophylaxie.g. CD20 est exprimé par les lymphocytes B transformés et non transformés.
Références
1. Bridre J. Recherche sur le cancer expérimental des souris. Ann Institut Pasteur 1907;21:760.
2. Coley WB. The treatment of inoperable sarcoma by bacterial toxins (the mixed toxins of the streptococcus erysipelas and the bacillus prodigiosus). Proc R Soc Med 1910;3(Surg Sect):1-48.
3. Foley EJ. Antigenic properties of methylcholanthrene-induced tumors in mice of the strain of origin. Cancer Res 1953;13:835-7.
4. Burnet FM. Immunological surveillance in neoplasia. Transplant Rev 1971;7:3-25.
5. Rosenberg SA. IL-2: the first effective immunotherapy for human cancer. J Immunol Baltim Md 2014;192:5451-8.
6. Marshall MJE, Stopforth RJ, Cragg MS. Therapeutic antibodies: what have we learnt from targeting CD20 and where are we going? Front Immunol 2017;8:1245.
7. June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science 2018;359:1361-5.
8. Vivier E, Daëron M. Immunoreceptor tyrosine-based inhibition motifs. Immunol Today 1997;18:286-91.
9. Brunet JF, Denizot F, Luciani MF, et al. A new member of the immunoglobulin superfamily--CTLA-4. Nature 1987;328:267-70.
10. Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J 1992;11:3887-95.
11. Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996;271:1734-6.
12. Iwai Y, Terawaki S, Honjo T. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol 2005;17:133-44.
13. Fernandes RA, Su L, Nishiga Y, et al. Immune receptor inhibition through enforced phosphatase recruitment. Nature 2020;586:779-84.
14. Daëron M, Jaeger S, Du Pasquier L, Vivier E. Immunoreceptor tyrosine-based inhibition motifs: a quest in the past and future. Immunol Rev 2008;224:11-43.
15. Demaria O, Cornen S, Daëron M, Morel Y, Medzhitov R, Vivier E. Harnessing innate immunity in cancer therapy. Nature 2019;574:45-56.
2. Coley WB. The treatment of inoperable sarcoma by bacterial toxins (the mixed toxins of the streptococcus erysipelas and the bacillus prodigiosus). Proc R Soc Med 1910;3(Surg Sect):1-48.
3. Foley EJ. Antigenic properties of methylcholanthrene-induced tumors in mice of the strain of origin. Cancer Res 1953;13:835-7.
4. Burnet FM. Immunological surveillance in neoplasia. Transplant Rev 1971;7:3-25.
5. Rosenberg SA. IL-2: the first effective immunotherapy for human cancer. J Immunol Baltim Md 2014;192:5451-8.
6. Marshall MJE, Stopforth RJ, Cragg MS. Therapeutic antibodies: what have we learnt from targeting CD20 and where are we going? Front Immunol 2017;8:1245.
7. June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science 2018;359:1361-5.
8. Vivier E, Daëron M. Immunoreceptor tyrosine-based inhibition motifs. Immunol Today 1997;18:286-91.
9. Brunet JF, Denizot F, Luciani MF, et al. A new member of the immunoglobulin superfamily--CTLA-4. Nature 1987;328:267-70.
10. Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J 1992;11:3887-95.
11. Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996;271:1734-6.
12. Iwai Y, Terawaki S, Honjo T. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol 2005;17:133-44.
13. Fernandes RA, Su L, Nishiga Y, et al. Immune receptor inhibition through enforced phosphatase recruitment. Nature 2020;586:779-84.
14. Daëron M, Jaeger S, Du Pasquier L, Vivier E. Immunoreceptor tyrosine-based inhibition motifs: a quest in the past and future. Immunol Rev 2008;224:11-43.
15. Demaria O, Cornen S, Daëron M, Morel Y, Medzhitov R, Vivier E. Harnessing innate immunity in cancer therapy. Nature 2019;574:45-56.