Pour éliminer le virus, le dépistage en France doit être universel
Le virus de l’hépatite C (VHC) est à l’origine d’hépatites aiguës spontanément résolutives dans un tiers des cas et a été identifié en 1988 comme étant un virus à ARN responsable de la majorité des hépatites « non A, non B » à transmission parentérale. Le taux élevé de passage à la chronicité de l’infection virale C de 70 % explique qu’environ 71 millions d’individus dans le monde ont une infection chronique par le VHC.1 Ce virus est, au moins dans les pays industrialisés, l’une des causes principales de transplantation hépatique et de carcinome hépatocellulaire, dont l’augmentation est prévue jusqu’à environ 2030.2, 3 La véritable révolution thérapeutique à laquelle on assiste aujourd’hui est unique par la rapidité de développement de nouveaux traitements (constamment plus efficaces et mieux tolérés), par l’agrément des agences d’enregistrement pour la mise sur le marché de molécules testées sans groupe contrôle et parfois sur un nombre limité de patients, ou par la discussion sur les prix avec le Comité économique des produits de santé. Le caractère unique actuel est aussi que, d’une part, l’infection par le VHC est la seule infection chronique dont on puisse espérer guérir et que, d’autre part, le foie ayant une capacité unique de régénération, la fibrose est en permanence remodelée par des enzymes hépatiques, ce qui permet d’observer sa régression, en l’absence de comorbidité hépatique, si l’activité nécrotico-inflammatoire est modeste ou absente. Cette réparation partielle (ou complète) s’observe aussi pour les manifestations extrahépatiques. Ces progrès thérapeutiques invitent à un dépistage élargi, voire universel4, pour un accès plus large aux traitements les plus efficaces, dans la perspective d’une élimination de l’infection par le VHC.
L’infection chronique virale C, une maladie systémique
Épidémiologie et diagnostic
Le virus de l’hépatite C est un virus à ARN, enveloppé, appartenant à la famille des Flaviviridae. Les régions codant la protéase NS3/NS4, l’ARN polymérase NS5B et la région NS5A (protéine intervenant dans le complexe de réplication et dans la formation des particules virales) sont les cibles principales des nouveaux antiviraux.3, 5La présence des anticorps anti-VHC dépistée par la méthode immuno-enzymatique ELISA témoigne d’une rencontre antérieure avec le virus et doit être confirmée sur un deuxième prélèvement. En cas de positivité des anticorps anti-VHC, le caractère actif de l’infection, c’est-à-dire la présence d’une réplication virale, est affirmé par l’identification de l’ARN viral par une technique de reverse transcriptase-polymerase chain reaction (RT-PCR). La séroconversion anti-VHC a lieu environ une dizaine de semaines après la contamination, mais peut être retardée chez les immunodéprimés, ce qui peut justifier en cas d’exposition ou d’hypertransaminasémie inexpliquée de faire d’emblée une RT-PCR car la virémie est détectable dans la semaine suivant l’infection. La RT-PCR permet une quantification de la charge virale et l’identification du ou des génotypes. Il existe au moins sept génotypes principaux. La prévalence de l’infection chronique par le VHC dans le monde décroît, puisque nous sommes passés de 150 millions dans les années 1990 à 71 millions de personnes en 2016.1 Les régions les plus touchées sont l’Afrique, l’Asie centrale et l’Asie. En 2004, en France, la prévalence estimée était de 0,83 % (enquête de l’Institut de veille sanitaire chez des assurés sociaux), soit environ 232 000 adultes contre 1,2 % en 1996 ; l’évaluation la plus récente par modélisation rapporte une prévalence autour de 0,47 % correspondant à 175 000 sujets adultes dont environ 40 % n’auraient pas été diagnostiqués.Le virus de l’hépatite C a une transmission princi- palement parentérale. Les infections nosocomiales, notamment par la transfusion sanguine, ont été la cause principale en France avant 1990 (et le reste dans les pays en développement). Dans les pays développés, l’usage de drogues par voie intraveineuse (et éventuellement par voie nasale) est aujourd’hui le mode principal de transmission du virus. Le risque de transmission sexuelle est faible (< 1 %) chez les couples hétérosexuels stables mais peut être augmenté en cas de rapports sexuels traumatiques, en particulier chez les hommes ayant des relations sexuelles avec des hommes, particulièrement mais pas uniquement chez ceux infectés par le virus de l’immunodéficience humaine (VIH). Le risque est alors sans doute plus parentéral (fist fucking, chemsex) que sexuel.Le risque de transmission de la mère à l’enfant est de l’ordre de 5 % mais est multiplié par 4 en cas d’infection associée par le VIH. La moitié des enfants contaminés par transmission materno-infantile guérissent dans les deux premières années de vie.D’autres modes de contamination (transcutanés, communautaires, folkloriques…) existent puisque aucun facteur de risque n’est identifié chez environ 20 % des patients infectés par le VHC ; on suspecte des risques comportementaux oubliés, voire déniés ou nosocomiaux ignorés, les soins dentaires, les tatouages ou le piercing.
Une maladie hépatique et extrahépatique
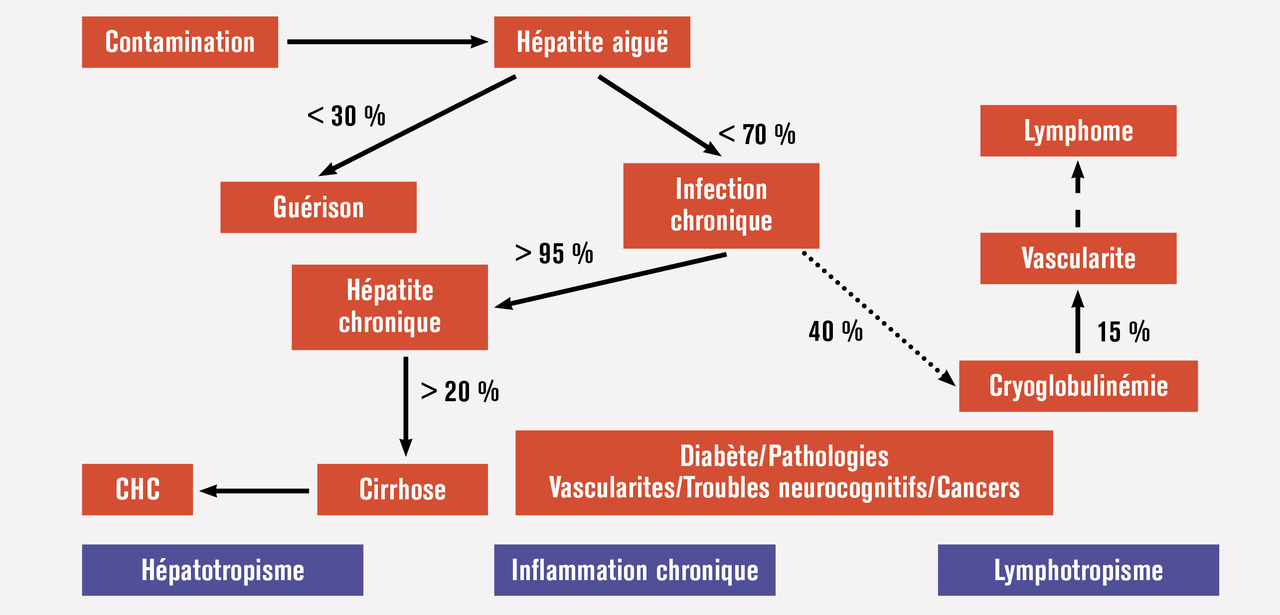
L’histoire naturelle de l’infection virale C est caractérisée par une hépatite aiguë survenant 5 à 45 jours après la contamination : si l’hypertransaminasémie est constante, l’ictère ne sera présent que dans 20 % des cas. Il n’y a pas de forme fulminante de l’hépatite aiguë, dont le taux de guérison spontanée est de l’ordre d’un tiers : l’évolution vers la chronicité est donc observée dans 60 à 80 % des cas. Les patients ayant eu une hépatite aiguë C résolutive (anti-VHC+ et ARN VHC négatif par RT-PCR) sont guéris : aucune prise en charge diagnostique ou thérapeutique n’est nécessaire, mais ils ne sont pas protégés du risque de réinfection en cas de réexposi- tion (transfusions itératives des hémoglobinopathies dans les années 1970-1980, par exemple, mais surtout aujourd’hui les homosexuels masculins ou les usagers de drogues avec des risques de 25 % et 15 % à 3 ans respectivement).6 Guérir de l’hépatite C ne confère en effet que peu d’immunité protectrice. Cela souligne l’intérêt de la poursuite de la recherche vaccinale mais surtout le renforcement des mesures d’éducation sur les risques comportementaux pour réduire le risque de réinfection. L’infection virale C est marquée par trois types d’atteinte : hépatique, vasculaire via la vascularite cryoglobulinémique et générale correspondant respectivement à l’hépatotropisme et au lymphotropisme du VHC et à l’inflammation chronique associée à l’infection.
Hépatotropisme du VHC
L’atteinte hépatique en cas d’infection chronique par le VHC est principalement immunomédiée : la reconnaissance des hépatocytes infectés par les lymphocytes T cytotoxiques est responsable de l’hépatite chronique2, 3 caractérisée par une activité nécrotico-inflammatoire et une fibrose. Elle entraîne dans un tiers des cas une fibrose extensive ou une cirrhose, qui favorisent la survenue du carcinome hépatocellulaire par la régénération hépatique (fig. 1 ). La capacité directement transformante de certaines protéines virales, NS3 ou protéine de core, est discutée et rendrait compte des rares cas de carcinome hépatocellulaire observés en l’absence de fibrose extensive ou de cirrhose.Le risque de cirrhose est très significativement accru par les comorbidités hépatiques : syndrome métabolique ou stéatohépatites non alcoolique (associant au moins deux des éléments suivants : surpoids, hypercholesté- rolémie, diabète, hypertension artérielle ou hyperuri- cémie) et alcoolique, infection associée par le virus de l’hépatite B (VHB). En cas de cirrhose, le risque est celui du carcinome hépatocellulaire, dont l’incidence annuelle est de 3 à 5 % à partir de la constitution de la cirrhose. Les principaux facteurs associés à la progression de la fibrose sont : le sexe masculin, l’âge élevé à la contamination, une transplantation d’organe, la surconsommation d’alcool, le syndrome métabolique, un génotype 3 et une co-infection VIH ou VHB. Les principaux facteurs associés au risque de carcinome hépatocellulaire sont l’âge supérieur à 60 ans, le sexe masculin, la cirrhose, l’absence de traitement antiviral (ou de guérison), le syndrome métabolique incluant le diabète ; la prise de statines et/ou de met- formine réduirait le risque.
Lymphotropisme du VHC
Le lymphotropisme du VHC explique la présence d’une cryoglobulinémie, le plus souvent mixte de type II (contingent polyclonal immunoglobuline G [IgG] et monoclonal IgM kappa à type de facteur rhumatoïde) chez 40 % des patients infectés ; au moins 10 % des patients cryoglobulinémiques peuvent avoir des manifestations cutanées (purpura vasculaire), rhumatologiques (polyarthrite), néphrologiques (glomérulonéphrite membranoproliférative) ou neurologiques (polyneuropathie périphérique) par dépôts dans les artères de petit et moyen calibre de complexes antigène/anticorps anti-VHC et de cryoglobuline. Les atteintes neurologiques centrales par vascularite cryoglobulinémique sont rares, mais l’asthénie est fréquente. Il existe aussi un risque de lymphome (notamment de lymphome splénique villeux).7 Le lymphome est lié à l’infection chronique du lymphocyte B par sélection clonale des lymphocytes infectés et/ou à l’activation lymphocytaire en rapport avec l’inflammation chronique.
Inflammation chronique et VHC
D’autres manifestations extrahépatiques témoignant de l’inflammation chronique associée à l’infection virale C (activation lymphocytaire comme celle de l’infection par le VIH) sont observées, avec un risque relatif de 1,5 à 3 de diabète non insulinodépendant, d’atteintes cardio-, cérébro- ou rénovasculaires et également de cancers extrahépatiques (fig. 1 ). Parmi les manifestations extrahépatiques, la fatigue est souvent au premier plan avec parfois des troubles neurocognitifs (troubles de concentration, des capacités de mémorisation ou de joie de vivre, ralentissement idéomoteur). Ils sont aussi une indication au traitement antiviral.
Traitement de l’infection virale C
Bénéfices associés à la guérison
L’infection virale C est la seule infection virale chronique dont il soit possible de guérir : il n’y a pas de réservoir viral et la réponse virologique prolongée correspond à une vraie guérison : l’ARN viral reste indétectable dans les potentiels lieux de réplication, foie comme cellules mononucléées ;7 il n’y a pas de rechute tardive même en cas d’immunosuppression puissante, comme après transplantation. Ces 20 dernières années, le traitement du VHC a évolué, avec un taux croissant de réponses virologiques prolongées. Depuis 1997, une injection sous-cutanée hebdomadaire d’interféron pégylé associée à la ribavirine augmentait l’efficacité thérapeutique, permettant de guérir l’infection de 45 %, 85 %, 70 %, 65 % des sujets infectés respectivement par un génotype 1, 2, 3, et 4,9 au prix de nombreux effets secondaires liés à l’interféron (syndrome pseudogrippal, troubles neurocognitifs, immunostimulation de situations préexistantes asymptomatiques –tuberculose, sarcoïdose, dysthyroïdie, diabète, hypoplasie médullaire…) ou à la ribavirine (troubles neurocognitifs, éruptions cutanées, prurit, toux, sécheresse cutanéomuqueuse, anémie…), d’autant plus fréquents que le traitement était prolongé de 24 (génotypes 2 et 3) à 48 (génotypes 1, 4, 5) voire 72 semaines (génotype 1 avec réponse virologique lente).La réponse virologique prolongée obtenue avec les traitements actuels est bénéfique sur les plans hépatique et extrahépatique : on note une disparition de l’asthénie dans deux tiers des cas si elle préexistait, une normalisation de l’hypertransaminasémie, une disparition des adéno- pathies du pédicule cœliaque et des manifestations extra- hépatiques (cutanées, articulaires, neurologiques, rénales) de vascularite cryoglobulinémique, incluant même la rémission des lymphomes.3, 7 La réponse virologique prolongée permet le remodelage de la fibrose hépatique en l’absence de comorbidité hépatique (surpoids, diabète, surconsommation d’alcool) même au stade de cirrhose10 expliquant que la morbi-mortalité hépatique soit réduite, particulièrement en cas de cirrhose préexistante (quasi- disparition des complications non carcinomateuses de la cirrhose et réduction significative de l’incidence du carcinome hépatocellulaire ou de sa récidive). L’amélioration histologique est observée chez 94 % des patients guéris, avec une normalisation dans 62 % des cas. Un éventuel effet antifibrosant de l’interféron utilisé dans le traitement des hépatites était suggéré mais ne peut être attendu avec les antiviraux directs.* Le concept de la réversibilité des cirrhoses, contredisant le dogme historique de l’irréversibilité, est aujourd’hui admis (quelle que soit la cause de la cirrhose) puisqu’il est décrit une réversion de la cirrhose histologiquement prouvée chez 10 à 30 % des patients traités, principalement répondeurs virologiques à long terme et tous ayant une cirrhose de bon groupe (Child A).10 L’arrêt durable de la multiplication virale permet en effet de réduire puis d’annuler l’activité nécrotico-inflammatoire de l’hépatopathie et à moyen terme d’espérer une régression de la fibrose, caractéristique des capacités régénératives du foie. La présence de comorbidités hépatiques (syndrome métabolique et alcoolisation chronique) limite la capacité de réversibilité : elles doivent être contrôlées pour réduire le risque de survenue de complications.11De larges cohortes rétrospectives, mais surtout prospectives, de sujets mono-infectés par le VHC virémiques ou non virémiques12 ou co-infectés VIH-VHC ayant une réponse virologique prolongée ou non ont montré une réduction de la mortalité globale, hépatique ou extrahépatique (cardiovasculaire, cérébrovasculaire ou par cancer extrahépatique) en cas de guérison. Surtout, la cohorte prospective Cirvir de l’ANRS (d’environ 1 350 cirrhoses compensées histologiquement prouvées liées à l’infection au VHC) a montré que la guérison virologique réduit significativement le risque de carcinome hépatocellulaire, de décompensation de la cirrhose, d’infections bactériennes et les risques vasculaires de 50 % à 3 ans.
Une révolution thérapeutique
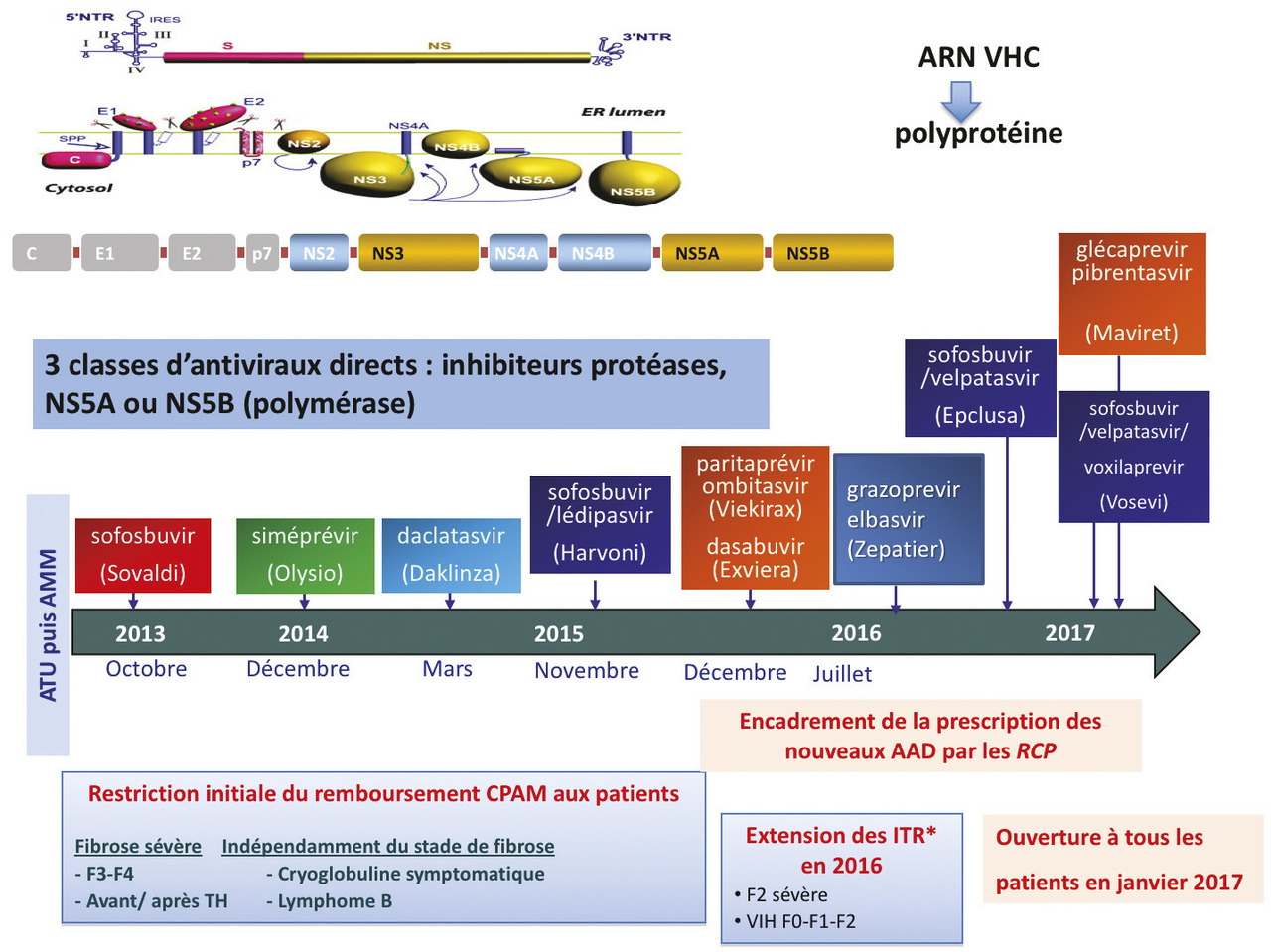
La meilleure connaissance des mécanismes d’entrée ou de relargage du VHC au cours des années 20005 et la caractérisation des protéines virales impliquées dans la réplication du VHC ont permis le développement d’antiviraux spécifiques du VHC (fig. 2 ).2, 3
Les inhibiteurs de protéases de 1re génération
Des inhibiteurs de protéases, et notamment le télaprévir et le bocéprévir, ont été les premiers mis sur le marché en France en 2011, permettant chez les sujets infectés par un VHC de génotype 1, en combinaison avec l’interféron et la ribavirine, d’obtenir une fréquence plus élevée de guérison virologique (70 % chez les sujets naïfs de traitement antérieur, 85 % chez les patients précédemment rechuteurs, environ 50 % chez les répondeurs partiels et seulement 30 % chez les « répondeurs nuls » à un précédent traitement par interféron pégylé et ribavirine) avec une réduction de 48 à 24 semaines de la durée du traitement chez la moitié des patients. La limite principale de ces traitements était celle des effets indésirables, qui s’ajoutaient à ceux liés au traitement classique : effets cutanés pour le télaprévir avec des rashs sévères dans 5 à 10 % des cas et anémie pour le télaprévir ou le bocéprévir majorant celle de la ribavirine. Ces deux antiviraux oraux ont constitué la première étape de la révolution thérapeutique et restaient le traitement de référence des infections liées au génotype 1 en 2012-2013, indispensables notamment chez les patients ayant une cirrhose, une fibrose extensive ou une fibrose intermédiaire mais des comorbidités hépatiques (surconsommation d’alcool, surpoids) qui favorisent une progression rapide de la fibrose.3 Les progrès ont été tellement rapides que ces trithérapies n’étaient déjà plus recommandées en janvier 2014 dans les recommandations américaines, soit deux ans après leur autorisation de mise sur le marché…L’efficacité accrue de ces nouvelles stratégies a annulé l’impact négatif de l’infection par le VIH associée : les recommandations thérapeutiques sont devenues les mêmes chez les co-infectés VIH-VHC et les mono-infectés VHC, au-delà des risques d’interactions médicamenteuses, notamment entre les inhibiteurs de protéases du VHC et les antirétroviraux (voir le site hep-druginteractions**).
Les inhibiteurs spécifiques de 2e vague et 2e génération de 2018
De nombreux autres antiviraux ont été développés, inhibiteurs de la polymérase NS5B nucléosidiques et nucléotidiques, inhibiteurs du complexe de réplication NS5A ou inhibiteurs de protéases de deuxième génération.14, 15 Ces nouveaux antiviraux ont été, pour un temps court, associés à l’interféron pégylé et la ribavirine, permettant d’obtenir une guérison des patients dans 75 à 90 % des cas. Cette deuxième phase de progrès, marquée par un éventail élargi de nouvelles armes thérapeutiques, l’a aussi été par une réduction de la durée des traitements (12 à 24 semaines) et du nombre de gélules.La vraie révolution a été le développement de stratégies thérapeutiques combinant des antiviraux directs souvent coformulés en une seule gélule et s’affran- chissant de l’interféron pégylé, puis de la ribavirine.14, 15 Ces multithérapies orales ont l’avantage d’être mieux tolérées, d’autoriser une prise moindre de comprimés et une réduction de la durée des traitements de 24 à 12 voire 8 semaines. Surtout, ces combinaisons orales permettent d’espérer plus de 95 % de guérison. Les différentes classes thérapeutiques disponibles sont les inhibiteurs de la protéase NS3/4A (siméprévir, paritaprévir, grazoprévir, voxilaprévir), les inhibiteurs de NS5A (daclatasvir, lédipasvir, ombitasvir, elbasvir, velpatasvir) et les inhibiteurs de la polymérase NS5B (sofosbuvir, dasabuvir) [fig. 2 ]. Ces multithérapies orales de 8, 12, 16 à 24 semaines (associés ou non à la ribavirine) permettront à moyen terme de guérir tous les patients. Les recommandations concernant la prise en charge de l’hépatite C évoluent actuellement très rapidement***.En résumé, ces multithérapies orales de 8 à 16 semaines ont une tolérance satisfaisante et permettront à moyen terme de guérir tous les patients par une activité pangé- notypique, en l’absence de résistance croisée entre les différentes classes d’antiviraux. Deux molécules de 2e génération ont été approuvées en 2017 et seront sur le marché au premier trimestre 2018 ; de nouvelles cibles (inhibiteurs d’entrée, inhibiteurs du relargage) sont en développement, et d’autres stratégies antivirales, inhibiteurs de la cyclophiline, ARN anti-sens voire vaccinothérapie, pourraient aider aux rares situations d’échec, principalement liées à l’inobservance et aux résistances virales. Depuis janvier 2017, le traitement est pris en charge pour tous les patients infectés (chroniques) par le VHC ; précédemment, une politique de priorisation de l’accès au traitement avait été préférée selon la sévérité des patients : fibrose F4 en 2014, F3-F4 en 2015 puis au moins F2 en 2016, ou, quel que soit le stade de fibrose, co-infection par le VIH, cryoglobulinémie mixte (II ou III) systémique et symptomatique incluant les lymphomes B associés au VHC, asthénie invalidante, ou risque élevé de contagiosité. La prescription devait être validée lors d’une réunion de concertation pluridisciplinaire qui décidait du choix thérapeutique le plus adapté à la situation générale.
Surveillance des sujets guéris
Selon les recommandations internationales, la suspension du suivi des patients guéris peut s’envisager 2 ans après la guérison mais cela se limite aux patients ayant une hépatopathie modérée et l’absence de comorbidités hépatiques. Pour les autres, un suivi régulier doit être maintenu : échographie semestrielle et bilan biologique annuel pour ceux qui avaient initialement une fibrose extensive ou une cirrhose, pour le dépistage du carcinome hépatocellulaire dont le risque est réduit mais pas nul.Pour les patients ayant une comorbidité hépatique (syndrome métabolique dont diabète, obésité ou surconsommation d’alcool…), les risques d’aggravation d’une maladie hépatique qui ne serait plus viro-induite mais toxique (40 % des sujets guéris prennent du poids) justifient le maintien d’un suivi médical avec biologie et échographie annuels.Pour ceux gardant des facteurs de risque d’exposition (principalement usagers de drogues actifs, hommes ayant des relations sexuelles avec les hommes, migrants recevant des soins médico-chirurgicaux dans leur pays d’origine…), une réinfection potentielle doit être recherchée par polymerase chain reaction.Pour les patients ayant une cryoglobulinémie initiale, les recommandations sont moins formelles : la moitié seulement des sujets guéris vont négativer à 2 ans leur cryoglobulinémie et leur suivi pourra alors être suspendu. Pour les autres, qui gardent une cryoglobu- linémie détectable, se pose la question du maintien d’une surveillance médicale, incluant une surveillance biologique (cryoglobulinémie certes mais l’intérêt du suivi de la lymphocytose, du complément ou du facteur rhumatoïde est discuté).
Défis de la guérison de l’infection par le VHC
Élimination, dépistage et accès au traitement
Grâce aux combinaisons efficaces d’antiviraux, des politiques nationales d’élimination du VHC sont mises en place dans de nombreux pays (Géorgie, Seychelles…). L’espoir réaliste d’élimination (plus que d’éradication) du VHC suppose des politiques de dépistage actives. Au niveau mondial, probablement moins de 10 % de la population infectée a été dépistée et il existe une relation inverse entre la prévalence et l’efficacité du dépistage ; en France, il est estimé que 65 % de la population infectée a été dépistée, sans doute principalement du fait du traumatisme du scandale du sang contaminé dans les années 1980. Les politiques proposées de dépistage varient selon les pays et leur épidémiologie propre. Le dépistage de tous les babyboomers nés entre 1945 et 1965 proposé aux États-Unis serait une politique inadaptée en Italie où la moyenne d’âge des sujets infectés est de l’ordre de 70 ans contre 57 ans en France. En France, le rapport d’experts de 2015 suggérait de dépister tous les hommes de plus de 18 ans et toutes les femmes enceintes, négligeant l’important contingent de femmes septuagénaires majoritairement infectées lors des transfusions de la délivrance ou de chirurgies gynécologiques avant 1990 ; c’est pourquoi l’actualisation de 2016 propose un dépistage universel. Le remboursement des tests rapides d’orientation diagnostique (TROD) devrait améliorer le dépistage des populations précaires, des usagers de drogues de bas seuil, des prisonniers et des migrants, souvent éloignés des systèmes de soins.Le dépistage amélioré, il faudra aussi améliorer le système d’accès au traitement et en lever les freins, dont les prises en charge sociales, là encore pour les populations les plus marginales et sans droit, qui représentent la majorité des nouvelles contaminations. Échecs thérapeutiques et résistance virale Les traitements antiviraux oraux permettent environ 95 % de guérison virologique, ce qui signifie que 5 % des sujets traités ne sont pas guéris. Au-delà de la non- observance, cause première qui souligne l’intérêt de l’éducation thérapeutique même pour des traitements courts et bien tolérés, ou de rares arrêts prématurés liés à des effets secondaires sévères (< 2 %), ces échecs sont principalement virologiques, liés à l’émergence de résistances (mutations de substitution pouvant induire une résistance). Environ 15 % des patients jamais traités ont des résistances préexistantes qui ne limitent qu’inconstamment l’efficacité des traitements. Chez les sujets en échec des antiviraux oraux, les taux de résistance sont plus élevés (environ 75 % pour la région NS5A, 40 % pour les NS3/4 et rarissimes pour les inhibiteurs nucléotidiques de polymérase). Les recommandations européennes, fondées sur l’analyse des résistances ou empiriques (switch à un inhibiteur de protéase quand on a précédemment utilisé un inhibiteur NS5A et réci- proquement, combinaison au sofosbuvir et ajout de la ribavirine pour 12 à 24 semaines) permettent la guérison de la plupart de ces patients en échec. Enfin, la nouvelle trithérapie combinant un inhibiteur de protéase, le voxilaprevir, au sofosbuvir et au velpatasvir permet la guérison de plus de 98 % de ces patients.
Le coût élevé des traitements
Une des limites du traitement, au moins pour les pays moins aisés que ceux de l’Europe du Nord ou les États-Unis, était aussi celle du coût (aux alentours de 35 000 € pour les coûts directs) et le nombre de gélules : 6 gélules pour le télaprévir et 12 gélules pour le bocéprévir, prises toutes les 8 ou 12 heures au moment d’un repas graisseux, s’additionnant aux 4 à 6 gélules de ribavirine.Le coût élevé des traitements (environ 40 000 € en France pour la guérison) a malheureusement dilué le message sur la guérison et la nécessité d’améliorer le dépistage et l’accès aux traitements. Les analyses médico-économiques ont montré que ces traitements étaient coût-efficaces même aux prix trop élevés de 2015-2016. Les prix ont mécaniquement baissé à partir de janvier 2017. Et surtout du fait de l’efficacité des traitements, nous avons la capacité de guérir tous les Français en 5 à 10 ans à des prix incomparablement inférieurs (700 millions d’euros par an) à ceux des analgésiques généraux, des antidiabétiques, des antirétroviraux, des antiarythmiques, des anticancéreux… dont chaque ligne coûte plus de 1 (à 4) milliard(s) d’euros, renouvelés chaque année pour « seulement » stabiliser des maladies chroniques. Enfin, rappelons que, comme pour le VIH, la mise à disposition de génériques, avec ou sans brevet partagé avec les compagnies pharmaceutiques, permet d’espérer aujourd’hui des prix entre 125 US dollars (générique de sofosbuvir et daclatasvir au Cambodge), 295 US dollars (générique de sofosbuvir et ravidasvir en Égypte) ou 750 US dollars (sofosbuvir et lédipasvir distribué en Inde par Mylan mais qui peut être commandé à l’échelle individuelle en France !).
En résumé, 30 ans après sa découverte et l’année suivant sa première visualisation en microscopie électronique, l’histoire du virus de l’hépatite C semble s’achever, avec la promesse que presque tous les patients dépistés seront guéris. De nombreux défis restent cependant à relever dont celui du dépistage et de l’amélioration de l’accès aux soins, notamment pour les populations les plus vulnérables qui sont la cible principale de l’infection virale C (usagers de drogues, détenus, précaires, migrants…) et qui sont encore très loin de l’accès au diagnostic et aux traitements. Mais on peut espérer que le développement des tests rapides d’orientation diag- nostique et les nouveaux traitements, mieux tolérés, plus efficaces et surtout plus faciles à prendre, pourront améliorer la prise en charge. Il existe aussi un défi économique car les traitements coûtent cher et il fau- dra apporter la preuve aux payeurs que la guérison de l’infection virale C est « coût-efficace » par la réduction de la morbi-mortalité hépatique mais aussi extrahépatique. Cela ne dispensera pas de se battre pour réduire les coûts. Le dernier défi est préventif : le développement d’un vaccin prophylactique est essentiel mais reste limité par la très grande variabilité du virus. Ainsi, si la réalité théorique permet d’espérer une élimination plus qu’une éradication complète de l’infection virale C dans les pays favorisés, l’essentiel reste à faire.
En résumé, 30 ans après sa découverte et l’année suivant sa première visualisation en microscopie électronique, l’histoire du virus de l’hépatite C semble s’achever, avec la promesse que presque tous les patients dépistés seront guéris. De nombreux défis restent cependant à relever dont celui du dépistage et de l’amélioration de l’accès aux soins, notamment pour les populations les plus vulnérables qui sont la cible principale de l’infection virale C (usagers de drogues, détenus, précaires, migrants…) et qui sont encore très loin de l’accès au diagnostic et aux traitements. Mais on peut espérer que le développement des tests rapides d’orientation diag- nostique et les nouveaux traitements, mieux tolérés, plus efficaces et surtout plus faciles à prendre, pourront améliorer la prise en charge. Il existe aussi un défi économique car les traitements coûtent cher et il fau- dra apporter la preuve aux payeurs que la guérison de l’infection virale C est « coût-efficace » par la réduction de la morbi-mortalité hépatique mais aussi extrahépatique. Cela ne dispensera pas de se battre pour réduire les coûts. Le dernier défi est préventif : le développement d’un vaccin prophylactique est essentiel mais reste limité par la très grande variabilité du virus. Ainsi, si la réalité théorique permet d’espérer une élimination plus qu’une éradication complète de l’infection virale C dans les pays favorisés, l’essentiel reste à faire.
* Les antiviraux directs sont bien tolérés. Si des effets indésirables sont rapportés chez 40 à 85 % des patients, ils sont rarement plus fréquents dans les essais contrôlés randomisés en double aveugle dans le groupe « verum » que dans le groupe « placebo ». Ils peuvent même être moins fréquents avec certaines combinaisons. Ceux le plus souvent rapportés sont des céphalées, une asthénie et des troubles digestifs. Ils ne sont responsables d’arrêt du traitement que dans moins de 1 % des cas. Sur le plan biologique, on note de rares hypertransami-nasémies rares ou une hyperbilirubinémie non conjuguée avec certains inhibiteurs de protéases.
**https://www.hep-druginteractions.org/*** www.afef.asso.fr
**https://www.hep-druginteractions.org/*** www.afef.asso.fr
Références
1. World Heath Organization. WHO Global Hepatitis Report 2017. http://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/
2. American Association for the Study of Liver Diseases. Recommendations for testing, managing, and treating hepatitis C. AASLD-IDSA, 2017; http://www.hcvguidelines.org.
3. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis C virus infection. J Hepatol 2011;55:245-64.
4. Ministère des Affaires sociales et de la Santé. Prise en charge thérapeutique et suivi de l’ensemble des personnes infectées par le virus de l’hépatite C. Rapport de recommandations ANRS-CNS, 2016. http://solidarites-sante.gouv.fr/IMG/pdf/rapport_.pdf
5. Buhler S, Bartenschlager R. New targets for antiviral therapy of chronic hepatitis C. Liver Int 2012;32(suppl):19-6.
6. Simmons B, Saleem J, Hill A, Riley RD, Cooke GS. Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response: a systematic review and meta-analysis. Clin Infect Dis 2016;15:62:68394.
7. Hermine O, Lefrère F, Bronowicki JP, et al. Regression of splenic lymphoma with lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002;347:89-94.
8. Fontaine H, Chaix ML, Lagneau JL, et al. Recovery from chronic hepatitis C in long-term responders to ribavirin plus interferon alfa. Lancet 2000;356:41.
9. Mchutchison JG, Lawitz, EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatement of hepatitis C infection. N Engl J Med 2009;361:580-93.
10. Mallet V, Gilgenkrantz H, Serpaggi J, et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med 2008;149:399-403.
11. Trinchet JC, Bourcier V, Chaffaut C, et al. Complications and competing risks of death in compensated viral cirrhosis (ANRS CO12 CirVir prospective cohort). Hepatology 2015;62:737-50.
12. Lee MH, Yang HI, Lu SN, et al. Chronic hepatitis C virus infection increases mortality from hepatic and extrahepatic diseases: a community-based long-term prospective study. J Infect Dis 2012;206:469-77.
13. Burger D, Back D, Buggish P, et al. Clinical management of drug-drug interactions in HCV therapy: challenges and solutions. J Hepatol 2013;58:792-800.
14. Zeuzem S, Ghalib R, Reddy KR, et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic HCV genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med 2015;163:1-13.
15. Bourliere M, Gordon SC, Flamm SL, et al. Sofosbuvir, velpatasvir, and voxilaprevir for previously treated HCV infection. N Engl J Med 2017;376:2134-46.
2. American Association for the Study of Liver Diseases. Recommendations for testing, managing, and treating hepatitis C. AASLD-IDSA, 2017; http://www.hcvguidelines.org.
3. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis C virus infection. J Hepatol 2011;55:245-64.
4. Ministère des Affaires sociales et de la Santé. Prise en charge thérapeutique et suivi de l’ensemble des personnes infectées par le virus de l’hépatite C. Rapport de recommandations ANRS-CNS, 2016. http://solidarites-sante.gouv.fr/IMG/pdf/rapport_.pdf
5. Buhler S, Bartenschlager R. New targets for antiviral therapy of chronic hepatitis C. Liver Int 2012;32(suppl):19-6.
6. Simmons B, Saleem J, Hill A, Riley RD, Cooke GS. Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response: a systematic review and meta-analysis. Clin Infect Dis 2016;15:62:68394.
7. Hermine O, Lefrère F, Bronowicki JP, et al. Regression of splenic lymphoma with lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002;347:89-94.
8. Fontaine H, Chaix ML, Lagneau JL, et al. Recovery from chronic hepatitis C in long-term responders to ribavirin plus interferon alfa. Lancet 2000;356:41.
9. Mchutchison JG, Lawitz, EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatement of hepatitis C infection. N Engl J Med 2009;361:580-93.
10. Mallet V, Gilgenkrantz H, Serpaggi J, et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med 2008;149:399-403.
11. Trinchet JC, Bourcier V, Chaffaut C, et al. Complications and competing risks of death in compensated viral cirrhosis (ANRS CO12 CirVir prospective cohort). Hepatology 2015;62:737-50.
12. Lee MH, Yang HI, Lu SN, et al. Chronic hepatitis C virus infection increases mortality from hepatic and extrahepatic diseases: a community-based long-term prospective study. J Infect Dis 2012;206:469-77.
13. Burger D, Back D, Buggish P, et al. Clinical management of drug-drug interactions in HCV therapy: challenges and solutions. J Hepatol 2013;58:792-800.
14. Zeuzem S, Ghalib R, Reddy KR, et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic HCV genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med 2015;163:1-13.
15. Bourliere M, Gordon SC, Flamm SL, et al. Sofosbuvir, velpatasvir, and voxilaprevir for previously treated HCV infection. N Engl J Med 2017;376:2134-46.
Dans cet article
- L’infection chronique virale C, une maladie systémique
- Hépatotropisme du VHC
- Lymphotropisme du VHC
- Inflammation chronique et VHC
- Traitement de l’infection virale C
- Les inhibiteurs de protéases de 1re génération
- Les inhibiteurs spécifiques de 2e vague et 2e génération de 2018
- Surveillance des sujets guéris
- Défis de la guérison de l’infection par le VHC