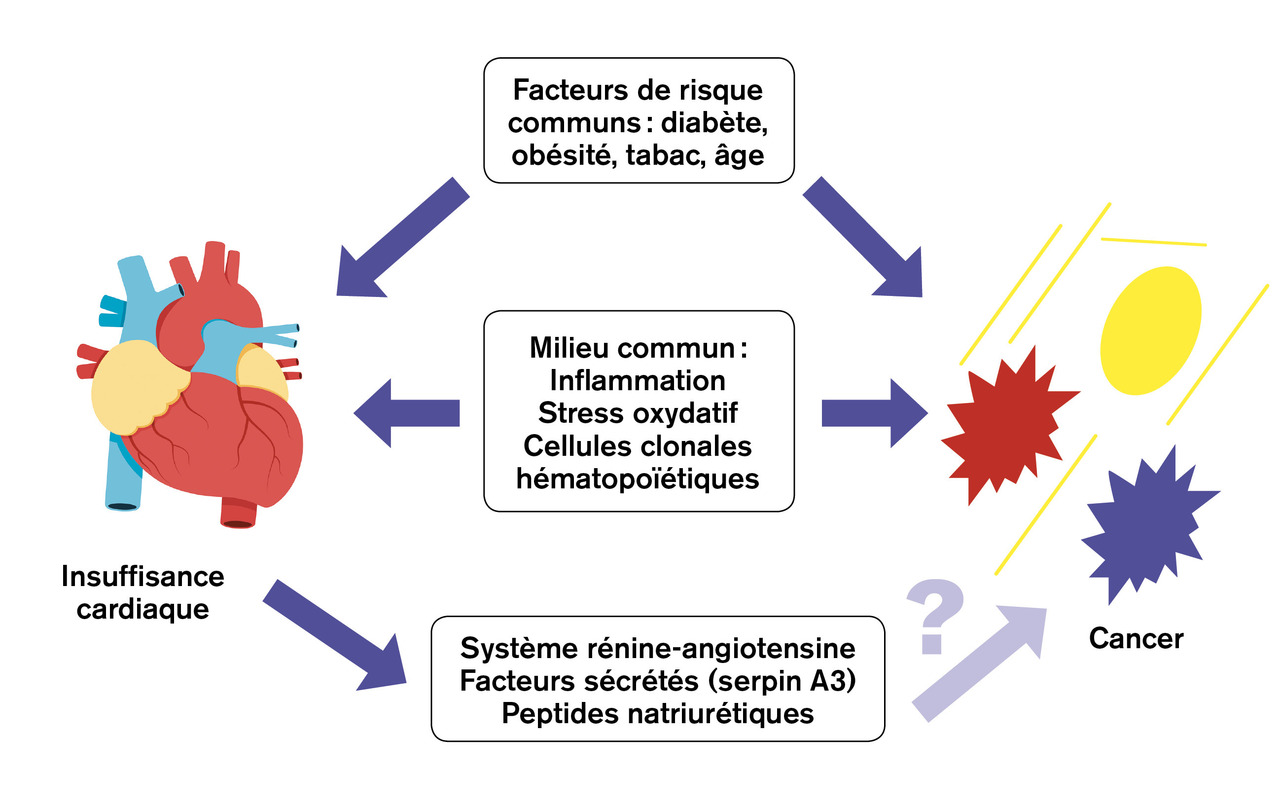
Les pathologies cardiovasculaires et le cancer sont les deux premières causes de mortalité non infantile à travers le monde. En raison du vieillissement de la population et de l’amélioration de la prise en charge du syndrome coronaire aigu, l’insuffisance cardiaque est devenue la pathologie cardiovasculaire à prévalence la plus élevée, touchant environ 34 millions de personnes dans le monde.1 Les traitements oncologiques comprenant chimiothérapies classiques, thérapies ciblées, immunothérapies et radiothérapies sont potentiellement pourvoyeurs d’insuffisance cardiaque. L’hypothèse d’une relation bidirectionnelle a été récemment soulevée (v. figure).
Apport de l’épidémiologie
Des données épidémiologiques ont fait soulever l’hypothèse d’une association entre l’insuffisance cardiaque et la survenue ultérieure de cancer(s).2, 3 Une équipe3 a montré pour la première fois que les patients qui ont une insuffisance cardiaque ont un risque augmenté de 60 % de développer un cancer par rapport à des personnes (appariés sur l’âge et le genre) sans insuffisance cardiaque, après ajustement pour l’indice de masse corporelle, le tabagisme et l’indice de comorbidité de Charlson. Une étude scandinave de plus grande envergure a confirmé ces données, homogènes pour l’ensemble des types de cancer, hormis le cancer de la prostate.2 Les arguments avancés en défaveur d’une causalité de l’insuffisance cardiaque comme facteur de risque de cancer étaient fondés sur les aspects méthodologiques des études épidémiologiques, en l’absence de prise en compte du risque compétitif ou de la taille relativement faible des échantillons. Une autre limite des études réalisées réside dans l’absence de prise en compte d’explorations radiologiques plus fréquentes chez les patients avec insuffisance cardiaque pouvant révéler des cancers à un stade précoce. Aussi, l’hétérogénéité des cancers potentiellement liés à l’insuffisance cardiaque soulève des questions sur le lien causal potentiel et les mécanismes impliqués.3
Apport de la recherche translationnelle
Outre de nombreux facteurs de risque partagés entre l’insuffisance cardiaque et le cancer (tabac, alcool, diabète, etc.), il existe de nombreux mécanismes physiopathologiques communs aux deux entités. Ces mécanismes communs sont les voies de l’inflammation, l’activation neuro-hormonale, le stress oxydatif et la dysimmunité en lien avec le vieillissement.
Des voies de l’inflammation sont activées au cours de l’insuffisance cardiaque, notamment dans les suites d’un syndrome coronaire aigu, ou avant, ou lors d’une décompensation aiguë. Il n’existe cependant pas de preuve directe de l’impact des protéines de l’inflammation sur la tumorogenèse, quoique des voies soient communes. La preuve indirecte de l’effet de l’inflammation a été apportée par une étude médicamenteuse industrielle. Le canakinumab, inhibiteur de l’interleukine-1-bêta, diminue non seulement le risque de récidive d’événement cardiovasculaire mais aussi l’incidence des cancers du poumon, signant ainsi l’importance de voies de signalisation communes entre la déstabilisation de plaques d’athérome et l’oncogenèse.4
L’activation du système rénine-angiotensine est l’une des voies adaptatives dans l’insuffisance cardiaque. Son implication dans la tumorogenèse demeure controversée. L’effet de l’angiotensine sur les récepteurs I ou II aurait des répercussions contraires sur la tumorogenèse ; l’inhibition du système rénine-angiotensine limiterait l’oncogenèse au cours de modèles murins du cancer du rein à cellules claires.
Le stress oxydatif joue un rôle pivot à la fois dans le métabolisme du cœur défaillant mais aussi dans celui de la cellule cancéreuse. Il n’existe cependant pas de données à ce jour démontrant l’impact de la bascule du métabolisme du cardiomyocyte défaillant sur la tumorogenèse.
Le rôle du système immunitaire dans l’insuffisance cardiaque d’origine ischémique est délétère lorsqu’il demeure activé au cours du temps. La défaillance de l’immunité joue, en revanche, un rôle péjoratif en termes de tumorogenèse. Le phénomène d’expansion clonale hématopoïétique constaté dans la population âgée (ou clonal hematopoiesis of indeterminate potential) est corrélé à la survenue d’hémopathies malignes et aux événements cardiovasculaires. Des modèles animaux ont mis en évidence le rôle de ces cellules hématopoïétiques clonales dans les mécanismes physiopathologiques de pathologies vasculaires.5
Récemment, le rôle de protéines sécrétées par le cœur défaillant dans la croissance tumorale a été démontré dans une étude translationnelle.6 Au cours d’un modèle murin de souris mutées avec prédisposition à la polypose colique, l’insuffisance cardiaque d’origine ischémique favorisait la croissance des tumeurs coliques. Via l’approche d’une protéine candidate, les auteurs ont identifié que le niveau de serpine A3 sécrétée par le cœur était associé à la survenue de tumeurs. Ce modèle murin ne s’applique néanmoins qu’à un seul type de cancer, le cancer colique chez des animaux génétiquement prédisposés.
Des voies de l’inflammation sont activées au cours de l’insuffisance cardiaque, notamment dans les suites d’un syndrome coronaire aigu, ou avant, ou lors d’une décompensation aiguë. Il n’existe cependant pas de preuve directe de l’impact des protéines de l’inflammation sur la tumorogenèse, quoique des voies soient communes. La preuve indirecte de l’effet de l’inflammation a été apportée par une étude médicamenteuse industrielle. Le canakinumab, inhibiteur de l’interleukine-1-bêta, diminue non seulement le risque de récidive d’événement cardiovasculaire mais aussi l’incidence des cancers du poumon, signant ainsi l’importance de voies de signalisation communes entre la déstabilisation de plaques d’athérome et l’oncogenèse.4
L’activation du système rénine-angiotensine est l’une des voies adaptatives dans l’insuffisance cardiaque. Son implication dans la tumorogenèse demeure controversée. L’effet de l’angiotensine sur les récepteurs I ou II aurait des répercussions contraires sur la tumorogenèse ; l’inhibition du système rénine-angiotensine limiterait l’oncogenèse au cours de modèles murins du cancer du rein à cellules claires.
Le stress oxydatif joue un rôle pivot à la fois dans le métabolisme du cœur défaillant mais aussi dans celui de la cellule cancéreuse. Il n’existe cependant pas de données à ce jour démontrant l’impact de la bascule du métabolisme du cardiomyocyte défaillant sur la tumorogenèse.
Le rôle du système immunitaire dans l’insuffisance cardiaque d’origine ischémique est délétère lorsqu’il demeure activé au cours du temps. La défaillance de l’immunité joue, en revanche, un rôle péjoratif en termes de tumorogenèse. Le phénomène d’expansion clonale hématopoïétique constaté dans la population âgée (ou clonal hematopoiesis of indeterminate potential) est corrélé à la survenue d’hémopathies malignes et aux événements cardiovasculaires. Des modèles animaux ont mis en évidence le rôle de ces cellules hématopoïétiques clonales dans les mécanismes physiopathologiques de pathologies vasculaires.5
Récemment, le rôle de protéines sécrétées par le cœur défaillant dans la croissance tumorale a été démontré dans une étude translationnelle.6 Au cours d’un modèle murin de souris mutées avec prédisposition à la polypose colique, l’insuffisance cardiaque d’origine ischémique favorisait la croissance des tumeurs coliques. Via l’approche d’une protéine candidate, les auteurs ont identifié que le niveau de serpine A3 sécrétée par le cœur était associé à la survenue de tumeurs. Ce modèle murin ne s’applique néanmoins qu’à un seul type de cancer, le cancer colique chez des animaux génétiquement prédisposés.
Des études supplémentaires sont nécessaires
Les données épidémiologiques suggèrent une association entre insuffisance cardiaque et cancer. La causalité commence à être explorée, avec des pistes portant sur les protéines sécrétées par le myocarde défaillant qui pourraient causer certaines tumeurs, ou sur le rôle des cellules clonales hématopoïétiques. Des études supplémentaires sont nécessaires afin d’en préciser les mécanismes, pouvant déboucher sur des hypothèses allant de l’intérêt du dépistage chez les patients insuffisants cardiaques à des voies thérapeutiques communes.
Références
1. Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380:2163-96.
2. Banke A, Schou M, Videbaek L, et al. Incidence of cancer in patients with chronic heart failure: a long-term follow-up study: cancer in patients with chronic HF: long-term follow-up. Eur J Heart Fail 2016;18:260-6.
3. Hasin T, Gerber Y, McNallan SM, et al. patients with heart failure have an increased risk of incident cancer. J Am Coll Cardiol 2013;62:881-6.
4. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119-31.
5. Khetarpal SA, Qamar A, Bick AG, et al. Clonal hematopoiesis of indeterminate potential reshapes age-related CVD. J Am Coll Cardiol 2019;74:578-86.
6. Meijers WC, Maglione M, Bakker SJL, et al. Heart failure stimulates tumor wgrowth by circulating factors. Circulation 2018;138:678-91.
2. Banke A, Schou M, Videbaek L, et al. Incidence of cancer in patients with chronic heart failure: a long-term follow-up study: cancer in patients with chronic HF: long-term follow-up. Eur J Heart Fail 2016;18:260-6.
3. Hasin T, Gerber Y, McNallan SM, et al. patients with heart failure have an increased risk of incident cancer. J Am Coll Cardiol 2013;62:881-6.
4. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119-31.
5. Khetarpal SA, Qamar A, Bick AG, et al. Clonal hematopoiesis of indeterminate potential reshapes age-related CVD. J Am Coll Cardiol 2019;74:578-86.
6. Meijers WC, Maglione M, Bakker SJL, et al. Heart failure stimulates tumor wgrowth by circulating factors. Circulation 2018;138:678-91.