La maladie de Kawasaki est une vascularite multi-systémique qui touche essentiellement les artères coronaires. Elle atteint principalement les enfants de moins de 5 ans. C’est la première cause de cardiopathie acquise chez l’enfant dans les pays développés. La précocité de la prise en charge par immunoglobulines intraveineuses diminue le risque d’atteintes coronaires.
La maladie de Kawasaki (MK) est une vascularite multisystémique qui touche essentiellement les artères de moyen calibre avec un tropisme électif pour les artères coronaires. Elle a été décrite par Tomisaku Kawasaki en 1967 au Japon.1
Son incidence est 10 à 60 fois plus élevée dans les populations japonaises et d’Asie du Nord-Est que dans les populations occidentales (9 cas pour 100 000 enfants français de moins de 5 ans pour 270 au Japon).2 Dans les pays développés, cette maladie est la première cause de cardiopathie acquise chez l’enfant. Elle touche avec prédilection les enfants âgés de 1 à 5 ans, avec un sex-ratio de 1,5.
Le diagnostic est suspecté devant un tableau aigu prenant le masque d’une maladie infectieuse infantile.
Sur le plan physiopathologique, elle associe des lésions endothéliales résultant de l’activation des cellules T et de l’effet de cytokines pro-inflammatoires avec nécrose artérielle, vascularite subaiguë/chronique et prolifération luminale myofibroblastique.3
Les nombreuses similitudes clinico-biologiques entre le syndrome inflammatoire multisystémique pédiatrique post-SARS-CoV-2 (MIS-C ou PIMS) lié à un virus unique et la MK ont relancé l’hypothèse d’une participation virale à la genèse de la MK.4 L’incidence plus élevée en Asie, l’observation de cas familiaux et le taux de récurrence de 3 % au Japon suggèrent une prédisposition génétique avec plusieurs gènes identifiés actuellement (ITPKC, Casp3, BLK, CD40, FCGR2A, HLA, LOC, LTA, C6orf10, IgHV1, TRX-CAT1-7, PGBD1…).5 Il est ainsi proposé que la MK soit secondaire à un déclencheur (trigger) infectieux (via de multiples virus plutôt qu’un virus unique) entraînant une réponse inflammatoire aberrante (hyperinflammation) chez un individu prédisposé.
Le traitement par immunoglobulines intraveineuses (IgIV) a permis de diminuer l’incidence des atteintes coronariennes de 25 % à moins de 5 %.6 Récemment, des indicateurs de forme sévère d’emblée ont été proposés et nécessitent une intensification thérapeutique initiale par IgIV et corticothérapie associée.7
Le risque d’atteinte coronarienne est plus élevé si le traitement est retardé, raison pour laquelle il est préconisé de traiter dans les sept premiers jours et, au plus tard, dans les dix premiers jours de fièvre.6 Le risque de survenue d’un anévrisme coronaire géant est d’au moins 1 %.6, 8 Le taux de mortalité calculé au Japon est de 0,015 %, avec un pic de mortalité entre le 15e et le 45e jour suivant le début de la fièvre, période durant laquelle la vascularite coronarienne, la thrombocytose et l’état d’hypercoagulabilité sont concomitants.6
Son incidence est 10 à 60 fois plus élevée dans les populations japonaises et d’Asie du Nord-Est que dans les populations occidentales (9 cas pour 100 000 enfants français de moins de 5 ans pour 270 au Japon).2 Dans les pays développés, cette maladie est la première cause de cardiopathie acquise chez l’enfant. Elle touche avec prédilection les enfants âgés de 1 à 5 ans, avec un sex-ratio de 1,5.
Le diagnostic est suspecté devant un tableau aigu prenant le masque d’une maladie infectieuse infantile.
Sur le plan physiopathologique, elle associe des lésions endothéliales résultant de l’activation des cellules T et de l’effet de cytokines pro-inflammatoires avec nécrose artérielle, vascularite subaiguë/chronique et prolifération luminale myofibroblastique.3
Les nombreuses similitudes clinico-biologiques entre le syndrome inflammatoire multisystémique pédiatrique post-SARS-CoV-2 (MIS-C ou PIMS) lié à un virus unique et la MK ont relancé l’hypothèse d’une participation virale à la genèse de la MK.4 L’incidence plus élevée en Asie, l’observation de cas familiaux et le taux de récurrence de 3 % au Japon suggèrent une prédisposition génétique avec plusieurs gènes identifiés actuellement (ITPKC, Casp3, BLK, CD40, FCGR2A, HLA, LOC, LTA, C6orf10, IgHV1, TRX-CAT1-7, PGBD1…).5 Il est ainsi proposé que la MK soit secondaire à un déclencheur (trigger) infectieux (via de multiples virus plutôt qu’un virus unique) entraînant une réponse inflammatoire aberrante (hyperinflammation) chez un individu prédisposé.
Le traitement par immunoglobulines intraveineuses (IgIV) a permis de diminuer l’incidence des atteintes coronariennes de 25 % à moins de 5 %.6 Récemment, des indicateurs de forme sévère d’emblée ont été proposés et nécessitent une intensification thérapeutique initiale par IgIV et corticothérapie associée.7
Le risque d’atteinte coronarienne est plus élevé si le traitement est retardé, raison pour laquelle il est préconisé de traiter dans les sept premiers jours et, au plus tard, dans les dix premiers jours de fièvre.6 Le risque de survenue d’un anévrisme coronaire géant est d’au moins 1 %.6, 8 Le taux de mortalité calculé au Japon est de 0,015 %, avec un pic de mortalité entre le 15e et le 45e jour suivant le début de la fièvre, période durant laquelle la vascularite coronarienne, la thrombocytose et l’état d’hypercoagulabilité sont concomitants.6
Poser le diagnostic
La maladie est devenue très rarement grave depuis qu’elle est traitée de manière précoce par les IgIV. Elle survient essentiellement en hiver et au début du printemps, et préférentiellement chez les garçons âgés de 1 à 5 ans. Mais elle touche également le nourrisson de moins de 1 an avec des formes sévères d’emblée ;6, 7 le diagnostic est alors plus difficile et souvent retardé, avec un risque coronarien plus important, raison pour laquelle la maladie doit être recherchée activement en cas de fièvre prolongée sans cause chez les enfants de moins de 6 mois.6
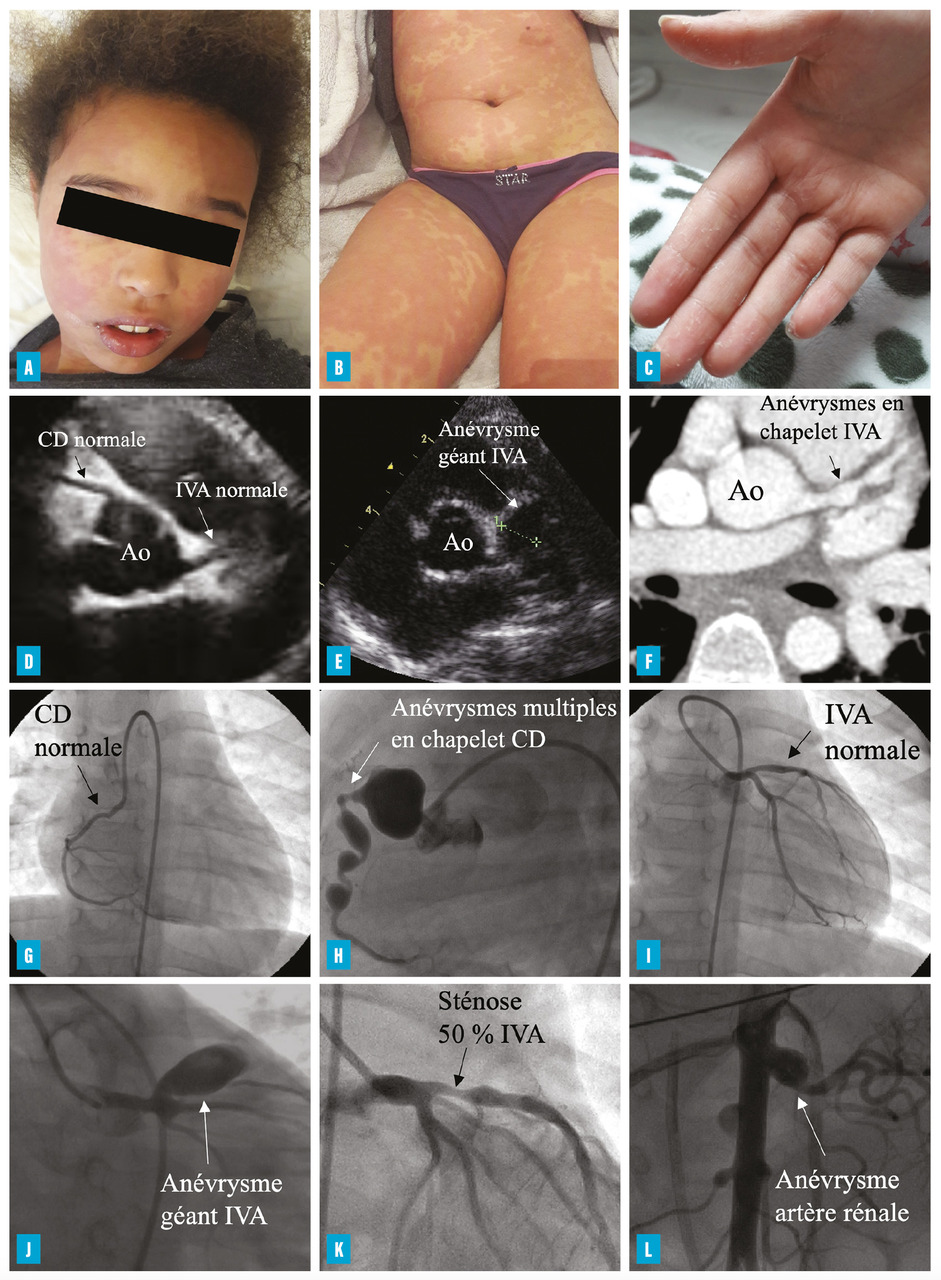
Le tableau typique aigu est dominé par une fièvre pendant plus de cinq jours (volontiers rebelle aux antipyrétiques), associée à une irritabilité, à une altération de l’état général d’apparition brutale et à des signes d’inflammation cutanéo-muqueuse (fig. 1A-C ). Le diagnostic est établi selon les critères internationaux (fig. 2 ).
Le tableau typique aigu est dominé par une fièvre pendant plus de cinq jours (volontiers rebelle aux antipyrétiques), associée à une irritabilité, à une altération de l’état général d’apparition brutale et à des signes d’inflammation cutanéo-muqueuse (
Au moins quatre des cinq critères majeurs
Le diagnostic typique de maladie de Kawasaki est posé en cas de fièvre d’au moins cinq jours, associée à au moins quatre critères cliniques d’inflammation cutanéo-muqueuse :
– éruption cutanée polymorphe (le plus souvent morbilliforme, scarlatiniforme ou urticarienne) ;
– hyperhémie conjonctivale aiguë non purulente bilatérale ;
– énanthème des lèvres et de l’ensemble de la cavité buccale, avec lèvres sèches et fissurées (chéilite), langue framboisée (avec desquamation des papilles filiformes donnant une surface rouge brillant), stomatite, énanthème pharyngé ;
– atteinte des extrémités avec érythème, œdème et desquamation en doigt de gant (signe tardif qui peut faire évoquer le diagnostic a posteriori [fig. 1C ]) ;
– adénopathies cervicales, dont une de plus de 1,5 cm (fig. 2, encadré bleu ).
L’érythème du périnée et l’inflammation sur la cicatrice du BCG peuvent également être une aide au diagnostic.
– éruption cutanée polymorphe (le plus souvent morbilliforme, scarlatiniforme ou urticarienne) ;
– hyperhémie conjonctivale aiguë non purulente bilatérale ;
– énanthème des lèvres et de l’ensemble de la cavité buccale, avec lèvres sèches et fissurées (chéilite), langue framboisée (avec desquamation des papilles filiformes donnant une surface rouge brillant), stomatite, énanthème pharyngé ;
– atteinte des extrémités avec érythème, œdème et desquamation en doigt de gant (signe tardif qui peut faire évoquer le diagnostic a posteriori [
– adénopathies cervicales, dont une de plus de 1,5 cm (
L’érythème du périnée et l’inflammation sur la cicatrice du BCG peuvent également être une aide au diagnostic.
Critères supplémentaires
Des critères supplémentaires doivent également faire évoquer le diagnostic de maladie de Kawasaki (fig. 2, encadré rose ).
Ainsi, pour les enfants avec fièvre depuis au moins cinq jours et deux ou trois critères majeurs ou supplémentaires ou pour les nourrissons de moins de 6 mois avec fièvre de plus de sept jours sans cause évidente (fig. 2, encadré orange ) et ayant un syndrome inflammatoire biologique, des critères biologiques spécifiques ou échocardiographiques permettent d’argumenter le diagnostic (fig. 2, encadré gris ) ; on parle alors de maladie de Kawasaki « incomplète ».6
Certains enfants peuvent présenter des formes atypiques, principalement lorsque la maladie apparaît avant l’âge de 1 an ou après 5 ans. Les signes possibles sont : convulsions, œdème pulmonaire, diarrhée sanglante, entérocolite nécessitant une résection du grêle, ascite, obstruction des voies aériennes supérieures, épiglottite, adénopathies cervicales compressives, hémolyse ou syndrome de défaillance multiviscérale.6
Certaines autres situations doivent également faire évoquer le diagnostic : nourrissons de moins de 6 mois avec fièvre prolongée et irritabilité ou avec méningite aseptique inexpliquée ; nourrissons ou enfants avec fièvre prolongée et choc inexpliqué avec des cultures bactériennes négatives, ou lymphadénite cervicale sans réponse aux antibiotiques, ou phlegmon rétropharyngé ou paratrachéal sans réponse aux antibiotiques. Enfin, des formes de l’adulte ont été rapportées dès 1977.6
Ainsi, pour les enfants avec fièvre depuis au moins cinq jours et deux ou trois critères majeurs ou supplémentaires ou pour les nourrissons de moins de 6 mois avec fièvre de plus de sept jours sans cause évidente (
Certains enfants peuvent présenter des formes atypiques, principalement lorsque la maladie apparaît avant l’âge de 1 an ou après 5 ans. Les signes possibles sont : convulsions, œdème pulmonaire, diarrhée sanglante, entérocolite nécessitant une résection du grêle, ascite, obstruction des voies aériennes supérieures, épiglottite, adénopathies cervicales compressives, hémolyse ou syndrome de défaillance multiviscérale.6
Certaines autres situations doivent également faire évoquer le diagnostic : nourrissons de moins de 6 mois avec fièvre prolongée et irritabilité ou avec méningite aseptique inexpliquée ; nourrissons ou enfants avec fièvre prolongée et choc inexpliqué avec des cultures bactériennes négatives, ou lymphadénite cervicale sans réponse aux antibiotiques, ou phlegmon rétropharyngé ou paratrachéal sans réponse aux antibiotiques. Enfin, des formes de l’adulte ont été rapportées dès 1977.6
Prise en charge initiale
Compte tenu du risque de complications cardiaques précoces, la seule suspicion diagnostique doit faire adresser l’enfant dans un centre hospitalier. Si le patient a des signes d’insuffisance cardiaque (pâleur, polypnée, tachycardie, sueurs, hépatomégalie, instabilité tensionnelle), un transfert par le Samu est indispensable.
Bilan paraclinique de première intention
Le diagnostic est clinique.
Les examens à réaliser sont l’hémogramme avec compte plaquettaire, le dosage de la protéine C-réactive (CRP) et/ou de la vitesse de sédimentation (VS), le bilan hépatique (transaminases, gamma-GT, bilirubine), le dosage de l’albumine et l’examen cytobactériologique des urines (ECBU) ainsi qu’un électrocardiogramme (ECG) à la recherche de troubles de la repolarisation ou de troubles de conduction.6
Le syndrome inflammatoire biologique (polynucléose et CRP élevée), s’il n’est pas spécifique, a une grande valeur pour le diagnostic. L’absence de syndrome inflammatoire, une leucopénie et/ou une hyperleucocytose à prédominance lymphocytaire sont des arguments plutôt en faveur d’une cause virale que d’une maladie de Kawasaki.
Les examens à réaliser sont l’hémogramme avec compte plaquettaire, le dosage de la protéine C-réactive (CRP) et/ou de la vitesse de sédimentation (VS), le bilan hépatique (transaminases, gamma-GT, bilirubine), le dosage de l’albumine et l’examen cytobactériologique des urines (ECBU) ainsi qu’un électrocardiogramme (ECG) à la recherche de troubles de la repolarisation ou de troubles de conduction.6
Le syndrome inflammatoire biologique (polynucléose et CRP élevée), s’il n’est pas spécifique, a une grande valeur pour le diagnostic. L’absence de syndrome inflammatoire, une leucopénie et/ou une hyperleucocytose à prédominance lymphocytaire sont des arguments plutôt en faveur d’une cause virale que d’une maladie de Kawasaki.
Diagnostics différentiels
D’autres examens peuvent être discutés pour éliminer les diagnostics différentiels : sérologies virales (dont sérothèque, à prélever avant l’administration d’immunoglobulines intraveineuses), test de diagnostic rapide du streptocoque du groupe A, échographie abdominale, ponction lombaire, ponction articulaire, triglycéridémie, ferritinémie, hémostase (syndrome d’activation macrophagique).6
Dans le contexte de pandémie de Covid-19, le diagnostic de syndrome inflammatoire multisystémique de l’enfant peut également être évoqué chez un enfant fébrile ayant été exposé au SARS-CoV-2 dans les quatre semaines qui précèdent. Il convient alors de réaliser un dosage du NT-proBNP (fragment du peptide natriurétique de type B) ou BNP (peptide natriurétique de type B) et de la troponine. La comparaison des principales caractéristiques clinico-biologiques de ces deux entités est présentée dans letableau 1 .
La recherche des diagnostics différentiels doit être envisagée au cas par cas et ne doit pas retarder l’instauration rapide du traitement de la maladie de Kawasaki (fig. 2, encadré vert ).6
Les co-infections virales et bactériennes sont fréquentes et ne doivent donc surtout pas faire écarter le diagnostic.
Dans le contexte de pandémie de Covid-19, le diagnostic de syndrome inflammatoire multisystémique de l’enfant peut également être évoqué chez un enfant fébrile ayant été exposé au SARS-CoV-2 dans les quatre semaines qui précèdent. Il convient alors de réaliser un dosage du NT-proBNP (fragment du peptide natriurétique de type B) ou BNP (peptide natriurétique de type B) et de la troponine. La comparaison des principales caractéristiques clinico-biologiques de ces deux entités est présentée dans le
La recherche des diagnostics différentiels doit être envisagée au cas par cas et ne doit pas retarder l’instauration rapide du traitement de la maladie de Kawasaki (
Les co-infections virales et bactériennes sont fréquentes et ne doivent donc surtout pas faire écarter le diagnostic.
Place de l’échocardiographie dans la prise en charge
Une échographie cardiaque est nécessaire pour dépister les complications, notamment les anévrismes coronaires. Elle doit rester l’examen de première intention (fig. 1D-E ). Les mesures des coronaires sont rapportées à la surface corporelle et exprimées en Z-score afin d’évaluer le risque coronarien initial.8, 9
En moyenne, 75 % des patients n’auront jamais d’atteinte coronarienne, 20 % auront une dilatation transitoire, 4 % auront des anévrismes coronaires et environ 1 % auront des anévrismes coronaires géants.6 Les anévrismes sont classés selon leur Z-score (tableau 2 ).
Dans les situations cliniques avec critères de sévérité d’emblée, le cardiopédiatre doit être sollicité rapidement.7 Ceci ne doit toutefois pas retarder les mesures thérapeutiques d’urgence qui sont prioritaires.
Dans les formes complètes, le délai de réalisation de l’échocardiographie ne doit pas non plus faire différer la prise en charge thérapeutique car les critères cliniques justifient à eux seuls l’instauration du traitement. Cet examen doit être fait dans la semaine suivant le diagnostic, puis le rythme de surveillance est fixé par le cardiopédiatre.
Il est important de rappeler qu’une échographie cardiaque normale n’élimine pas le diagnostic de maladie de Kawasaki.
L’apparition d’une desquamation des extrémités peut justifier une échocardiographie afin d’éliminer une atteinte coronarienne secondaire à une maladie de Kawasaki qui n’aurait pas été traitée, surtout si un épisode de fièvre inexpliquée est survenu dans les semaines qui précèdent.6
Enfin, dans les formes incomplètes, le cardiopédiatre peut être sollicité pour aider dans la démarche diagnostique : en cas d’échocardiographie anormale (fig. 2, encadré violet ), le diagnostic est confirmé et le traitement instauré.6, 7
En moyenne, 75 % des patients n’auront jamais d’atteinte coronarienne, 20 % auront une dilatation transitoire, 4 % auront des anévrismes coronaires et environ 1 % auront des anévrismes coronaires géants.6 Les anévrismes sont classés selon leur Z-score (
Dans les situations cliniques avec critères de sévérité d’emblée, le cardiopédiatre doit être sollicité rapidement.7 Ceci ne doit toutefois pas retarder les mesures thérapeutiques d’urgence qui sont prioritaires.
Dans les formes complètes, le délai de réalisation de l’échocardiographie ne doit pas non plus faire différer la prise en charge thérapeutique car les critères cliniques justifient à eux seuls l’instauration du traitement. Cet examen doit être fait dans la semaine suivant le diagnostic, puis le rythme de surveillance est fixé par le cardiopédiatre.
Il est important de rappeler qu’une échographie cardiaque normale n’élimine pas le diagnostic de maladie de Kawasaki.
L’apparition d’une desquamation des extrémités peut justifier une échocardiographie afin d’éliminer une atteinte coronarienne secondaire à une maladie de Kawasaki qui n’aurait pas été traitée, surtout si un épisode de fièvre inexpliquée est survenu dans les semaines qui précèdent.6
Enfin, dans les formes incomplètes, le cardiopédiatre peut être sollicité pour aider dans la démarche diagnostique : en cas d’échocardiographie anormale (
Le traitement doit être entrepris dès la suspicion clinique
Effet spectaculaire des immunoglobulines intraveineuses
Le traitement de référence de la maladie de Kawasaki comporte une perfusion d’IgIV à la dose de 2 g/kg, administrée en une seule fois sur douze heures,6,9 dès la suspicion diagnostique.
Il a un effet spectaculaire sur la fièvre et l’altération de l’état général et permet de diminuer le risque d’anévrismes coronaires à moins de 5 %.9
Après un délai de dix jours, le traitement par IgIV n’est justifié qu’en cas de persistance de la fièvre et/ou de signes biologiques inflammatoires.
Un traitement par aspirine à dose anti-inflammatoire (30 à 50 mg/kg/j en 3 prises) est initialement associé. Il est poursuivi à dose antiagrégante (3 à 5 mg/kg/j), pendant six à huit semaines minimum.
Il a un effet spectaculaire sur la fièvre et l’altération de l’état général et permet de diminuer le risque d’anévrismes coronaires à moins de 5 %.9
Après un délai de dix jours, le traitement par IgIV n’est justifié qu’en cas de persistance de la fièvre et/ou de signes biologiques inflammatoires.
Un traitement par aspirine à dose anti-inflammatoire (30 à 50 mg/kg/j en 3 prises) est initialement associé. Il est poursuivi à dose antiagrégante (3 à 5 mg/kg/j), pendant six à huit semaines minimum.
Forme sévère d’emblée : associer une corticothérapie
Récemment, des critères de forme sévère d’emblée ont été définis, et leur objectivation impose une prise en charge dans un centre expert pour une intensification thérapeutique d’emblée par IgIV et corticothérapie associée. Ces critères sont : un âge inférieur à 1 an, la présence d’un état de choc (Kawasaki disease shock syndrome), un score de Kobayashi supérieur ou égal à 5 (score prédictif de non-réponse aux IgIV), un syndrome d’activation macrophagique et/ou des anévrismes coronaires et/ou périphériques (fig. 2, encadré jaune ).7
La corticothérapie systémique associée aux IgIV dans ces situations comporte de la méthylprednisolone (1 mg/kg/12 heures) par voie intraveineuse pendant cinq à sept jours ou jusqu’à normalisation de la CRP ; une décroissance de la corticothérapie est ensuite entreprise sur deux à trois semaines.7
La corticothérapie systémique associée aux IgIV dans ces situations comporte de la méthylprednisolone (1 mg/kg/12 heures) par voie intraveineuse pendant cinq à sept jours ou jusqu’à normalisation de la CRP ; une décroissance de la corticothérapie est ensuite entreprise sur deux à trois semaines.7
Aspirine à vie et anticoagulation en cas d’anévrismes coronaires géants
En cas d’anévrismes coronaires géants, une anticoagulation par héparine relayée par un traitement anticoagulant par antivitamine-K (AVK) doit être débutée avec un international normalized ratio (INR) cible de 2,5, sous couvert d’une éducation thérapeutique du patient et de sa famille.10 L’aspirine est maintenue à vie dans cette situation, quelle que soit l’évolution de l’atteinte coronarienne, à la dose de 100 mg/j après l’âge de 1 an. La durée du traitement par AVK dépend de l’évolution de l’atteinte coronarienne et est définie lors du suivi cardiologique ; elle est d’un an au minimum.
La recrudescence de la fièvre nécessite une intensification thérapeutique
La résistance au traitement est définie par la persistance ou la recrudescence de la fièvre au-delà de trente-six heures après la fin de la perfusion d’IgIV.6 Cette situation augmente le risque de complications et nécessite aussi une intensification thérapeutique, en centre expert. Le traitement comporte alors une deuxième perfusion d’IgIV associée à une corticothérapie.7
Les traitements de troisième intention comportent des immunomodulateurs puissants, comme l’anti-TNF alpha, l’anti-IL-1 ou la ciclosporine.7
Les traitements de troisième intention comportent des immunomodulateurs puissants, comme l’anti-TNF alpha, l’anti-IL-1 ou la ciclosporine.7
Mesures associées
Le traitement par IgIV nécessite une adaptation du calendrier vaccinal : pas d’influence sur les vaccins inactivés, respect d’un délai pour les vaccins rougeole-oreillons-rubéole (ROR) et varicelle mais pas de contre-indications (se référer au Plan national de diagnostic et de soins [PNDS] maladie de Kawasaki, publié en août 2022 par la Haute Autorité de santé [HAS]).8
L’activité physique peut être reprise quelques semaines après le diagnostic.
L’activité physique peut être reprise quelques semaines après le diagnostic.
Évolution le plus souvent favorable
Le pronostic est en général très bon, et une majorité d’enfants se rétablit sans séquelle. Les complications coronariennes font toute la gravité de la maladie, notamment la survenue d’anévrismes géants susceptibles de provoquer une ischémie myocardique par thrombose coronarienne ou d’un exceptionnel hémopéricarde par rupture d’anévrisme.6, 10
Pas de suivi cardiologique prolongé en l’absence d’atteinte coronarienne
Les enfants sans atteinte coronarienne ne nécessitent pas de suivi cardiologique après six à huit semaines ; ils ont trois échocardiographies (une lors du diagnostic, puis une entre 1 et 2 semaines, et une entre 4 à 6 semaines), puis le suivi cardiologique est arrêté.6
Suivi rapproché en cas d’anomalies artérielles
Pour les patients avec anomalies coronariennes évolutives, un suivi échographique rapproché est nécessaire : au moins deux échocardiographies par semaine initialement, puis une par semaine durant les quarante-cinq premiers jours, puis une mensuelle jusqu’au troisième mois.6, 10
Certains patients peuvent développer des anévrismes d’autres artères, responsables de thrombose ou de rupture (artères axillaires, sous-clavières, brachiales, rénales [fig. 1L ], fémorales, iliaques, splanchniques et/ou mésentériques). L’évolution de ces vascularites est probablement similaire à celle des coronaires, mais elles sont rarement symptomatiques en raison du développement d’une collatéralité.6
fig. 1K ) ou des thromboses coronariennes peuvent apparaître tout au long de la vie.
L’instauration d’un traitement anticoagulant précoce chez les patients avec anévrismes coronaires géants pourrait contribuer à améliorer le devenir cardiologique des adultes les plus sévèrement atteints dans l’enfance.17 L’ajout d’un bêtabloquant, d’un deuxième antiagrégant plaquettaire et de statines lors du suivi reste discuté au cas par cas.6 Enfin, les résultats des essais thérapeutiques visant à évaluer l’efficacité et la sécurité des anticoagulants oraux directs dans la prévention de la thrombose coronarienne permettront, peut-être, de simplifier l’anticoagulation de ces patients avec anévrismes coronaires géants persistants.18
Certains patients peuvent développer des anévrismes d’autres artères, responsables de thrombose ou de rupture (artères axillaires, sous-clavières, brachiales, rénales [
Complications tardives possibles
Si le tableau initial de la maladie de Kawasaki est aigu et mime une maladie infectieuse, son évolution, elle, est chronique, en particulier en cas de lésions coronariennes non régressives. Des complications tardives telles que des sténoses (Particularités des patients avec anévrismes coronaires géants
En cas d’anévrismes géants, les patients ont un risque majoré d’infarctus et de mort subite durant les deux premières années qui suivent le diagnostic mais ils sont également plus à risque de syndrome coronaire aigu (SCA) à l’âge adulte.10,12-14 Les séquelles coronariennes peuvent se traduire par un SCA à court, moyen ou long terme. Il faut savoir que 5 % des SCA des adultes de moins de 45 ans sont secondaires à des séquelles d’une maladie de Kawasaki connue ou inconnue.15 Ces patients rares doivent avoir un suivi cardiologique à long terme et faire l’objet d’un programme d’éducation thérapeutique de transition vers l’âge adulte en cas de lésions coronariennes persistantes (anévrismes ou sténoses). Ils sont à haut risque cardiovasculaire et doivent être éduqués en ce sens.10,16 En effet, le taux de survie des patients avec anévrismes géants persistants est de 90 % à 30 ans, et 50 % d’entre eux nécessitent un pontage.10L’instauration d’un traitement anticoagulant précoce chez les patients avec anévrismes coronaires géants pourrait contribuer à améliorer le devenir cardiologique des adultes les plus sévèrement atteints dans l’enfance.17 L’ajout d’un bêtabloquant, d’un deuxième antiagrégant plaquettaire et de statines lors du suivi reste discuté au cas par cas.6 Enfin, les résultats des essais thérapeutiques visant à évaluer l’efficacité et la sécurité des anticoagulants oraux directs dans la prévention de la thrombose coronarienne permettront, peut-être, de simplifier l’anticoagulation de ces patients avec anévrismes coronaires géants persistants.18
Suivi à long terme en fonction du risque
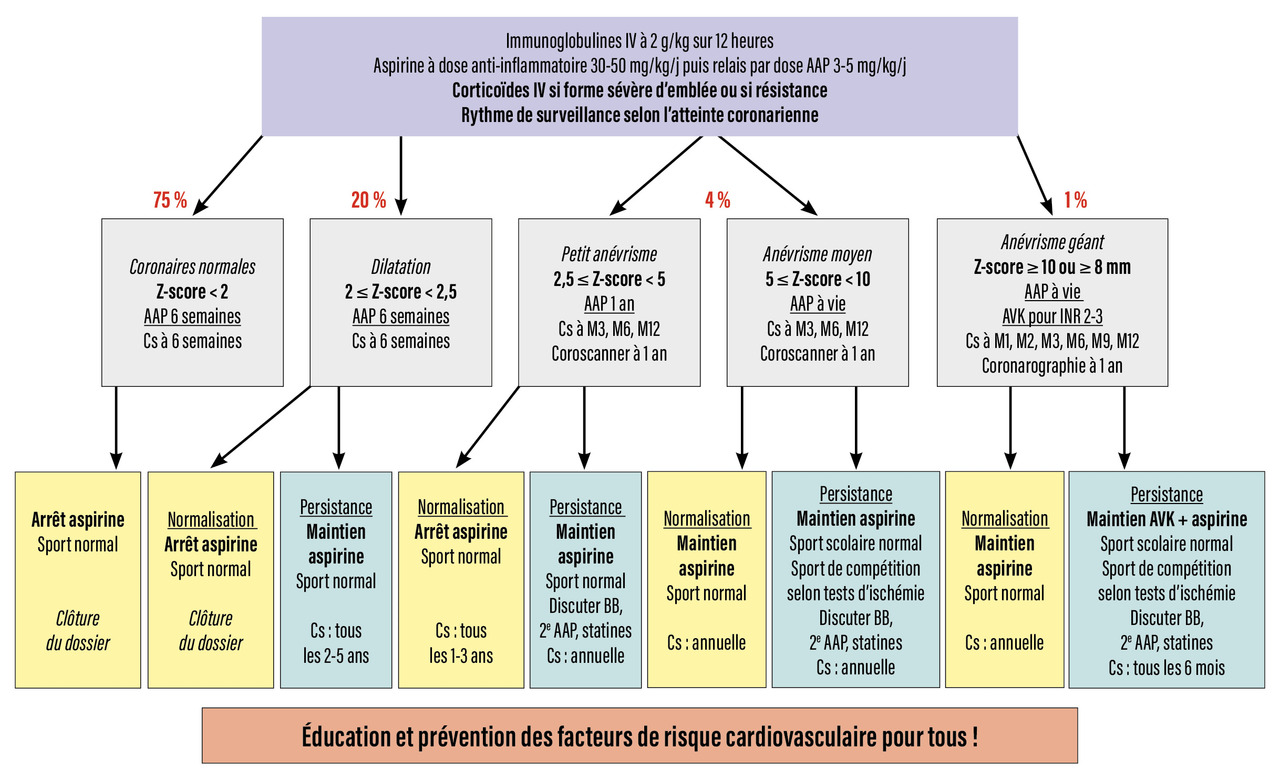
Le suivi à long terme est établi selon une stratification du risque (fig. 3 ).6
En l’absence de lésion coronarienne
Il faut être rassurant avec les parents des enfants qui n’ont jamais eu de lésion coronarienne ou une dilatation transitoire : ils ne nécessitent pas de suivi cardiologique, mais ils doivent être sensibilisés, de principe, à la prévention des facteurs de risque cardiovasculaire à l’âge adulte.10
En cas d’anévrisme coronaire
Pour les enfants avec anévrisme coronaire, la réalisation d’une imagerie coronarienne est préconisée à un an d’évolution de la maladie pour faire un bilan lésionnel et définir le type de surveillance et de traitement (fig. 1F-L ) :6
– en cas d’atteinte coronarienne persistante, un traitement antiagrégant peut être maintenu à vie ;
– en cas d’anévrisme géant persistant (25 % des patients avec anévrismes géants initiaux, dans le centre de référence M3C-Necker), un traitement par AVK associé à un traitement antiagrégant est prescrit à vie, en plus d’une prévention des facteurs de risque cardiovasculaire. Le suivi (clinique, électrocardiogramme, échocardiographie, épreuve d’effort) et les outils d’imagerie permettent de surveiller l’évolution à long terme (fig. 3 ). Ils comportent l’imagerie coronarienne (coroscanner [fig. 1 F] et/ou coronarographie [fig. 1 G-L]) et une recherche d’ischémie myocardique inductible (échocardiographie de stress, imagerie par résonance magnétique [IRM] de stress et/ou scintigraphie myocardique). Le rythme de ces examens, dont certains sont irradiants, a été proposé par l’American Heart Association (AHA) en 2017 ;6 il faut cependant veiller à limiter les irradiations.10 Enfin, les techniques chirurgicales (pontage) et/ou interventionnelles (stenting) peuvent être discutées pour le traitement des coronaropathies les plus sévères.19
– en cas d’atteinte coronarienne persistante, un traitement antiagrégant peut être maintenu à vie ;
– en cas d’anévrisme géant persistant (25 % des patients avec anévrismes géants initiaux, dans le centre de référence M3C-Necker), un traitement par AVK associé à un traitement antiagrégant est prescrit à vie, en plus d’une prévention des facteurs de risque cardiovasculaire. Le suivi (clinique, électrocardiogramme, échocardiographie, épreuve d’effort) et les outils d’imagerie permettent de surveiller l’évolution à long terme (
Une vie la plus normale possible
Les enfants doivent mener une vie normale.
L’activité sportive doit être encouragée pour tous. L’adaptation de certaines pratiques sportives ne concerne que les patients nécessitant une surveillance cardiologique prolongée. Les sports de contact sont contre-indiqués pour les patients sous AVK et antiagrégant plaquettaire ou prenant deux antiagrégants plaquettaires.
La contraception doit être évoquée (éviter la pilule œstroprogestative, augmentant le risque de thrombose) ainsi que le projet conceptionnel en cas d’anévrismes résiduels (prophylaxie thromboembolique per-partum).6, 10
Les patients à haut risque cardiovasculaire doivent être éduqués drastiquement à la prévention de tous les facteurs de risque, et la consommation de cocaïne doit être redoutée.
L’activité sportive doit être encouragée pour tous. L’adaptation de certaines pratiques sportives ne concerne que les patients nécessitant une surveillance cardiologique prolongée. Les sports de contact sont contre-indiqués pour les patients sous AVK et antiagrégant plaquettaire ou prenant deux antiagrégants plaquettaires.
La contraception doit être évoquée (éviter la pilule œstroprogestative, augmentant le risque de thrombose) ainsi que le projet conceptionnel en cas d’anévrismes résiduels (prophylaxie thromboembolique per-partum).6, 10
Les patients à haut risque cardiovasculaire doivent être éduqués drastiquement à la prévention de tous les facteurs de risque, et la consommation de cocaïne doit être redoutée.
Lire aussi | Urgences en dermatologie pédiatrique
La prise en charge précoce et spécialisée limite les complications
Le diagnostic de maladie de Kawasaki est essentiellement clinique. Elle est potentiellement grave en raison de l’atteinte des artères coronaires, qui est plus fréquente en cas de retard diagnostique et/ou thérapeutique. Un traitement administré précocement réduit grandement le risque d’anévrismes coronaires, raison pour laquelle cette maladie doit être connue de tous. La prise en charge spécialisée des patients les plus graves doit se poursuivre à vie.
Références
1. Kawasaki T. Acute febrile mucocutaneous syndrome with lymphoid involvement with specific desquamation of the fingers and toes in children. Arerugi 1967;16(3):178-222.
2. Singh S, Vignesh P, Burgner D. The epidemiology of Kawasaki disease: A global update. Arch Dis Child 2015;100(11):1084-8.
3. Galeotti C, Kaveri SV, Cimaz R, Koné-Paut I, Bayry J. Predisposing factors, pathogenesis and therapeutic intervention of Kawasaki disease. Drug Discov Today 2016;21(11):1850-7.
4. Sancho-Shimizu V, Brodin P, Cobat A, Biggs CM, Toubiana J, Lucas CL, et al. SARS-CoV-2-related MIS-C: A key to the viral and genetic causes of Kawasaki disease? J Exp Med 2021;218(6):e20210446.
5. Xie X, Shi X, Liu M. The roles of genetic factors in Kawasaki disease: A systematic review and meta-analysis of genetic association studies. Pediatr Cardiol 2018;39(2):207-25.
6. McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: A scientific statement for health professionals from the American Heart Association. Circulation 2017;135(17):e927-e99.
7. de Graeff N, Groot N, Ozen S, Eleftheriou D, Avcin T, Bader-Meunier B, et al. European consensus-based recommendations for the diagnosis and treatment of Kawasaki disease - the SHARE initiative. Rheumatology (Oxford) 2019;58(4):672-82.
8. Plan national de diagnostic et de soins (PNDS) Maladie de Kawasaki. Haute Autorité de santé (HAS), août 2022. https://vu.fr/AxYg
9. Friedman KG, Gauvreau K, Hamaoka-Okamoto A, Tang A, Berry E, Tremoulet AH, et al. Coronary artery aneurysms in Kawasaki disease: Risk factors for progressive disease and adverse cardiac events in the US population. J Am Heart Assoc 2016;5(9):e003289.
10. Newburger JW, Takahashi M, Burns JC. Kawasaki disease. J Am Coll Cardiol 2016;67(14):1738‑49.
11. Bajolle F, Lasne D, Elie C, Cheurfi R, Grazioli A, Traore M, et al. Home point-of-care international normalised ratio monitoring sustained by a non-selective educational program in children. Thromb Haemost 2012;108(4):710-8.
12. McCrindle BW, Manlhiot C, Newburger JW, Harahsheh AS, Giglia TM, Dallaire F, et al. Medium-term complications associated with coronary artery aneurysms after Kawasaki disease: A study from the International Kawasaki Disease Registry. J Am Heart Assoc 2020;9(15):e016440.
13. Advani N, Sastroasmoro S, Ontoseno T, Uiterwaal CS. Long-term outcome of coronary artery dilatation in Kawasaki disease. Ann Pediatr Cardiol 2018;11(2):125-9.
14. Miura M, Kobayashi T, Kaneko T, Ayusawa M, Fukazawa R, Fukushima N, et al. Association of severity of coronary artery aneurysms in patients with Kawasaki disease and risk of later coronary events. JAMA Pediatr 2018;172(5):e180030.
15. Mitani Y, Tsuda E, Kato H, Higaki T, Fujiwara M, Ogawa S, et al. Emergence and characterization of acute coronary syndrome in adults after confirmed or missed history of Kawasaki disease in Japan: A japanese nationwide survey. Front Pediatr 2019;7:275.
16. Kamiyama H, Ayusawa M, Ogawa S, Saji T, Hamaoka K. Health-care transition after Kawasaki disease in patients with coronary artery lesion. Pediatr Int 2018;60(3):232-9.
17. Su D, Wang K, Qin S, Pang Y. Safety and efficacy of warfarin plus aspirin combination therapy for giant coronary artery aneurysm secondary to Kawasaki disease: A meta-analysis. Cardiology 2014;129(1):55-64.
18. Bhatt MD, Portman MA, Berger F, Jacobs JP, Newburger J, Duggal A, et al. ENNOBLE-ATE trial: An open-label, randomised, multi-centre, observational study of edoxaban for children with cardiac diseases at risk of thromboembolism. Cardiol Young 2021;31(8):1213-9.
19. Kitamura S, Tsuda E. Significance of coronary revascularization for coronary-artery obstructive lesions due to Kawasaki disease. Children (Basel) 2019;6(2):16.
2. Singh S, Vignesh P, Burgner D. The epidemiology of Kawasaki disease: A global update. Arch Dis Child 2015;100(11):1084-8.
3. Galeotti C, Kaveri SV, Cimaz R, Koné-Paut I, Bayry J. Predisposing factors, pathogenesis and therapeutic intervention of Kawasaki disease. Drug Discov Today 2016;21(11):1850-7.
4. Sancho-Shimizu V, Brodin P, Cobat A, Biggs CM, Toubiana J, Lucas CL, et al. SARS-CoV-2-related MIS-C: A key to the viral and genetic causes of Kawasaki disease? J Exp Med 2021;218(6):e20210446.
5. Xie X, Shi X, Liu M. The roles of genetic factors in Kawasaki disease: A systematic review and meta-analysis of genetic association studies. Pediatr Cardiol 2018;39(2):207-25.
6. McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: A scientific statement for health professionals from the American Heart Association. Circulation 2017;135(17):e927-e99.
7. de Graeff N, Groot N, Ozen S, Eleftheriou D, Avcin T, Bader-Meunier B, et al. European consensus-based recommendations for the diagnosis and treatment of Kawasaki disease - the SHARE initiative. Rheumatology (Oxford) 2019;58(4):672-82.
8. Plan national de diagnostic et de soins (PNDS) Maladie de Kawasaki. Haute Autorité de santé (HAS), août 2022. https://vu.fr/AxYg
9. Friedman KG, Gauvreau K, Hamaoka-Okamoto A, Tang A, Berry E, Tremoulet AH, et al. Coronary artery aneurysms in Kawasaki disease: Risk factors for progressive disease and adverse cardiac events in the US population. J Am Heart Assoc 2016;5(9):e003289.
10. Newburger JW, Takahashi M, Burns JC. Kawasaki disease. J Am Coll Cardiol 2016;67(14):1738‑49.
11. Bajolle F, Lasne D, Elie C, Cheurfi R, Grazioli A, Traore M, et al. Home point-of-care international normalised ratio monitoring sustained by a non-selective educational program in children. Thromb Haemost 2012;108(4):710-8.
12. McCrindle BW, Manlhiot C, Newburger JW, Harahsheh AS, Giglia TM, Dallaire F, et al. Medium-term complications associated with coronary artery aneurysms after Kawasaki disease: A study from the International Kawasaki Disease Registry. J Am Heart Assoc 2020;9(15):e016440.
13. Advani N, Sastroasmoro S, Ontoseno T, Uiterwaal CS. Long-term outcome of coronary artery dilatation in Kawasaki disease. Ann Pediatr Cardiol 2018;11(2):125-9.
14. Miura M, Kobayashi T, Kaneko T, Ayusawa M, Fukazawa R, Fukushima N, et al. Association of severity of coronary artery aneurysms in patients with Kawasaki disease and risk of later coronary events. JAMA Pediatr 2018;172(5):e180030.
15. Mitani Y, Tsuda E, Kato H, Higaki T, Fujiwara M, Ogawa S, et al. Emergence and characterization of acute coronary syndrome in adults after confirmed or missed history of Kawasaki disease in Japan: A japanese nationwide survey. Front Pediatr 2019;7:275.
16. Kamiyama H, Ayusawa M, Ogawa S, Saji T, Hamaoka K. Health-care transition after Kawasaki disease in patients with coronary artery lesion. Pediatr Int 2018;60(3):232-9.
17. Su D, Wang K, Qin S, Pang Y. Safety and efficacy of warfarin plus aspirin combination therapy for giant coronary artery aneurysm secondary to Kawasaki disease: A meta-analysis. Cardiology 2014;129(1):55-64.
18. Bhatt MD, Portman MA, Berger F, Jacobs JP, Newburger J, Duggal A, et al. ENNOBLE-ATE trial: An open-label, randomised, multi-centre, observational study of edoxaban for children with cardiac diseases at risk of thromboembolism. Cardiol Young 2021;31(8):1213-9.
19. Kitamura S, Tsuda E. Significance of coronary revascularization for coronary-artery obstructive lesions due to Kawasaki disease. Children (Basel) 2019;6(2):16.
Dans cet article
- Poser le diagnostic
- Prise en charge initiale
- Bilan paraclinique de première intention
- Diagnostics différentiels
- Place de l’échocardiographie dans la prise en charge
- Le traitement doit être entrepris dès la suspicion clinique
- Évolution le plus souvent favorable
- Suivi à long terme en fonction du risque
- La prise en charge précoce et spécialisée limite les complications