Histoire. De la description de la paralysie agitante en 1817 jusqu’aux concepts actuels, de l’utilisation de la L-dopa dans les années 1960 à la stimulation cérébrale profonde, la compréhension et le traitement de la maladie de Parkinson ont suscité un intérêt constant et bien des travaux.
La maladie de Parkinson se définit classiquement par des signes moteurs, tremblement de repos, rigidité, akinésie et altération des réflexes de posture, en relation avec une dégénérescence de la voie dopaminergique nigrostriée. Nous présentons une revue historique de la description de cette affection à l’occasion de la célébration du bicentenaire de l’individualisation de cette entité par James Parkinson (1755-1824), médecin à Londres.1
Les signes cliniques moteurs, psychiques et cognitifs
identification de la maladie par Parkinson : la paralysie agitante
Dans sa monographie An Essay on the shaking palsy, publiée en 1817 (fig. 1), Parkinson rapporte le cas de six patients dont il fait une description assez fine : posture en flexion, tremblement de repos, festination (marche sur la pointe de pieds, accélération, et risque de chute), constipation, troubles du sommeil, dysarthrie, troubles de la déglutition, chutes, évolution terminale comportant perte de la parole, incontinence, somnolence, « léger délire », fatigue extrême, et désespoir du patient. La publication de Parkinson est reconnue rapidement sur le plan international.
contribution de Trousseau, Charcot et Gowers sur les signes moteurs
Dans ses leçons cliniques de l’Hôtel-Dieu (1862-1868), Armand Trousseau (1801-1867) précise les troubles de propulsion (le malade court après son centre de gravité) et de rétropulsion (marche en arrière quand le malade redresse le tronc et la tête). Il remet en cause la notion de paralysie, car pour lui la force est préservée, et individualise pour la première fois la lenteur des mouvements.
Jean-Martin Charcot (1825-1893), à La Salpêtrière, aborde à plusieurs reprises cette maladie qu’il propose d’appeler « maladie de Parkinson ». Les premiers travaux sont présentés avec Alfred Vulpian (1826-1887) dans la Gazette hebdomadaire en 1861-1862. Charcot revient de façon plus approfondie sur cette affection dans plusieurs de ses leçons entre 1872 et 1888. Le tremblement de repos est distingué du tremblement intentionnel de la sclérose en plaques et est enregistré avec le myographe de Marey. La rigidité est individualisée pour la première fois. La posture caractéristique de la main, dénommée aujourd’hui main dystonique ou main creuse parkin- sonienne, est décrite. La posture en flexion du tronc, qui peut être sévère, est illustrée par des dessins et statuettes de son élève Paul Richer (fig. 2). La lenteur des mouvements est notée. Charcot montre comment s’y prendre pour détecter la tendance au déséquilibre par le test de la rétropulsion, qui consiste à tirer le malade par son habit par l’arrière. Enfin, il est le premier à suggérer un traitement médical à base d’alcaloïdes de la belladone (aux effets anticholinergiques) et de dérivés de l’ergot de seigle.
William Richard Gowers (1845-1915), à Londres, fait une étude de la paralysie agitante dans son ouvrage de neurologie de 1888 et met l’accent pour la première fois sur les formes familiales.
Au début du xxe siècle, des analyses complémentaires sur la rigidité sont réalisées.2 À côté de la rigidité cireuse, « en tuyau de plomb », observée dans les stades avancés de la maladie, la « roue dentée » est décrite, en 1901 à Turin par Camillo Negro et en 1911 à Chicago par Harold N. Moyer, rigidité cédant par « à-coups » et notée à des stades moins avancés et surtout dans les formes tremblantes.
Jean-Martin Charcot (1825-1893), à La Salpêtrière, aborde à plusieurs reprises cette maladie qu’il propose d’appeler « maladie de Parkinson ». Les premiers travaux sont présentés avec Alfred Vulpian (1826-1887) dans la Gazette hebdomadaire en 1861-1862. Charcot revient de façon plus approfondie sur cette affection dans plusieurs de ses leçons entre 1872 et 1888. Le tremblement de repos est distingué du tremblement intentionnel de la sclérose en plaques et est enregistré avec le myographe de Marey. La rigidité est individualisée pour la première fois. La posture caractéristique de la main, dénommée aujourd’hui main dystonique ou main creuse parkin- sonienne, est décrite. La posture en flexion du tronc, qui peut être sévère, est illustrée par des dessins et statuettes de son élève Paul Richer (fig. 2). La lenteur des mouvements est notée. Charcot montre comment s’y prendre pour détecter la tendance au déséquilibre par le test de la rétropulsion, qui consiste à tirer le malade par son habit par l’arrière. Enfin, il est le premier à suggérer un traitement médical à base d’alcaloïdes de la belladone (aux effets anticholinergiques) et de dérivés de l’ergot de seigle.
William Richard Gowers (1845-1915), à Londres, fait une étude de la paralysie agitante dans son ouvrage de neurologie de 1888 et met l’accent pour la première fois sur les formes familiales.
Au début du xxe siècle, des analyses complémentaires sur la rigidité sont réalisées.2 À côté de la rigidité cireuse, « en tuyau de plomb », observée dans les stades avancés de la maladie, la « roue dentée » est décrite, en 1901 à Turin par Camillo Negro et en 1911 à Chicago par Harold N. Moyer, rigidité cédant par « à-coups » et notée à des stades moins avancés et surtout dans les formes tremblantes.
individualisation des troubles psychiques par Ball et Brissaud
Les principaux troubles psychiques dont nous venons de rappeler l’historique dans une publication récente,3 sont identifiés dès les années 1880-1890. Benjamin Ball (1833-1893), à l’hôpital Sainte-Anne à Paris, décrit en 1882 les troubles psychiques de la maladie : impression d’étrangeté, irritabilité, illusions et hallucinations, délire (persécution, jalousie), stupeur, et même mélancolie avec pulsions suicidaires. Ball conclut que les troubles psychiques font partie intégrante de la maladie. Édouard Brissaud (1852-1909), élève de Charcot, consacre, dans une leçon sur la maladie de Parkinson, un chapitre sur les troubles psychiques et identifie pour la première fois l’apathie :3« Les patients parkinsoniens semblent indifférents à ce qui les environne, ne parlent guère plus qu’ils ne bougent, sont renfermés sur eux-mêmes, répugnent à émettre leurs idées… ; on leur annonce des nouvelles, joyeuses ou tristes, et leur visage impassible ne trahit ni plaisir ni douleur, ils ont l’air détachés du monde. »
avancées majeures faisant suite à l’encéphalite épidémique léthargique de 1916-1926
Les premiers rapports sur l’épidémie d’encéphalite léthargique datent de février 1917 par Constantin von Economo (1876-1931), de Vienne, et René Cruchet (1875-1959), de Bordeaux. De nombreux cas de syndromes parkinsoniens séquellaires sont décrits, ce qui conduit à des avancées sur la caractérisation de la bradykinésie/akinésie, la rigidité, et la bradyphrénie.4, 5
Cruchet analyse le mouvement volontaire chez les patients parkinsoniens et, grâce à l’enregistrement myographique, il décrit la bradykinésie montrant que l’amplitude du mouvement n’est pas diminuée, alors que le temps de réaction et le temps de mouvement sont sensiblement augmentés. À Berlin, Friedrich Heinrich Lewy (1885-1950) propose en 1923 le terme d’akinésie pour décrire le retard à l’initiation du mou- vement. Samuel Alexander Kinnier Wilson (1878-1937), à Londres, étudie l’akinésie et montre, dans ses Croonian Lectures de 1925, que l’augmentation du temps de réaction en est l’expression la plus nette.
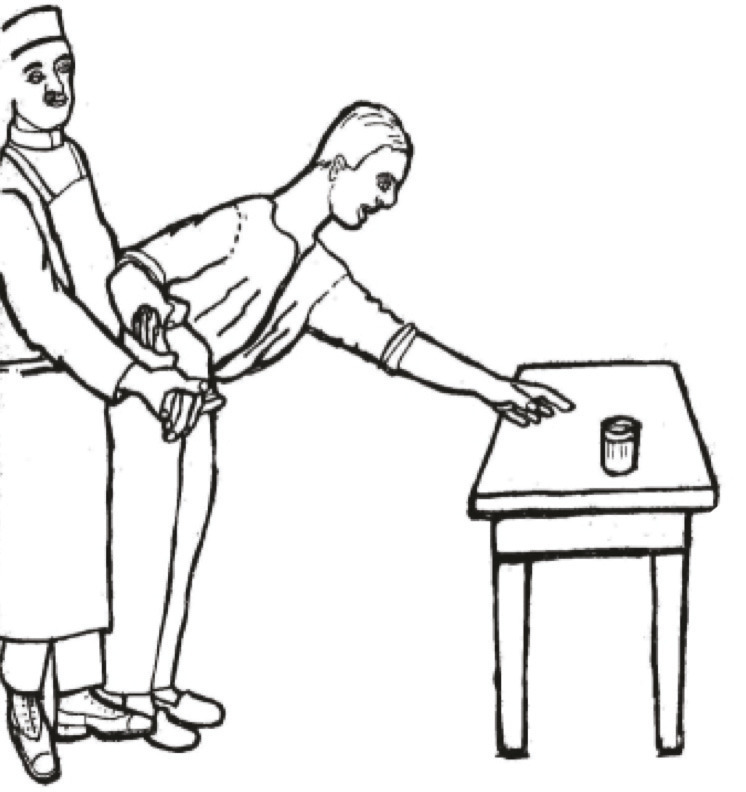
Achille Alexandre Souques (1860-1944), à Paris, décrit dans son rapport de 1921 l’abolition des mouvements automatiques et associés (perte du ballant des bras à la marche) et la kinésie paradoxale. Jules Froment (fig. 3) (1878-1946), à Lyon, explore la rigidité2 et décrit en 1926 le test du poignet figé ou signe du comptoir (manœuvre de Froment) qui permet de démasquer la roue dentée en cas de déséquilibre ou de mouvement de moulinet d’un autre membre (fig. 4).
En 1922, François Naville (1883-1968) effectue à Genève une étude plus approfondie de l’apathie et développe le concept de bradyphrénie dans le syndrome parkinsonien post-encéphalitique.3 Pour lui, la brady- phrénie associe l’apathie et une lenteur de la pensée, qu’il est possible de distinguer de la lenteur motrice par des tests neuropsychologiques. L’apathie et la bradyphrénie vont revenir sur le devant de la scène vers les années 1990 grâce aux travaux de Marin à Pittsburg (États-Unis). L’apathie est fréquente dans la maladie de Parkinson, souvent associée à la dépression et à l’anxiété mais pouvant être isolée.
Cruchet analyse le mouvement volontaire chez les patients parkinsoniens et, grâce à l’enregistrement myographique, il décrit la bradykinésie montrant que l’amplitude du mouvement n’est pas diminuée, alors que le temps de réaction et le temps de mouvement sont sensiblement augmentés. À Berlin, Friedrich Heinrich Lewy (1885-1950) propose en 1923 le terme d’akinésie pour décrire le retard à l’initiation du mou- vement. Samuel Alexander Kinnier Wilson (1878-1937), à Londres, étudie l’akinésie et montre, dans ses Croonian Lectures de 1925, que l’augmentation du temps de réaction en est l’expression la plus nette.
Achille Alexandre Souques (1860-1944), à Paris, décrit dans son rapport de 1921 l’abolition des mouvements automatiques et associés (perte du ballant des bras à la marche) et la kinésie paradoxale. Jules Froment (fig. 3) (1878-1946), à Lyon, explore la rigidité2 et décrit en 1926 le test du poignet figé ou signe du comptoir (manœuvre de Froment) qui permet de démasquer la roue dentée en cas de déséquilibre ou de mouvement de moulinet d’un autre membre (fig. 4).
En 1922, François Naville (1883-1968) effectue à Genève une étude plus approfondie de l’apathie et développe le concept de bradyphrénie dans le syndrome parkinsonien post-encéphalitique.3 Pour lui, la brady- phrénie associe l’apathie et une lenteur de la pensée, qu’il est possible de distinguer de la lenteur motrice par des tests neuropsychologiques. L’apathie et la bradyphrénie vont revenir sur le devant de la scène vers les années 1990 grâce aux travaux de Marin à Pittsburg (États-Unis). L’apathie est fréquente dans la maladie de Parkinson, souvent associée à la dépression et à l’anxiété mais pouvant être isolée.
troubles cognitifs
Il a fallu une longue période avant que ne soient individualisés dans la maladie de Parkinson les troubles mentaux, appelés aujourd’hui troubles cognitifs. Parkinson en 1817 indique que les sens et l’intellect sont préservés. Dans ses différentes leçons, Charcot précise qu’il n’y a pas de détérioration intellectuelle sauf à un stade avancé de la maladie.
Au début du xxe siècle, Koenig à Kiehl en 1912 et Lewy à Berlin en 1923 établissent la notion de démence chez certains patients à un stade avancé. À partir des années 1960, des travaux approfondis sont effectués sur la démence parkinsonienne, précisant sa fréquence, effectuant une analyse clinique, neuropsychologique, et des études neuropathologiques. Les années 1980-2000 sont marquées par l’individualisation de la démence à corps de Lewy diffus.
Les travaux approfondis sur les troubles cognitifs sont réalisés grâce aux tests neuropsychologiques à partir des années 1980.6 Sont caractérisés les troubles dysexécutifs (double tâche, flexibilité mentale, résolution de problèmes, élaboration de concepts, de règles, représentation interne), de la mémoire (mémoire de travail, à long terme, et procédurale), et visuo-spatiaux. Il est démontré que les troubles cognitifs peuvent exister dès la phase précoce de la maladie.
Au début du xxe siècle, Koenig à Kiehl en 1912 et Lewy à Berlin en 1923 établissent la notion de démence chez certains patients à un stade avancé. À partir des années 1960, des travaux approfondis sont effectués sur la démence parkinsonienne, précisant sa fréquence, effectuant une analyse clinique, neuropsychologique, et des études neuropathologiques. Les années 1980-2000 sont marquées par l’individualisation de la démence à corps de Lewy diffus.
Les travaux approfondis sur les troubles cognitifs sont réalisés grâce aux tests neuropsychologiques à partir des années 1980.6 Sont caractérisés les troubles dysexécutifs (double tâche, flexibilité mentale, résolution de problèmes, élaboration de concepts, de règles, représentation interne), de la mémoire (mémoire de travail, à long terme, et procédurale), et visuo-spatiaux. Il est démontré que les troubles cognitifs peuvent exister dès la phase précoce de la maladie.
Les lésions anatomiques
L’identification du siège de la lésion dans la maladie de Parkinson a nécessité plus d’un siècle de travaux.1, 7 Pour Charcot, il n’y a pas de lésion spécifique bien définie. Brissaud (1894) fait l’hypothèse que la lésion de la maladie de Parkinson se situe dans le locus niger ou substance noire. En 1912, Lewy fait la découverte, lors d’études post mortem, d’inclusions cytoplasmiques dans les neurones du noyau dorsal du vague et les noyaux caudé- putamen. En 1919, Konstantin Nikolaevich Tretiakoff (1892-1956) soutient à Paris sa thèse sur l’étude post mortem de cas de parkinsonisme post-encéphalitique. Il constate que les inclusions cytoplasmiques les plus importantes se situent dans le locus niger (substance noire), et propose de les appeler corps de Lewy. Tretiakoff souligne que les signes moteurs sont consécutifs, en premier lieu, aux lésions du locus niger.
Les avis restent cependant longtemps partagés concernant la localisation des lésions cérébrales de cette maladie.7 Vont ainsi s’opposer les tenants du corps strié et de l’anse réticulaire, tels Wilson à Londres, Lewy et Cécile Vogt-Mugnier (1875-1962) à Berlin, et James Ramsay Hunt (1874–1937) à New York, et ceux en faveur de la substance noire, tels Charles Foix (1882-1927) à Paris, Rolf Hassler (1914-1984) en Allemagne, et Ludo van Bogaert (1897-1989) à Anvers. Les raisons de ces divergences viennent notamment du fait que coexistent deux types de formes de la maladie, la forme « classique », dégénérative, et la forme « post-encéphalitique ». La controverse ne prendra fin que durant les années 1950 quand Joseph Godwin Greenfield (1884-1958) de Londres imposera définitivement le siège principal des lésions dans la substance noire.7
Au cours des années 1990, les travaux sur les formes familiales mettent en évidence des gènes dont le premier identifié code une protéine, l’α-synucléine, présente en abondance dans les corps de Lewy.1 Cela conduit à introduire le concept de « synucléinopathie ». C’est ainsi que Braak, en Allemagne, grâce à des travaux minutieux corrélant les lésions anatomiques et les signes cliniques, va proposer en 2003 plusieurs stades de progression de la maladie de Parkinson,1 avec un début au niveau des lobes olfactifs et/ou du bulbe, ensuite une diffusion au niveau du mésencéphale, puis du cortex à un stade avancé de la maladie. Cela permet de rendre compte de l’histoire naturelle de la maladie, depuis son début par une anosmie ou des troubles du comportement en sommeil paradoxal, jusqu’à l’évolution tardive vers la perte d’autonomie avec démence parkinsonienne.
Les avis restent cependant longtemps partagés concernant la localisation des lésions cérébrales de cette maladie.7 Vont ainsi s’opposer les tenants du corps strié et de l’anse réticulaire, tels Wilson à Londres, Lewy et Cécile Vogt-Mugnier (1875-1962) à Berlin, et James Ramsay Hunt (1874–1937) à New York, et ceux en faveur de la substance noire, tels Charles Foix (1882-1927) à Paris, Rolf Hassler (1914-1984) en Allemagne, et Ludo van Bogaert (1897-1989) à Anvers. Les raisons de ces divergences viennent notamment du fait que coexistent deux types de formes de la maladie, la forme « classique », dégénérative, et la forme « post-encéphalitique ». La controverse ne prendra fin que durant les années 1950 quand Joseph Godwin Greenfield (1884-1958) de Londres imposera définitivement le siège principal des lésions dans la substance noire.7
Au cours des années 1990, les travaux sur les formes familiales mettent en évidence des gènes dont le premier identifié code une protéine, l’α-synucléine, présente en abondance dans les corps de Lewy.1 Cela conduit à introduire le concept de « synucléinopathie ». C’est ainsi que Braak, en Allemagne, grâce à des travaux minutieux corrélant les lésions anatomiques et les signes cliniques, va proposer en 2003 plusieurs stades de progression de la maladie de Parkinson,1 avec un début au niveau des lobes olfactifs et/ou du bulbe, ensuite une diffusion au niveau du mésencéphale, puis du cortex à un stade avancé de la maladie. Cela permet de rendre compte de l’histoire naturelle de la maladie, depuis son début par une anosmie ou des troubles du comportement en sommeil paradoxal, jusqu’à l’évolution tardive vers la perte d’autonomie avec démence parkinsonienne.
La découverte de la dopamine et du traitement par la L-dopa
La question reste posée dans les années 1950 sur le lien existant entre les lésions de la substance noire et le striatum. La réponse vient rapidement, avec la découverte de la dopamine et de la dopathérapie.1, 8 La dopamine est synthétisée pour la première fois en 1910, identifiée comme un précurseur de la noradrénaline. La L-dopa, précurseur de la dopamine, est isolée pour la première fois en 1913 dans la fève du marais puis dans Mucuna pruriens. En 1957-58, Arvid Carlsson à Lund (Suède) démontre que la dopamine est un neurotransmetteur à part entière dans le cerveau, distinct de la noradré- naline, qu’elle est concentrée presque exclusivement dans le striatum (noyau caudé et putamen). Chez le lapin, l’injection par voie intraveineuse de réserpine entraîne une chute du taux de dopamine dans le cerveau et parallèlement une réduction majeure de l’activité des animaux (syndrome parkinsonien réserpinique). Enfin, l’injection par voie intraveineuse de L-dopa chez le lapin traité par réserpine se traduit par une remontée majeure des taux de dopamine dans le cerveau et par une amélioration parallèle de la mobilité. Carlsson et l’école suédoise établissent le marquage des monoamines cérébrales par histofluorescence, puis le traçage des voies dopa- minergiques et notamment de la voie nigrostriée.
Oleh Hornykiewicz (né en 1926) et Walther Birkmayer (1910-1996), à Vienne, mettent en évidence un déficit en dopamine dans le cerveau post mortem des patients parkinsoniens, et réalisent en 1961 le premier essai de traitement par la L-dopa par voie intraveineuse dans la maladie de Parkinson. Les travaux d’André Barbeau (1931-1986) à Montréal et de Melvin Yahr (1917-2004) à New York vont permettre de tester la L-dopa par voie orale, mais avec des résultats initialement modestes. Une avancée décisive est faite en 1967 grâce à l’essai de doses importantes de L-dopa par George Cotzias (1918-1977) à Brookhaven (États-Unis). Les effets thérapeutiques sont spectaculaires, d’où la rapide diffusion de la dopathérapie dans le monde entier. Les années 1970 sont marquées par la mise au point d’un traitement combinant la L-dopa associée à la dopa-décarboxylase, ce qui permet d’utiliser des doses plus faibles de L-dopa pour une même efficacité tout en réduisant les effets indésirables, notamment nauséeux. Les progrès de la neurochimie conduisent à établir le concept de récepteurs dopaminergiques et l’élaboration de plusieurs médicaments agonistes dopaminergiques.
Le suivi au long cours des patients parkinsoniens sous traitement dopaminergique va faire l’objet de nombreuses publications dans les années 1970-1990. Il apparaît ainsi des fluctuations motrices de plus en plus marquées avec l’avancée de la dénervation dopaminergique, conduisant au phénomène « on-off » (blocage moteur sévère lors de la chute des taux sanguins de L-dopa en phase « off », et libération des mouvements avec souvent des dyskinésies lors de la montée des taux de L-dopa en phase « on »). En outre, le traitement dopaminergique ne contrôle que partiellement les signes de la maladie. Au stade avancé, les signes dopa-résistants concernent une partie croissante de la rigidité et de l’akinésie, des signes axiaux (dysarthrie, troubles de marche et de posture, chutes) et des troubles psychiques (anxiété, dépression, apathie, voire hallucinations et psychose dopaminergique). Les travaux neurochimiques post mortem vont montrer que le processus pathologique n’est pas que dopaminergique (et n’intéresse pas seulement la voie nigrostriée) mais aussi sérotoninergique, noradrénergique, cholinergique, peptidergique … Il est ainsi proposé le concept de lésions en série et de lésions en parallèle.9
Oleh Hornykiewicz (né en 1926) et Walther Birkmayer (1910-1996), à Vienne, mettent en évidence un déficit en dopamine dans le cerveau post mortem des patients parkinsoniens, et réalisent en 1961 le premier essai de traitement par la L-dopa par voie intraveineuse dans la maladie de Parkinson. Les travaux d’André Barbeau (1931-1986) à Montréal et de Melvin Yahr (1917-2004) à New York vont permettre de tester la L-dopa par voie orale, mais avec des résultats initialement modestes. Une avancée décisive est faite en 1967 grâce à l’essai de doses importantes de L-dopa par George Cotzias (1918-1977) à Brookhaven (États-Unis). Les effets thérapeutiques sont spectaculaires, d’où la rapide diffusion de la dopathérapie dans le monde entier. Les années 1970 sont marquées par la mise au point d’un traitement combinant la L-dopa associée à la dopa-décarboxylase, ce qui permet d’utiliser des doses plus faibles de L-dopa pour une même efficacité tout en réduisant les effets indésirables, notamment nauséeux. Les progrès de la neurochimie conduisent à établir le concept de récepteurs dopaminergiques et l’élaboration de plusieurs médicaments agonistes dopaminergiques.
Le suivi au long cours des patients parkinsoniens sous traitement dopaminergique va faire l’objet de nombreuses publications dans les années 1970-1990. Il apparaît ainsi des fluctuations motrices de plus en plus marquées avec l’avancée de la dénervation dopaminergique, conduisant au phénomène « on-off » (blocage moteur sévère lors de la chute des taux sanguins de L-dopa en phase « off », et libération des mouvements avec souvent des dyskinésies lors de la montée des taux de L-dopa en phase « on »). En outre, le traitement dopaminergique ne contrôle que partiellement les signes de la maladie. Au stade avancé, les signes dopa-résistants concernent une partie croissante de la rigidité et de l’akinésie, des signes axiaux (dysarthrie, troubles de marche et de posture, chutes) et des troubles psychiques (anxiété, dépression, apathie, voire hallucinations et psychose dopaminergique). Les travaux neurochimiques post mortem vont montrer que le processus pathologique n’est pas que dopaminergique (et n’intéresse pas seulement la voie nigrostriée) mais aussi sérotoninergique, noradrénergique, cholinergique, peptidergique … Il est ainsi proposé le concept de lésions en série et de lésions en parallèle.9
L’essor de la chirurgie, des lésions à la stimulation cérébrale profonde
L’histoire du traitement chirurgical de la maladie de Parkinson se fait en plusieurs étapes.10 En 1939, un neurochirurgien américain, Russell Meyers (1909-1999), réalise une résection en ouvert de la tête du noyau caudé et du bras antérieur de la capsule interne d’un patient chez lequel on note une régression du tremblement et de la rigidité sans paralysie. Ce chirurgien s’oriente rapidement ensuite vers la cible du pallidum, et réalise une incision des fibres pallido-thalamiques. Dans les années 1950, un autre neurochirurgien américain, Irving Cooper (1922-1985), constate chez un patient parkinsonien la disparition sur le membre controlatéral du tremblement et de la rigidité après ligature de l’artère choroïdienne antérieure. De plus en plus d’équipes vont réaliser des pallidotomies, grâce à l’essor de la chirurgie stéréotaxique avec repérage de la cible par ventriculographie. Parmi les premiers cadres stéréotaxiques mis au point, citons ceux de Jean Talairach (1911-2007) en France et de Lars Leksell (1907-1986) en Suède. À la même époque en Allemagne, Rolf Hassler et Traugott Riechert (1905-1983) vont recommander la cible du noyau ventrolatéral du thalamus pour le traitement de la rigidité et du tremblement. À Paris, Gérard Guiot (1912-1998), neurochirurgien, et Denise Albe- Fessard (1916–2003), neurophysiologiste, réalisent à l’hôpital Foch le micro-enregistrement per-opératoire et démontrent que la meilleure cible pour contrôler le tremblement par thalamotomie est le noyau ventral-intermédiaire du thalamus, ce qui sera appliqué dans de nombreux centres. Parallèlement, en Suède, Leksell établit que la pallidotomie centrée sur la région ventrale postérieure donne de bons résultats sur le tremblement et la rigidité.
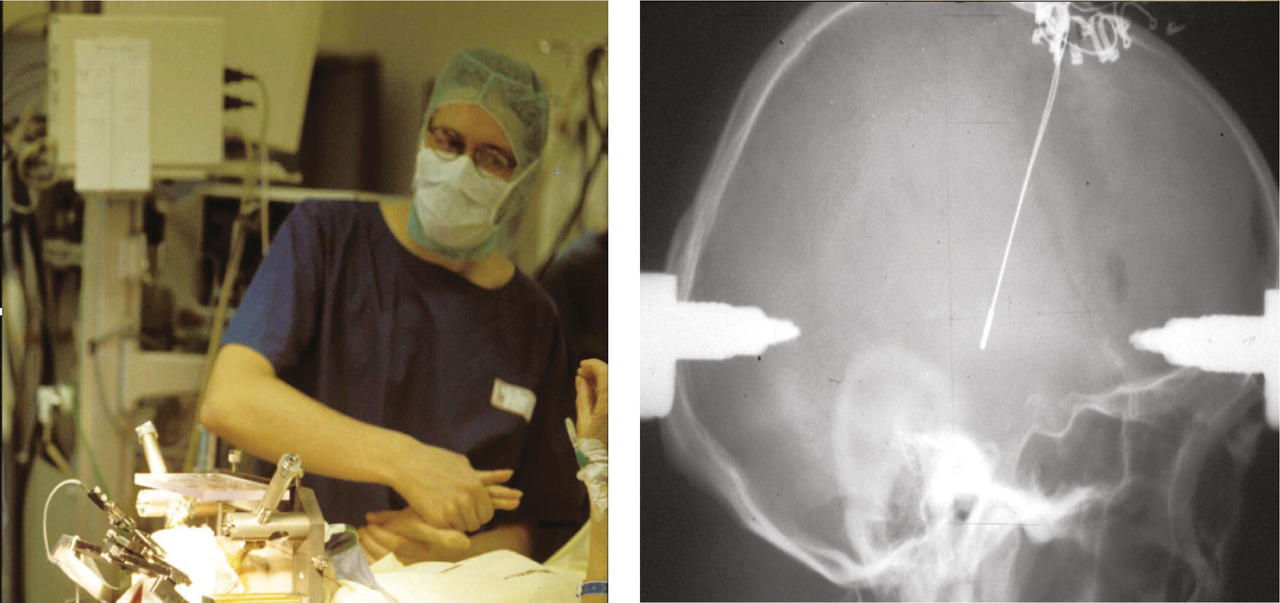
L’avènement de la L-dopa à la fin des années 1960 va cependant conduire à la quasi-disparition de la chirurgie stéréotaxique dans la maladie de Parkinson. La chirurgie va connaître une renaissance à la fin les années 1980 du fait des limites du traitement dopaminergique avec les complications de la dopathérapie au long cours, des progrès des techniques stéréotaxiques et neuro- radiologiques (avec repérage de la cible par imagerie par résonance magnétique), et de la découverte d’un neurotoxique dopaminergique puissant, le MPTP, permettant d’étudier les modèles animaux. On assiste ainsi au développement de la pallidotomie postéro- ventrale dans le traitement de la maladie de Parkinson, sous l’impulsion notamment de Lauri Laitinen (1928-2005) en Suède en 1985. Parallèlement, une nouvelle approche neurochirurgicale conservatrice, qui abandonne les lésions, la stimulation cérébrale profonde, prend naissance à la même époque dans plusieurs centres européens, notamment Zurich, Vienne, Bordeaux et Grenoble. C’est d’abord la stimulation thalamique qui est mise au point pour le tremblement parkinsonien, puis la stimulation pallidale interne, efficace sur les dyskinésies. Une avancée majeure est faite en 1993 à Grenoble avec la stimulation bilatérale du noyau sous-thalamique par Alim-Louis Benabid, neurochirurgien, et Pierre Pollak, neurologue. Cette thérapie s’impose progressivement, la stimulation sous-thalamique s’avérant efficace sur l’akinésie comme sur la rigidité, le tremblement, et les dyskinésies (fig. 5).11 Toutefois, la pallidotomie connaît ces dernières années un regain d’intérêt, étant considérée par certains comme moins coûteuse et plus simple (un seul geste).
L’avènement de la L-dopa à la fin des années 1960 va cependant conduire à la quasi-disparition de la chirurgie stéréotaxique dans la maladie de Parkinson. La chirurgie va connaître une renaissance à la fin les années 1980 du fait des limites du traitement dopaminergique avec les complications de la dopathérapie au long cours, des progrès des techniques stéréotaxiques et neuro- radiologiques (avec repérage de la cible par imagerie par résonance magnétique), et de la découverte d’un neurotoxique dopaminergique puissant, le MPTP, permettant d’étudier les modèles animaux. On assiste ainsi au développement de la pallidotomie postéro- ventrale dans le traitement de la maladie de Parkinson, sous l’impulsion notamment de Lauri Laitinen (1928-2005) en Suède en 1985. Parallèlement, une nouvelle approche neurochirurgicale conservatrice, qui abandonne les lésions, la stimulation cérébrale profonde, prend naissance à la même époque dans plusieurs centres européens, notamment Zurich, Vienne, Bordeaux et Grenoble. C’est d’abord la stimulation thalamique qui est mise au point pour le tremblement parkinsonien, puis la stimulation pallidale interne, efficace sur les dyskinésies. Une avancée majeure est faite en 1993 à Grenoble avec la stimulation bilatérale du noyau sous-thalamique par Alim-Louis Benabid, neurochirurgien, et Pierre Pollak, neurologue. Cette thérapie s’impose progressivement, la stimulation sous-thalamique s’avérant efficace sur l’akinésie comme sur la rigidité, le tremblement, et les dyskinésies (fig. 5).11 Toutefois, la pallidotomie connaît ces dernières années un regain d’intérêt, étant considérée par certains comme moins coûteuse et plus simple (un seul geste).
Le cadre nosologique actuel de la maladie de Parkinson
Le cadre nosologique de la maladie de Parkinson connaît des avancées importantes à partir des années 1980.
Diagnostic différentiel avec les syndromes parkinsoniens « Plus »
Le diagnostic différentiel avec les autres syndromes parkinsoniens dégénératifs est mieux identifié à partir des années 1990,1 sur la base de critères cliniques, radiologiques et neuropathologiques. Cela conduit au concept de syndromes parkinsoniens « plus », qui intéresse la paralysie supranucléaire progressive, l’atrophie multisystématisée, la dégénérescence cortico-basale, et la maladie diffuse des corps de Lewy.
Facteurs étiologiques environnementaux et génétiques
Les années 1980-2000 comportent des recherches majeures sur les facteurs d’environnement et les facteurs génétiques.1 Pour les premiers, outre la forme historique du parkinsonisme post-encéphalitique, la découverte en 1982 d’une neurotoxine puissante détruisant les neurones dopaminergiques, le MPTP, va susciter des recherches appliquées précliniques majeures. Elle suscite la réalisation d’études épidémiologiques impliquant les pesticides comme facteurs favorisant, modérément mais significativement, l’émergence de la maladie de Parkinson. Pour ce qui concerne les facteurs génétiques, les études épidémiologiques montrent qu’il y a 10 à 15 % de cas familiaux, tandis que les travaux cliniques et en biologie moléculaire permettent l’identification de multiples gènes, et ainsi une hétérogénéité des formes cliniques et parfois des données neuropathologiques de cette affection.
Il apparaît ainsi que la maladie de Parkinson est une entité comportant de multiples causes, avec une étiopathogénie mal identifiée. En d’autres termes se pose la question non pas d’une mais de plusieurs maladies de Parkinson, ce qui souligne la nécessité d’établir des critères de diagnostic cliniques confrontés aux données neuropathologiques afin d’améliorer le diagnostic dans la pratique médicale courante et de permettre une recherche clinique de qualité.
Il apparaît ainsi que la maladie de Parkinson est une entité comportant de multiples causes, avec une étiopathogénie mal identifiée. En d’autres termes se pose la question non pas d’une mais de plusieurs maladies de Parkinson, ce qui souligne la nécessité d’établir des critères de diagnostic cliniques confrontés aux données neuropathologiques afin d’améliorer le diagnostic dans la pratique médicale courante et de permettre une recherche clinique de qualité.
Critères de diagnostic de l’UKPSBB
Les critères de diagnostic de l’United Kingdom Parkinson’s Disease Society Brain Bank (UKPSBB) ont été élaborés à Londres à la fin des années 1980,12 et sont les plus utilisés encore à l’heure actuelle. L’examen neuropathologique reste la référence, mais, étant rarement possible, le diagnostic positif de la maladie de Parkinson repose sur des données cliniques et comporte trois étapes : 1) le diagnostic de syndrome parkinsonien, fondé sur l’existence d’une bradykinésie et d’un au moins des autres signes cardinaux ; 2) des critères excluant toutes les autres causes de syndrome parkinsonien ; 3) des critères prospectifs de la maladie de Parkinson, avec le caractère asymétrique, l’évolution lente, la réponse nette et prolongée plus de 5 ans à la L-dopa, l’apparition de dyskinésies sous traitement. Ces critères ont fait l’objet d’évaluations rigoureuses, montrant une valeur prédictive positive de 76 %.12
Nouveaux concepts de la maladie de Parkinson des décennies 2000-2010
L’époque contemporaine a permis l’émergence de nouveaux concepts, d’une part celui de signes moteurs et de signes non moteurs (dont les troubles psychiques), et d’autre part celui de l’existence d’une phase prémotrice (anosmie, troubles du comportement en sommeil paradoxal, constipation, qui peuvent précéder les signes moteurs de plusieurs années). Ces nouveaux concepts montrent la nécessité de mettre au point des biomarqueurs de la maladie.
Critères de diagnostic de maladie de Parkinson de la MDS de 2015
La Movement Disorders Society (MDS) a publié en 2015 une mise à jour des critères de diagnostic de la maladie de Parkinson. Ainsi les signes moteurs restent primordiaux, avec la bradykinésie comme premier critère, associée au tremblement de repos ou à la rigidité. Une reconnaissance croissante est cependant faite aux signes non moteurs, qui sont incorporés dans les critères actuels mais aussi dans des critères séparés pour la phase dite prémotrice de la maladie de Parkinson.13
ENCORE BIEN DES PROGRÈS À FAIRE
Cette revue historique montre le cheminement des idées sur la maladie de Parkinson depuis 1817. Les avancées thérapeutiques majeures sont vraiment sensibles à partir des années 1960. Des progrès restent à faire pour une meilleure prise en charge des troubles psychiques et cognitifs, et pour tenter d’agir sur le cours évolutif de la maladie.
Références
1. Przedborski S. The two-century journey of Parkinson disease research. Nature Rev Neurosci 2017;18:251-9.
2. Broussolle E, Krack P, Thobois S, Xie-Brustolin J, Pollak P, Goetz CG. Contribution of Jules Froment to the study of parkinsonian rigidity. Mov Disord 2007;22:909-14.
3. Prange S, Pagonabarraga J, Krack P, et al. Historical crossroads in the conceptual delineation of apathy in Parkinson’s disease. Brain 2018;141:613-9.
4. Verger H, Cruchet R. Les états parkinsoniens et le syndrome bradykinétique. Paris : J.-B. Baillière et fils, 1925.
5. de Ajuriaguerra J. La notion d’akinésie. In : de Ajuriaguerra J, Gauthier G. Monoamines, noyaux gris centraux et syndrome de Parkinson. Genève : Georg & Cie, 1971 : 565-79.
6. Guillard A, Fénelon G, Mahieux F. Les altérations cognitives au cours de la maladie de Parkinson. Rev Neurol (Paris) 1991;147:337-55.
7. Lees AJ, Selikhova M, Andrade LA, Duyckaerts C. The black stuff and Konstantin Nikolaevich Tretiakoff. Mov Disord 2008;23:770-83.
8. Fahn S, Poewe W, Special issue. Levodoa: 50 years of a revolutionary drug for Parkinson disease. Mov Disord 2015;30:1-3.
9. Agid Y. Parkinson’s disease: Pathophysiology. Lancet 1991;337:1321-4.
10. Cif L, Hariz M. Seventy years of pallidotomy for movement disorders. Mov Disord 2017;32:972-82.
11. Limousin P, Pollak P, Benazzouz A, et al. Effect on parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation. Lancet 1995;345:91-5.
12. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992;55:181-4.
13. Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord 2015;30:1591-9.
2. Broussolle E, Krack P, Thobois S, Xie-Brustolin J, Pollak P, Goetz CG. Contribution of Jules Froment to the study of parkinsonian rigidity. Mov Disord 2007;22:909-14.
3. Prange S, Pagonabarraga J, Krack P, et al. Historical crossroads in the conceptual delineation of apathy in Parkinson’s disease. Brain 2018;141:613-9.
4. Verger H, Cruchet R. Les états parkinsoniens et le syndrome bradykinétique. Paris : J.-B. Baillière et fils, 1925.
5. de Ajuriaguerra J. La notion d’akinésie. In : de Ajuriaguerra J, Gauthier G. Monoamines, noyaux gris centraux et syndrome de Parkinson. Genève : Georg & Cie, 1971 : 565-79.
6. Guillard A, Fénelon G, Mahieux F. Les altérations cognitives au cours de la maladie de Parkinson. Rev Neurol (Paris) 1991;147:337-55.
7. Lees AJ, Selikhova M, Andrade LA, Duyckaerts C. The black stuff and Konstantin Nikolaevich Tretiakoff. Mov Disord 2008;23:770-83.
8. Fahn S, Poewe W, Special issue. Levodoa: 50 years of a revolutionary drug for Parkinson disease. Mov Disord 2015;30:1-3.
9. Agid Y. Parkinson’s disease: Pathophysiology. Lancet 1991;337:1321-4.
10. Cif L, Hariz M. Seventy years of pallidotomy for movement disorders. Mov Disord 2017;32:972-82.
11. Limousin P, Pollak P, Benazzouz A, et al. Effect on parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation. Lancet 1995;345:91-5.
12. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992;55:181-4.
13. Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord 2015;30:1591-9.