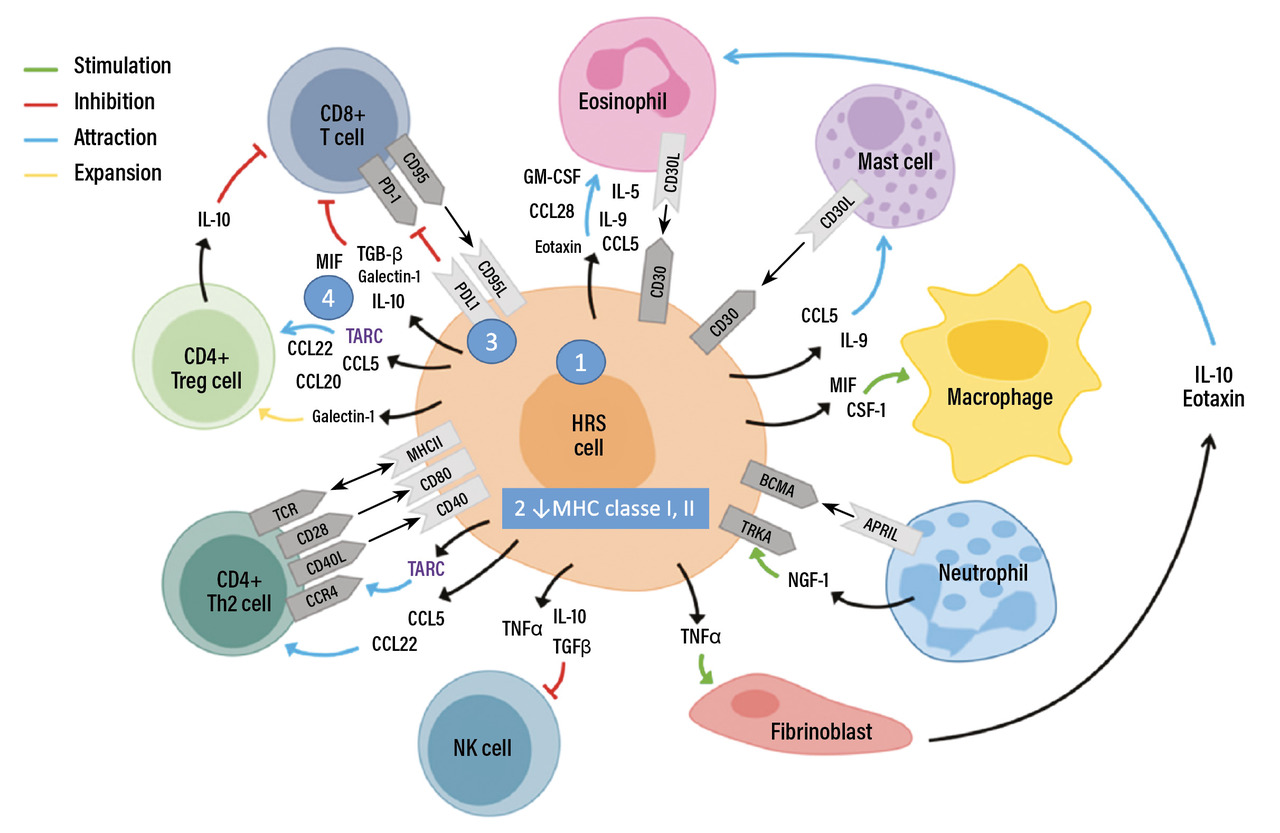
Les cellules tumorales du lymphome de Hodgkin, cellules de « Hodgkin et de Reed-Sternberg (HRS) », représentent moins de 5 % des éléments cellulaires au sein d’un granulome composé des différents types cellulaires du système immunitaire (lymphocytes B, T, NK, des macrophages, mastocytes, polynucléaires éosinophiles, polynucléaires neutrophiles, fibroblastes). L’une des premières conséquences pratiques de ces données est de s’assurer d’une biopsie diagnostique représentative - et donc si possible chirurgicale - pour mettre en évidence les cellules tumorales qui sont en proportion minoritaire au sein du tissu prélevé. L’origine de ces cellules de HRS est restée inconnue jusqu’en 1996, date à laquelle il a été formellement montré que la cellule d’origine était un lymphocyte B. Les mécanismes de la lymphomagenèse restent très mystérieux, d’autant que les connaissances actuelles suggèrent probablement « plusieurs entités » de LH en fonction de l’âge des patients et de son association au virus d’Epstein-Barr (voir l’article « Épidémiologie du lymphome de Hodgkin », p. 611 ).
Cellules tumorales caractéristiques
Les données biologiques du LH peuvent être synthétisées en quatre caractéristiques1 décrites sur la figure :
1. Des cellules tumorales de morphologie (cellules de grande taille avec un noyau mono- ou multinucléé) et de phénotype très aberrant. Contrairement aux lymphomes B, ces cellules HRS ont perdu leur marqueur d’origine et n’expriment pas à leur surface l’antigène CD20. Elles acquièrent d’autres marqueurs de différenciation « empruntés » à des cellules de différenciation différente comme le CD15 (marqueur habituellement de la lignée granulocytaire). Elles expriment le marqueur CD30, cible de l’anticorps thérapeutique brentuximab vedotin. Les analyses de microdissections des cellules HRS retrouvent des mutations de voies oncogéniques spécifiques, comme les voies JAK/STAT, NFkB et Pi3K. L’utilisation d’inhibiteurs de ces différentes voies oncogéniques a eu, en monothérapie, des résultats modestes.
2. L’acquisition d’altérations génomiques permettant un échappement au système immunitaire avec des mutations notamment au niveau du système HLA de classes I et II.
3. L’acquisition de ligands à leur surface qui favorisent l’exhaustion des lymphocytes T et contrecarrent l’efficacité du système immunitaire. Elles expriment ainsi les ligands (PDL1) des récepteurs de type « programmed cell death 1 » (PD1) des lymphocytes T, ce qui entraîne l’anergie de la réponse immunitaire. Une « synapse immunosuppressive » entre les cellules tumorales et les lymphocytes T est ainsi mise en place. Les connaissances des points de contrôle de l‘activation et de l’inhibition des lymphocytes T du système immunitaire ont permis le développement d’anticorps monoclonaux à visée thérapeutique comme les anticorps anti-PD1 qui assurent « la levée » de l’exhaustion du système immunitaire avec, dans le LH, des réponses spectaculaires. D’autres anticorps monoclonaux agissant sur le même principe sont en cours de développement (anti-LAG3, anti-TIM3). Il existe un lien étroit entre les anomalies génomiques des cellules HRS et la mise en place de ces mécanismes d’inhibition du système immunitaire avec, par exemple, des amplifications du gène de PDL1 et PDL2 situé sur le chromosome 9p24.1 menant à la surexpression de PDL1 à la surface des cellules HRS.
4. L’influence des cellules HRS sur leur micro-environnement par un réseau de cytokines, de chimiokines et de récepteurs solubles de la famille du TNFα, en mettant à leur profil les cellules réactionnelles.
Amélioration des connaissances biologiques au service de la thérapeutique
On peut espérer que l’amélioration des connaissances biologiques qui, pour certaines, sont communes à d’autres cancers, notamment le rôle des points de contrôle du système immunitaire (ou « immune checkpoints »),2 permette de poursuivre les avancées thérapeutiques pour les patients en rechute, mais également pour développer des programmes thérapeutiques à même de réduire l’utilisation d’agents cytotoxiques ou de la radiothérapie. L’amélioration des connaissances biologiques pourra probablement favoriser un meilleur suivi des patients porteurs de LH.
Les données biologiques récentes montrent que de l’ADN tumoral des cellules de HRS est libéré dans le sang, correspondant à l’ADN tumoral circulant (ADNct). Les premières études montrent que l’analyse de l’ADNct permet un « monitoring » de l’efficacité des traitements probablement complémentaires aux outils d’imagerie.3 Ces propriétés concourent également à « simplifier » l’étude du génome des cellules tumorales via le séquençage de l’ADNtc, l’accessibilité aux cellules HRS au sein du tissu tumoral via les techniques de microdissection étant complexe.
Les données biologiques récentes montrent que de l’ADN tumoral des cellules de HRS est libéré dans le sang, correspondant à l’ADN tumoral circulant (ADNct). Les premières études montrent que l’analyse de l’ADNct permet un « monitoring » de l’efficacité des traitements probablement complémentaires aux outils d’imagerie.3 Ces propriétés concourent également à « simplifier » l’étude du génome des cellules tumorales via le séquençage de l’ADNtc, l’accessibilité aux cellules HRS au sein du tissu tumoral via les techniques de microdissection étant complexe.
Références
1. Zijtregtop EAM, van der Strate I, Beishuizen A, Zwaan CM, Scheijde-Vermeulen MA, Brandsma AM, et al. Biology and clinical applicability of plasma Thymus and Activation-Regulated Chemokine (TARC) in classical Hodgkin lymphoma. Cancers (Basel) 2021;13(4):884.
2. Carbone A, Gloghini A, Carlo Stella C. Tumor microenvironment contribution to checkpoint blockade therapy. Lessons learned from Hodgkin lymphoma. Blood 2023; blood.2022016590.
3. Spina V, Bruscaggin A, Cuccaro A, Martini M, Di Trani M, Forestieri G, et al. Circulating tumor DNA reveals genetics, clonal evolution, and residual disease in classical Hodgkin lymphoma. Blood 2018;131(22):2413-25.
2. Carbone A, Gloghini A, Carlo Stella C. Tumor microenvironment contribution to checkpoint blockade therapy. Lessons learned from Hodgkin lymphoma. Blood 2023; blood.2022016590.
3. Spina V, Bruscaggin A, Cuccaro A, Martini M, Di Trani M, Forestieri G, et al. Circulating tumor DNA reveals genetics, clonal evolution, and residual disease in classical Hodgkin lymphoma. Blood 2018;131(22):2413-25.