La transplantation d’organes est actuellement le traitement de choix pour suppléer les dysfonctions d’organes arrivées au stade terminal. De nombreuses maladies peuvent nécessiter une greffe d’organe : insuffisance rénale terminale, malformation ou maladie cardiaque, maladie du foie, mucoviscidose, certains cancers, etc. Le rein est l’organe le plus greffé, suivi par le foie, le cœur et les poumons, puis le pancréas et l’intestin. Il est également possible de greffer des tissus tels que la cornée, la peau ou les artères. Le vieillissement de la population conduit à une augmentation du nombre de receveurs éligibles, avec une évolution du nombre d’inscrits sur la liste d’attente active au 1er janvier entre 2012 et 2022, de respectivement 7 041 à 10 983 ; le nombre de greffes effectuées, tous organes confondus, est passé de 5 023 à 5 276.1 L’âge des greffés a également augmenté entre 2012 à 2021 excepté pour le cœur, le cœur-poumon, l’intestin et le pancréas.1
L’évolution du nombre de décès en liste d’attente par année de 2012 à 2021 est marquée par une augmentation de 537 à 995.1 Ces chiffres soulignent une carence d’organes disponibles consécutive notamment à l’amélioration de la sécurité routière et à la prise en charge des accidents vasculaires cérébraux par les unités neurovasculaires.2
Ces constatations ont conduit les équipes à élargir les sources de donneurs d’organes (tableau ) en prélevant des donneurs de plus 60 ans, décédés de cause vasculaire cérébrale et/ou ayant une hypertension artérielle et/ou ayant une créatininémie supérieure à 1,5 mg/dL (150 µmol/L), ou des donneurs décédés après arrêt circulatoire (DDAC, classification de Maastricht). Trois types de donneurs sont ainsi distingués :
L’évolution du nombre de décès en liste d’attente par année de 2012 à 2021 est marquée par une augmentation de 537 à 995.1 Ces chiffres soulignent une carence d’organes disponibles consécutive notamment à l’amélioration de la sécurité routière et à la prise en charge des accidents vasculaires cérébraux par les unités neurovasculaires.2
Ces constatations ont conduit les équipes à élargir les sources de donneurs d’organes (
- les donneurs vivants, pour le rein et une partie de foie ;
- les donneurs décédés après mort encéphalique (DDME), pour les reins, foie, cœur, poumon, pancréas et intestin ;
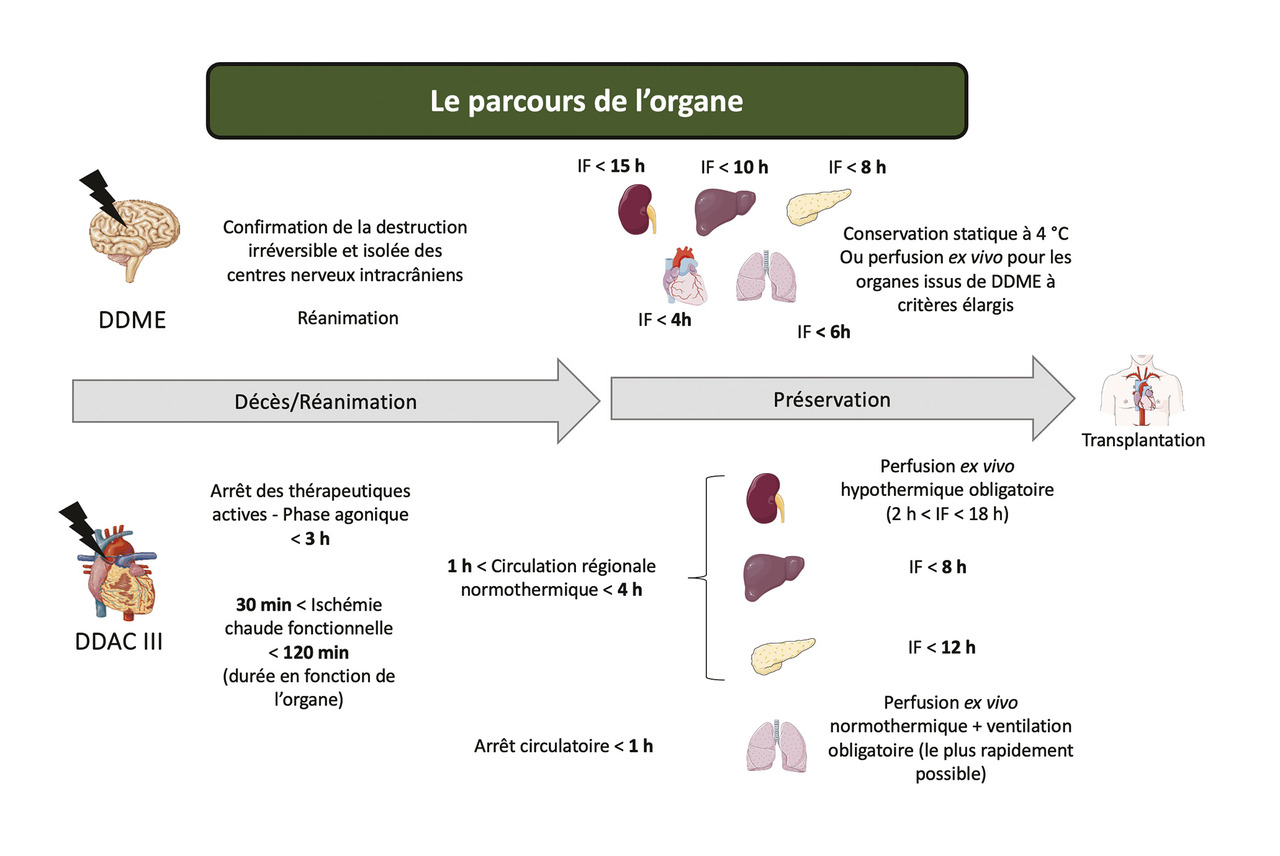
- les DDAC (principalement la catégorie III de Maastricht en France), pour les rein, foie, pancréas et poumon (
fig. 1 ).
Risque de syndrome d’ischémie reperfusion
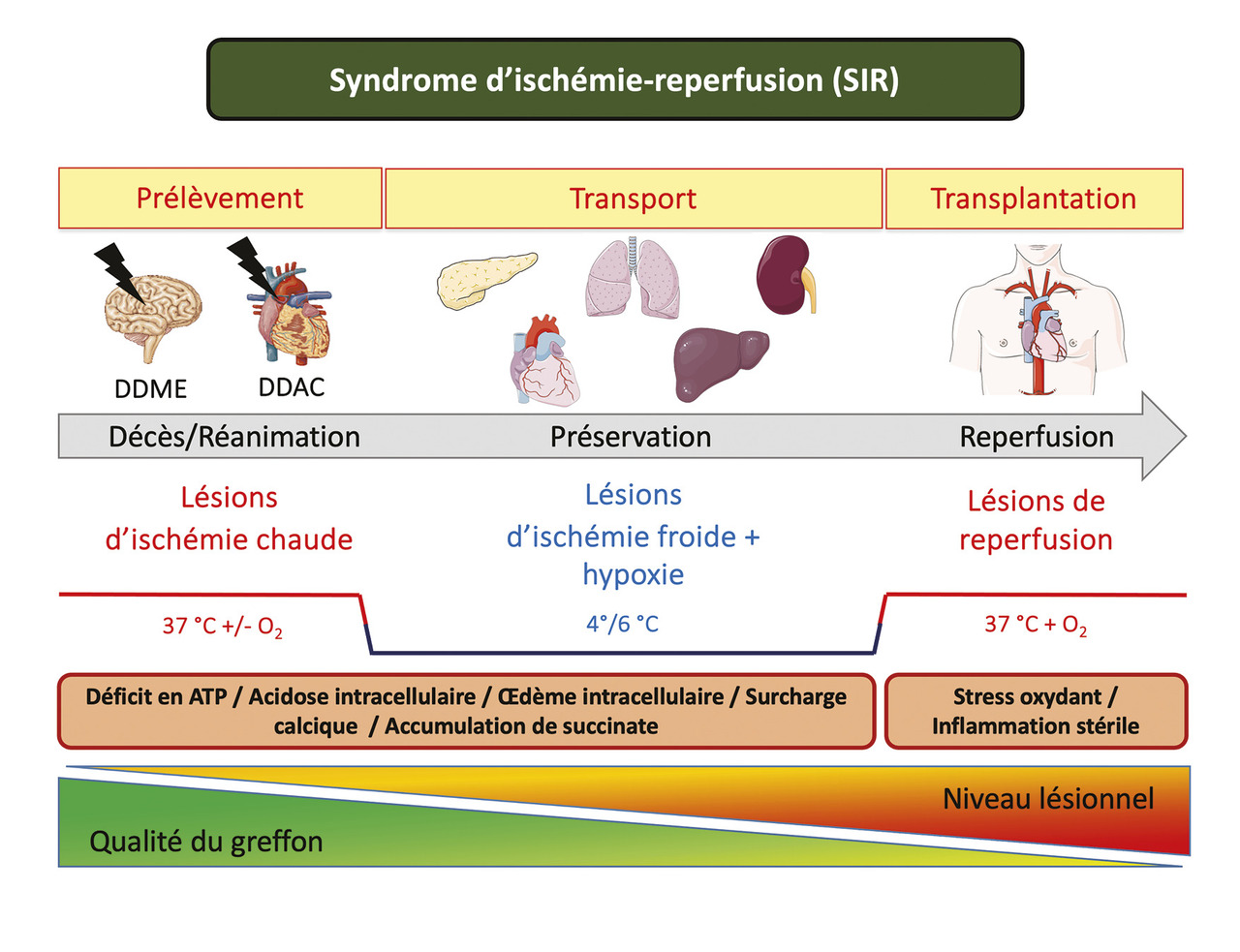
Les organes sont exposés au syndrome d’ischémie reperfusion (SIR), qui regroupe l’ensemble des lésions survenant lors du prélèvement, de la conservation et allant jusqu’à la phase de réchauffement et de réoxygénation (stress oxydant) chez le receveur (fig. 2 ).3 Le SIR capitalise aussi les lésions potentielles en lien avec la réanimation du donneur. Les conséquences de ce SIR peuvent être une mauvaise fonction du greffon et le rejet.4 L’adaptation des moyens de conservation des greffons a été nécessaire pour limiter voire prévenir le SIR.
Conserver les greffons dans de meilleures conditions
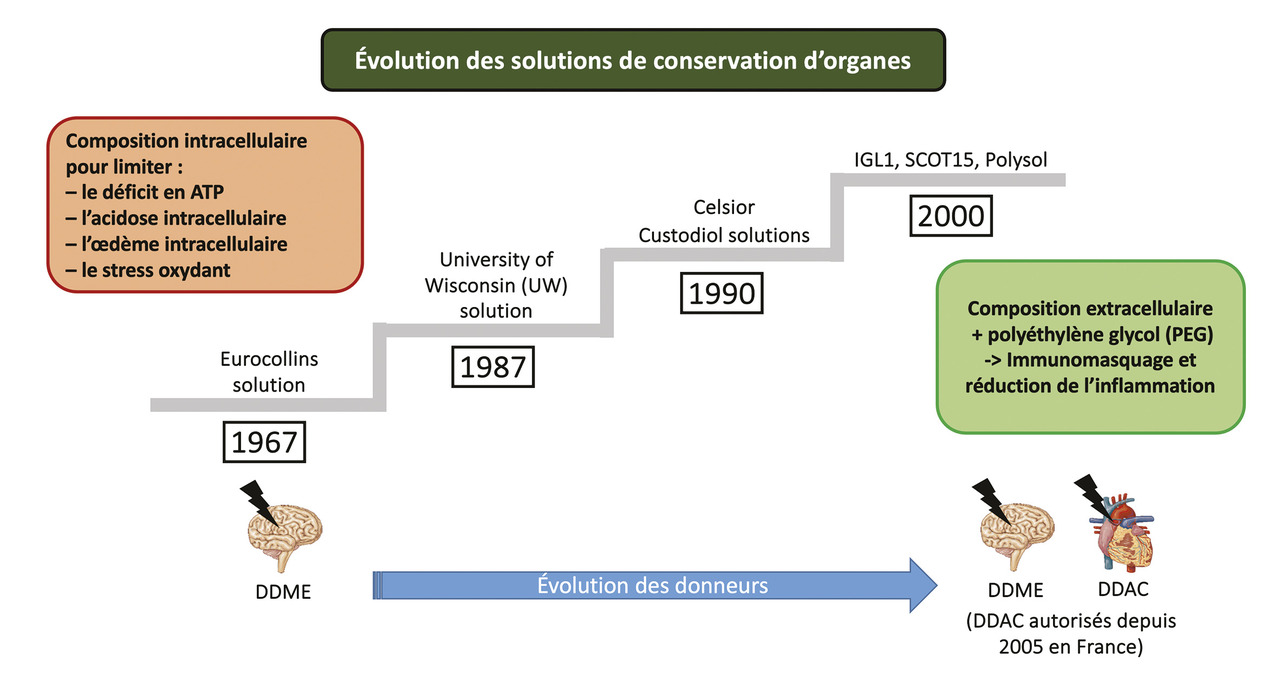
Initialement, la conservation était fondée sur l’hypothermie (entre 4 et 6 °C), qui avait pour but de limiter l’activité métabolique et les besoins en oxygène des greffons.5 En parallèle, les compositions des solutions de conservation des organes ont évolué afin de répondre aux différentes méthodes de préservation des greffons et limiter les lésions du SIR (fig. 3 ).14 Dans les années 1970, les solutions de conservation étaient de type intracellulaire contenant plus de 5 mmol/L de potassium, avec parfois la présence de colloïdes. Depuis les années 2000, les solutions ont évolué vers une composition plus physiologique, avec une concentration de potassium proche de 5 mmol/L et la présence de colloïdes plus adaptés, tels que le polyéthylène glycol (PEG), colloïde atoxique neutre et ayant des propriétés immunoprotectrices potentielles (concept d’immunomasquage).6
Apport des machines de perfusion
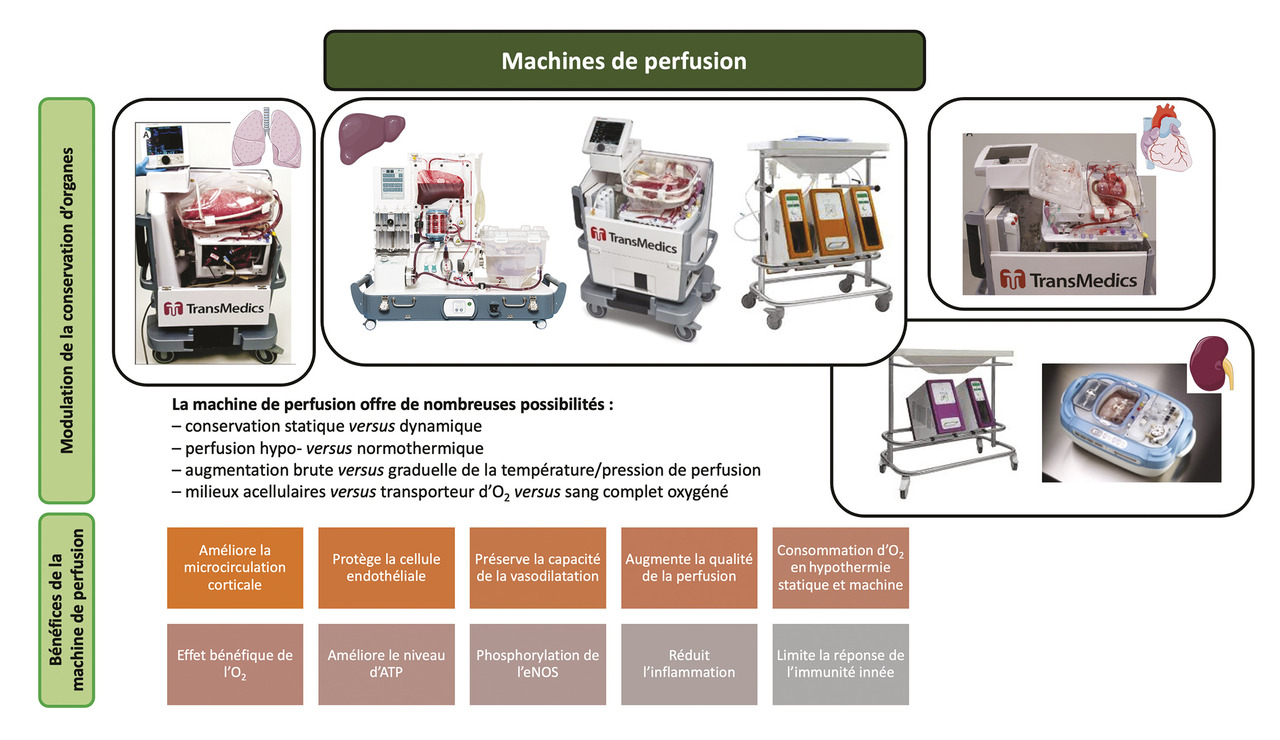
Compte tenu de l’évolution des donneurs, l’Agence de la biomédecine impose le recours à la perfusion ex vivo, c’est-à-dire sur machine, pour certains organes issus de DDAC III, notamment le rein (conservation hypothermique, ischémie froide comprise entre 2 et 18 heures) et les poumons (conservation normothermique oxygénée). La perfusion ex vivo peut aussi être utilisée pour certains organes issus de donneurs en état de mort encéphalique, dits à critères élargis.7 Ces machines initialement développées pour le rein existent maintenant pour chaque organe, et aujourd’hui une part importante de la recherche clinique en transplantation se porte sur les possibilités de conservation qu’offrent ces machines (oxygénation à 4 °C ou à 37 °C, augmentation progressive de la température…). Notre équipe a apporté un éclairage cognitif sur le rôle de la machine de perfusion, son rôle dans la protection de la voie de signalisation du monoxyde d’azote et l’apport d’oxygène (fig. 4 ).8-10
Vers une perfusion normothermique ?
D’autres approches sont en cours d’évaluation, comme la perfusion normothermique (NMP) pour à la fois préserver, évaluer et réhabiliter les organes, en particulier venant des DDAC, comme dans le cas de la transplantation pulmonaire.11 Ce concept s’étend actuellement à d’autres organes, comme le foie, le cœur et le pancréas et peut-être le rein. L’Agence de la biomédecine recommande également, pour les DDAC III, la mise en place d’une circulation régionale normothermique (CRN) avec le sang du donneur oxygéné pour la greffe hépatique, pancréatique et rénale. D’une durée comprise entre une et quatre heures, elle permet la récupération des dommages cellulaires induits par l’ischémie chaude. Nous avons modélisé cette technique au laboratoire et précisé les modalités de son utilisation.12 La CRN représente un moyen de conditionnement qui est actuellement utilisé dans certains pays et pourrait être une évolution intéressante.13 La période de conservation est une fenêtre thérapeutique très prometteuse, permettant l’utilisation d’agents pharmacologiques ciblés, mais envisageable uniquement en NMP.14,15
Besoin prégnant de nouveaux outils d’évaluation des greffons
Étant donné la diversité des donneurs et de la qualité des organes prélevés, de nouveaux outils d’évaluation et de classification des greffons sont nécessaires. Les agences chargées de l’attribution des greffons et les équipes de transplantation ont de plus en plus besoin de modèles pronostiques permettant d’anticiper la qualité et la survie du greffon. Les approches transcriptomique, métabolomique ou protéomique sont des perspectives intéressantes pour optimiser le processus du don d’organes.
Des algorithmes pour optimiser la transplantation ?
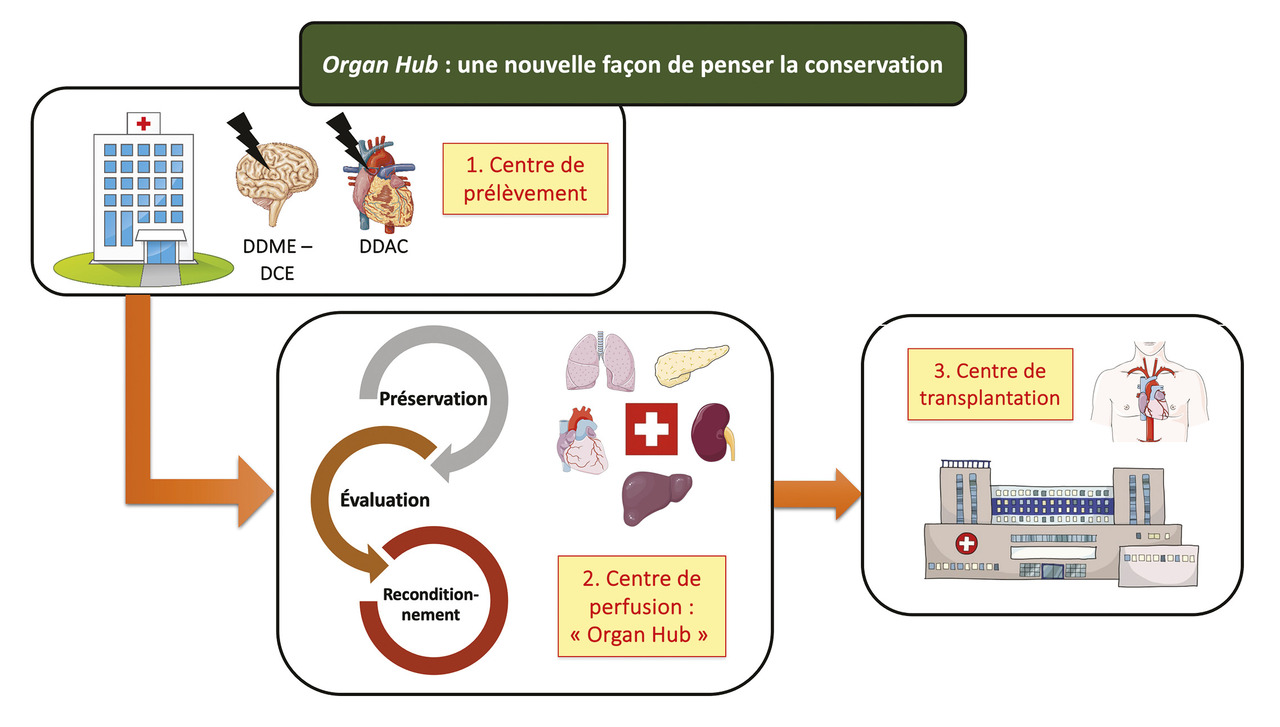
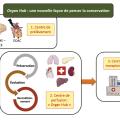
Enfin, la création d’« Organ Hubs » impliqués au sein d’un réseau de transplantation d’organes permettrait une concentration de moyens et d’outils thérapeutiques nécessaires pour proposer des protocoles de prise en charge optimisée et harmonisée (fig. 5 ). Ce concept permettrait d’établir des algorithmes décisionnels fondés sur la qualité de l’organe à transplanter et ainsi de personnaliser la prise en charge pour augmenter le succès de la transplantation d’organes.15 Ces avancées sont soutenues par le Plan ministériel 2022-2026 organes-tissus, qui prévoit d’injecter 210 millions d’euros supplémentaires pour développer, entre autres, les prélèvements multisources (donneurs vivants et DDAC III), former davantage de personnels hospitaliers et soutenir la recherche dans ce domaine.
Références
1. Agence de la biomédecine. Rapport médical et scientifique du prélèvement et de la greffe en France. https://vu.fr/tdniQ
2. Chapelon J. L’impact économique de la sécurité routière. Les Tribunes de la santé 2008;4(21):65-70.
3. Fernández AR, Sánchez-Tarjuelo R, Cravedi P, Ochando J, López-Hoyos M. Review: Ischemia reperfusion injury - A translational perspective in organ transplantation. Int J Mol Sci 2020;21:8549.
4. Resch T, Cardini B, Oberhuber R, Weissenbacher A, Dumfarth J, Krapf C, et al. Transplanting marginal organs in the era of modern machine perfusion and advanced organ monitoring. Front Immunol 2020;11:631.
5. Southard JH, Belzer FO. Organ preservation. Annu Rev Med 1995;46:235-47.
6. Hauet T, Eugene M. A new approach in organ preservation: Potential role of new polymers. Kidney Int 2008;74(8):998-1003.
7. Smith M, Dominguez-Gil B, Greer DM, Manara AR, Souter MJ. Organ donation after circulatory death: Current status and future potential. Intensive Care Med 2019;45(3):310-21.
8. Chatauret N, Coudroy R, Delpech PO, Vandebrouck C, Hosni S, Scepi M, et al. Mechanistic analysis of nonoxygenated hypothermic machine perfusion’s protection on warm ischemic kidney uncovers greater eNOS phosphorylation and vasodilation. Am J Transplant 2014;14(11):2500-14.
9. Aubert V, Kaminski J, Guillaud F, Hauet T, Hannaert P. A computer model of oxygen dynamics in the cortex of the rat kidney at the cell-tissue level. Int J Mol Sci 2019;20(24):6246.
10. Venema LH, Brat A, Moers C, Hart NA, Ploeg RJ, Hannaert P, et al. COPE consortium. Effects of oxygen during long-term hypothermic machine perfusion in a porcine model of kidney donation after circulatory death. Transplantation 2019;103(10):2057-64.
11. Dunne B, Pozniak J, Campo-Canaveral de la Cruz JL, Lemaitre P, Ma J, Pierre AF, et al. Ex vivo lung evaluation of single donor lungs when the contralateral lung is rejected increases safe use. J Thorac Cardiovasc Surg 2023;165(2):526-31.
12. Kerforne T, Allain G, Giraud S, Bon D, Ameteau V, Couturier P, et al. Defining the optimal duration for normothermic regional perfusion in the kidney donor: A porcine preclinical study. Am J Transplant 2019;19(3):737-51.
13. Hessheimer AJ, Billault C, Barrou B, Fondevila C. Hypothermic or normothermic abdominal regional perfusion in high-risk donors with extended warm ischemia times: Impact on outcomes? Transpl Int 2015;28(6):700-7.
14. Giraud S, Thuillier R, Kerforne T, Barrou B, Badet L, Bucur P, et al. Preservation of organs to be transplanted: Development of an essential step in the transplant process. Bull Acad Natl Med 2022;206(4):518-33.
15. Lepoittevin M, Giraud S, Kerforne T, Barrou B, Badet L, Bucur P, et al. Preservation of organs to be transplanted: An essential step in the transplant process. Int J Mol Sci 2022;23(9):4989.
2. Chapelon J. L’impact économique de la sécurité routière. Les Tribunes de la santé 2008;4(21):65-70.
3. Fernández AR, Sánchez-Tarjuelo R, Cravedi P, Ochando J, López-Hoyos M. Review: Ischemia reperfusion injury - A translational perspective in organ transplantation. Int J Mol Sci 2020;21:8549.
4. Resch T, Cardini B, Oberhuber R, Weissenbacher A, Dumfarth J, Krapf C, et al. Transplanting marginal organs in the era of modern machine perfusion and advanced organ monitoring. Front Immunol 2020;11:631.
5. Southard JH, Belzer FO. Organ preservation. Annu Rev Med 1995;46:235-47.
6. Hauet T, Eugene M. A new approach in organ preservation: Potential role of new polymers. Kidney Int 2008;74(8):998-1003.
7. Smith M, Dominguez-Gil B, Greer DM, Manara AR, Souter MJ. Organ donation after circulatory death: Current status and future potential. Intensive Care Med 2019;45(3):310-21.
8. Chatauret N, Coudroy R, Delpech PO, Vandebrouck C, Hosni S, Scepi M, et al. Mechanistic analysis of nonoxygenated hypothermic machine perfusion’s protection on warm ischemic kidney uncovers greater eNOS phosphorylation and vasodilation. Am J Transplant 2014;14(11):2500-14.
9. Aubert V, Kaminski J, Guillaud F, Hauet T, Hannaert P. A computer model of oxygen dynamics in the cortex of the rat kidney at the cell-tissue level. Int J Mol Sci 2019;20(24):6246.
10. Venema LH, Brat A, Moers C, Hart NA, Ploeg RJ, Hannaert P, et al. COPE consortium. Effects of oxygen during long-term hypothermic machine perfusion in a porcine model of kidney donation after circulatory death. Transplantation 2019;103(10):2057-64.
11. Dunne B, Pozniak J, Campo-Canaveral de la Cruz JL, Lemaitre P, Ma J, Pierre AF, et al. Ex vivo lung evaluation of single donor lungs when the contralateral lung is rejected increases safe use. J Thorac Cardiovasc Surg 2023;165(2):526-31.
12. Kerforne T, Allain G, Giraud S, Bon D, Ameteau V, Couturier P, et al. Defining the optimal duration for normothermic regional perfusion in the kidney donor: A porcine preclinical study. Am J Transplant 2019;19(3):737-51.
13. Hessheimer AJ, Billault C, Barrou B, Fondevila C. Hypothermic or normothermic abdominal regional perfusion in high-risk donors with extended warm ischemia times: Impact on outcomes? Transpl Int 2015;28(6):700-7.
14. Giraud S, Thuillier R, Kerforne T, Barrou B, Badet L, Bucur P, et al. Preservation of organs to be transplanted: Development of an essential step in the transplant process. Bull Acad Natl Med 2022;206(4):518-33.
15. Lepoittevin M, Giraud S, Kerforne T, Barrou B, Badet L, Bucur P, et al. Preservation of organs to be transplanted: An essential step in the transplant process. Int J Mol Sci 2022;23(9):4989.