Le diagnostic étiologique de maladie rénale chronique (MRC) permet parfois un traitement spécifique : levée d’un obstacle, immunosuppression pour une pathologie auto-immune, arrêt d’un néphrotoxique… Au-delà, un traitement symptomatique néphroprotecteur doit être proposé.
Le traitement d’une hypertension artérielle est plus exigeant chez les patients porteurs de MRC albuminurique, avec des cibles de pression artérielle systolique (PAS) encore débattues. La cible de PAS retenue actuellement est < 130 mmHg au cabinet (ou < 125 - 130 mmHg en automesure) dans des conditions de mesure standardisées.1 Les conditions de mesure standardisées au cabinet sont strictes et difficiles à respecter. Le patient doit être assis sur une chaise pour s’adosser, le bras posé sur une table, les pieds posés à plat sans croiser les jambes, vessie vide et déclencher les mesures par un appareil automatique après au moins cinq minutes de repos strict sans télévision, ni radio, ni lecture, ni conversation. Théoriquement, le malade doit être seul, sans présence du médecin. L’appareil automatique doit déclencher trois prises à deux minutes d’intervalle, et on fera la moyenne des deux dernières mesures. Comme il est difficile en pratique de respecter ces conditions de mesure au cabinet, même chez des spécialistes, il faudra réaliser des automesures tensionnelles à domicile, dans les mêmes conditions, avec trois jours de suite, trois mesures le matin et trois mesures le soir. La PAS retenue sera la moyenne des dix-huit mesures réalisées. Il faudra aussi veiller à ne pas abaisser volontairement la PAS en dessous de 110 mmHg et contrôler l’absence d’hypotension artérielle orthostatique. Cette recherche d’hypotension artérielle orthostatique comporte un interrogatoire (lipothymies lors des passages en orthostatisme) et des mesures de pression artérielle une et trois minutes après le lever (baisse de plus de PAS ≥ 20 mmHg et/ou de PAS ≥ 10 mmHg).
En plus d’une restriction sodée à 5 - 6 g/j, si le rapport albuminurie/créatininurie (RAC) est ≥ 30 mg/g de créatininurie, le traitement doit comporter en première intention un blocage du système rénine-angiotensine-aldostérone (SRAA) par inhibiteur de l’enzyme de conversion (IEC) ou antagoniste des récepteurs de l’angiotensine 2 (ARA2).2 Il ne faudra pas associer ces traitements. Le blocage du SRAA par IEC ou ARA2 diminue le risque d’événements rénaux majeurs (doublement de créatininémie ou insuffisance rénale terminale) d’environ 20 %.3,4 Les IEC et les ARA2 agissent essentiellement en vasodilatant les artérioles efférentes des glomérules, permettant une diminution de la pression intraglomérulaire et donc de l’albuminurie. Plus l’albuminurie résiduelle est basse, plus la perte du début de filtration glomérulaire estimée (DFGe) ultérieure sera lente. Le risque principal de l’association d’un blocage du SRAA avec une restriction sodée et un traitement diurétique est de favoriser des épisodes d’insuffisance rénale aiguë fonctionnelle à l’occasion de pertes sudorales ou digestive accrues.
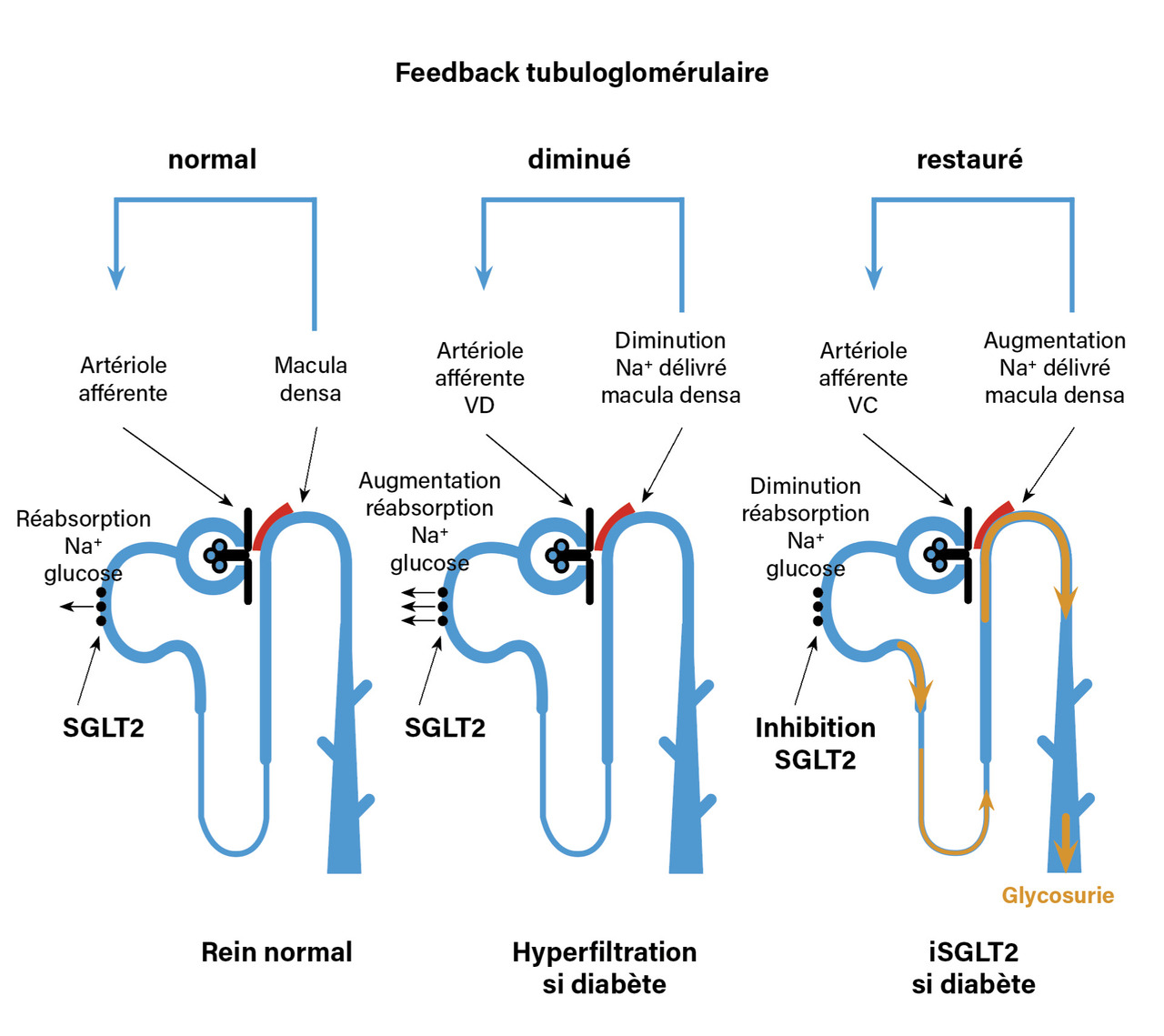
Il faut maintenant associer, en deuxième intention, un inhibiteur du cotransport sodium-glucose de type 2 (iSGLT2), même en l’absence de diabète, si le RAC résiduel sous IEC ou ARA2 reste ≥ 200 mg/g ou quel que soit le RAC si le DFGe est entre 20 et 45 mL/min/1,73 m2.5,6 L’indication des iSGLT2 est encore plus large chez les sujets diabétiques si le DFGe est supérieur à 60 mL/min/1,73 m2, puisque ces médicaments participent alors au contrôle de la glycémie. La réduction supplémentaire des événements rénaux majeurs chez des patients prenant déjà un IEC ou un ARA2 est de 30 à 44 % supplémentaires.5,6 Le mécanisme de la néphroprotection par les iSGLT2 est débattu. Il passe certainement en partie par un contrôle de l’hypervolémie et donc de l’albuminurie, comme tous les natriurétiques en association avec les bloqueurs du SRAA.7,8 L’effet natriurétique des iSGLT2 est comparable à celui exercé par un diurétique thiazidique pendant les premières semaines de traitement, avec une perte de poids similaire jusqu’à huit semaines, nécessairement liée à une perte d’eau et de sodium.9 Cette déplétion explique la perte aiguë de DFGe observée dès les deux premières semaines (fig. 1).5 Puis on observe une récupération très partielle aiguë du DFGe, probablement associée à un échappement partiel de l’effet diurétique, et ensuite la pente de la perte de DFGe sera plus lente que sous placebo.5 L’action natriurétique des iSGLT2 reste significative même quand le DFGe est < 45 mL/min/1,73 m2, alors que l’effet hypoglycémiant devient négligeable.8 Les iSGLT2 abaissent d’ailleurs la PAS d’environ 4 mmHg, et même 5 mmHg en mesure ambulatoire de la pression artérielle.9 Cependant, la réduction des événements rénaux majeurs est identique chez les diabétiques et les non-diabétiques, bien que la baisse d’albuminurie soit plus importante chez les diabétiques,10 démontrant qu’une partie du bénéfice rénal est indépendant de la baisse de l’albuminurie. La baisse supplémentaire de l’albuminurie chez les diabétiques s’explique par un effet hémodynamique supplémentaire des iSGLT2, spécifique à cette population, lié à la réactivation du feedback tubuloglomérulaire dans un contexte de multiplication des SGLT2 en réponse à la glycosurie (fig. 2).11 Les risques principaux associés au traitement par iSGLT2 sont les infections urogénitales et les acidocétoses chez les diabétiques.
Chez les diabétiques, il faudra bientôt associer, en troisième intention, un antagoniste des récepteurs aux minéralocorticoïdes (ARM).12 Le bénéfice des ARM chez les non-diabétiques est en cours d’évaluation. Cet effet néphroprotecteur passe aussi probablement par plusieurs mécanismes. Une monothérapie par IEC ou ARA2 n’empêche pas un échappement du taux d’aldostérone après seulement un an de traitement, permettant une réactivation des récepteurs aux minéralocorticoïdes, avec de nombreuses conséquences délétères.13 Les ARM non stéroïdiens auraient le double avantage de ne pas interférer avec les hormones sexuelles et de limiter le recrutement de facteurs de transcription impliqués dans les mécanismes de fibrose.14
La restriction des apports en protéines à 0,6 - 0,8 g/kg de poids par jour chez les diabétiques et 0,4 - 0,6 g/kg par jour chez les non-diabétiques contribue significativement à retarder l’échéance des traitements de suppléance rénale.15 Une restriction plus drastique des apports en protéines est possible, sous couvert d’une surveillance nutritionnelle et d’une supplémentation en céto-analogues.
Enfin, les patients MRC sont à très haut risque cardiovasculaire et doivent bénéficier d’une prise en charge globale de tous leurs facteurs de risque vasculaires : arrêt d’un tabagisme, réduction pondérale, équilibre d’un diabète, baisse du LDLc (cholestérol à lipoprotéines de basse densité)… En effet, un patient MRC est parfois à plus haut risque de mourir d’une complication cardiovasculaire que d’arriver au stade des traitements de suppléance rénale. Le contrôle de l’ensemble des facteurs de risque vasculaires pourrait aussi contribuer à freiner la progression de la MRC.
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel du laboratoire AstraZeneca , sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
2. Executive summary of the KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Cheung AK, Chang TI, Cushman WC, Furth SL, Hou FF, Ix JH, Knoll GA, Muntner P, Pecoits-Filho R, Sarnak MJ, Tobe SW, Tomson CRV, Lytvyn L, Craig JC, Tunnicliffe DJ, Howell M, Tonelli M, Cheung M, Earley A, Mann JFE. Kidney Int 2021 Mar;99(3):559-69.
3. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, Remuzzi G, Snapinn SM, Zhang Z, Shahinfar S; RENAAL Study Investigators. N Engl J Med 2001 Sep 20;345(12):861-9.
4. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to tpe 2 diabetes. Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, Ritz E, Atkins RC, Rohde R, Raz I; Collaborative Study Group. N Engl J Med 2001 Sep 20;345(12):851-60.
5. Dapagliflozin in Patients with Chronic Kidney Disease. Heerspink HJL, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, Sjöström CD, Toto RD, Langkilde AM, Wheeler DC; DAPA-CKD Trial Committees and Investigators. N Engl J Med 2020 Oct 8;383(15):1436-46.
6. Empagliflozin in Patients with Chronic Kidney Disease.The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, Wanner C, Green JB, Hauske SJ, Emberson JR, Preiss D, Judge P, Mayne KJ, Ng SYA, Sammons E, Zhu D, Hill M, Stevens W, Wallendszus K, Brenner S, Cheung AK, Liu ZH, Li J, Hooi LS, Liu W, Kadowaki T, Nangaku M, Levin A, Cherney D, Maggioni AP, Pontremoli R, Deo R, Goto S, Rossello X, Tuttle KR, Steubl D, Petrini M, Massey D, Eilbracht J, Brueckmann M, Landray MJ, Baigent C, Haynes R. N Engl J Med 2023 Jan 12;388(2):117-27.
7. Diuretic and enhanced sodium restriction results in improved antiproteinuric response to RAS blocking agents. Esnault VL, Ekhlas A, Delcroix C, Moutel MG, Nguyen JM. J Am Soc Nephrol 2005 Feb;16(2):474-81.
8. Effects of dietary sodium and hydrochlorothiazide on the antiproteinuric efficacy of losartan. Vogt L, Waanders F, Boomsma F, de Zeeuw D, Navis G. J Am Soc Nephrol 2008 May;19(5):999-1007.
9. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kohan DE, Fioretto P, Tang W, List JF. Kidney Int 2014 Apr;85(4):962-71.
10. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Wheeler DC, Stefánsson BV, Jongs N, Chertow GM, Greene T, Hou FF, McMurray JJV, Correa-Rotter R, Rossing P, Toto RD, Sjöström CD, Langkilde AM, Heerspink HJL; DAPA-CKD Trial Committees and Investigators. Lancet Diabetes Endocrinol 2021 Jan;9(1):22-31.
11. Activation of the Tubulo-Glomerular Feedback by SGLT2 Inhibitors in Patients With Type 2 Diabetes and Advanced Chronic Kidney Disease: Toward the End of a Myth? Gérard AO, Laurain A, Favre G, Drici MD, Esnault VLM. Diabetes Care 2022 Oct 1;45(10):e148-e149.
12. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A, Filippatos G; FIDELIO-DKD Investigators. N Engl J Med 2020 Dec 3;383(23):2219-29.
13. Determinants and changes associated with aldosterone breakthrough after angiotensin II receptor blockade in patients with type 2 diabetes with overt nephropathy. Moranne O, Bakris G, Fafin C, Favre G, Pradier C, Esnault VL. Clin J Am Soc Nephrol. 2013 Oct;8(10):1694-701.
14. Steroidal and non-steroidal mineralocorticoid receptor antagonists in cardiorenal medicine. Agarwal R, Kolkhof P, Bakris G, Bauersachs J, Haller H, Wada T, Zannad F. Eur Heart J. 2021 Jan 7;42(2):152-61.
15. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Ikizler TA, Burrowes JD, Byham-Gray LD, Campbell KL, Carrero JJ, Chan W, Fouque D, Friedman AN, Ghaddar S, Goldstein-Fuchs DJ, Kaysen GA, Kopple JD, Teta D, Yee-Moon Wang A, Cuppari L. Am J Kidney Dis. 2020 Sep;76(3 Suppl 1):S1-S107.