Le diabète de type 1 est une maladie auto-immune caractérisée par une perte quasiment complète de la sécrétion d’insuline due à une destruction des cellules bêta des îlots de Langerhans pancréatiques. Depuis la découverte de l’insuline en 1921, la thérapeutique du diabète de type 1 a été fondée sur l’administration parentérale d’insuline pour couvrir les besoins vitaux en insuline de l’organisme. Alors que la survie des patients a été l’objectif initial de ce traitement, l’étude du Diabetes Control and Complications Trial (DCCT) a clairement démontré que restaurer la glycémie à un niveau proche de la normale était le but véritable à poursuivre en vue d’une prévention ou d’une stabili- sation effective des complications du diabète dues à l’hyperglycémie chronique.1 Le DCCT a aussi montré que le risque principal en visant la normalisation glycémique était la survenue d’hypoglycémies sévères qui peuvent, par elles-mêmes, avoir des conséquences graves. Les objectifs du traitement du diabète de type 1 ont ensuite été précisés, comme l’association d’un contrôle glycémique au long cours démontré par des niveaux d’hémoglobine glyquée (HbA1c) proches de 7 % (53 mmol/mol) associés à un risque minimal d’hypoglycémies. Les nouveaux moyens d’administration d’insuline et de surveillance glycémique qui font l’objet de cet article promeuvent le nouveau concept du maintien de la glycémie dans un intervalle-cible proche de la norme (70-140 mg/dL) comme l’objectif thérapeutique-clé pour le diabète de type 1.2
Atteindre de tels résultats avec des injections sous- cutanées intermittentes d’insuline en adaptant les doses selon une mesure également intermittente de la glycosurie ou de la glycémie s’apparente à chercher à résoudre la quadrature du cercle. Depuis les années 1970, des efforts constants ont été consacrés à la recherche d’une administration modulable de l’insuline en fonction des besoins eux-mêmes estimés à partir d’une mesure la plus fréquente possible de la glycémie. Ce défi a été relevé avec succès par des équipes européennes et américaines dans la décennie 1970-1980 par la mise au point du « pancréas artificiel au lit du malade ».3 Ce système comprenait un dispositif continu de mesure de la glycémie par voie veineuse, une perfusion intraveineuse d’insuline et, au besoin, de glucose, les deux étant reliés par un calculateur (algorithme) qui régulait la quantité d’insuline à perfuser pour maintenir la glycémie dans une fourchette normale en fonction de la glycémie instantanée et de ses variations. Dès lors, les enjeux technologiques et pharmacologiques ont été d’essayer de reproduire le même système au moyen de solutions d’insuline dont l’action était plus proche de la physiologie et plus reproductible, ou de dispositifs de perfusion continue d’in- suline miniaturisés et programmables, couplés à des dispositifs également miniaturisés et portables ou implantables capables d’estimer la glycémie quasiment en continu. Cette quête a conduit au développement des analogues de l’insuline, des pompes à insuline, des capteurs et moniteurs continus du glucose, et au cours des 15 dernières années des premiers modèles d’insulinothérapie en boucle fermée, ou « pancréas artificiels » d’utilisation ambulatoire.
Atteindre de tels résultats avec des injections sous- cutanées intermittentes d’insuline en adaptant les doses selon une mesure également intermittente de la glycosurie ou de la glycémie s’apparente à chercher à résoudre la quadrature du cercle. Depuis les années 1970, des efforts constants ont été consacrés à la recherche d’une administration modulable de l’insuline en fonction des besoins eux-mêmes estimés à partir d’une mesure la plus fréquente possible de la glycémie. Ce défi a été relevé avec succès par des équipes européennes et américaines dans la décennie 1970-1980 par la mise au point du « pancréas artificiel au lit du malade ».3 Ce système comprenait un dispositif continu de mesure de la glycémie par voie veineuse, une perfusion intraveineuse d’insuline et, au besoin, de glucose, les deux étant reliés par un calculateur (algorithme) qui régulait la quantité d’insuline à perfuser pour maintenir la glycémie dans une fourchette normale en fonction de la glycémie instantanée et de ses variations. Dès lors, les enjeux technologiques et pharmacologiques ont été d’essayer de reproduire le même système au moyen de solutions d’insuline dont l’action était plus proche de la physiologie et plus reproductible, ou de dispositifs de perfusion continue d’in- suline miniaturisés et programmables, couplés à des dispositifs également miniaturisés et portables ou implantables capables d’estimer la glycémie quasiment en continu. Cette quête a conduit au développement des analogues de l’insuline, des pompes à insuline, des capteurs et moniteurs continus du glucose, et au cours des 15 dernières années des premiers modèles d’insulinothérapie en boucle fermée, ou « pancréas artificiels » d’utilisation ambulatoire.
Nouveaux modes d’administration : analogues de l’insuline et pompes à insuline
Les apports d’insuline qu’il faut assurer chez les mala- des affectés d’un diabète de type 1 répondent à deux principes :
– couvrir les besoins de base pour permettre une entrée de glucose dans les tissus cibles, principalement le muscle, producteurs et consommateurs d’énergie, et réguler la production hépatique de glucose de façon à maintenir une concentration physiologique de glucose dans le sang nécessaire au fonctionnement cérébral ;
– et garantir un apport suffisant et rapide d’insuline lors de l’ingestion d’aliments glucidiques pour permettre la clairance du glucose d’origine alimentaire par les tissus insulino-dépendants (muscle, foie, tissu adipeux) où il est stocké sous forme de réserves énergétiques, et freiner simultanément la production hépatique de glucose.
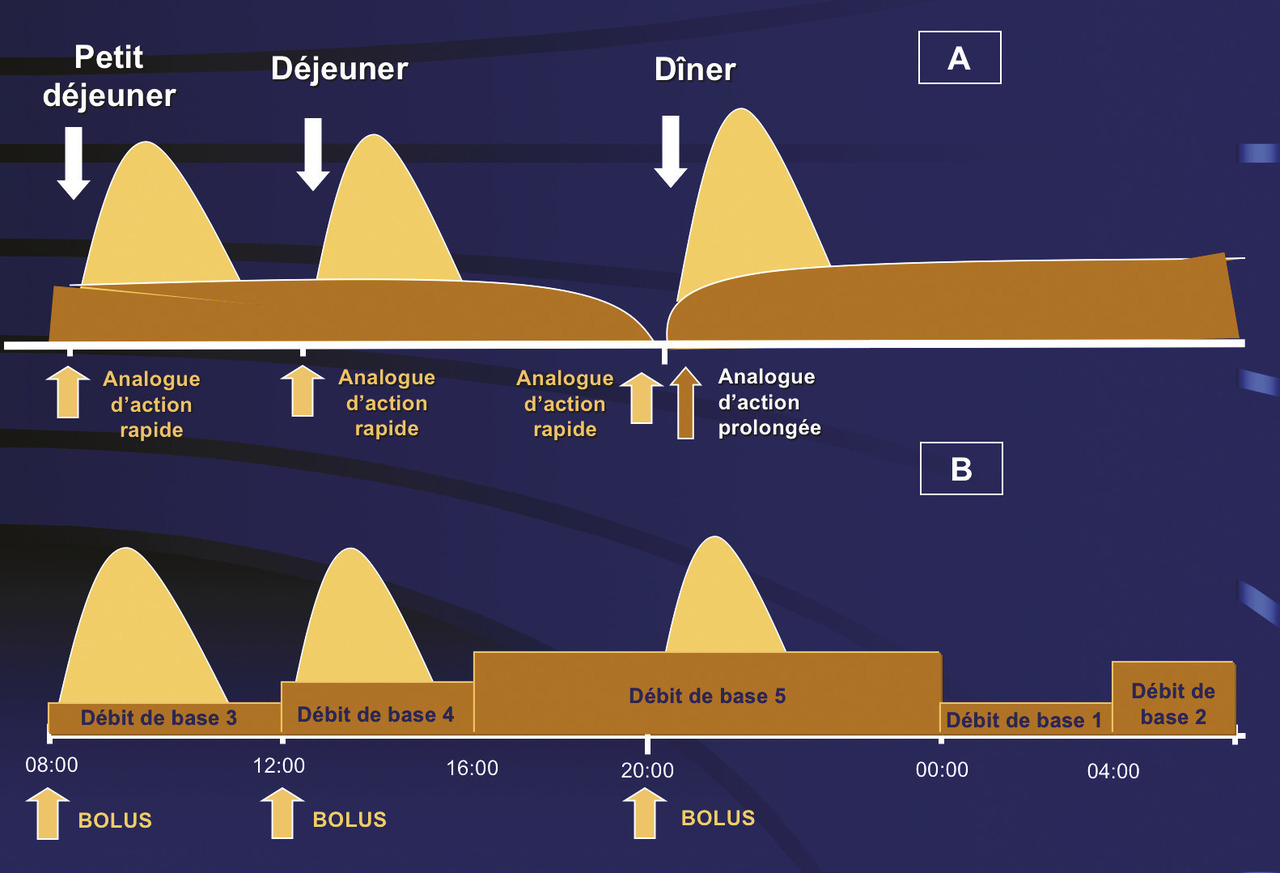
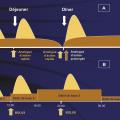
Ni l’insuline ordinaire, dite « rapide », ni les préparations d’insuline comportant de la protamine (NPH) et/ou du zinc, dites « lentes ou semi-lentes », ne permettaient de répondre à ces besoins d’insuline de façon appropriée. Le développement des analogues de l’insuline d’action rapide ou prolongée d’une part, la mise au point de la perfusion continue d’insuline au moyen de pompes portables d’autre part ont visé à permettre une insulinothérapie selon un schéma « basal-bolus » satisfaisant les deux composantes des apports d’insuline (fig. 1).
– couvrir les besoins de base pour permettre une entrée de glucose dans les tissus cibles, principalement le muscle, producteurs et consommateurs d’énergie, et réguler la production hépatique de glucose de façon à maintenir une concentration physiologique de glucose dans le sang nécessaire au fonctionnement cérébral ;
– et garantir un apport suffisant et rapide d’insuline lors de l’ingestion d’aliments glucidiques pour permettre la clairance du glucose d’origine alimentaire par les tissus insulino-dépendants (muscle, foie, tissu adipeux) où il est stocké sous forme de réserves énergétiques, et freiner simultanément la production hépatique de glucose.
Ni l’insuline ordinaire, dite « rapide », ni les préparations d’insuline comportant de la protamine (NPH) et/ou du zinc, dites « lentes ou semi-lentes », ne permettaient de répondre à ces besoins d’insuline de façon appropriée. Le développement des analogues de l’insuline d’action rapide ou prolongée d’une part, la mise au point de la perfusion continue d’insuline au moyen de pompes portables d’autre part ont visé à permettre une insulinothérapie selon un schéma « basal-bolus » satisfaisant les deux composantes des apports d’insuline (fig. 1).
Les analogues de l’insuline : à la recherche d’une action mieux contrôlée et plus reproductible
L’élément-clé à maîtriser lors de l’injection sous-cutanée d’insuline est la cinétique de passage du tissu sous-cutané au milieu plasmatique. Ainsi l’insuline ordinaire qui se présente en solution sous forme d’hexamères (6 molécules d’insuline) autour d’un atome de zinc nécessite, après son injection sous-cutanée, une dilution dans le liquide interstitiel pour la dissociation des hexamères en dimères puis en monomères d’insuline. Ces monomères peuvent diffuser dans le plasma et parvenir aux sites d’action de l’insuline. Lors d’une consommation alimentaire de glucides, le glucose libéré par la digestion passe rapidement dans le sang et conduit à une hyper- glycémie en l’absence d’un passage facilité dans les tissus insulinodépendants et si la production hépatique de glucose persiste. L’insuline injectée doit donc être rapidement disponible pour contrôler cette ascension glycémique.
Le génie génétique permet de modifier le gène de l’insuline de telle façon que certains acides aminés peuvent être remplacés dans la séquence primaire de l’hormone afin d’accélérer la libération sous-cutanée des monomères d’insuline tout en conservant l’action de l’insuline. Le passage sanguin des monomères d’insuline est accéléré de 30 à 15 minutes en moyenne, ce qui permet une action de l’insuline dans les 30 à 45 minutes.4 Qui plus est, cette action est plus reproductible et l’augmentation de la dose accroît l’effet hypoglycémiant en proportion sans allonger l’action de l’insuline, qui reste de 3 à 4 heures.
Les analogues de l’insuline ayant ces caractéristiques (lispro, aspart, glulisine) ont ainsi aujourd’hui supplanté l’insuline ordinaire pour couvrir les besoins prandiaux d’insuline. Le délai de leur action demeure néanmoins excessif par rapport à celui de l’insuline sécrétée physiologiquement sous l’influence du système nerveux (phase céphalique de l’insulinosécrétion qui commence dès la vue des aliments) et des entérohormones (insulinosécrétion médiée par les incrétines sécrétées dès l’arrivée du glucose dans le tractus digestif). Ce constat conduit au développement actuel de nouvelles formulations des analogues de l’insuline (faster aspart, BioChaperone Lispro) où des adjuvants accélèrent encore le passage des monomères d’insuline dans le plasma.
Inversement, la recherche d’une action prolongée et stable de l’insuline injectée par voie sous-cutanée pour assurer les besoins de base en insuline a conduit à modifier la structure primaire de l’hormone de telle façon que le passage du tissu sous-cutané dans le plasma et du plasma aux tissus cibles soit ralenti et que s’établisse un plateau stable de la concentration d’insuline libre dans le sang.4 Dans le cas de l’insuline glargine, c’est la modification de son point isoélectrique qui conduit à sa précipitation en cristaux sous la peau à pH neutre qui permet un passage plus lent dans le plasma sous l’effet de la dilution dans le liquide interstitiel. Pour l’insuline détémir, c’est la greffe d’un acide gras sur sa structure primaire qui conduit à une liaison à l’albumine sous- cutanée et plasmatique et ainsi réduit et étale la libération des monomères d’insuline. On dispose alors d’analogues de l’insuline qui établissent une concentration à peu près stable d’insuline active, sans pic d’action après plusieurs jours d’injections toutes les 12 à 24 heures.
De nouvelles formulations d’insuline (insuline dégludec, insuline glargine concentrée à 300 U/mL) visent à améliorer cette action en plateau sur 24 heures. La moindre variabilité de la disponibilité de l’insuline active réduit en outre la survenue d’hypoglycémies.
Tout en conservant l’administration sous-cutanée d’insuline, mais en agissant sur la cinétique de disponibilité des monomères actifs d’insuline, on dispose ainsi aujourd’hui d’analogues de l’insuline qui exercent l’action hormonale mais de façon contrôlée dans le temps. La combinaison d’analogues d’action rapide et d’action prolongée permet d’assurer au prix d’injections multiquotidiennes les besoins prandiaux et de base en insuline, respectivement. Les limites persistantes de ces schémas d’injections basal-bolus sont le manque de flexibilité dans la couverture des besoins de base qui varient en fonction de nombreux facteurs (stress, activité physique, imprégnation hormonale, notamment) et le défaut d’asservissement aux variations du niveau glycémique qui nécessitent des ajustements de l’action hormonale non rythmés par la périodicité des injections.
Le génie génétique permet de modifier le gène de l’insuline de telle façon que certains acides aminés peuvent être remplacés dans la séquence primaire de l’hormone afin d’accélérer la libération sous-cutanée des monomères d’insuline tout en conservant l’action de l’insuline. Le passage sanguin des monomères d’insuline est accéléré de 30 à 15 minutes en moyenne, ce qui permet une action de l’insuline dans les 30 à 45 minutes.4 Qui plus est, cette action est plus reproductible et l’augmentation de la dose accroît l’effet hypoglycémiant en proportion sans allonger l’action de l’insuline, qui reste de 3 à 4 heures.
Les analogues de l’insuline ayant ces caractéristiques (lispro, aspart, glulisine) ont ainsi aujourd’hui supplanté l’insuline ordinaire pour couvrir les besoins prandiaux d’insuline. Le délai de leur action demeure néanmoins excessif par rapport à celui de l’insuline sécrétée physiologiquement sous l’influence du système nerveux (phase céphalique de l’insulinosécrétion qui commence dès la vue des aliments) et des entérohormones (insulinosécrétion médiée par les incrétines sécrétées dès l’arrivée du glucose dans le tractus digestif). Ce constat conduit au développement actuel de nouvelles formulations des analogues de l’insuline (faster aspart, BioChaperone Lispro) où des adjuvants accélèrent encore le passage des monomères d’insuline dans le plasma.
Inversement, la recherche d’une action prolongée et stable de l’insuline injectée par voie sous-cutanée pour assurer les besoins de base en insuline a conduit à modifier la structure primaire de l’hormone de telle façon que le passage du tissu sous-cutané dans le plasma et du plasma aux tissus cibles soit ralenti et que s’établisse un plateau stable de la concentration d’insuline libre dans le sang.4 Dans le cas de l’insuline glargine, c’est la modification de son point isoélectrique qui conduit à sa précipitation en cristaux sous la peau à pH neutre qui permet un passage plus lent dans le plasma sous l’effet de la dilution dans le liquide interstitiel. Pour l’insuline détémir, c’est la greffe d’un acide gras sur sa structure primaire qui conduit à une liaison à l’albumine sous- cutanée et plasmatique et ainsi réduit et étale la libération des monomères d’insuline. On dispose alors d’analogues de l’insuline qui établissent une concentration à peu près stable d’insuline active, sans pic d’action après plusieurs jours d’injections toutes les 12 à 24 heures.
De nouvelles formulations d’insuline (insuline dégludec, insuline glargine concentrée à 300 U/mL) visent à améliorer cette action en plateau sur 24 heures. La moindre variabilité de la disponibilité de l’insuline active réduit en outre la survenue d’hypoglycémies.
Tout en conservant l’administration sous-cutanée d’insuline, mais en agissant sur la cinétique de disponibilité des monomères actifs d’insuline, on dispose ainsi aujourd’hui d’analogues de l’insuline qui exercent l’action hormonale mais de façon contrôlée dans le temps. La combinaison d’analogues d’action rapide et d’action prolongée permet d’assurer au prix d’injections multiquotidiennes les besoins prandiaux et de base en insuline, respectivement. Les limites persistantes de ces schémas d’injections basal-bolus sont le manque de flexibilité dans la couverture des besoins de base qui varient en fonction de nombreux facteurs (stress, activité physique, imprégnation hormonale, notamment) et le défaut d’asservissement aux variations du niveau glycémique qui nécessitent des ajustements de l’action hormonale non rythmés par la périodicité des injections.
Les pompes à insuline : comment coller au plus près aux besoins variables d’insuline
L’insulinosécrétion physiologique a la particularité d’une modulation fine de la mise à disposition de l’insuline selon le niveau glycémique, lui-même sous l’influence de nombreux facteurs endogènes et environnementaux. La perfusion continue d’insuline d’action rapide constitue une réponse à l’objectif d’un apport variable d’insuline à intervalles courts. Initialement menée par voie intraveineuse, la faisabilité ambulatoire a conduit à lui préférer la voie sous-cutanée afin de réduire les risques infectieux et de thrombose veineuse. La réactivité nécessaire aux besoins fluctuants d’action de l’insuline a fait adopter les analogues d’action rapide de l’insuline à la place de l’insuline ordinaire initialement utilisée pour la perfusion continue sous-cutanée d’insuline.5
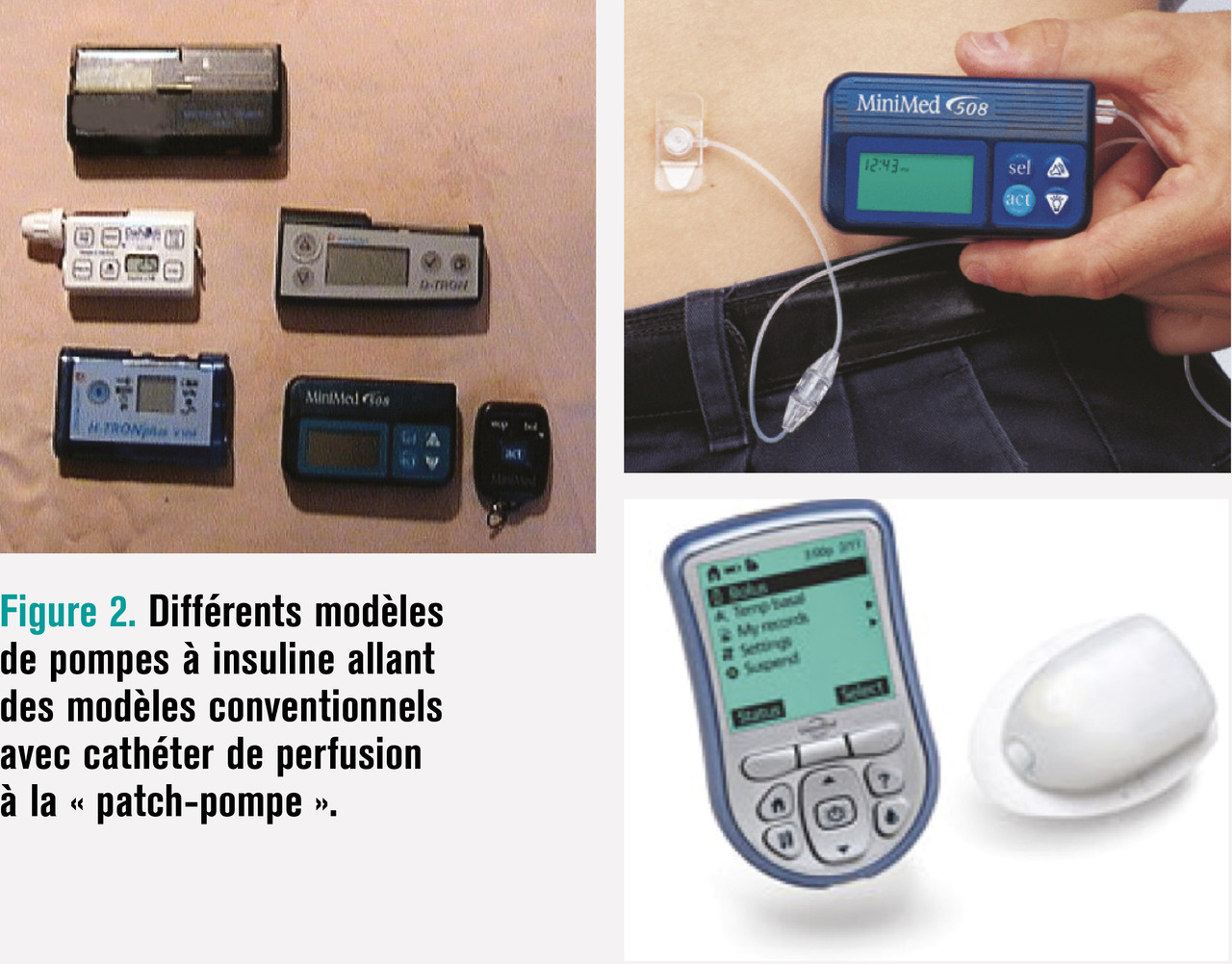
La mise au point de pompes à insuline miniaturisées portables, sûres et programmables a été l’objet de recherche et développement depuis la fin des années 1970 (fig. 2). Afin de réduire la consommation d’énergie et les traumatismes physiques et thermiques de la solution perfusée d’insuline, les pompes pulsatiles à débit intermittent ont été préférées aux pompes péristaltiques à débit continu. Les progrès de l’électronique ont per- mis de miniaturiser et de sophistiquer la commande de distribution. Asservie à une horloge interne, la perfusion d’insuline peut être programmée par intervalles de temps pour répondre à la fluctuation des besoins individuels d’insuline de base. Lors des repas ou excursions hyperglycémiques, des bolus d’insuline peuvent être activés par les patients pour satisfaire aux besoins accrus d’insuline. Les conditions de stockage de l’insuline dans le réservoir de la pompe (température ambiante, agitation) limitent la capacité du réservoir et déterminent la fréquence des renouvellements d’insuline, tous les 3 jours en moyenne. Le transport de l’insuline depuis la pompe vers le tissu sous-cutané fait classiquement appel à un cathéter terminé par une canule insérée sous la peau. Les matériaux du cathéter et de la canule répondent à des conditions préservant la stabilité physique et chimique de l’insuline. La canule est l’élément le plus sensible car elle doit faire face à la fois aux contraintes mécaniques pour son maintien en place et sa perméabilité, et aux réactions du tissu sous-cutané à la présence d’un corps étranger. Les canules métalliques résistent mieux aux contraintes mécaniques mais traumatisent davantage le tissu sous-cutané, d’où leur remplacement recommandé toutes les 48 heures. Les canules en matériau synthétique souple exposent davantage aux obstructions par plicature ou torsion mais affichent une meilleure biocompatibilité permettant des remplacements plus espacés, tous les 3 à 4 jours.
Les pompes les plus récentes, dites « patch-pompes », combinent les progrès de la microélectronique dans leur capacité de programmation, une miniaturisation accrue par transfert de la commande de distribution dans un programmateur extérieur sans fil et un circuit de perfusion court par issue directe de la canule depuis le corps de la pompe sans recours à un cathéter.
Les pompes portables pour la perfusion continue sous-cutanée d’insuline ont montré leur sécurité et leur fiabilité avec l’absence d’épisodes d’emballement et une bonne stabilité de leur délivrance d’insuline qui peut être finement modulée. Elles permettent une baisse du niveau moyen d’HbA1c, une réduction de la variabilité glycémique sur la journée et d’un jour à l’autre, et une diminution des épisodes hypoglycémiques sévères. Elles sont adoptées par près de 30 % des adultes et 50 % des enfants ayant un diabète de type 1 en France. Le bénéfice du traitement par pompe est cependant assujetti à l’acceptation du patient du port de la pompe en permanence, à son éducation thérapeutique à la bonne utilisation et à la qualité de la surveillance glycémique qui permet l’ajustement de la perfusion et l’identification rapide des interruptions de perfusion.6
Les contraintes de la perfusion sous-cutanée sur la pharmacocinétique de l’insuline, autant en termes de délai que de variabilité, ont conduit à envisager, dès le début des années 1980, une alternative pour la voie de perfusion de l’insuline. C’est la voie intrapéritonéale qui a retenu l’attention grâce à la rapidité d’action de l’insuline qu’elle permet, à la moindre variabilité de la mise à disposition d’insuline et à la restauration d’une diffusion physiologique de l’insuline par un premier passage hépatique.7 Initialement réalisée via l’insertion à travers la paroi abdominale d’un cathéter de perfusion auquel une pompe portable peut être connectée, elle a connu son essor avec la mise au point de pompes implantables mises en place chirurgicalement dans la paroi abdominale. Ces dispositifs de la taille d’un palet de hockey sur glace ont une coque en titane parfaitement biocompatible, une batterie d’alimentation qui permet une utilisation sur au moins 7 ans, une télécommande externe qui permet un réglage précis et programmable de la perfusion d’insuline et un port de remplissage du réservoir accessible par piqûre transcutanée (fig. 3). Si leur fiabilité électronique et leur tolérance au site d’implantation sont établies, les limites de leur utilisation tiennent au risque d’obstruction du cathéter péritonéal imposant un remplacement chirurgical, au manque de stabilité physique de l’insuline utilisée (insuline ordinaire concentrée à 400 U/mL stabilisée par un agent tensioactif, le génapol) qui conduit à la formation d’agrégats d’insuline dans la pompe nécessitant des rinçages alcalins dissolvants périodiques pour restaurer la délivrance programmée d’insuline, et au coût des dispositifs et de leur maintenance (remplissages en milieu hospitalier et procédures d’entretien). Malgré ces contraintes, les pompes implantables à insuline apportent une solution sans égale aux patients ayant des problèmes de diffusion fiable de l’insuline administrée sous la peau et/ou une variabilité glycémique extrême les exposant à des épisodes d’hyperglycémie ou d’hypoglycémie sévères récurrents.8 Le cathéter péritonéal relié à un port cutané de connexion à une pompe portable qui constitue le système DiaPort (Roche Diabetes Care) assure les mêmes bénéfices sur le contrôle glycémique pour ces cas difficiles mais expose à des risques importants d’infection locale et occasionnels d’obstruction du cathéter.
Ces moyens innovants d’insulinothérapie demeurent dépendants pour la performance de leurs résultats de l’ajustement de l’administration d’insuline effectué par le patient sur la base de son autosurveillance glycémique. La continuité de l’information sur le niveau glycémique et au mieux l’asservissement des dispositifs de perfusion d’insuline à la mesure de la glycémie constituent dès lors des enjeux complémentaires au développement des nouveaux modes d’administration d’insuline.
La mise au point de pompes à insuline miniaturisées portables, sûres et programmables a été l’objet de recherche et développement depuis la fin des années 1970 (fig. 2). Afin de réduire la consommation d’énergie et les traumatismes physiques et thermiques de la solution perfusée d’insuline, les pompes pulsatiles à débit intermittent ont été préférées aux pompes péristaltiques à débit continu. Les progrès de l’électronique ont per- mis de miniaturiser et de sophistiquer la commande de distribution. Asservie à une horloge interne, la perfusion d’insuline peut être programmée par intervalles de temps pour répondre à la fluctuation des besoins individuels d’insuline de base. Lors des repas ou excursions hyperglycémiques, des bolus d’insuline peuvent être activés par les patients pour satisfaire aux besoins accrus d’insuline. Les conditions de stockage de l’insuline dans le réservoir de la pompe (température ambiante, agitation) limitent la capacité du réservoir et déterminent la fréquence des renouvellements d’insuline, tous les 3 jours en moyenne. Le transport de l’insuline depuis la pompe vers le tissu sous-cutané fait classiquement appel à un cathéter terminé par une canule insérée sous la peau. Les matériaux du cathéter et de la canule répondent à des conditions préservant la stabilité physique et chimique de l’insuline. La canule est l’élément le plus sensible car elle doit faire face à la fois aux contraintes mécaniques pour son maintien en place et sa perméabilité, et aux réactions du tissu sous-cutané à la présence d’un corps étranger. Les canules métalliques résistent mieux aux contraintes mécaniques mais traumatisent davantage le tissu sous-cutané, d’où leur remplacement recommandé toutes les 48 heures. Les canules en matériau synthétique souple exposent davantage aux obstructions par plicature ou torsion mais affichent une meilleure biocompatibilité permettant des remplacements plus espacés, tous les 3 à 4 jours.
Les pompes les plus récentes, dites « patch-pompes », combinent les progrès de la microélectronique dans leur capacité de programmation, une miniaturisation accrue par transfert de la commande de distribution dans un programmateur extérieur sans fil et un circuit de perfusion court par issue directe de la canule depuis le corps de la pompe sans recours à un cathéter.
Les pompes portables pour la perfusion continue sous-cutanée d’insuline ont montré leur sécurité et leur fiabilité avec l’absence d’épisodes d’emballement et une bonne stabilité de leur délivrance d’insuline qui peut être finement modulée. Elles permettent une baisse du niveau moyen d’HbA1c, une réduction de la variabilité glycémique sur la journée et d’un jour à l’autre, et une diminution des épisodes hypoglycémiques sévères. Elles sont adoptées par près de 30 % des adultes et 50 % des enfants ayant un diabète de type 1 en France. Le bénéfice du traitement par pompe est cependant assujetti à l’acceptation du patient du port de la pompe en permanence, à son éducation thérapeutique à la bonne utilisation et à la qualité de la surveillance glycémique qui permet l’ajustement de la perfusion et l’identification rapide des interruptions de perfusion.6
Les contraintes de la perfusion sous-cutanée sur la pharmacocinétique de l’insuline, autant en termes de délai que de variabilité, ont conduit à envisager, dès le début des années 1980, une alternative pour la voie de perfusion de l’insuline. C’est la voie intrapéritonéale qui a retenu l’attention grâce à la rapidité d’action de l’insuline qu’elle permet, à la moindre variabilité de la mise à disposition d’insuline et à la restauration d’une diffusion physiologique de l’insuline par un premier passage hépatique.7 Initialement réalisée via l’insertion à travers la paroi abdominale d’un cathéter de perfusion auquel une pompe portable peut être connectée, elle a connu son essor avec la mise au point de pompes implantables mises en place chirurgicalement dans la paroi abdominale. Ces dispositifs de la taille d’un palet de hockey sur glace ont une coque en titane parfaitement biocompatible, une batterie d’alimentation qui permet une utilisation sur au moins 7 ans, une télécommande externe qui permet un réglage précis et programmable de la perfusion d’insuline et un port de remplissage du réservoir accessible par piqûre transcutanée (fig. 3). Si leur fiabilité électronique et leur tolérance au site d’implantation sont établies, les limites de leur utilisation tiennent au risque d’obstruction du cathéter péritonéal imposant un remplacement chirurgical, au manque de stabilité physique de l’insuline utilisée (insuline ordinaire concentrée à 400 U/mL stabilisée par un agent tensioactif, le génapol) qui conduit à la formation d’agrégats d’insuline dans la pompe nécessitant des rinçages alcalins dissolvants périodiques pour restaurer la délivrance programmée d’insuline, et au coût des dispositifs et de leur maintenance (remplissages en milieu hospitalier et procédures d’entretien). Malgré ces contraintes, les pompes implantables à insuline apportent une solution sans égale aux patients ayant des problèmes de diffusion fiable de l’insuline administrée sous la peau et/ou une variabilité glycémique extrême les exposant à des épisodes d’hyperglycémie ou d’hypoglycémie sévères récurrents.8 Le cathéter péritonéal relié à un port cutané de connexion à une pompe portable qui constitue le système DiaPort (Roche Diabetes Care) assure les mêmes bénéfices sur le contrôle glycémique pour ces cas difficiles mais expose à des risques importants d’infection locale et occasionnels d’obstruction du cathéter.
Ces moyens innovants d’insulinothérapie demeurent dépendants pour la performance de leurs résultats de l’ajustement de l’administration d’insuline effectué par le patient sur la base de son autosurveillance glycémique. La continuité de l’information sur le niveau glycémique et au mieux l’asservissement des dispositifs de perfusion d’insuline à la mesure de la glycémie constituent dès lors des enjeux complémentaires au développement des nouveaux modes d’administration d’insuline.
Nouveau mode de surveillance glycémique : la mesure continue du glucose
L’autosurveillance glycémique capillaire a définitivement supplanté la surveillance glycosurique dans les années 1980. Elle permet une connaissance précise du niveau glycémique lors de la mesure effectuée et d’identifier en particulier les hypoglycémies. Sa valeur reste cependant instantanée et une connaissance du profil glycémique impose sa répétition dont la limite est l’acceptation du traumatisme digital récurrent. De nombreux travaux ont montré la relation entre la fréquence des mesures capillaires et le niveau de contrôle du diabète jugé sur l’HbA1c, en particulier sous pompe à insuline. Il en résulte qu’une mesure continue de la glycémie serait le moyen optimal permettant d’ajuster l’administration d’insuline. Le traitement par pompe facilite ces ajustements par la possibilité d’une programmation rapide d’un débit accru ou réduit d’insuline.
La mesure continue du glucose interstitiel : un moyen d’approche du niveau glycémique
La mesure continue intraveineuse de la glycémie se heurte au problème de sa faisabilité prolongée ambu- latoire en raison du risque infectieux et thrombotique d’un accès veineux périphérique permanent. Le lien entre la concentration du glucose dans le liquide interstitiel sous-cutané et la glycémie a conduit à considérer cet espace comme un moyen d’accès plus commode à la mesure glycémique continue.
Les systèmes de mesure glycémique continue actuellement disponibles pour un usage clinique reposent tous sur une détection électro-enzymatique du glucose.9 Brièvement, la glucose oxydase, enzyme spécifique d’oxydation du glucose, déposée sur une électrode (l’anode), est mise au contact du liquide interstitiel. En proportion de la concentration de glucose et en présence d’oxygène, la réaction enzymatique produit de l’acide gluconique et de l’eau oxygénée. Si on applique une différence de potentiel d’environ ½ volt entre l’anode et la cathode, l’eau oxygénée se décompose en eau et en oxygène et libère un électron. Ce dernier, lors de sa migration à l’anode, crée un signal électrique dont l’intensité est proportionnelle au glucose oxydé par l’enzyme. À partir de là, on dispose d’un moyen de mesure du glucose interstitiel en continu. Afin d’établir une relation entre le signal perçu et la glycémie, un étalonnage du signal est réalisé par une mesure contemporaine de la glycémie capillaire. Il faut cependant être conscient que la cinétique d’équilibre entre la glycémie et le glucose interstitiel n’est pas instantanée en cas de variation glycémique : il existe ainsi un décalage de 5 à 15 minutes entre la glycémie réelle et la glycémie estimée à partir de la mesure du glucose interstitiel. Cela est important à prendre en compte, surtout en cas de baisse glycémique. Si une alerte est couplée à l’atteinte d’un seuil de glycémie estimée, elle est déclenchée, alors que la glycémie réelle est déjà plus basse. Inversement, en cas de prise de sucre pour corriger une hypoglycémie, la glycémie réelle remonte plus vite que la glycémie estimée à partir de la mesure du glucose interstitiel. Un autre élément à prendre en compte est la réaction de l’organisme au site de mise en place du détecteur de glucose interstitiel, couramment appelé capteur de glucose. Cette réaction inflammatoire tend à créer un écran entre le liquide interstitiel et le capteur, ce qui induit une dérive progressive entre la glycémie réelle et la glycémie estimée. Ce phénomène implique une recherche d’encapsulation du capteur par une membrane la plus biocompatible possible pour réduire cette réaction de l’organisme, la nécessité d’un étalonnage périodique du signal du capteur sur une mesure de glycémie capillaire (1 ou 2 fois par jour en pratique), une durée de vie limitée des capteurs de glucose lorsqu’il devient impossible de réétalonner le signal du capteur en raison d’un écart devenu trop grand avec la glycémie réelle.
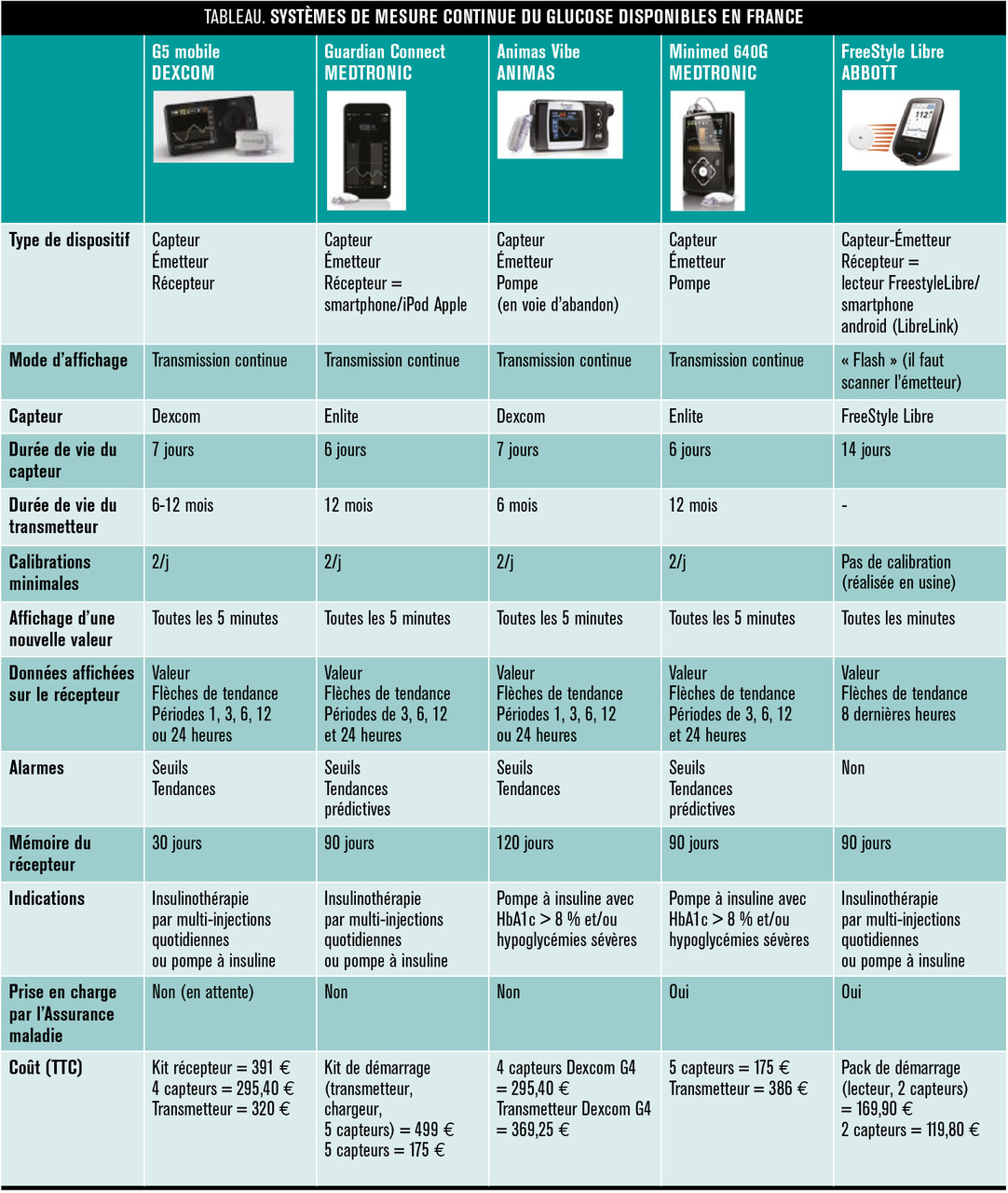
Les premiers capteurs de glucose disponibles ne permettaient pas de délivrer une estimation fiable immédiate de la glycémie. Ils étaient utilisés exclusivement pour une évaluation a posteriori du profil glycémique après étalonnage du signal du capteur enregistré sur plusieurs jours en utilisant des mesures de glycémie capillaire pratiquées 4 fois par jour au cours de l’enregistrement. Ces enregistrements dénommés « Holter glycémiques » permettaient a posteriori d’identifier les écarts glycémiques fréquents, notamment nocturnes et postprandiaux.10 L’amélioration de la stabilité et de la biocompatibilité des capteurs a permis d’aboutir aux systèmes actuels de mesure glycémique délivrant une information en temps réel. Récemment, a été mis à disposition un capteur reposant sur une enzyme liée à un transporteur d’électrons, lui-même lié à l’anode. Il est possible d’étalonner le signal produit par ce capteur en usine, ce qui libère le patient des glycémies capillaires, sauf en cas de mouvement glycémique rapide que le capteur ne peut pas immédiatement identifier. Ce capteur de mesure glycémique continue (FreeStyle Libre, Abbott) peut être utilisé durant 14 jours. L’information sur la glycémie est obtenue, à la demande, au moyen d’un lecteur sans fil mis en regard de l’émetteur du signal issu du capteur. C’est le seul capteur de glucose actuellement pris en charge par l’Assurance maladie pour les patients diabétiques de type 1.
L’utilisation clinique de la mesure glycémique continue a montré son efficacité pour améliorer le contrôle glycémique des patients ayant un diabète de type 1 jugé sur l’HbA1c et la fréquence des hypoglycémies.11 Le patient doit être éduqué à l’utilisation de la mesure continue, tant pour la mise en place des capteurs que pour en interpréter les données et en tirer des conséquences pour ajuster sa thérapeutique. L’utilisation de la mesure glycémique continue pendant plus de 70 % du temps est en outre nécessaire pour obtenir un gain sur le contrôle glycémique, car principalement issu des adaptations immédiates réalisées par le patient : ajouts d’insuline ou resucrages. Les limites du recours à la mesure glycémique continue, outre son coût non couvert, sont la fréquence des alertes, dont certaines sont de fausses alertes dues à une dérive du signal du capteur, et la nécessité pour le patient de prendre des décisions en fonction des données glycémiques. Cette information « envahissante » justifie encore plus son traitement automatisé dans les dispositifs d’insulinothérapie en boucle fermée.
Les systèmes de mesure glycémique continue actuellement disponibles pour un usage clinique reposent tous sur une détection électro-enzymatique du glucose.9 Brièvement, la glucose oxydase, enzyme spécifique d’oxydation du glucose, déposée sur une électrode (l’anode), est mise au contact du liquide interstitiel. En proportion de la concentration de glucose et en présence d’oxygène, la réaction enzymatique produit de l’acide gluconique et de l’eau oxygénée. Si on applique une différence de potentiel d’environ ½ volt entre l’anode et la cathode, l’eau oxygénée se décompose en eau et en oxygène et libère un électron. Ce dernier, lors de sa migration à l’anode, crée un signal électrique dont l’intensité est proportionnelle au glucose oxydé par l’enzyme. À partir de là, on dispose d’un moyen de mesure du glucose interstitiel en continu. Afin d’établir une relation entre le signal perçu et la glycémie, un étalonnage du signal est réalisé par une mesure contemporaine de la glycémie capillaire. Il faut cependant être conscient que la cinétique d’équilibre entre la glycémie et le glucose interstitiel n’est pas instantanée en cas de variation glycémique : il existe ainsi un décalage de 5 à 15 minutes entre la glycémie réelle et la glycémie estimée à partir de la mesure du glucose interstitiel. Cela est important à prendre en compte, surtout en cas de baisse glycémique. Si une alerte est couplée à l’atteinte d’un seuil de glycémie estimée, elle est déclenchée, alors que la glycémie réelle est déjà plus basse. Inversement, en cas de prise de sucre pour corriger une hypoglycémie, la glycémie réelle remonte plus vite que la glycémie estimée à partir de la mesure du glucose interstitiel. Un autre élément à prendre en compte est la réaction de l’organisme au site de mise en place du détecteur de glucose interstitiel, couramment appelé capteur de glucose. Cette réaction inflammatoire tend à créer un écran entre le liquide interstitiel et le capteur, ce qui induit une dérive progressive entre la glycémie réelle et la glycémie estimée. Ce phénomène implique une recherche d’encapsulation du capteur par une membrane la plus biocompatible possible pour réduire cette réaction de l’organisme, la nécessité d’un étalonnage périodique du signal du capteur sur une mesure de glycémie capillaire (1 ou 2 fois par jour en pratique), une durée de vie limitée des capteurs de glucose lorsqu’il devient impossible de réétalonner le signal du capteur en raison d’un écart devenu trop grand avec la glycémie réelle.
Les premiers capteurs de glucose disponibles ne permettaient pas de délivrer une estimation fiable immédiate de la glycémie. Ils étaient utilisés exclusivement pour une évaluation a posteriori du profil glycémique après étalonnage du signal du capteur enregistré sur plusieurs jours en utilisant des mesures de glycémie capillaire pratiquées 4 fois par jour au cours de l’enregistrement. Ces enregistrements dénommés « Holter glycémiques » permettaient a posteriori d’identifier les écarts glycémiques fréquents, notamment nocturnes et postprandiaux.10 L’amélioration de la stabilité et de la biocompatibilité des capteurs a permis d’aboutir aux systèmes actuels de mesure glycémique délivrant une information en temps réel. Récemment, a été mis à disposition un capteur reposant sur une enzyme liée à un transporteur d’électrons, lui-même lié à l’anode. Il est possible d’étalonner le signal produit par ce capteur en usine, ce qui libère le patient des glycémies capillaires, sauf en cas de mouvement glycémique rapide que le capteur ne peut pas immédiatement identifier. Ce capteur de mesure glycémique continue (FreeStyle Libre, Abbott) peut être utilisé durant 14 jours. L’information sur la glycémie est obtenue, à la demande, au moyen d’un lecteur sans fil mis en regard de l’émetteur du signal issu du capteur. C’est le seul capteur de glucose actuellement pris en charge par l’Assurance maladie pour les patients diabétiques de type 1.
L’utilisation clinique de la mesure glycémique continue a montré son efficacité pour améliorer le contrôle glycémique des patients ayant un diabète de type 1 jugé sur l’HbA1c et la fréquence des hypoglycémies.11 Le patient doit être éduqué à l’utilisation de la mesure continue, tant pour la mise en place des capteurs que pour en interpréter les données et en tirer des conséquences pour ajuster sa thérapeutique. L’utilisation de la mesure glycémique continue pendant plus de 70 % du temps est en outre nécessaire pour obtenir un gain sur le contrôle glycémique, car principalement issu des adaptations immédiates réalisées par le patient : ajouts d’insuline ou resucrages. Les limites du recours à la mesure glycémique continue, outre son coût non couvert, sont la fréquence des alertes, dont certaines sont de fausses alertes dues à une dérive du signal du capteur, et la nécessité pour le patient de prendre des décisions en fonction des données glycémiques. Cette information « envahissante » justifie encore plus son traitement automatisé dans les dispositifs d’insulinothérapie en boucle fermée.
L’asservissement de la perfusion d’insuline à la mesure continue du glucose : vers le pancréas artificiel endocrine
La disponibilité de pompes à insuline miniaturisées sûres et fiables et de systèmes de mesure glycémique continue fournissant une information de plus en plus exacte sur le niveau glycémique a constitué une base technologique solide pour le développement au cours des 15 dernières années de modèles d’insulinothérapie en boucle fermée, couramment dénommés « pancréas artificiels », dont le premier a été commercialisé aux États-Unis en 2017.
Les premières approches d’un traitement automatisé de la mesure glycémique continue par l’électronique d’une pompe à insuline ont visé la prévention des hypoglycémies sévères. La base a été la transmission sans fil du signal du capteur de mesure glycémique à la pompe à insuline. Ensuite, l’absence de réponse à l’alerte déclenchée par le franchissement par la glycémie estimée d’un seuil prédéfini a conduit à automatiser l’arrêt du débit de la pompe durant 2 heures, ou au moins jusqu’au moment où le patient manifeste sa prise en compte de l’alerte. Ce système a montré son efficacité sur la réduction des épisodes hypoglycémiques profonds et sur la durée du temps passé en hypoglycémie.12 Il s’est avéré particulièrement utile en cas de non-perception des hypoglycémies, notamment durant le sommeil, et plus particulièrement chez les enfants. L’arrêt automatisé de la perfusion d’insuline n’expose pas à des déviations hyperglycémiques délétères. Une étape de plus a été franchie en interrompant le débit de la pompe sur la base d’une prédiction d’atteinte du seuil d’alerte hypogly- cémique dans les 30 minutes suivantes, calculée à partir de la pente évolutive du signal de mesure glycémique continue. Ce système a confirmé son efficacité sur la réduction de tous les événements hypoglycémiques et du temps passé en hypoglycémie, sans occasionner non plus de dérive hyperglycémique.13 Ces dispositifs automatisés de sécurité vis-à-vis des alertes hypoglycémiques non perçues sont disponibles en France, et remboursés par l’Assurance-maladie depuis quelques mois.
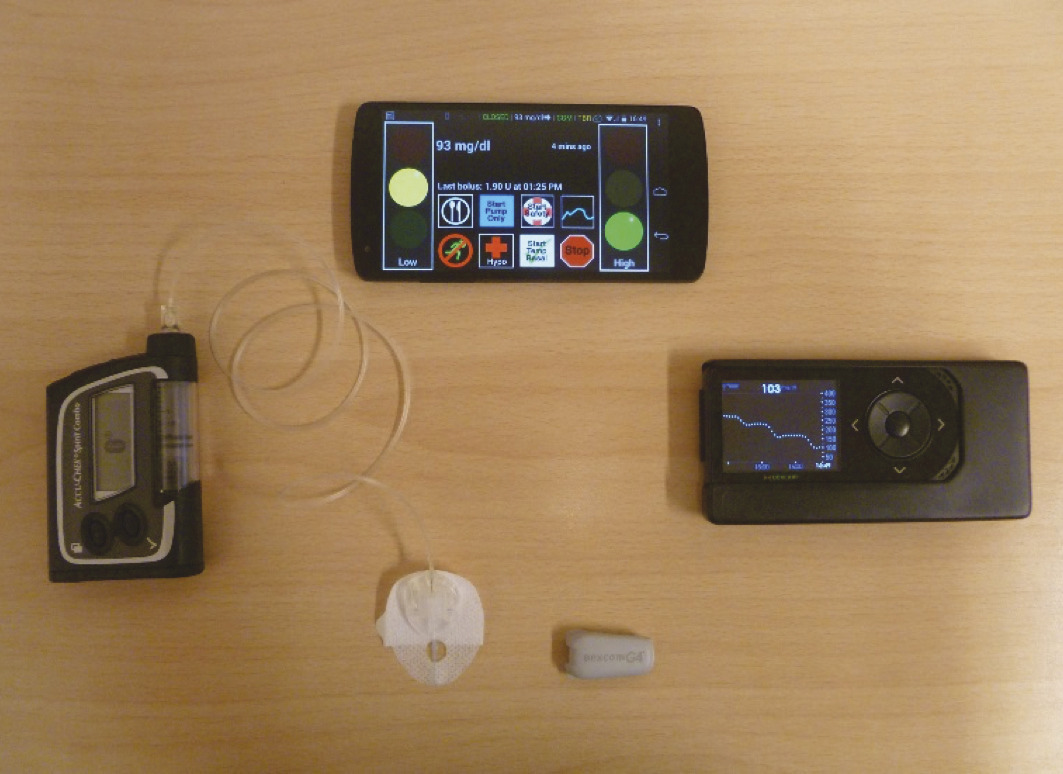
Parallèlement à ces développements, des collaborations scientifiques se sont mises en place en Europe et aux États-Unis pour mettre au point des algorithmes capables de guider la perfusion d’insuline afin de maintenir la glycémie dans un intervalle de sécurité proche de la normale, puis tester leur sécurité et leur efficacité chez des patients volontaires en milieu hospitalier puis en ambulatoire sur des durées croissantes.14 La difficulté principale est la prise en compte des délais d’action de l’insuline administrée en sous-cutané pour moduler la perfusion d’insuline. Les progrès de la simulation informatique ont accéléré la mise au point des algorithmes en permettant de les tester sur ordinateur chez des patients virtuels avant de procéder aux essais cliniques. Par ailleurs, le développement des smartphones et des tablettes numériques a procuré le matériel nécessaire au port ambulatoire des algorithmes, les pompes et les systèmes de mesure glycémique continue étant connectés sans fil au support numérique pour fournir en continu les données glycémiques et commander en retour la perfusion d’insuline (fig. 4). Certains systèmes plus complexes ont couplé en outre une pompe perfusant du glucagon, activée lorsque la prévision d’une hypoglycémie ne peut être contrecarrée par la seule interruption du débit de la pompe à insuline.
Les premières approches d’un traitement automatisé de la mesure glycémique continue par l’électronique d’une pompe à insuline ont visé la prévention des hypoglycémies sévères. La base a été la transmission sans fil du signal du capteur de mesure glycémique à la pompe à insuline. Ensuite, l’absence de réponse à l’alerte déclenchée par le franchissement par la glycémie estimée d’un seuil prédéfini a conduit à automatiser l’arrêt du débit de la pompe durant 2 heures, ou au moins jusqu’au moment où le patient manifeste sa prise en compte de l’alerte. Ce système a montré son efficacité sur la réduction des épisodes hypoglycémiques profonds et sur la durée du temps passé en hypoglycémie.12 Il s’est avéré particulièrement utile en cas de non-perception des hypoglycémies, notamment durant le sommeil, et plus particulièrement chez les enfants. L’arrêt automatisé de la perfusion d’insuline n’expose pas à des déviations hyperglycémiques délétères. Une étape de plus a été franchie en interrompant le débit de la pompe sur la base d’une prédiction d’atteinte du seuil d’alerte hypogly- cémique dans les 30 minutes suivantes, calculée à partir de la pente évolutive du signal de mesure glycémique continue. Ce système a confirmé son efficacité sur la réduction de tous les événements hypoglycémiques et du temps passé en hypoglycémie, sans occasionner non plus de dérive hyperglycémique.13 Ces dispositifs automatisés de sécurité vis-à-vis des alertes hypoglycémiques non perçues sont disponibles en France, et remboursés par l’Assurance-maladie depuis quelques mois.
Parallèlement à ces développements, des collaborations scientifiques se sont mises en place en Europe et aux États-Unis pour mettre au point des algorithmes capables de guider la perfusion d’insuline afin de maintenir la glycémie dans un intervalle de sécurité proche de la normale, puis tester leur sécurité et leur efficacité chez des patients volontaires en milieu hospitalier puis en ambulatoire sur des durées croissantes.14 La difficulté principale est la prise en compte des délais d’action de l’insuline administrée en sous-cutané pour moduler la perfusion d’insuline. Les progrès de la simulation informatique ont accéléré la mise au point des algorithmes en permettant de les tester sur ordinateur chez des patients virtuels avant de procéder aux essais cliniques. Par ailleurs, le développement des smartphones et des tablettes numériques a procuré le matériel nécessaire au port ambulatoire des algorithmes, les pompes et les systèmes de mesure glycémique continue étant connectés sans fil au support numérique pour fournir en continu les données glycémiques et commander en retour la perfusion d’insuline (fig. 4). Certains systèmes plus complexes ont couplé en outre une pompe perfusant du glucagon, activée lorsque la prévision d’une hypoglycémie ne peut être contrecarrée par la seule interruption du débit de la pompe à insuline.
PANCRÉAS ARTIFICIEL COMPLÈTEMENT AUTOMATISÉ : ENTRE RÊVE ET RÉALITÉ
2. Maahs DM, Buckingham BA, Castle JR, et al. Outcome measures for artificial pancreas clinical trials: a consensus report. Diabetes Care 2016;39:1175-9.
3. Cobelli C, Renard E, Kovatchev B. Artificial pancreas: past, present, future. Diabetes 2011;60:2672-82.
4. Home PD. Plasma insulin profiles after subcutaneous injection: how close can we get to physiology in people with diabetes? Diabetes Obes Metab 2015;17:1011-20.
5. Pozzilli P, Battelino T, Danne T, Hovorka R, Jarosz-Chobot P, Renard E. Continuous subcutaneous insulin infusion in diabetes: patient populations, safety, efficacy, and pharmacoeconomics. Diabetes Metab Res Rev 2016;32:21-39.
6. Lassmann-Vague V, Clavel S, Guerci B, et al. When to treat a diabetic patient using an external insulin pump. Expert consensus. Société francophone du diabète (ex-Alfediam). Diabetes Metab 2010;36:79-85.
7. Selam JL, Raymond M, Jacquemin JL, Orsetti A, Richard JL, Mirouze J. Pharmacokinetics of insulin infused intra-peritoneally via portable pumps. Diabete Metab 1985;11:170-3.
8. Renard E, Schaepelynck-Belicar P on behalf of the EVADIAC group. Implantable insulin pumps: a position statement about their clinical use. Diabetes Metab 2007;33:158-66.
9. Reach G. Toutes les questions que vous vous êtes toujours posées sur le fonctionnement des capteurs de glucose. Med Mal Metab 2016;10:615-23.
10. Joubert M, Baillot-Rudoni S, Catargi B, et al. Indication, organization, practical implementation and interpretation guidelines for retrospective CGM recording: A French position statement. Diabetes Metab 2015;41:498-508.
11. Danne T, Nimri R, Battelino T, et al. International consensus on use of continuous glucose monitoring. Diabetes Care 2017;40:1361-40.
12. Bergenstal RM, Klonoff DC, Garg SK, et al. Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J Med 2013;369:224-32.
13. Maahs DM, Calhoun P, Buckingham BA, et al. A randomized trial of a home system to reduce nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2014;37:1885-91.
14. Thabit H, Hovorka R. Coming of age: the artificial pancreas for type 1 diabetes. Diabetologia 2016;59:1795-805.
15. Renard E, Farret A, Kropff J, et al. Day-and-night closed-loop glucose control in patients with type 1 diabetes under free-living conditions: results of a single-arm 1-month experience compared with a previously reported feasibility study of evening and night at home. Diabetes Care 2016;39:1151-60
Références
1. The Diabetes Control and Complications Trial Research Group (DCCT). The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-86.
2. Maahs DM, Buckingham BA, Castle JR, et al. Outcome measures for artificial pancreas clinical trials: a consensus report. Diabetes Care 2016;39:1175-9.
3. Cobelli C, Renard E, Kovatchev B. Artificial pancreas: past, present, future. Diabetes 2011;60:2672-82.
4. Home PD. Plasma insulin profiles after subcutaneous injection: how close can we get to physiology in people with diabetes? Diabetes Obes Metab 2015;17:1011-20.
5. Pozzilli P, Battelino T, Danne T, Hovorka R, Jarosz-Chobot P, Renard E. Continuous subcutaneous insulin infusion in diabetes: patient populations, safety, efficacy, and pharmacoeconomics. Diabetes Metab Res Rev 2016;32:21-39.
6. Lassmann-Vague V, Clavel S, Guerci B, et al. When to treat a diabetic patient using an external insulin pump. Expert consensus. Société francophone du diabète (ex-Alfediam). Diabetes Metab 2010;36:79-85.
7. Selam JL, Raymond M, Jacquemin JL, Orsetti A, Richard JL, Mirouze J. Pharmacokinetics of insulin infused intra-peritoneally via portable pumps. Diabete Metab 1985;11:170-3.
8. Renard E, Schaepelynck-Belicar P on behalf of the EVADIAC group. Implantable insulin pumps: a position statement about their clinical use. Diabetes Metab 2007;33:158-66.
9. Reach G. Toutes les questions que vous vous êtes toujours posées sur le fonctionnement des capteurs de glucose. Med Mal Metab 2016;10:615-23.
10. Joubert M, Baillot-Rudoni S, Catargi B, et al. Indication, organization, practical implementation and interpretation guidelines for retrospective CGM recording: A French position statement. Diabetes Metab 2015;41:498-508.
11. Danne T, Nimri R, Battelino T, et al. International consensus on use of continuous glucose monitoring. Diabetes Care 2017;40:1361-40.
12. Bergenstal RM, Klonoff DC, Garg SK, et al. Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J Med 2013;369:224-32.
13. Maahs DM, Calhoun P, Buckingham BA, et al. A randomized trial of a home system to reduce nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2014;37:1885-91.
14. Thabit H, Hovorka R. Coming of age: the artificial pancreas for type 1 diabetes. Diabetologia 2016;59:1795-805.
15. Renard E, Farret A, Kropff J, et al. Day-and-night closed-loop glucose control in patients with type 1 diabetes under free-living conditions: results of a single-arm 1-month experience compared with a previously reported feasibility study of evening and night at home. Diabetes Care 2016;39:1151-60
2. Maahs DM, Buckingham BA, Castle JR, et al. Outcome measures for artificial pancreas clinical trials: a consensus report. Diabetes Care 2016;39:1175-9.
3. Cobelli C, Renard E, Kovatchev B. Artificial pancreas: past, present, future. Diabetes 2011;60:2672-82.
4. Home PD. Plasma insulin profiles after subcutaneous injection: how close can we get to physiology in people with diabetes? Diabetes Obes Metab 2015;17:1011-20.
5. Pozzilli P, Battelino T, Danne T, Hovorka R, Jarosz-Chobot P, Renard E. Continuous subcutaneous insulin infusion in diabetes: patient populations, safety, efficacy, and pharmacoeconomics. Diabetes Metab Res Rev 2016;32:21-39.
6. Lassmann-Vague V, Clavel S, Guerci B, et al. When to treat a diabetic patient using an external insulin pump. Expert consensus. Société francophone du diabète (ex-Alfediam). Diabetes Metab 2010;36:79-85.
7. Selam JL, Raymond M, Jacquemin JL, Orsetti A, Richard JL, Mirouze J. Pharmacokinetics of insulin infused intra-peritoneally via portable pumps. Diabete Metab 1985;11:170-3.
8. Renard E, Schaepelynck-Belicar P on behalf of the EVADIAC group. Implantable insulin pumps: a position statement about their clinical use. Diabetes Metab 2007;33:158-66.
9. Reach G. Toutes les questions que vous vous êtes toujours posées sur le fonctionnement des capteurs de glucose. Med Mal Metab 2016;10:615-23.
10. Joubert M, Baillot-Rudoni S, Catargi B, et al. Indication, organization, practical implementation and interpretation guidelines for retrospective CGM recording: A French position statement. Diabetes Metab 2015;41:498-508.
11. Danne T, Nimri R, Battelino T, et al. International consensus on use of continuous glucose monitoring. Diabetes Care 2017;40:1361-40.
12. Bergenstal RM, Klonoff DC, Garg SK, et al. Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J Med 2013;369:224-32.
13. Maahs DM, Calhoun P, Buckingham BA, et al. A randomized trial of a home system to reduce nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2014;37:1885-91.
14. Thabit H, Hovorka R. Coming of age: the artificial pancreas for type 1 diabetes. Diabetologia 2016;59:1795-805.
15. Renard E, Farret A, Kropff J, et al. Day-and-night closed-loop glucose control in patients with type 1 diabetes under free-living conditions: results of a single-arm 1-month experience compared with a previously reported feasibility study of evening and night at home. Diabetes Care 2016;39:1151-60