Les traitements médicamenteux cardioprotecteurs et interventionnels (pacemakers resynchronisateurs, défibrillateurs, chirurgie ou techniques percutanées de la maladie coronaire et des valvulopathies) pour le traitement de l’insuffisance cardiaque ont réalisé des avancées déterminantes ces 30 dernières années en permettant d’améliorer très fortement la survie et la qualité de vie, et de réduire les réhospitalisations. De plus, dans un nombre important de cas, la guérison peut être obtenue et la maladie très longuement stabilisée. Parallèlement, des progrès diagnostiques considérables ont été réalisés, en particulier en imagerie et génétique. Ils permettent un diagnostic précoce et la mise en place de stratégies préventives ou curatrices avant un remodelage cardiaque irréversible.
Toutefois, la mortalité reste importante aux stades les plus évolués de la maladie, avec un risque de déstabilisation lorsque l’altération de la fonction cardiaque n’a pas pu être prévenue ou reversée en l’absence d’un traitement étiologique ou cardioprotecteur bien conduit ou parce que les processus physiopathologiques incomplètement bloqués perdurent malgré – en l’absence bien des fois – d’une optimisation des thérapeutiques.
Le parcours de soins reste très complexe, car il s’agit de malades chroniques, souvent âgés, avec de nombreuses comorbidités rendant les prescriptions difficiles dans un contexte de tension des filières médicales en lien avec l’augmentation des maladies chroniques, la désertification des territoires et les modifications des exercices des professions médicales.
Le phénotype des patients se modifie également avec le vieillissement de la population et l’augmentation de la prévalence des comorbidités (hypertension artérielle, diabète, obésité) faisant le lit de l’insuffisance cardiaque à fraction d’éjection préservée (fraction d’éjection ventriculaire gauche [FEVG] > 50 %), qui devient actuellement la forme la plus fréquente. Cette dernière est tout aussi symptomatique et grave mais de reconnaissance plus difficile et, à l’heure actuelle, sans traitement spécifique, en dehors de celui des comorbidités et des facteurs déclenchants des poussées congestives.
Toutefois, la mortalité reste importante aux stades les plus évolués de la maladie, avec un risque de déstabilisation lorsque l’altération de la fonction cardiaque n’a pas pu être prévenue ou reversée en l’absence d’un traitement étiologique ou cardioprotecteur bien conduit ou parce que les processus physiopathologiques incomplètement bloqués perdurent malgré – en l’absence bien des fois – d’une optimisation des thérapeutiques.
Le parcours de soins reste très complexe, car il s’agit de malades chroniques, souvent âgés, avec de nombreuses comorbidités rendant les prescriptions difficiles dans un contexte de tension des filières médicales en lien avec l’augmentation des maladies chroniques, la désertification des territoires et les modifications des exercices des professions médicales.
Le phénotype des patients se modifie également avec le vieillissement de la population et l’augmentation de la prévalence des comorbidités (hypertension artérielle, diabète, obésité) faisant le lit de l’insuffisance cardiaque à fraction d’éjection préservée (fraction d’éjection ventriculaire gauche [FEVG] > 50 %), qui devient actuellement la forme la plus fréquente. Cette dernière est tout aussi symptomatique et grave mais de reconnaissance plus difficile et, à l’heure actuelle, sans traitement spécifique, en dehors de celui des comorbidités et des facteurs déclenchants des poussées congestives.
Recommandations européennes
Pour l’insuffisance cardiaque à fraction d’éjection altérée, au contraire, de nombreuses recommandations de sociétés savantes ont régulièrement été mises à jour sur la base des avancées scientifiques majeures et de la disponibilité d’options thérapeutiques toujours plus nombreuses.
Après une période prolifique pendant les années 1980-2000 où les essais thérapeutiques établissaient les bases du traitement cardioprotecteur moderne par les antagonistes du système rénine-angiotensine-aldostérone (SRAA) en association aux bêtabloquants et resynchronisateurs-défibrillateurs, ils ont ensuite marqué le pas pendant une dizaine d’années avec l’échec de nombreuses nouvelles molécules n’apportant pas de réduction de la mortalité.
Depuis 2010, de nouvelles classes montrent des bénéfices significatifs sur la morbi-mortalité. L’essai clinique SHIFT1 démontrait que l’optimisation de la fréquence cardiaque avec l’ivabradine permettait de réduire les réhospitalisations et la mortalité par aggravation de l’insuffisance cardiaque. En 2014, l’essai PARADIGM-HF2 montrait un bénéfice important de l’association valsartan-sacubitril (association d’inhibiteurs des récepteurs de l’angiotensine et de la néprilysine [IRAN]) en réduisant de 20 % la mortalité cardiovasculaire et les réhospitalisations pour insuffisance cardiaque par rapport au traitement conventionnel par inhibiteur de l’enzyme de conversion (IEC), et également la mortalité toutes causes (-20 %), cardiovasculaire (-16 %), et les réhospitalisations pour insuffisance cardiaque (-21 %).
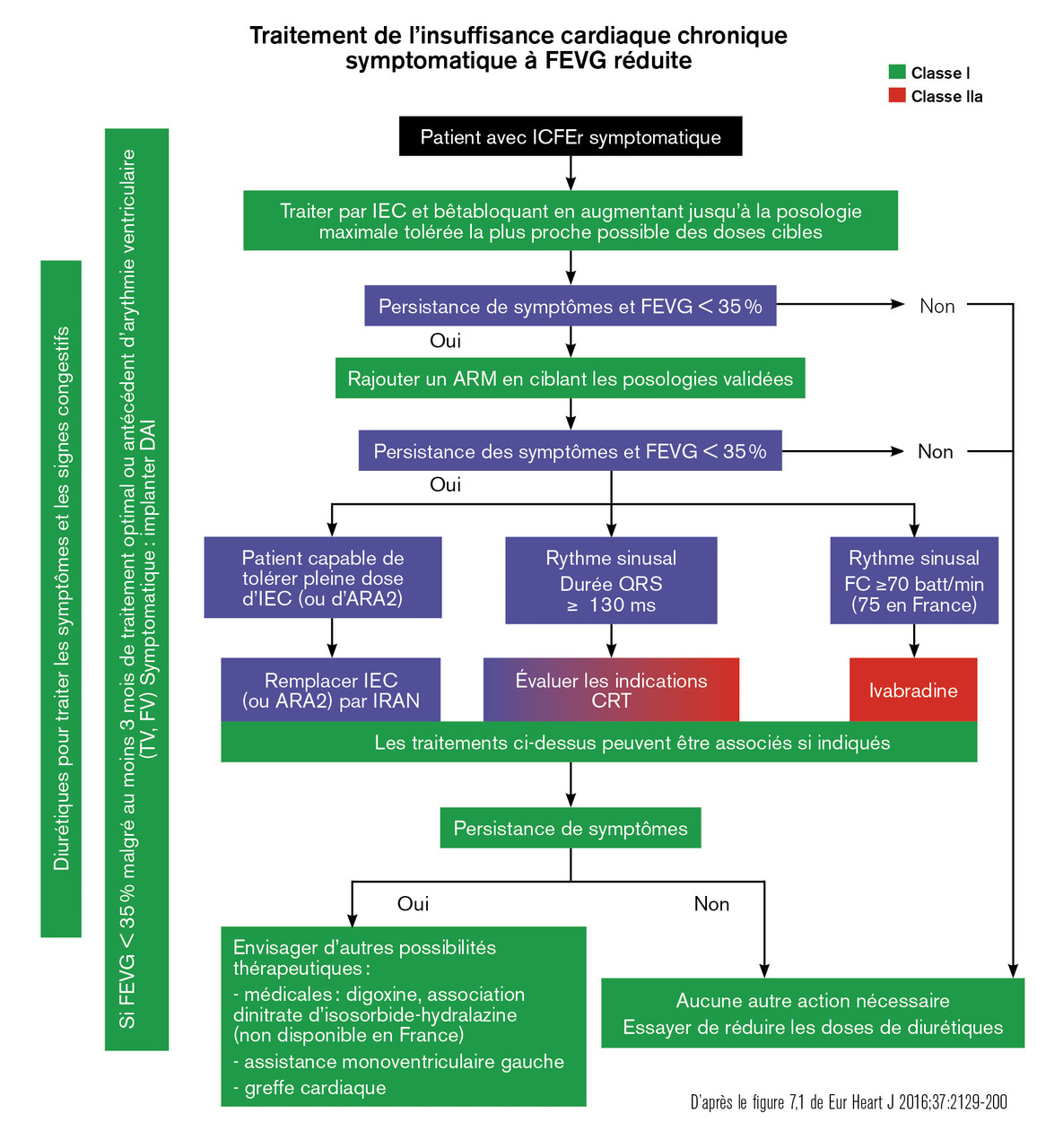
Sur la base de ces derniers essais, la Société française de cardiologie a endossé les dernières recommandations européennes du traitement de l’insuffisance cardiaque à fraction d’éjection altérée publiées en 2016.3 Elles proposent un arbre décisionnel clair et pragmatique (v. figure ). La très grande gravité de la pathologie, son retentissement fonctionnel majeur et le coût sociétal majeur lié aux nombreuses hospitalisations justifient – quel que soit l’âge du patient – de suivre précisément ces recommandations.
Après une période prolifique pendant les années 1980-2000 où les essais thérapeutiques établissaient les bases du traitement cardioprotecteur moderne par les antagonistes du système rénine-angiotensine-aldostérone (SRAA) en association aux bêtabloquants et resynchronisateurs-défibrillateurs, ils ont ensuite marqué le pas pendant une dizaine d’années avec l’échec de nombreuses nouvelles molécules n’apportant pas de réduction de la mortalité.
Depuis 2010, de nouvelles classes montrent des bénéfices significatifs sur la morbi-mortalité. L’essai clinique SHIFT1 démontrait que l’optimisation de la fréquence cardiaque avec l’ivabradine permettait de réduire les réhospitalisations et la mortalité par aggravation de l’insuffisance cardiaque. En 2014, l’essai PARADIGM-HF2 montrait un bénéfice important de l’association valsartan-sacubitril (association d’inhibiteurs des récepteurs de l’angiotensine et de la néprilysine [IRAN]) en réduisant de 20 % la mortalité cardiovasculaire et les réhospitalisations pour insuffisance cardiaque par rapport au traitement conventionnel par inhibiteur de l’enzyme de conversion (IEC), et également la mortalité toutes causes (-20 %), cardiovasculaire (-16 %), et les réhospitalisations pour insuffisance cardiaque (-21 %).
Sur la base de ces derniers essais, la Société française de cardiologie a endossé les dernières recommandations européennes du traitement de l’insuffisance cardiaque à fraction d’éjection altérée publiées en 2016.3 Elles proposent un arbre décisionnel clair et pragmatique (
Bilan et objectif du traitement pharmacologique
Le bilan étiologique est tout d’abord incontournable et bien conduit, fondé sur une évaluation cardiologique exhaustive afin de traiter efficacement la cause et d’évaluer précisément le pronostic, de traiter au mieux toutes les comorbidités (diabète, insuffisance rénale, bronchopneumopathie chronique obstructive, carence martiale en particulier) et les facteurs aggravants (ischémie myocardique, troubles du rythme, hypertension artérielle, prévention des infections par les vaccinations, etc.).
Parallèlement, le traitement pharmacologique est adapté. Ses trois objectifs fondamentaux sont :
– de prescrire aux doses maximales tolérées les cardioprotecteurs et d’implanter les dispositifs qui réduisent la mortalité et inversent les processus physiopathologiques, préviennent les rechutes et décompensations, améliorent la qualité de vie ;
– de traiter la congestion avec les diurétiques ;
– et de prévenir la mort subite.
Parallèlement, le traitement pharmacologique est adapté. Ses trois objectifs fondamentaux sont :
– de prescrire aux doses maximales tolérées les cardioprotecteurs et d’implanter les dispositifs qui réduisent la mortalité et inversent les processus physiopathologiques, préviennent les rechutes et décompensations, améliorent la qualité de vie ;
– de traiter la congestion avec les diurétiques ;
– et de prévenir la mort subite.
Arbre de décision et parcours de soins
La « titration » (augmentation progressive des doses par paliers pour atteindre la dose maximale recommandée et tolérée) est réalisée en quelques semaines : il est nécessaire qu’elle se fasse sans perdre de temps car c’est très souvent en raison de la non-optimisation du traitement que les patients rechutent et sont réhospitalisés dans les semaines suivant le diagnostic ou la première décompensation.
Après stabilisation de la congestion, la première étape est d’introduire un inhibiteur de l’enzyme de conversion (IEC) ou un antagoniste de l’angiotensine II (AA2), d’y adjoindre un bêtabloquant et, si le patient reste symptomatique avec une fraction d’éjection inférieure ou égale à 35 %, un antagoniste des récepteurs aux minéralocorticoïdes (spironolactone, éplérénone). Si, malgré cette trithérapie, le patient reste symptomatique – c’est-à-dire qu’il reste au moins en classe 2 de la New York Heart Association (NYHA) –, il doit lui être proposé soit un changement de l’IEC ou l’AA2 par l’association valsartan-sacubitril (Entresto), soit l’association d’inhibiteurs des récepteurs de l’angiotensine et de la néprilysine (IRAN). Ce changement de classe nécessite une fenêtre d’au moins 36 heures après arrêt de l’IEC, une surveillance de la fonction rénale et de la kaliémie (en pratique ionogramme, créatininémie 5 à 7 jours après l’introduction, éventuellement à 15 jours et après chaque augmentation de dose). Des études ont également montré qu’il peut être initié en première intention en phase d’hospitalisation pour décompensation chez des patients vierges de traitement cardioprotecteur.4, 5
Si la fréquence cardiaque reste élevée (> 70 batt/min) malgré le traitement bêtabloquant prescrit aux doses maximales tolérées, ou en cas d’intolérance, l’ivabradine peut être ajoutée. S’il existe un QRS élargi (≥ 130 ms) et une FEVG inférieure ou égale à 35 %, un pacemaker resynchronisateur peut être proposé, associé ou non à une fonction de défibrillateur en prévention primaire selon l’évaluation cardiologique du risque de mortalité rythmique. En cas d’inefficacité chez les plus jeunes patients (autour de 65 ans) sont discutées une transplantation cardiaque, une assistance monoventriculaire gauche définitive ou en attente de greffe, ou la mise en place d’un « cœur artificiel total » en attendant une greffe cardiaque – l’indication d’une implantation « définitive » pour le cœur artificiel total n’est pas encore clairement validée avec le système actuel. La réadaptation cardiaque doit être systématiquement proposée car elle permet d’améliorer la qualité de vie, la survie si elle pouvait être poursuivie continuellement, et permet sans conteste de redonner aux patients la confiance en eux qu’ils ont souvent perdue. La réadaptation est également un temps privilégié pour l’optimisation du traitement médicamenteux.
L’organisation du parcours de soins est également déterminante. Elle repose idéalement sur le cardiologue, l’unité d’insuffisance cardiaque et les acteurs de soins ambulatoires : médecin traitant, infirmières, services sociaux, pharmaciens, cliniques de l’insuffisance cardiaque, etc., en s’appuyant sur une répartition préalable des rôles de chacun des acteurs qui se connaissent (qui fait quoi ?), plus rarement sur un réseau de soins formalisé et/ou un télésuivi et/ou une télésurveillance (poids, symptômes, données des enregistrements des stimulateurs cardiaques) ainsi qu’un suivi biologique indispensable.
Aux stades les plus avancés de l’insuffisance cardiaque, ou en cas de décompensation cardiaque sévère, les soins de support sont systématiquement proposés au patient et à son entourage. Une prise en charge palliative doit être envisagée en cas d’insuffisance cardiaque réfractaire, avec un accompagnement en établissement ou à domicile en fonction des ressources locales.
Après stabilisation de la congestion, la première étape est d’introduire un inhibiteur de l’enzyme de conversion (IEC) ou un antagoniste de l’angiotensine II (AA2), d’y adjoindre un bêtabloquant et, si le patient reste symptomatique avec une fraction d’éjection inférieure ou égale à 35 %, un antagoniste des récepteurs aux minéralocorticoïdes (spironolactone, éplérénone). Si, malgré cette trithérapie, le patient reste symptomatique – c’est-à-dire qu’il reste au moins en classe 2 de la New York Heart Association (NYHA) –, il doit lui être proposé soit un changement de l’IEC ou l’AA2 par l’association valsartan-sacubitril (Entresto), soit l’association d’inhibiteurs des récepteurs de l’angiotensine et de la néprilysine (IRAN). Ce changement de classe nécessite une fenêtre d’au moins 36 heures après arrêt de l’IEC, une surveillance de la fonction rénale et de la kaliémie (en pratique ionogramme, créatininémie 5 à 7 jours après l’introduction, éventuellement à 15 jours et après chaque augmentation de dose). Des études ont également montré qu’il peut être initié en première intention en phase d’hospitalisation pour décompensation chez des patients vierges de traitement cardioprotecteur.4, 5
Si la fréquence cardiaque reste élevée (> 70 batt/min) malgré le traitement bêtabloquant prescrit aux doses maximales tolérées, ou en cas d’intolérance, l’ivabradine peut être ajoutée. S’il existe un QRS élargi (≥ 130 ms) et une FEVG inférieure ou égale à 35 %, un pacemaker resynchronisateur peut être proposé, associé ou non à une fonction de défibrillateur en prévention primaire selon l’évaluation cardiologique du risque de mortalité rythmique. En cas d’inefficacité chez les plus jeunes patients (autour de 65 ans) sont discutées une transplantation cardiaque, une assistance monoventriculaire gauche définitive ou en attente de greffe, ou la mise en place d’un « cœur artificiel total » en attendant une greffe cardiaque – l’indication d’une implantation « définitive » pour le cœur artificiel total n’est pas encore clairement validée avec le système actuel. La réadaptation cardiaque doit être systématiquement proposée car elle permet d’améliorer la qualité de vie, la survie si elle pouvait être poursuivie continuellement, et permet sans conteste de redonner aux patients la confiance en eux qu’ils ont souvent perdue. La réadaptation est également un temps privilégié pour l’optimisation du traitement médicamenteux.
L’organisation du parcours de soins est également déterminante. Elle repose idéalement sur le cardiologue, l’unité d’insuffisance cardiaque et les acteurs de soins ambulatoires : médecin traitant, infirmières, services sociaux, pharmaciens, cliniques de l’insuffisance cardiaque, etc., en s’appuyant sur une répartition préalable des rôles de chacun des acteurs qui se connaissent (qui fait quoi ?), plus rarement sur un réseau de soins formalisé et/ou un télésuivi et/ou une télésurveillance (poids, symptômes, données des enregistrements des stimulateurs cardiaques) ainsi qu’un suivi biologique indispensable.
Aux stades les plus avancés de l’insuffisance cardiaque, ou en cas de décompensation cardiaque sévère, les soins de support sont systématiquement proposés au patient et à son entourage. Une prise en charge palliative doit être envisagée en cas d’insuffisance cardiaque réfractaire, avec un accompagnement en établissement ou à domicile en fonction des ressources locales.
Nouveautés
L’actualité scientifique est riche, et, tout récemment, deux nouvelles classes thérapeutiques et un nouveau dispositif ont montré des résultats très intéressants qui vont impacter la prise en charge à court terme.
Inhibiteurs du SGLT2 ou gliflozines (empagliflozine, canagliflozine, dapagliflozine)
Ils ont montré leur efficacité dans le traitement du diabète de type 2. Il s’agit d’inhibiteurs du cotransporteur sodium-glucose (SGLT2) au niveau rénal qui produisent une augmentation de la glycosurie.
Concernant l’association des deux pathologies, on sait que les patients avec un prédiabète ou un diabète ont un risque accru d’insuffisance cardiaque, que ce soit à fraction d’éjection altérée ou préservée et qu’inversement l’insuffisance cardiaque accroît le risque de diabète de type 2. L’association diabète et insuffisance cardiaque augmente le risque d’hospitalisation pour insuffisance cardiaque, la mortalité toutes causes et cardiovasculaire. Les traitements de l’insuffisance cardiaque sont aussi efficaces chez les patients avec ou sans diabète, mais peuvent nécessiter l’adaptation des doses des antagonistes du système rénine-angiotensine-aldostérone (SRRA) compte tenu d’une prévalence supérieure de l’insuffisance rénale et d’une hyperkaliémie. Selon les recommandations de l’European Society of Cardiology,6 le traitement de première intention du diabète de type 2 en cas d’insuffisance cardiaque repose sur la metformine et les inhibiteurs de SGLT2 (c’est également le cas en présence d’une pathologie cardiovasculaire ou de haut ou très haut risque cardiovasculaire pour en réduire les événements).
Les études initiales réalisées avec l’empagliflozine pour évaluer sa toxicité cardiovasculaire (systématiquement recherchée depuis l’identification d’effets indésirables cardiovasculaires avec les glitazones, pioglitazone et rosiglitazone – et pour la saxagliptine, un inhibiteur de DPP4) montraient de forts signaux en faveur d’une diminution des hospitalisations pour insuffisance cardiaque (étude EMPA-REG et données de pratique courante).
Le mécanisme d’action cardioprotecteur est incomplètement compris mais a été confirmé dans l’étude DAPA-HF publiée en 2019.7 Cette étude a comparé la dapagliflozine au placebo chez 4 744 patients avec une insuffisance cardiaque chronique et une FEVG inférieure à 40 %, avec ou sans diabète, recevant un traitement optimal de l’insuffisance cardiaque. L’étude a montré une réduction significative de 26 % du critère combiné aggravation de l’insuffisance cardiaque ou mortalité cardiovasculaire. Cet essai excluait les patients avec un débit de filtration glomérulaire (eDFG) inférieur à 30 mL/min/1,73 m2, et 40 % des patients avaient un eDFG inférieur à 60 mL/min/1,73 m2 sans augmentation du risque rénal par rapport au placebo. L’essai de morbi-mortalité (critère combiné décès cardiovasculaire ou première hospitalisation pour insuffisance cardiaque) chez des patients en insuffisance cardiaque systolique avec l’empagliflozine est en cours et devrait être présenté au Congrès européen de cardiologie en 2020.
Concernant l’association des deux pathologies, on sait que les patients avec un prédiabète ou un diabète ont un risque accru d’insuffisance cardiaque, que ce soit à fraction d’éjection altérée ou préservée et qu’inversement l’insuffisance cardiaque accroît le risque de diabète de type 2. L’association diabète et insuffisance cardiaque augmente le risque d’hospitalisation pour insuffisance cardiaque, la mortalité toutes causes et cardiovasculaire. Les traitements de l’insuffisance cardiaque sont aussi efficaces chez les patients avec ou sans diabète, mais peuvent nécessiter l’adaptation des doses des antagonistes du système rénine-angiotensine-aldostérone (SRRA) compte tenu d’une prévalence supérieure de l’insuffisance rénale et d’une hyperkaliémie. Selon les recommandations de l’European Society of Cardiology,6 le traitement de première intention du diabète de type 2 en cas d’insuffisance cardiaque repose sur la metformine et les inhibiteurs de SGLT2 (c’est également le cas en présence d’une pathologie cardiovasculaire ou de haut ou très haut risque cardiovasculaire pour en réduire les événements).
Les études initiales réalisées avec l’empagliflozine pour évaluer sa toxicité cardiovasculaire (systématiquement recherchée depuis l’identification d’effets indésirables cardiovasculaires avec les glitazones, pioglitazone et rosiglitazone – et pour la saxagliptine, un inhibiteur de DPP4) montraient de forts signaux en faveur d’une diminution des hospitalisations pour insuffisance cardiaque (étude EMPA-REG et données de pratique courante).
Le mécanisme d’action cardioprotecteur est incomplètement compris mais a été confirmé dans l’étude DAPA-HF publiée en 2019.7 Cette étude a comparé la dapagliflozine au placebo chez 4 744 patients avec une insuffisance cardiaque chronique et une FEVG inférieure à 40 %, avec ou sans diabète, recevant un traitement optimal de l’insuffisance cardiaque. L’étude a montré une réduction significative de 26 % du critère combiné aggravation de l’insuffisance cardiaque ou mortalité cardiovasculaire. Cet essai excluait les patients avec un débit de filtration glomérulaire (eDFG) inférieur à 30 mL/min/1,73 m2, et 40 % des patients avaient un eDFG inférieur à 60 mL/min/1,73 m2 sans augmentation du risque rénal par rapport au placebo. L’essai de morbi-mortalité (critère combiné décès cardiovasculaire ou première hospitalisation pour insuffisance cardiaque) chez des patients en insuffisance cardiaque systolique avec l’empagliflozine est en cours et devrait être présenté au Congrès européen de cardiologie en 2020.
Vériciguat
La guanylate cyclase soluble joue un rôle essentiel dans la production de guanosine monophosphate cyclique (GMPc), qui a un rôle déterminant dans la relaxation vasculaire et cardiaque. En cas d‘insuffisance cardiaque, les études expérimentales ont montré qu’il existe une diminution de l’oxyde nitrique (NO) et une altération fonctionnelle de la guanylate cyclase soluble responsable d’une augmentation du stress oxydant et une diminution du GMPc contribuant aux altérations endothéliales et de la fonction cardiaque. Le vériciguat est un composé pharmacologique qui agit comme un stimulateur direct de la guanylate cyclase soluble et est donc susceptible d’améliorer la vasorelaxation et la fonction cardiaque.
Après plusieurs essais de phase II démontrant son intérêt potentiel, l’étude VICTORIA publiée8 en mars 2020 a comparé l’effet du vériciguat 10 mg au placebo chez 5 050 patients insuffisants cardiaques en classe NYHA II, III ou IV avec une fraction d’éjection inférieure à 45 % sous traitements recommandés mais « récemment décompensés » (en pratique, il s’agissait d’un événement d’insuffisance cardiaque récent ou de symptômes et signes d’insuffisance cardiaque s’aggravant progressivement nécessitant soit un traitement ambulatoire, soit un passage aux urgences ou une hospitalisation) rendant la population étudiée un peu plus sévère que dans les essais PARADIGM et DAPA-HF (41 % NYHA classe III et IV vs 25 % et 32 % et valeurs médianes de BNP plus élevées). Il était observé à partir de 3 mois de suivi chez les patients traités par vériciguat une diminution significative du critère combiné mortalité cardiovasculaire ou hospitalisations pour insuffisance cardiaque, effet essentiellement lié à la réduction des hospitalisations mais avec une augmentation non significative des syncopes (4 vs 3,5 %) et épisodes d’hypotension (9,1 vs 7,9 %). Il était également observé dans cette étude l’absence d’effet dans les sous-groupes de patients avec les valeurs de NT-proBNP les plus élevées (> 5 314 pg/mL). Dans cette étude, le nombre de patients traités par SGLT2 n’était pas suffisant pour juger des effets de l’association, mais l’effet observé était conservé chez les patients traités par sacubitril-valsartan.
Après plusieurs essais de phase II démontrant son intérêt potentiel, l’étude VICTORIA publiée8 en mars 2020 a comparé l’effet du vériciguat 10 mg au placebo chez 5 050 patients insuffisants cardiaques en classe NYHA II, III ou IV avec une fraction d’éjection inférieure à 45 % sous traitements recommandés mais « récemment décompensés » (en pratique, il s’agissait d’un événement d’insuffisance cardiaque récent ou de symptômes et signes d’insuffisance cardiaque s’aggravant progressivement nécessitant soit un traitement ambulatoire, soit un passage aux urgences ou une hospitalisation) rendant la population étudiée un peu plus sévère que dans les essais PARADIGM et DAPA-HF (41 % NYHA classe III et IV vs 25 % et 32 % et valeurs médianes de BNP plus élevées). Il était observé à partir de 3 mois de suivi chez les patients traités par vériciguat une diminution significative du critère combiné mortalité cardiovasculaire ou hospitalisations pour insuffisance cardiaque, effet essentiellement lié à la réduction des hospitalisations mais avec une augmentation non significative des syncopes (4 vs 3,5 %) et épisodes d’hypotension (9,1 vs 7,9 %). Il était également observé dans cette étude l’absence d’effet dans les sous-groupes de patients avec les valeurs de NT-proBNP les plus élevées (> 5 314 pg/mL). Dans cette étude, le nombre de patients traités par SGLT2 n’était pas suffisant pour juger des effets de l’association, mais l’effet observé était conservé chez les patients traités par sacubitril-valsartan.
Traitement percutané de la fuite mitrale fonctionnelle
Concernant le dispositif, deux études récentes (MITRA-FR et COAPT)9, 10 ont permis de préciser les indications du traitement percutané de la fuite mitrale dite « secondaire », c’est-à-dire une fuite mitrale observée dans l’insuffisance cardiaque et liée essentiellement à la dilatation du ventricule gauche, ou en cas de trouble de la cinétique ventriculaire après un infarctus du myocarde ou de bloc de branche gauche sans anomalie structurelle de la valve mitrale. Le remboursement est en cours de discussion pour cette indication (fuite secondaire), et les indications seront bien réglementées (fuite mitrale secondaire importante sans dilatation excessive du ventricule gauche) et elles feront l’objet d’avis d’experts dans le cadre d’une validation par une équipe pluridisciplinaire.
Perspectives
Nous constatons donc un enrichissement récent de l’arsenal des traitements médicamenteux et interventionnels de l’insuffisance cardiaque fondé sur des approches physiopathologiques complémentaires à l’inhibition de l’hyperactivation des systèmes adrénergique et rénine-angiotensine.
Le recours à l’association sacubitril-valsartan fait désormais partie de la pratique quotidienne, et devant sa bonne tolérance et les bénéfices confirmés en pratique courante, elle pourrait basculer lors des prochaines recommandations européennes sur une indication de première intention, comme cela est déjà le cas aux États-Unis.
La tolérance générale, rénale et l’efficacité des gliflozines en font une classe intéressante et complémentaire chez les patients diabétiques en particulier mais pas seulement, puisque le même bénéfice sur l’insuffisance cardiaque à FEVG réduite est observé chez les non-diabétiques. Un ajustement des doses de diurétique peut être envisagé avec ces traitements, comme cela est également le cas pour l’association sacubitril-valsartan. Il faut également souligner sa facilité d’utilisation sans nécessité de titration, l’absence de risque hypoglycémique (sauf en association aux sulfamides hypoglycémiants et/ou à l’insuline), comme démontré chez les patients non diabétiques dans l’essai DAPA-HF, en restant vigilant sur le respect des contre-indications et le suivi des effets indésirables : insuffisance rénale aiguë réversible en initiation, déplétion volumique et hypotension, infections génitales (mycose) surtout chez la femme et plus rarement urinaires, acidocétose sans hyperglycémie, gangrène de Fournier (rare mais sévère).
L’insuffisance cardiaque est une maladie chronique complexe nécessitant une prise en charge spécialisée et une expertise cardiologique pour son diagnostic et son traitement, et il est très fortement souhaitable que les cardiologues français puissent accéder à la prescription de la dapagliflozine, qui diminue précocement la mortalité totale, la mortalité cardiovasculaire et les hospitalisations pour insuffisance cardiaque (pour cette dernière, on rappelle les taux de 10 % dans le groupe traité vs 13,7 % dans le groupe placebo au bout de 18 mois dans l’essai DAPA-HF spécifiquement conduit chez des patients avec une insuffisance cardiaque à FEVG réduite en comparaison des 2,5 % vs 3,3 % au bout de 50 mois des patients diabétiques dans l’essai DECLARE-TIMI 58 chez des diabétiques de type 2 à très haut risque cardiovasculaire).11 Actuellement, la prescription en France est réservée aux endocrinologues et internistes.
Le vériciguat offre également des perspectives complémentaires intéressantes sur la réduction des hospitalisations chez les patients avec une décompensation récente gardant un NT-proBNP élevé et une FEVG inférieure à 45 % avec comme pour le sacubitril-valsartan une vigilance sur l’hypotension artérielle signalée en phase initiale d’administration des plus faibles doses dans les premiers essais (non confirmés dans l’étude Victoria) alors que la tolérance rénale est bonne comme pour les gliflozines.
Dans l’avenir, ces nouvelles molécules permettront certainement d’adapter, sur la base des associations des inhibiteurs historiques du SRAA et adrénergique, les traitements recommandés selon un schéma de titration à la carte ou personnalisé en fonction des effets indésirables ou des comorbidités associées. L’observance du traitement est déterminante pour améliorer la qualité de vie et la survie, et essentiellement déterminée par les effets indésirables dans les 2 à 4 mois suivant leur initiation.12 Le traitement interventionnel relève d’équipes spécialisées, mais il est très important de l’évoquer et de leur adresser au plus tôt pour avis les patients ayant une insuffisance cardiaque et une régurgitation mitrale secondaire.
Le recours à l’association sacubitril-valsartan fait désormais partie de la pratique quotidienne, et devant sa bonne tolérance et les bénéfices confirmés en pratique courante, elle pourrait basculer lors des prochaines recommandations européennes sur une indication de première intention, comme cela est déjà le cas aux États-Unis.
La tolérance générale, rénale et l’efficacité des gliflozines en font une classe intéressante et complémentaire chez les patients diabétiques en particulier mais pas seulement, puisque le même bénéfice sur l’insuffisance cardiaque à FEVG réduite est observé chez les non-diabétiques. Un ajustement des doses de diurétique peut être envisagé avec ces traitements, comme cela est également le cas pour l’association sacubitril-valsartan. Il faut également souligner sa facilité d’utilisation sans nécessité de titration, l’absence de risque hypoglycémique (sauf en association aux sulfamides hypoglycémiants et/ou à l’insuline), comme démontré chez les patients non diabétiques dans l’essai DAPA-HF, en restant vigilant sur le respect des contre-indications et le suivi des effets indésirables : insuffisance rénale aiguë réversible en initiation, déplétion volumique et hypotension, infections génitales (mycose) surtout chez la femme et plus rarement urinaires, acidocétose sans hyperglycémie, gangrène de Fournier (rare mais sévère).
L’insuffisance cardiaque est une maladie chronique complexe nécessitant une prise en charge spécialisée et une expertise cardiologique pour son diagnostic et son traitement, et il est très fortement souhaitable que les cardiologues français puissent accéder à la prescription de la dapagliflozine, qui diminue précocement la mortalité totale, la mortalité cardiovasculaire et les hospitalisations pour insuffisance cardiaque (pour cette dernière, on rappelle les taux de 10 % dans le groupe traité vs 13,7 % dans le groupe placebo au bout de 18 mois dans l’essai DAPA-HF spécifiquement conduit chez des patients avec une insuffisance cardiaque à FEVG réduite en comparaison des 2,5 % vs 3,3 % au bout de 50 mois des patients diabétiques dans l’essai DECLARE-TIMI 58 chez des diabétiques de type 2 à très haut risque cardiovasculaire).11 Actuellement, la prescription en France est réservée aux endocrinologues et internistes.
Le vériciguat offre également des perspectives complémentaires intéressantes sur la réduction des hospitalisations chez les patients avec une décompensation récente gardant un NT-proBNP élevé et une FEVG inférieure à 45 % avec comme pour le sacubitril-valsartan une vigilance sur l’hypotension artérielle signalée en phase initiale d’administration des plus faibles doses dans les premiers essais (non confirmés dans l’étude Victoria) alors que la tolérance rénale est bonne comme pour les gliflozines.
Dans l’avenir, ces nouvelles molécules permettront certainement d’adapter, sur la base des associations des inhibiteurs historiques du SRAA et adrénergique, les traitements recommandés selon un schéma de titration à la carte ou personnalisé en fonction des effets indésirables ou des comorbidités associées. L’observance du traitement est déterminante pour améliorer la qualité de vie et la survie, et essentiellement déterminée par les effets indésirables dans les 2 à 4 mois suivant leur initiation.12 Le traitement interventionnel relève d’équipes spécialisées, mais il est très important de l’évoquer et de leur adresser au plus tôt pour avis les patients ayant une insuffisance cardiaque et une régurgitation mitrale secondaire.
Vers un traitement à la carte
D’autres résultats d’essais cliniques – adossés à d’autres voies physiopathologiques – sont attendus dans les prochains mois, en particulier celui concernant l’omécamtiv mécarbil, activateur sélectif de la myosine cardiaque qui augmente la contractilité et a des effets favorables sur le remodelage sans augmenter la consommation d’oxygène (GALACTIC-HF). Avec l’arrivée de tous ces nouveaux traitements, il sera nécessaire de prendre le temps de préciser leur utilisation dans l’insuffisance cardiaque à fraction d’éjection altérée dans les prochains mois ainsi que leurs associations, avec certainement l’opportunité d’instaurer un traitement à la carte en fonction de la tolérance, des effets indésirables des cardioprotecteurs et de l’évolution de la pathologie. Le traitement étiologique est fondamental, ainsi que l’évaluation pronostique pour cette prise en charge complexe, et l’imagerie y tient une place importante avec les biomarqueurs et la génétique. La complexité des nouveaux schémas thérapeutiques fait du cardiologue un acteur central et un interlocuteur incontournable pour toutes ces étapes du parcours de soins, la titration des traitements et la (télé)surveillance en lien avec le médecin traitant, les acteurs ambulatoires, les établissements et les unités spécialisées d’insuffisance cardiaque, partenaires qui doivent préciser et partager le rôle et les responsabilités de chacun.
Références
1. Karl Swedberg K, Komajda M, Böhm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. SHIFT investigators. Lancet 2010;376:875-85.
2. McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993-1004.
3. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-200.
4. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med 2019;380:539-48.
5. Wachter R, Senni M, Belohlavek J et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019;21:998-1007.
6. Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J 2020;41:255-323.
7. McMurray JJV, Solomon SD, Inzucchi SE. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995-2008.
8. Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020;382:1883-93.
9. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med 2018;379:2297-306.
10. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med 2018;379:2307-18.
11. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347-57.
12. Ruppar TM, Cooper PS, Mehr DR, Delgado JM, Dunbar-Jacob JM. Medication adherence interventions improve heart failure mortality and readmission rates: systematic review and meta-analysis of controlled trials. J Am Heart Assoc 2016;5:e002606.
2. McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993-1004.
3. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-200.
4. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med 2019;380:539-48.
5. Wachter R, Senni M, Belohlavek J et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019;21:998-1007.
6. Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J 2020;41:255-323.
7. McMurray JJV, Solomon SD, Inzucchi SE. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995-2008.
8. Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020;382:1883-93.
9. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med 2018;379:2297-306.
10. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med 2018;379:2307-18.
11. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347-57.
12. Ruppar TM, Cooper PS, Mehr DR, Delgado JM, Dunbar-Jacob JM. Medication adherence interventions improve heart failure mortality and readmission rates: systematic review and meta-analysis of controlled trials. J Am Heart Assoc 2016;5:e002606.