Les syndromes périodiques associés à des mutations du gène de la cryopyrine (cryopyrin-associated periodic syndromes [CAPS]) font partie des syndromes auto-inflammatoires héréditaires de transmission autosomique dominante. Les CAPS regroupent trois entités cliniques initialement décrites comme distinctes mais proches tant sur le plan phénotypique que génétique : il s’agit de l’urticaire familiale au froid (familial cold autoinflammatory syndrome [FCAS] ; code Mendelian inheritance in man [MIM] 120100), du syndrome de Muckle-Wells (Muckle-Wells syndrome [MWS] ; MIM 191100) et du syndrome chronique infantile neurologique cutané et articulaire (CINCA ; MIM 607115) ou encore NOMID (neonatal-onset multisystem inflammatory disease). La symptomatologie s’enrichit, depuis l’urticaire familiale au froid, forme la plus bénigne, jusqu’aux formes sévères de CINCA.
Ces pathologies sont également proches sur le plan génétique. Elles sont toutes autosomiques dominantes ou sporadiques, associées à des mutations du gène CIAS1/NLRP3. Ce gène code pour la cryopyrine/NLRP3, une protéine fortement exprimée dans les polynucléaires neutrophiles et les monocytes. Cette protéine joue un rôle central dans la régulation des voies de l’inflammation et la sécrétion des cytokines, en particulier l’interleukine 1β (IL-1β). L’identification du gène impliqué dans ce groupe de pathologies auto-inflammatoires systémiques permet des avancées importantes dans la compréhension des mécanismes physiopathologiques des CAPS mais également plus largement des maladies auto-inflammatoires, ce qui amène à proposer de nouvelles thérapeutiques.
Il s’agit de pathologies rares dont la prévalence en France est estimée à 1/360 000 habitants. Il n’y a pas de différence significative entre les hommes et les femmes.1
Ces pathologies sont également proches sur le plan génétique. Elles sont toutes autosomiques dominantes ou sporadiques, associées à des mutations du gène CIAS1/NLRP3. Ce gène code pour la cryopyrine/NLRP3, une protéine fortement exprimée dans les polynucléaires neutrophiles et les monocytes. Cette protéine joue un rôle central dans la régulation des voies de l’inflammation et la sécrétion des cytokines, en particulier l’interleukine 1β (IL-1β). L’identification du gène impliqué dans ce groupe de pathologies auto-inflammatoires systémiques permet des avancées importantes dans la compréhension des mécanismes physiopathologiques des CAPS mais également plus largement des maladies auto-inflammatoires, ce qui amène à proposer de nouvelles thérapeutiques.
Il s’agit de pathologies rares dont la prévalence en France est estimée à 1/360 000 habitants. Il n’y a pas de différence significative entre les hommes et les femmes.1
Caractéristiques cliniques des CAPS variables, signes cutanés constants
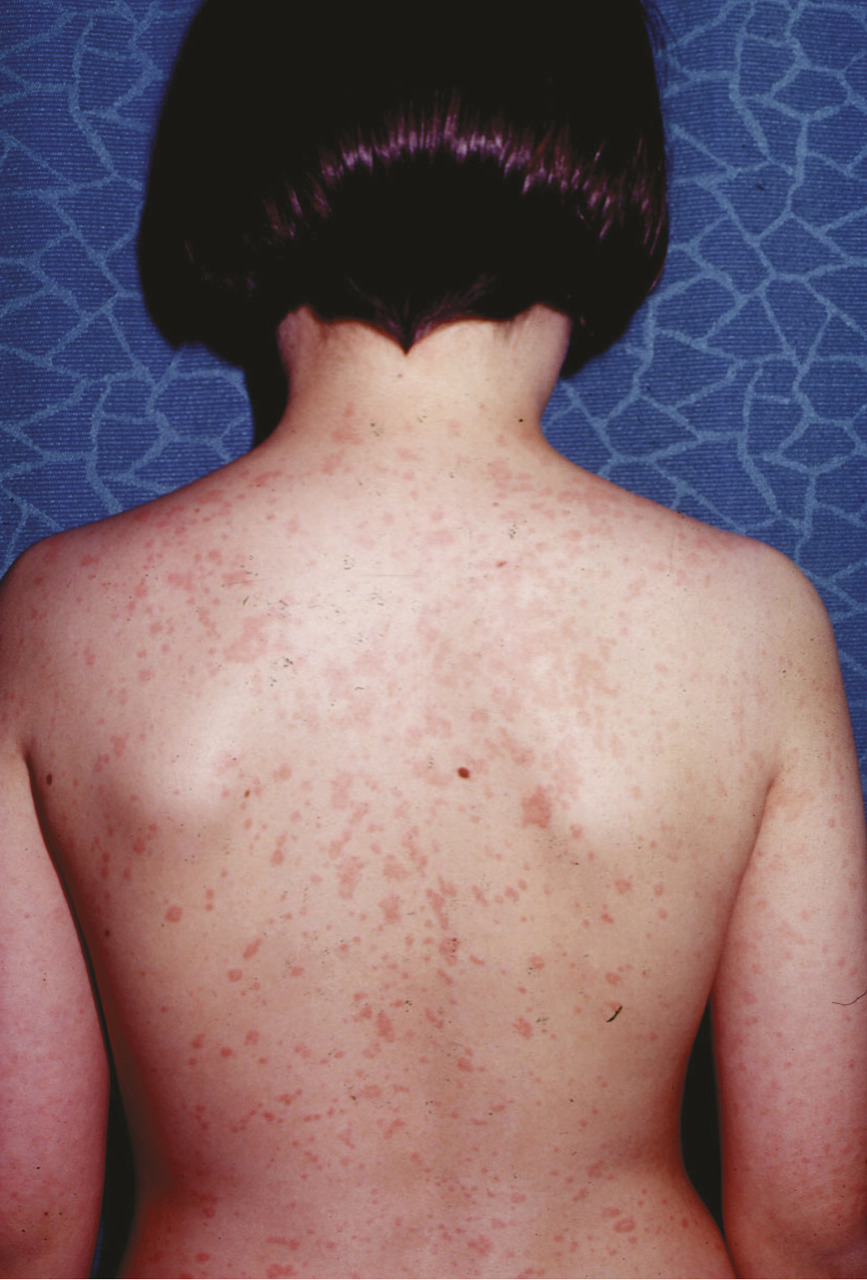
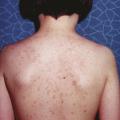
Les principales caractéristiques des FCAS, MWS et CINCA sont résumées dans le tableau .2-4 Le dénominateur commun est la présence d’un rash d’allure urticarienne, concomitant aux épisodes inflammatoires. Il s’agit d’une éruption maculo-papuleuse, migratrice, parfois confluente (fig. 1 ). L’histologie cutanée montre invariablement un infiltrat inflammatoire périvasculaire à polynucléaires neutrophiles.
Dans le FCAS, les poussées inflammatoires déclenchées par l’exposition au froid associent une éruption cutanée, une fièvre, une conjonctivite et des arthralgies.
Le MWS est la forme intermédiaire : il n’y a pas de facteur déclenchant précis aux épisodes de fièvre, les manifestations articulaires peuvent être plus marquées, avec développement d’arthrites inflammatoires transitoires ; des complications telles qu’une surdité et une amylose peuvent survenir.
Le syndrome CINCA représente le phénotype le plus sévère. Le tableau clinique se complète par l’atteinte du système nerveux central secondaire à une méningite chronique à polynucléaires. Dans un tiers des cas, la pathologie articulaire adopte une forme particulière, non inflammatoire, caractérisée par une hypertrophie métaphysaire des os longs, entraînant des arthropathies hypertrophiques invalidantes.
Dans le FCAS, les poussées inflammatoires déclenchées par l’exposition au froid associent une éruption cutanée, une fièvre, une conjonctivite et des arthralgies.
Le MWS est la forme intermédiaire : il n’y a pas de facteur déclenchant précis aux épisodes de fièvre, les manifestations articulaires peuvent être plus marquées, avec développement d’arthrites inflammatoires transitoires ; des complications telles qu’une surdité et une amylose peuvent survenir.
Le syndrome CINCA représente le phénotype le plus sévère. Le tableau clinique se complète par l’atteinte du système nerveux central secondaire à une méningite chronique à polynucléaires. Dans un tiers des cas, la pathologie articulaire adopte une forme particulière, non inflammatoire, caractérisée par une hypertrophie métaphysaire des os longs, entraînant des arthropathies hypertrophiques invalidantes.
Urticaire familiale au froid
L’urticaire familiale au froid a été décrite pour la première fois en 1940 par Kile et Rusk comme une pathologie autosomique dominante à début précoce, caractérisée par des épisodes récurrents de fièvre associée à un rash et des arthralgies, déclenchés par l’exposition au froid.
Les crises sont typiquement déclenchées par l’exposition généralisée au froid. Elles sont plus fréquentes en hiver qu’en été, sont souvent déclenchées par une exposition à l’air conditionné ou à une variation importante de température. À température égale, un taux d’humidité élevé de l’air ambiant augmente le risque de crise. Les patients décrivent souvent une corrélation entre la sévérité de la crise et l’intensité de l’exposition au froid. Le délai moyen entre l’exposition au froid et le début de la crise est de 2 heures 30, mais ce délai varie de 10 minutes à 8 heures.6
Ces accès inflammatoires associent à l’éruption cutanée et à la fièvre (souvent élevée, supérieure à 38,5 °C) des signes généraux (frissons, céphalées, fatigue), des manifestations articulaires et ophtalmologiques. Les manifestations articulaires sont très fréquentes et participent à l’inconfort de ces malades en période de crise (douleurs et raideur articulaires, myalgies). L’atteinte est le plus souvent symétrique et transitoire, concomitante aux manifestations extra-articulaires de l’épisode paroxystique. Il n’y a pas de complications érosives à long terme mais des déformations des articulations métacarpo-phalangiennes et interphalangiennes proximales peuvent s’observer à l’âge adulte. Les signes oculaires sont rapportés, selon les études, pour 40 à 80 % des patients. Il s’agit classiquement d’un érythème conjonctival parfois associé à un larmoiement, une douleur oculaire.
Survenue précoce et déclenchement par une exposition au froid
L’âge de survenue de la maladie est précoce, les premiers épisodes inflammatoires sont rapportés dès les premières semaines de vie, parfois même dès la naissance. Quelques cas à début plus tardif, dans l’enfance ou au début de l’âge adulte, sont rapportés. À titre indicatif, H. Hoffman et al. ont observé, parmi 45 patients (issus de 5 familles), un début avant l’âge de 6 mois chez 95 % des sujets (âge moyen de survenue : 47 jours ; variable de la naissance à 10 ans).5Les crises sont typiquement déclenchées par l’exposition généralisée au froid. Elles sont plus fréquentes en hiver qu’en été, sont souvent déclenchées par une exposition à l’air conditionné ou à une variation importante de température. À température égale, un taux d’humidité élevé de l’air ambiant augmente le risque de crise. Les patients décrivent souvent une corrélation entre la sévérité de la crise et l’intensité de l’exposition au froid. Le délai moyen entre l’exposition au froid et le début de la crise est de 2 heures 30, mais ce délai varie de 10 minutes à 8 heures.6
Accès inflammatoires en fin de journée
La symptomatologie est faite d’épisodes paroxystiques déclenchés par l’exposition au froid. Typiquement, les patients décrivent un cycle circadien : ils sont asymptomatiques en début de journée et les symptômes se déclenchent en fin de journée, en fonction de l’exposition aux facteurs déclenchants au cours de la journée.Ces accès inflammatoires associent à l’éruption cutanée et à la fièvre (souvent élevée, supérieure à 38,5 °C) des signes généraux (frissons, céphalées, fatigue), des manifestations articulaires et ophtalmologiques. Les manifestations articulaires sont très fréquentes et participent à l’inconfort de ces malades en période de crise (douleurs et raideur articulaires, myalgies). L’atteinte est le plus souvent symétrique et transitoire, concomitante aux manifestations extra-articulaires de l’épisode paroxystique. Il n’y a pas de complications érosives à long terme mais des déformations des articulations métacarpo-phalangiennes et interphalangiennes proximales peuvent s’observer à l’âge adulte. Les signes oculaires sont rapportés, selon les études, pour 40 à 80 % des patients. Il s’agit classiquement d’un érythème conjonctival parfois associé à un larmoiement, une douleur oculaire.
Répercussions sur la qualité de vie
Ces épisodes durent de quelques heures à 24 heures, exceptionnellement 48 à 72 heures. Ils sont spontanément résolutifs. Ces crises se répètent au gré de l’exposition aux facteurs déclenchants. Elles peuvent avoir tendance à s’espacer avec le temps, sont parfois moins fréquentes et moins sévères à l’âge adulte que dans l’enfance. Bien que le pronostic vital de cette affection soit bon, les crises inflammatoires répétées peuvent avoir des répercussions sur la qualité de vie et l’insertion professionnelle de ces patients. De très rares cas d’amylose tardive ont été rapportés.Signes biologiques pendant les crises
Les signes biologiques associent une hyperleucocytose neutrophile, qui précède et accompagne les symptômes cliniques, un syndrome inflammatoire, avec une augmentation modérée de la vitesse de sédimentation, de la protéine C-réactive (CRP) et de la protéine sérique amyloïde A (SAA). Ces signes disparaissent entre les crises.À différencier de l’urticaire au froid acquise
Il faut distinguer l’urticaire familiale au froid de l’urticaire au froid acquise. Dans cette dernière entité, l’histoire familiale est négative, les symptômes sont plus tardifs et débutent le plus souvent à l’âge adulte, les signes cutanés sont localisés aux zones exposées au froid, le délai entre l’exposition et l’urticaire est très court, de l’ordre de quelques minutes. Le test de provocation par exposition d’une petite surface cutanée à des cubes de glace déclenche l’apparition de lésions urticariennes localisées à la zone de contact. Ce test est négatif dans le FCAS.Syndrome de Muckle-Wells
Le syndrome de Muckle-Wells a été décrit pour la première fois par Thomas Muckle et Michael Wells en 1962 comme une affection autosomique dominante associant des épisodes récurrents de fièvre et une éruption urticarienne, se compliquant d’une surdité et d’une amylose rénale.
Il n’y a pas de facteur déclenchant très précis aux accès inflammatoires. Certains patients signalent une influence climatique, avec des crises plus fréquentes en saison hivernale, ou déclenchées par des changements de temps. Ce facteur est cependant moins marqué que dans le FCAS. Quelques patients rapportent des crises déclenchées par la chaleur. Le stress, la fatigue, les émotions et les vaccinations sont également décrits comme favorisant les crises.
Les manifestations articulaires peuvent être discrètes, à type d’arthralgies. Elles peuvent être plus sévères et constituer de véritables arthrites aiguës. Les poussées articulaires sont souvent moins fréquentes que les manifestations cutanées. L’atteinte peut être mono- ou polyarticulaire. Les articulations les plus fréquemment atteintes sont les genoux, les chevilles et les avant-pieds, les mains et les poignets. Ces poussées articulaires durent en moyenne de six à sept jours. Il n’apparaît pas de séquelle, les radiographies ne montrent pas d’altération ostéocartilagineuse.
Les manifestations oculaires sont variables : il peut exister le plus fréquemment des rougeurs conjonctivales, plus rarement une iridocyclite, une épisclérite, une kératite, une uvéite.
L’atteinte du système nerveux telle qu’on la retrouve dans le CINCA n’est classiquement pas décrite dans le syndrome de Muckle-Wells. Cependant, des céphalées et un discret retard mental sont signalés dans quelques cas. De même, quelques cas d’œdème papillaire et d’atrophie optique ont été rapportés, soulignant la continuité clinique entre le MWS et le CINCA.7
L’amylose est inconstante mais constitue la gravité de ce syndrome. Les dépôts de protéines SAA se retrouvent non seulement au niveau rénal mais aussi au niveau des glandes salivaires, de la thyroïde, des testicules. L’atteinte rénale se traduit par une protéinurie, une hypoalbuminémie, une insuffisance rénale progressive pouvant mettre en jeu le pronostic vital. Elle se déclare à l’âge adulte, rarement à l’adolescence, dix à quarante ans après les premiers symptômes de la maladie. Cette complication survient, selon les études, dans 10 à 50 % des cas, plus fréquemment en Europe qu’en Amérique du Nord.
Conséquence de l’inflammation chronique, un retard de croissance staturo-pondérale est parfois observé. Un hypogonadisme hypogonadotrope, de même qu’une oligozoospermie responsable d’une hypofertilité masculine ont été rapportés.8
Pas de facteur déclenchant précis
L’âge des premiers symptômes est précoce. Dans la littérature, la majorité des cas débutent dans l’enfance, à la naissance ou dans les premiers mois de vie ; quelques cas à début plus tardif sont signalés.Il n’y a pas de facteur déclenchant très précis aux accès inflammatoires. Certains patients signalent une influence climatique, avec des crises plus fréquentes en saison hivernale, ou déclenchées par des changements de temps. Ce facteur est cependant moins marqué que dans le FCAS. Quelques patients rapportent des crises déclenchées par la chaleur. Le stress, la fatigue, les émotions et les vaccinations sont également décrits comme favorisant les crises.
Symptomatologie très variable d’un patient à l’autre
Les accès inflammatoires sont moins typiques que dans le FCAS. Si l’éruption cutanée est constamment observée aux cours des poussées, elle est parfois isolée, parfois accompagnée de fièvre (intensité variable, parfois absente), de sensation de malaise (frissons, myalgies), de manifestations oculaires ou articulaires. La fréquence de ces différents symptômes est très variable d’un patient à l’autre. Ces signes cliniques peuvent être dissociés dans le temps. La symptomatologie peut s’enrichir avec l’âge, les manifestations articulaires ayant tendance à apparaître plus tardivement. Une surdité de perception, le plus souvent symétrique, se développe avec le temps chez la majorité des patients. Certains développent une amylose à l’âge adulte.Les manifestations articulaires peuvent être discrètes, à type d’arthralgies. Elles peuvent être plus sévères et constituer de véritables arthrites aiguës. Les poussées articulaires sont souvent moins fréquentes que les manifestations cutanées. L’atteinte peut être mono- ou polyarticulaire. Les articulations les plus fréquemment atteintes sont les genoux, les chevilles et les avant-pieds, les mains et les poignets. Ces poussées articulaires durent en moyenne de six à sept jours. Il n’apparaît pas de séquelle, les radiographies ne montrent pas d’altération ostéocartilagineuse.
Les manifestations oculaires sont variables : il peut exister le plus fréquemment des rougeurs conjonctivales, plus rarement une iridocyclite, une épisclérite, une kératite, une uvéite.
L’atteinte du système nerveux telle qu’on la retrouve dans le CINCA n’est classiquement pas décrite dans le syndrome de Muckle-Wells. Cependant, des céphalées et un discret retard mental sont signalés dans quelques cas. De même, quelques cas d’œdème papillaire et d’atrophie optique ont été rapportés, soulignant la continuité clinique entre le MWS et le CINCA.7
Syndrome inflammatoire biologique parfois persistant
Un syndrome inflammatoire avec hyperleucocytose neutrophile, accélération de la vitesse de sédimentation, augmentation de la CRP et de la SAA sont constamment constatés au cours des poussées inflammatoires. Ces anomalies biologiques peuvent persister entre les poussées. Une hypergammaglobulinémie polyclonale est fréquente. Tous les marqueurs biologiques d’auto-immunité sont négatifs.Complications sur le long terme
La surdité de perception est le plus souvent symétrique, d’aggravation progressive. Elle débute en général dans l’enfance ou à l’adolescence, plus rarement à l’âge adulte. Elle est très fréquente et se retrouve chez 70 à 85 % des patients selon les études. La cause de cette surdité n’est pas encore complètement élucidée. Muckle et Wells ont décrit, à l’autopsie de deux malades souffrant de surdité de perception, une absence d’organe de Corti et d’épithélium vestibulaire sensoriel, une atrophie du nerf cochléaire et une ossification de la membrane basale. Des données plus récentes d’imagerie cérébrale par résonance magnétique nucléaire montrant une prise de contraste au niveau de la cochlée ainsi que la sensibilité partielle de cette surdité aux nouvelles modalités thérapeutiques anti-inflammatoires suggèrent une origine inflammatoire.L’amylose est inconstante mais constitue la gravité de ce syndrome. Les dépôts de protéines SAA se retrouvent non seulement au niveau rénal mais aussi au niveau des glandes salivaires, de la thyroïde, des testicules. L’atteinte rénale se traduit par une protéinurie, une hypoalbuminémie, une insuffisance rénale progressive pouvant mettre en jeu le pronostic vital. Elle se déclare à l’âge adulte, rarement à l’adolescence, dix à quarante ans après les premiers symptômes de la maladie. Cette complication survient, selon les études, dans 10 à 50 % des cas, plus fréquemment en Europe qu’en Amérique du Nord.
Conséquence de l’inflammation chronique, un retard de croissance staturo-pondérale est parfois observé. Un hypogonadisme hypogonadotrope, de même qu’une oligozoospermie responsable d’une hypofertilité masculine ont été rapportés.8
Syndrome chronique infantile neurologique cutané articulaire
Le CINCA a été décrit pour la première fois comme une entité distincte en 1980 par Anne-Marie Prieur.
Ce syndrome associe une triade de signes cliniques : éruption cutanée précoce, présente souvent dès la naissance, atteinte du système nerveux central, avec une méningite chronique à polynucléaires, et atteinte articulaire. Ce syndrome est également connu sous le terme NOMID (neonatal-onset multisystemic inflammatory disease) dans la littérature nord-américaine.
Depuis cette description initiale, une centaine de cas ont été rapportés dans la littérature, la majorité sont sporadiques, mais il existe quelques formes familiales de transmission autosomique dominante.
Le CINCA est une affection inflammatoire plus chronique que périodique, qui évolue par poussées irrégulières sans régresser totalement entre les accès.
Dans deux tiers des cas, les premiers symptômes se manifestent dès la naissance. Les nouveau-nés peuvent avoir, outre l’éruption cutanée typique, un aspect pseudo-septique sans qu’aucun germe ne soit retrouvé, de la fièvre, un syndrome inflammatoire biologique et d’emblée une méningite à polynucléaires. Prématurité et/ou dysmaturité sont possibles.
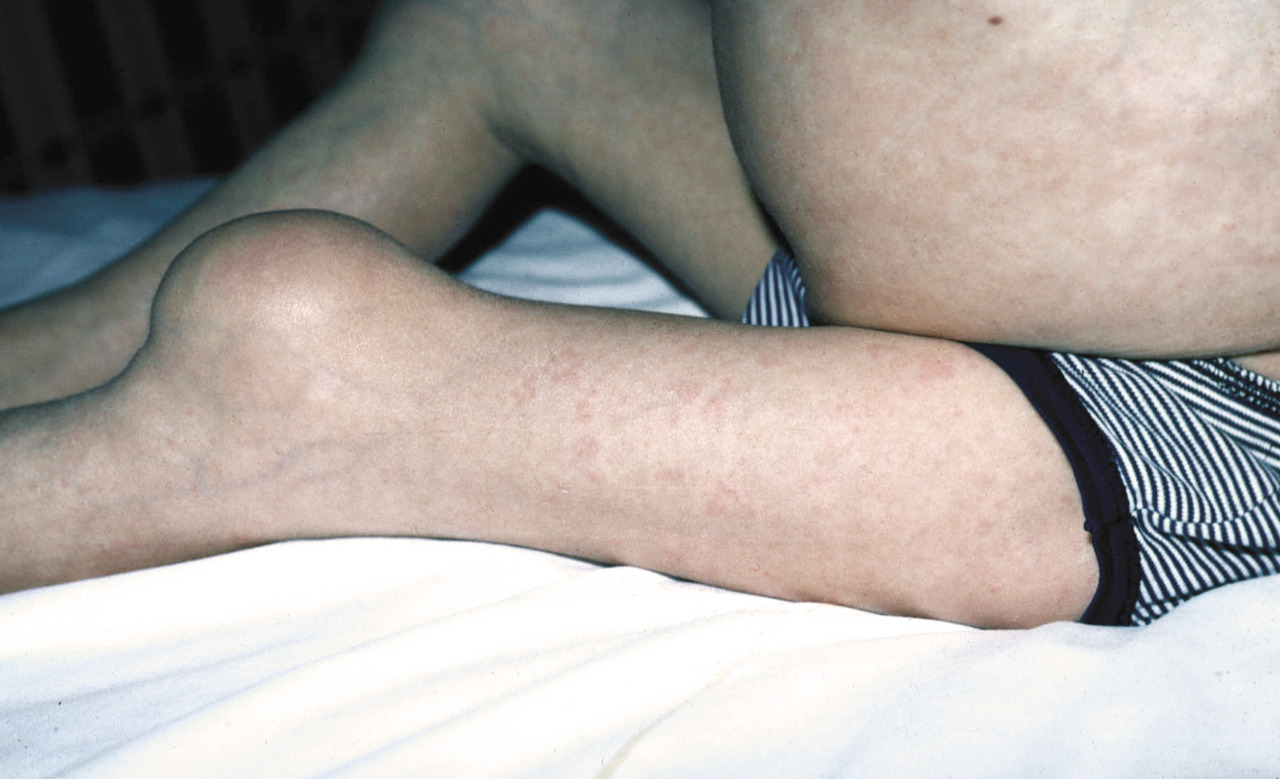
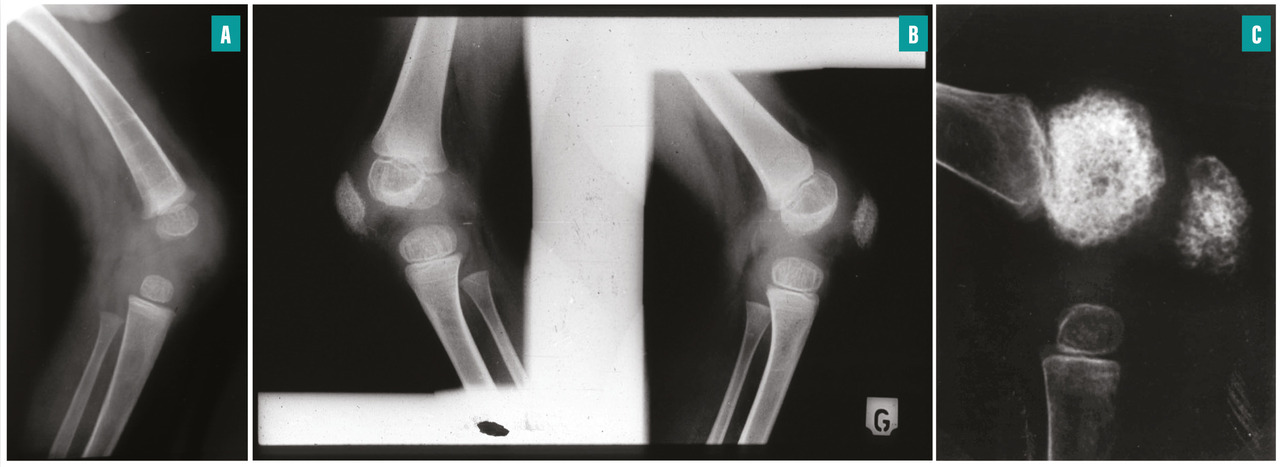
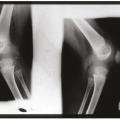
fig. 2 ). Cette atteinte articulaire est d’autant plus sévère et invalidante qu’elle débute précocement. Elle s’accompagne de contractures, d’impotence fonctionnelle et parfois d’intenses douleurs. Cette hypertrophie est secondaire à des remaniements épiphysaires et métaphysaires des os longs et à une hypertrophie des cartilages de croissance. Une hypertrophie caractéristique de la rotule est fréquente. Radiologiquement, les métaphyses sont élargies et irrégulières, en forme de cupule. Les épiphyses sont élargies et irrégulières, elles peuvent prendre un aspect « grotesque », en « mie de pain ». Les noyaux d’ossification de la rotule apparaissent précocement et ont un aspect inhomogène (fig. 3 ). Une ostéoporose modérée est fréquente.
L’imagerie cérébrale par tomodensitométrie peut être anormale et montrer des calcifications de la faux du cerveau et de la dure-mère, une atrophie cérébrale, une dilatation des ventricules cérébraux. L’imagerie par résonance magnétique (IRM) cérébrale peut montrer une prise de contraste leptoméningée et de la cochlée et en séquence FLAIR des hypersignaux périventriculaires.9,10 La ponction lombaire révèle une augmentation de la pression d’ouverture en rapport avec l’hypertension intracrânienne, une cellularité variable, parfois très modeste, à prédominance de polynucléaires et une augmentation inconstante de la protéinorachie. Les anomalies de la ponction lombaire peuvent précéder les signes cliniques neurologiques.
Un aspect dysmorphique est fréquemment retrouvé, avec une macrocrânie, des bosses frontales proéminentes, un retard de fermeture de la fontanelle.
Une surdité de perception bilatérale et progressive s’installe fréquemment dans l’enfance ou à l’adolescence. Comme dans le syndrome de Muckle-Wells, une amylose peut se développer avec le temps, à l’adolescence ou à l’âge adulte.
Un retard de croissance staturo-pondérale progressif et un retard de développement pubertaire sont fréquents, secondaires à l’inflammation chronique.
Il existe une grande variabilité en matière de sévérité au sein de ce syndrome. Certains patients développent le tableau clinique pathognomonique complet, avec un début précoce, une prématurité et/ou une dysmaturité, un retard de croissance, une macrocrânie et une dysmorphie, une atteinte du système nerveux central et des arthropathies à début précoce au cours des deux premières années de vie. La qualité de vie de ces malades est souvent médiocre et le pronostic fonctionnel réservé du fait des rétractions tendineuses secondaires aux arthropathies.
Certains patients présentent un tableau neurologique sévère et une expression articulaire pauvre, d’autres sont paucisymptomatiques sur le plan neurologique mais ont une arthropathie précoce et invalidante. Enfin, certains patients ont une expression articulaire modérée, des arthralgies ou des arthrites et une atteinte du système nerveux central fruste, d’apparition tardive et peu ou non parlante sur le plan clinique. Ce sous-groupe est souvent difficile à distinguer du MWS.
Ce syndrome associe une triade de signes cliniques : éruption cutanée précoce, présente souvent dès la naissance, atteinte du système nerveux central, avec une méningite chronique à polynucléaires, et atteinte articulaire. Ce syndrome est également connu sous le terme NOMID (neonatal-onset multisystemic inflammatory disease) dans la littérature nord-américaine.
Depuis cette description initiale, une centaine de cas ont été rapportés dans la littérature, la majorité sont sporadiques, mais il existe quelques formes familiales de transmission autosomique dominante.
Le CINCA est une affection inflammatoire plus chronique que périodique, qui évolue par poussées irrégulières sans régresser totalement entre les accès.
Dans deux tiers des cas, les premiers symptômes se manifestent dès la naissance. Les nouveau-nés peuvent avoir, outre l’éruption cutanée typique, un aspect pseudo-septique sans qu’aucun germe ne soit retrouvé, de la fièvre, un syndrome inflammatoire biologique et d’emblée une méningite à polynucléaires. Prématurité et/ou dysmaturité sont possibles.
Éruption cutanée précoce
L’éruption cutanée est présente chez tous les patients. C’est souvent le premier symptôme. Cette éruption est d’intensité variable, elle peut survenir en poussées ou être permanente. La fièvre est inconstante. Certains patients présentent de brèves poussées fébriles, d’autres un état subfébrile permanent. La fièvre peut cependant être absente.Atteinte articulaire
Les atteintes articulaires sont d’expression très variable. Certains malades se plaignent d’arthralgies pouvant s’accompagner d’un gonflement articulaire transitoire. Elles touchent en priorité les grosses articulations telles que les genoux, les chevilles, les coudes, les poignets mais peuvent aussi concerner les extrémités telles que les mains et les pieds. Ces atteintes sont le plus souvent symétriques. Elles n’évoluent vers aucune modification ostéoarticulaire. Dans un tiers des cas, une arthropathie apparaît et se caractérise par une hypertrophie symétrique des grosses articulations, en particulier des genoux, des chevilles, des poignets et des coudes (Atteinte du système nerveux central
L’atteinte du système nerveux central est propre au CINCA et est le reflet d’une méningite chronique à polynucléaires. Les signes cliniques, en rapport avec une hypertension intracrânienne, sont des céphalées, souvent matinales, parfois des vomissements, un œdème papillaire au fond d’œil. Dans les formes sévères, un retard mental et de développement est possible. Une épilepsie peut compliquer l’évolution. Des accidents vasculaires cérébraux ont été décrits. Un retard de fermeture de la fontanelle, parfois de plusieurs années, est possible. L’âge de survenue des signes neurologiques est variable, au cours de la première année de vie dans les formes sévères, dans l’enfance ou à l’adolescence dans les formes plus modérées. Les symptômes peuvent être frustes.L’imagerie cérébrale par tomodensitométrie peut être anormale et montrer des calcifications de la faux du cerveau et de la dure-mère, une atrophie cérébrale, une dilatation des ventricules cérébraux. L’imagerie par résonance magnétique (IRM) cérébrale peut montrer une prise de contraste leptoméningée et de la cochlée et en séquence FLAIR des hypersignaux périventriculaires.9,10 La ponction lombaire révèle une augmentation de la pression d’ouverture en rapport avec l’hypertension intracrânienne, une cellularité variable, parfois très modeste, à prédominance de polynucléaires et une augmentation inconstante de la protéinorachie. Les anomalies de la ponction lombaire peuvent précéder les signes cliniques neurologiques.
Un aspect dysmorphique est fréquemment retrouvé, avec une macrocrânie, des bosses frontales proéminentes, un retard de fermeture de la fontanelle.
Autres atteintes
L’atteinte ophtalmologique est polymorphe : une kératite peut survenir, la chambre antérieure peut être le siège d’une uvéite chronique, mais les anomalies du disque optique sont les plus fréquentes. Un œdème papillaire est constamment décrit en cas de méningite chronique à polynucléaires, une atrophie optique et une baisse secondaire de l’acuité visuelle est présente dans les formes sévères, ce qui, à terme, peut mener à une cécité.Une surdité de perception bilatérale et progressive s’installe fréquemment dans l’enfance ou à l’adolescence. Comme dans le syndrome de Muckle-Wells, une amylose peut se développer avec le temps, à l’adolescence ou à l’âge adulte.
Un retard de croissance staturo-pondérale progressif et un retard de développement pubertaire sont fréquents, secondaires à l’inflammation chronique.
Il existe une grande variabilité en matière de sévérité au sein de ce syndrome. Certains patients développent le tableau clinique pathognomonique complet, avec un début précoce, une prématurité et/ou une dysmaturité, un retard de croissance, une macrocrânie et une dysmorphie, une atteinte du système nerveux central et des arthropathies à début précoce au cours des deux premières années de vie. La qualité de vie de ces malades est souvent médiocre et le pronostic fonctionnel réservé du fait des rétractions tendineuses secondaires aux arthropathies.
Certains patients présentent un tableau neurologique sévère et une expression articulaire pauvre, d’autres sont paucisymptomatiques sur le plan neurologique mais ont une arthropathie précoce et invalidante. Enfin, certains patients ont une expression articulaire modérée, des arthralgies ou des arthrites et une atteinte du système nerveux central fruste, d’apparition tardive et peu ou non parlante sur le plan clinique. Ce sous-groupe est souvent difficile à distinguer du MWS.
Inflammation biologique non spécifique
Les signes biologiques montrent une inflammation non spécifique, avec une vitesse de sédimentation (VS) accélérée, une augmentation de la CRP et de la SAA, une hyperleucocytose neutrophile, une anémie inflammatoire. Dans les formes sévères, ces signes biologiques sont permanents.Continuum de sévérité
Il existe clairement un continuum de sévérité parmi les CAPS, entre l’urticaire familiale au froid, la forme la plus bénigne et les formes extrêmes de CINCA (tableau ). Certains malades se trouvent à la frontière entre deux syndromes contigus et sont donc difficiles à catégoriser. Certains patients avec un syndrome de Muckle-Wells décrivent des facteurs déclenchants aux accès inflammatoires qui rappellent l’urticaire familiale au froid. La présence d’un œdème papillaire et d’un retard mental ont également été rapportés chez quelques malades « Muckle-Wells ».7 La symptomatologie peut s’enrichir avec le temps, une atteinte du système nerveux central fruste au départ peut devenir plus manifeste et nécessiter de réviser le diagnostic.
Plus de cent mutations génétiques identifiées
Le FCAS et le MWS se transmettent selon un mode autosomique dominant bien que des formes sporadiques soient également décrites. Le CINCA est principalement une maladie sporadique, mais quelques cas de formes familiales autosomiques dominantes ont été décrits.
En 2001, Hal Hoffman a identifié, par clonage positionnel, le gène responsable de l’urticaire familiale au froid et du syndrome de Muckle-Wells.11 Ce gène initialement connu sous le terme CIAS1 est plus communément appelé NLRP3 (nucleotide-binding oligomerization domain, leucine-rich repeat family, pyrin domain-containing protein 3). Secondairement, des mutations de ce même gène ont été identifiées dans le CINCA du fait de l’analogie clinique entre ces différents syndromes.12
Le gène CIAS1 est localisé sur le chromosome 1 en 1q44. Il est constitué de neuf exons et code pour une protéine, la cryopyrine, encore appelée NLRP3, NALP3 (NACHT-, LRR- and PYD domains-containing protein 3)13 ou encore PYPAF1. Cette protéine intracellulaire est fortement exprimée dans les monocytes et les polynucléaires.
À ce jour, plus de cent mutations ont été identifiées dans le FCAS, le MWS et le CINCA. Ces mutations sont répertoriées sur le site http://fmf.igh.cnrs.fr/ISSAID/infevers/. Elles sont très majoritairement de type faux-sens. La grande majorité est localisée dans l’exon 3 qui code pour le domaine NBS central, à l’exception de rares mutations localisées dans les exons 4 et 6 codant pour le domaine riche en leucine. L’étude de ces mutations semble montrer un certain degré de corrélation génotype-phénotype sans que l’on puisse exclure des facteurs externes ou génétiques influençant le phénotype clinique.14,15 Chez 30 à 40 % des patients CINCA et chez quelques rares patients MWS, on ne retrouve pas de mutation germinale de NLRP3, et 70 % de ces patients portent une mutation somatique de NLRP3, responsable du phénotype clinique.16
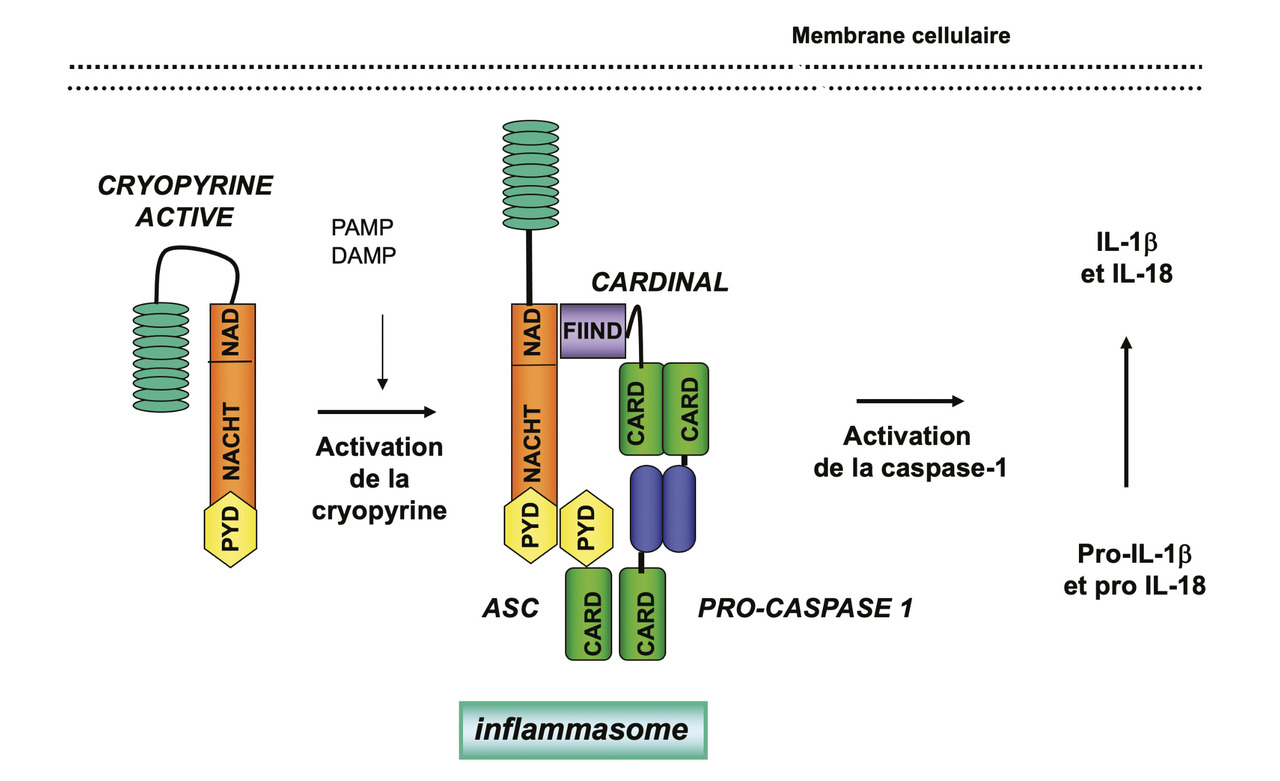
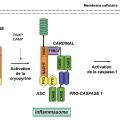
La cryopyrine/NALP3 interagit avec plusieurs protéines (ASC, caspase 1 et Cardinal) pour former un macrocomplexe protéique, appelé inflammasome.17,18 Cette plateforme moléculaire active la caspase 1, elle-même responsable de la transformation du pro-IL-1β en IL-1β, cytokine pro-inflammatoire. À l’état de base, la cryopyrine est auto-inhibée. À la suite de l’interaction entre le domaine riche en leucine et son ligand, la cryopyrine est activée, ce qui lui permet d’interagir avec ses partenaires, l’ASC, la pro-caspase 1 et Cardinal, pour former l’inflammasome. Le domaine pyrine de la cryopyrine interagit avec le domaine pyrine de l’ASC, petite protéine adaptatrice constituée d’un domaine pyrine et d’un domaine CARD. C’est par ce dernier que l’ASC interagit avec le domaine CARD de la caspase 1 (fig. 4 ).
La cryopyrine joue le rôle de détecteur (« sensor ») intracellulaire de stress ou de danger. NLRP3 peut être activé par différents PAMPS (pathogen-associated molecular patterns) tels que le muramyldipeptide (constituant de la paroi bactérienne de la plupart des bactéries à Gram + et Gram -) ou encore l’ARN bactérien ou viral. Ce rôle peut également être joué par des molécules de danger (danger-associated molecular patterns) comme l’ATP, les cristaux d’urate monosodique (responsables de la goutte) ou encore le glucose ou la substance bêta-amyloïde soit directement, soit via un médiateur intracellulaire commun.19 La compréhension du rôle central de l’inflammasome de NLRP3 dans la production de la forme active de l’IL-1β et son mode d’activation apporte ainsi un éclairage nouveau sur la physiopathologie de maladies aussi fréquentes que la goutte, le diabète ou la maladie d’Alzheimer.
Les mutations faux-sens identifiées dans les CAPS confèrent un gain de fonction à la cryopyrine, il en résulte une augmentation de l’activité de l’inflammasome et une augmentation de la production d’IL-1β.19 On retrouve d’ailleurs un taux anormalement élevé d’IL-1β dans le sérum de malades atteints de CAPS.
En 2001, Hal Hoffman a identifié, par clonage positionnel, le gène responsable de l’urticaire familiale au froid et du syndrome de Muckle-Wells.11 Ce gène initialement connu sous le terme CIAS1 est plus communément appelé NLRP3 (nucleotide-binding oligomerization domain, leucine-rich repeat family, pyrin domain-containing protein 3). Secondairement, des mutations de ce même gène ont été identifiées dans le CINCA du fait de l’analogie clinique entre ces différents syndromes.12
Le gène CIAS1 est localisé sur le chromosome 1 en 1q44. Il est constitué de neuf exons et code pour une protéine, la cryopyrine, encore appelée NLRP3, NALP3 (NACHT-, LRR- and PYD domains-containing protein 3)13 ou encore PYPAF1. Cette protéine intracellulaire est fortement exprimée dans les monocytes et les polynucléaires.
À ce jour, plus de cent mutations ont été identifiées dans le FCAS, le MWS et le CINCA. Ces mutations sont répertoriées sur le site http://fmf.igh.cnrs.fr/ISSAID/infevers/. Elles sont très majoritairement de type faux-sens. La grande majorité est localisée dans l’exon 3 qui code pour le domaine NBS central, à l’exception de rares mutations localisées dans les exons 4 et 6 codant pour le domaine riche en leucine. L’étude de ces mutations semble montrer un certain degré de corrélation génotype-phénotype sans que l’on puisse exclure des facteurs externes ou génétiques influençant le phénotype clinique.14,15 Chez 30 à 40 % des patients CINCA et chez quelques rares patients MWS, on ne retrouve pas de mutation germinale de NLRP3, et 70 % de ces patients portent une mutation somatique de NLRP3, responsable du phénotype clinique.16
La cryopyrine/NALP3 interagit avec plusieurs protéines (ASC, caspase 1 et Cardinal) pour former un macrocomplexe protéique, appelé inflammasome.17,18 Cette plateforme moléculaire active la caspase 1, elle-même responsable de la transformation du pro-IL-1β en IL-1β, cytokine pro-inflammatoire. À l’état de base, la cryopyrine est auto-inhibée. À la suite de l’interaction entre le domaine riche en leucine et son ligand, la cryopyrine est activée, ce qui lui permet d’interagir avec ses partenaires, l’ASC, la pro-caspase 1 et Cardinal, pour former l’inflammasome. Le domaine pyrine de la cryopyrine interagit avec le domaine pyrine de l’ASC, petite protéine adaptatrice constituée d’un domaine pyrine et d’un domaine CARD. C’est par ce dernier que l’ASC interagit avec le domaine CARD de la caspase 1 (
La cryopyrine joue le rôle de détecteur (« sensor ») intracellulaire de stress ou de danger. NLRP3 peut être activé par différents PAMPS (pathogen-associated molecular patterns) tels que le muramyldipeptide (constituant de la paroi bactérienne de la plupart des bactéries à Gram + et Gram -) ou encore l’ARN bactérien ou viral. Ce rôle peut également être joué par des molécules de danger (danger-associated molecular patterns) comme l’ATP, les cristaux d’urate monosodique (responsables de la goutte) ou encore le glucose ou la substance bêta-amyloïde soit directement, soit via un médiateur intracellulaire commun.19 La compréhension du rôle central de l’inflammasome de NLRP3 dans la production de la forme active de l’IL-1β et son mode d’activation apporte ainsi un éclairage nouveau sur la physiopathologie de maladies aussi fréquentes que la goutte, le diabète ou la maladie d’Alzheimer.
Les mutations faux-sens identifiées dans les CAPS confèrent un gain de fonction à la cryopyrine, il en résulte une augmentation de l’activité de l’inflammasome et une augmentation de la production d’IL-1β.19 On retrouve d’ailleurs un taux anormalement élevé d’IL-1β dans le sérum de malades atteints de CAPS.
Trois nouvelles molécules pour un traitement ciblé sur l’interleukine 1
Les objectifs thérapeutiques dans ce contexte de maladies auto-inflammatoires sont de réduire les accès inflammatoires et d’empêcher les complications à long terme en rapport avec l’inflammation chronique telles que l’amylose, la surdité, ou encore l’atteinte du système nerveux central dans le CINCA.
Ces traitements doivent par ailleurs avoir une faible toxicité, de manière à pouvoir être utilisés de façon prolongée.
Les efforts menés ces dernières années pour comprendre les bases génétiques et immunologiques des CAPS, démontrant le rôle central de l’IL-1β dans les manifestations inflammatoires de ces patients, ont abouti à l’utilisation de nouvelles thérapeutiques ciblées transformant radicalement la vie et le pronostic de ces malades, offrant par ailleurs un bel exemple de recherche translationnelle.
Trois molécules sont disponibles et permettent de cibler spécifiquement l’IL-1 :
– l’anakinra, forme recombinante du récepteur antagoniste de l’IL-1, a été le premier utilisé dans les CAPS, il a une demi-vie courte, ce qui nécessite des injections sous-cutanées quotidiennes ;
– le rilonacept correspond à une forme recombinante du récepteur à l’IL-1, sa demi-vie de huit jours permet une injection hebdomadaire ;
– le canakinumab est un anticorps monoclonal anti-IL-1. Sa demi-vie est de trois semaines, permettant une injection toutes les quatre à huit semaines.
Ces trois molécules ont une efficacité remarquable dans ces pathologies. Des recommandations concernant la prise en charge des cryopyrinopathies ont été publiées dans un protocole national de soin (PNDS).20
Ces traitements doivent par ailleurs avoir une faible toxicité, de manière à pouvoir être utilisés de façon prolongée.
Les efforts menés ces dernières années pour comprendre les bases génétiques et immunologiques des CAPS, démontrant le rôle central de l’IL-1β dans les manifestations inflammatoires de ces patients, ont abouti à l’utilisation de nouvelles thérapeutiques ciblées transformant radicalement la vie et le pronostic de ces malades, offrant par ailleurs un bel exemple de recherche translationnelle.
Trois molécules sont disponibles et permettent de cibler spécifiquement l’IL-1 :
– l’anakinra, forme recombinante du récepteur antagoniste de l’IL-1, a été le premier utilisé dans les CAPS, il a une demi-vie courte, ce qui nécessite des injections sous-cutanées quotidiennes ;
– le rilonacept correspond à une forme recombinante du récepteur à l’IL-1, sa demi-vie de huit jours permet une injection hebdomadaire ;
– le canakinumab est un anticorps monoclonal anti-IL-1. Sa demi-vie est de trois semaines, permettant une injection toutes les quatre à huit semaines.
Ces trois molécules ont une efficacité remarquable dans ces pathologies. Des recommandations concernant la prise en charge des cryopyrinopathies ont été publiées dans un protocole national de soin (PNDS).20
De la compréhension de la physiopathologie aux traitements ciblés
Les efforts menés ces dix dernières années pour comprendre la physiopathologie des maladies auto-inflammatoires et des CAPS ont permis de proposer de nouveaux traitements, ciblés, apportant un bénéfice thérapeutique considérable à ces malades.
L’étude physiopathologique des CAPS offre un très bel exemple de recherche translationnelle.
L’étude physiopathologique des CAPS offre un très bel exemple de recherche translationnelle.
Références
1. Cuisset L, Jeru I, Dumont B, Fabre A, Cochet E, Le Bozec J, et al. Mutations in the autoinflammatory cryopyrin-associated periodic syndrome gene: Epidemiological study and lessons from eight years of genetic analysis in France. Ann Rheum Dis 2011;70(3):495-9.
2. Goldbach-Mansky R. Current status of understanding the pathogenesis and management of patients with NOMID/CINCA. Curr Rheumatol Rep 2011;13(2):123-31.
3. Neven B, Prieur AM, Quartier dit Maire P. Cryopyrinopathies: Update on pathogenesis and treatment. Nat Clin Pract Rheumatol 2008;4(9):481-9.
4. Shinkai K, McCalmont TH, Leslie KS. Cryopyrin-associated periodic syndromes and autoinflammation. Clin Exp Dermatol 2008;33(1):1-9.
5. Hoffman HM, Wanderer AA, Broide DH. Familial cold autoinflammatory syndrome: Phenotype and genotype of an autosomal dominant periodic fever. J Allergy Clin Immunol 2001;108(4):615-20.
6. Wanderer AA, Hoffman HM. The spectrum of acquired and familial cold-induced urticaria/urticaria-like syndromes. Immunol Allergy Clin North Am 2004;24(2):259-86, vii.
7. Hawkins PN, Lachmann HJ, Aganna E, McDermott MF. Spectrum of clinical features in Muckle-Wells syndrome and response to anakinra. Arthritis Rheum 2004;50(2):607-12.
8. Tran TA, Kone-Paut I, Marie I, Ninet J, Cuisset L, Meinzer U. Muckle-Wells syndrome and male hypofertility: A case series. Semin Arthritis Rheum 2012;42(3):327-31.
9. Goldbach-Mansky R, Dailey NJ, Canna SW, Gelabert A, Jones J, Rubin BI, et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1beta inhibition. N Engl J Med 2006;355(6):581-92.
10. Neven B, Marvillet I, Terrada C, Ferster A, Boddaert N, Couloignier V, et al. Long-term efficacy of the interleukin-1 receptor antagonist anakinra in ten patients with neonatal-onset multisystem inflammatory disease/chronic infantile neurologic, cutaneous, articular syndrome. Arthritis Rheum 2010;62(1):258-67.
11. Hoffman HM, Mueller JL, Broide DH, Wanderer AA, Kolodner RD. Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet 2001;29(3):301-5.
12. Feldmann J, Prieur AM, Quartier P, Berquin P, Certain S, Cortis E, et al. Chronic infantile neurological cutaneous and articular syndrome is caused by mutations in CIAS1, a gene highly expressed in polymorphonuclear cells and chondrocytes. Am J Hum Genet 2002;71(1):198-203.
13. Aganna E, Martinon F, Hawkins PN, Ross JB, Swan DC, Booth DR, et al. Association of mutations in the NALP3/CIAS1/PYPAF1 gene with a broad phenotype including recurrent fever, cold sensitivity, sensorineural deafness, and AA amyloidosis. Arthritis Rheum 2002;46(9):2445-52.
14. Neven B, Callebaut I, Prieur AM, Feldmann J, Bodemer C, Lepore L, et al. Molecular basis of the spectral expression of CIAS1 mutations associated with phagocytic cell-mediated autoinflammatory disorders CINCA/NOMID, MWS, and FCU. Blood 2004;103(7):2809-15.
15. Aksentijevich I, Putnam CD, Remmers EF, Mueller JL, Le J, Kolodner RD, et al. The clinical continuum of cryopyrinopathies: Novel CIAS1 mutations in North American patients and a new cryopyrin model. Arthritis Rheum 2007;56(4):1273-85.
16. Tanaka N, Izawa K, Saito MK, Sakuma M, Oshima K, Ohara O, et al. High incidence of NLRP3 somatic mosaicism in patients with chronic infantile neurologic, cutaneous, articular syndrome: Results of an international multicenter collaborative study. Arthritis Rheum 2011;63(11):3625-32.
17. Martinon F, Agostini L, Meylan E, Tschopp J. Identification of bacterial muramyl dipeptide as activator of the NALP3/cryopyrin inflammasome. Curr Biol 2004;14(21):1929-34.
18. Gross O, Thomas CJ, Guarda G, Tschopp J. The inflammasome: An integrated view. Immunol Rev 2011;243(1):136-51.
19. Romano M, Arici ZS, Piskin D, Alehashemi S, Aletaha D, Barron KS, et al. The 2021 EULAR/American College of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin-1 mediated autoinflammatory diseases: Cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Ann Rheum Dis 2022;81:907-21.
20. Protocole national de diagnostic et de soins (PNDS). Fièvres récurrentes héréditaires-Syndromes périodiques associés à la cryopyrine (CAPS). Haute Autorité de santé. Janvier 2013. https://vu.fr/qiHy
2. Goldbach-Mansky R. Current status of understanding the pathogenesis and management of patients with NOMID/CINCA. Curr Rheumatol Rep 2011;13(2):123-31.
3. Neven B, Prieur AM, Quartier dit Maire P. Cryopyrinopathies: Update on pathogenesis and treatment. Nat Clin Pract Rheumatol 2008;4(9):481-9.
4. Shinkai K, McCalmont TH, Leslie KS. Cryopyrin-associated periodic syndromes and autoinflammation. Clin Exp Dermatol 2008;33(1):1-9.
5. Hoffman HM, Wanderer AA, Broide DH. Familial cold autoinflammatory syndrome: Phenotype and genotype of an autosomal dominant periodic fever. J Allergy Clin Immunol 2001;108(4):615-20.
6. Wanderer AA, Hoffman HM. The spectrum of acquired and familial cold-induced urticaria/urticaria-like syndromes. Immunol Allergy Clin North Am 2004;24(2):259-86, vii.
7. Hawkins PN, Lachmann HJ, Aganna E, McDermott MF. Spectrum of clinical features in Muckle-Wells syndrome and response to anakinra. Arthritis Rheum 2004;50(2):607-12.
8. Tran TA, Kone-Paut I, Marie I, Ninet J, Cuisset L, Meinzer U. Muckle-Wells syndrome and male hypofertility: A case series. Semin Arthritis Rheum 2012;42(3):327-31.
9. Goldbach-Mansky R, Dailey NJ, Canna SW, Gelabert A, Jones J, Rubin BI, et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1beta inhibition. N Engl J Med 2006;355(6):581-92.
10. Neven B, Marvillet I, Terrada C, Ferster A, Boddaert N, Couloignier V, et al. Long-term efficacy of the interleukin-1 receptor antagonist anakinra in ten patients with neonatal-onset multisystem inflammatory disease/chronic infantile neurologic, cutaneous, articular syndrome. Arthritis Rheum 2010;62(1):258-67.
11. Hoffman HM, Mueller JL, Broide DH, Wanderer AA, Kolodner RD. Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet 2001;29(3):301-5.
12. Feldmann J, Prieur AM, Quartier P, Berquin P, Certain S, Cortis E, et al. Chronic infantile neurological cutaneous and articular syndrome is caused by mutations in CIAS1, a gene highly expressed in polymorphonuclear cells and chondrocytes. Am J Hum Genet 2002;71(1):198-203.
13. Aganna E, Martinon F, Hawkins PN, Ross JB, Swan DC, Booth DR, et al. Association of mutations in the NALP3/CIAS1/PYPAF1 gene with a broad phenotype including recurrent fever, cold sensitivity, sensorineural deafness, and AA amyloidosis. Arthritis Rheum 2002;46(9):2445-52.
14. Neven B, Callebaut I, Prieur AM, Feldmann J, Bodemer C, Lepore L, et al. Molecular basis of the spectral expression of CIAS1 mutations associated with phagocytic cell-mediated autoinflammatory disorders CINCA/NOMID, MWS, and FCU. Blood 2004;103(7):2809-15.
15. Aksentijevich I, Putnam CD, Remmers EF, Mueller JL, Le J, Kolodner RD, et al. The clinical continuum of cryopyrinopathies: Novel CIAS1 mutations in North American patients and a new cryopyrin model. Arthritis Rheum 2007;56(4):1273-85.
16. Tanaka N, Izawa K, Saito MK, Sakuma M, Oshima K, Ohara O, et al. High incidence of NLRP3 somatic mosaicism in patients with chronic infantile neurologic, cutaneous, articular syndrome: Results of an international multicenter collaborative study. Arthritis Rheum 2011;63(11):3625-32.
17. Martinon F, Agostini L, Meylan E, Tschopp J. Identification of bacterial muramyl dipeptide as activator of the NALP3/cryopyrin inflammasome. Curr Biol 2004;14(21):1929-34.
18. Gross O, Thomas CJ, Guarda G, Tschopp J. The inflammasome: An integrated view. Immunol Rev 2011;243(1):136-51.
19. Romano M, Arici ZS, Piskin D, Alehashemi S, Aletaha D, Barron KS, et al. The 2021 EULAR/American College of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin-1 mediated autoinflammatory diseases: Cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Ann Rheum Dis 2022;81:907-21.
20. Protocole national de diagnostic et de soins (PNDS). Fièvres récurrentes héréditaires-Syndromes périodiques associés à la cryopyrine (CAPS). Haute Autorité de santé. Janvier 2013. https://vu.fr/qiHy