Le traitement de référence des cancers du rectum repose sur l’exérèse rectale carcinologique (exérèse du mésorectum). Cette approche, proposée dès le début des années 1980 par R. J Heald, a permis d’améliorer considérablement les résultats oncologiques.1 En cas de tumeur localement évoluée, cT3T4 et/ou N+, une radiochimiothérapie préopératoire a été utilisée depuis le début des années 2000 pour améliorer le contrôle local et réduire encore le risque de récidive locorégionale.2, 3 Au cours des trente dernières années, les progrès considérables de la technique chirurgicale ont également permis d’augmenter le taux de conservation sphinctérienne et de limiter la morbidité grâce à des approches moins invasives (laparoscopie, chirurgie robotique).4
L’association chirurgie et radiochimiothérapie comporte cependant des inconvénients : tout d’abord, la radiochimiothérapie ne permet pas de réduire le risque de récidive métastatique et de prolonger la survie des malades opérés d’un cancer du rectum.3 Cette séquence chirurgie-radiochimiothérapie est associée à un risque de complications à court terme (30 % de morbidité globale, 10 à 15 % de morbidité sévère)5 et augmente le risque de séquelles fonctionnelles à long terme, digestives (syndrome de résection antérieure du rectum, stomies définitives) et génito-urinaires, par rapport à la chirurgie seule.5-7 Appliquée de façon systématique, elle conduit à surtraiter une proportion importante de malades. C’est pourquoi de nouvelles stratégies émergent dont l’objectif demeure l’optimisation du résultat oncologique tout en limitant la morbidité à court et à long termes.5
Le traitement local est admis pour les tumeurs bénignes et superficielles. De nouvelles approches sont utilisées dans la prise en charge des cancers du rectum localement évolués, parmi lesquelles la préservation d’organe, la suppression de l’irradiation pelvienne ou encore la personnalisation.
L’association chirurgie et radiochimiothérapie comporte cependant des inconvénients : tout d’abord, la radiochimiothérapie ne permet pas de réduire le risque de récidive métastatique et de prolonger la survie des malades opérés d’un cancer du rectum.3 Cette séquence chirurgie-radiochimiothérapie est associée à un risque de complications à court terme (30 % de morbidité globale, 10 à 15 % de morbidité sévère)5 et augmente le risque de séquelles fonctionnelles à long terme, digestives (syndrome de résection antérieure du rectum, stomies définitives) et génito-urinaires, par rapport à la chirurgie seule.5-7 Appliquée de façon systématique, elle conduit à surtraiter une proportion importante de malades. C’est pourquoi de nouvelles stratégies émergent dont l’objectif demeure l’optimisation du résultat oncologique tout en limitant la morbidité à court et à long termes.5
Le traitement local est admis pour les tumeurs bénignes et superficielles. De nouvelles approches sont utilisées dans la prise en charge des cancers du rectum localement évolués, parmi lesquelles la préservation d’organe, la suppression de l’irradiation pelvienne ou encore la personnalisation.
Préservation rectale : une alternative à la proctectomie ?
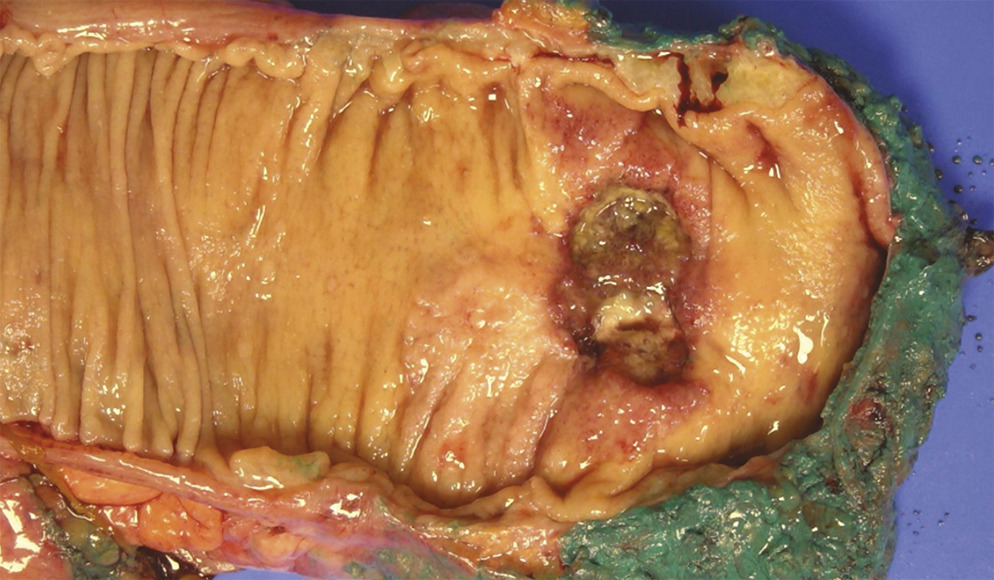
La prise en charge des cancers du moyen et du bas rectum localement évolués repose sur la radiochimiothérapie précédant l’exérèse totale du mésorectum (fig. 1 ). Au cours des années 2000, de nombreuses études se sont intéressées à la réponse histologique des cancers du rectum sous traitement. L’analyse de l’ensemble de ces données montre que la combinaison d’une irradiation pelvienne de 50 Gy et d’une chimiothérapie par capécitabine (5-FU oral) est associée à un taux de stérilisation tumorale qui varie de 15 à 25 %.8 En 2004, l’équipe d’A. Habr-Gama a proposé d’éviter une chirurgie d’exérèse aux malades très bons répondeurs à la radiochimiothérapie, par analogie au traitement des carcinomes épidermoïdes du canal anal.9 À la suite de ces premiers travaux et de la description de la stratégie de « watch and wait »9-11, le concept de préservation d’organe, ou préservation rectale, est apparu. Cette approche, si elle supprime une étape lourde du traitement, la chirurgie, comporte un risque d’insuffisance du contrôle local de la maladie et de reprise évolutive après traitement.10,11 En effet, il n’existe pas de concordance parfaite entre réponses clinique et histologique à la radiochimiothérapie des cancers du rectum et, quels que soient les moyens utilisés (toucher rectal, rectoscopie avec biopsie, écho-endoscopie, IRM), la précision diagnostique pour affirmer la réponse histologique à partir d’une très bonne réponse clinique est insuffisante.11,12 Actuellement, c’est encore surtout à partir du volume et du stade initiaux de la tumeur que peut se mesurer le risque, et ces facteurs sont utilisés pour sélectionner les candidats potentiels à une stratégie de préservation rectale. Le risque de repousse locale après « watch and wait » est de 19 % pour les tumeurs cT1T2, 31 % pour les tumeurs cT3 et 37 % pour les tumeurs cT4.11 En cas de repousse locale, une chirurgie de rattrapage est proposée et repose souvent sur une amputation abdominopérinéale.13
Afin d’améliorer les résultats de la méthode de préservation rectale, d’autres équipes, notamment celle de Bordeaux, ont proposé une approche comportant une exérèse locale de la cicatrice après radiochimiothérapie pour confirmer histologiquement la bonne réponse au traitement (fig. 2 ). Cette approche a été testée dans l’essai de phase III randomisé GRECAR II, qui a formellement validé le principe de préservation rectale dans la prise en charge des cancers du rectum localement évolués.14 Dans cette étude, les patients qui avaient un cancer du rectum localement évolué de moins de 4 cm, classé cT2T3 à l’issue du bilan préthérapeutique, recevaient une radiochimiothérapie standard. En cas de bonne réponse, définie par une réduction de taille de la tumeur conduisant à un résidu tumoral de moins de 2 cm, les malades étaient randomisés pour avoir soit une exérèse locale de la cicatrice, soit le traitement standard, c’est-à-dire une proctectomie avec exérèse totale du mésorectum. Une chirurgie de rattrapage était proposée dans le groupe exérèse locale en cas de réponse histologique insuffisante (tumeur résiduelle ypT2T3) ou d’exérèse incomplète R1. Le critère principal de l’étude était composite, comportant la morbidité postopératoire sévère, la récidive locale, la mortalité, et les événements indésirables sévères à distance.
L’étude a inclus 145 malades, dont 74 dans le groupe préservation, parmi lesquels 39 (53 %) avaient une lésion résiduelle minime ypT0T1 et ont pu bénéficier d’une surveillance sans proctectomie complémentaire. L’étude montre que l’approche qui repose sur une préservation rectale comportant l’exérèse locale de la cicatrice est oncologiquement sûre puisqu’il n’y avait pas de différence entre les deux groupes en termes de récidive locale (5 % vs 6 % ; p = 0,68), de survie sans récidive à deux ans (78 % vs 76 % ; p = 0,45 ) et de survie globale à deux ans (92 % vs 92 % ; p = 0,92).14,15 L’étude est cependant négative sur le critère de jugement principal (56 % d’événements dans le groupe expérimental vs 46 % dans le groupe contrôle ; p = 0,43). En effet, les malades du groupe préservation qui ont dû subir une chirurgie de rattrapage ont eu de moins bons résultats postopératoires en termes de morbidité.
Pour résumer, les données disponibles montrent donc qu’une stratégie de préservation d’organe réussie est très certainement profitable, mais que, en revanche, en cas d’échec (réponse ou exérèse incomplète ou de repousse locale), les patients pourraient être pénalisés par rapport à une stratégie classique.13,14 Cette approche est par conséquent admise en cas de petit cancer du rectum localement évolué de moins de 4 cm.16
Il s’agit maintenant de déterminer si l’intensification du traitement préopératoire par une chimiothérapie d’induction (avant la radiochimiothérapie) ou de consolidation (après radiochimiothérapie) permettrait d’améliorer le taux de préservation rectale.17
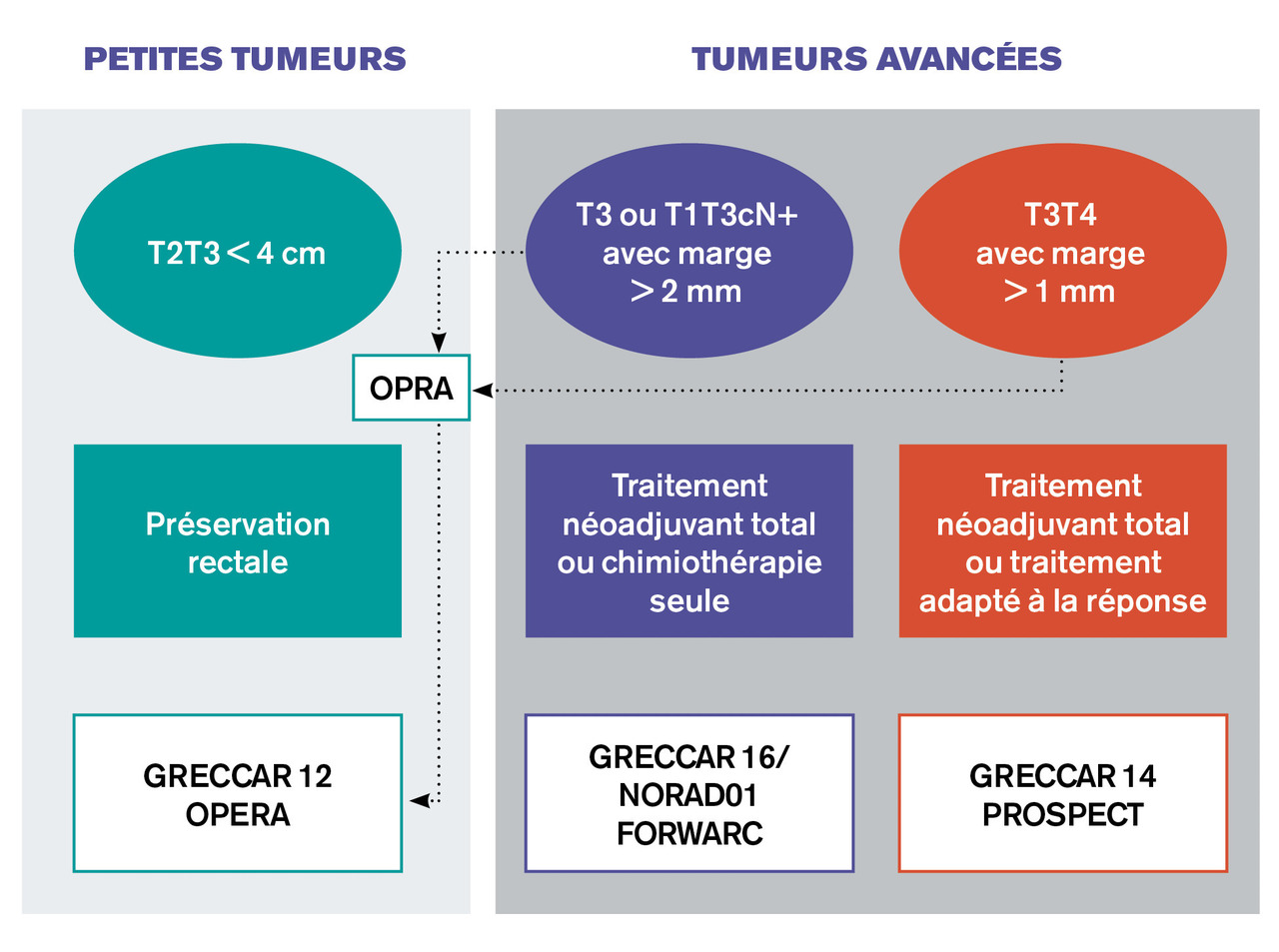
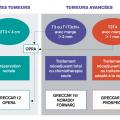
La préservation rectale pourrait aussi être proposée dans des formes plus avancées, mais élargir les critères, donc la population cible, risquerait d’augmenter le recours à la chirurgie de rattrapage, dont les résultats sont décevants.14 Plusieurs études sont actuellement en cours pour apporter des éléments de réponse à ces nouvelles questions (essai GRECCAR 12, OPERA et OPRA)17 [fig. 3 ].
Afin d’améliorer les résultats de la méthode de préservation rectale, d’autres équipes, notamment celle de Bordeaux, ont proposé une approche comportant une exérèse locale de la cicatrice après radiochimiothérapie pour confirmer histologiquement la bonne réponse au traitement (
L’étude a inclus 145 malades, dont 74 dans le groupe préservation, parmi lesquels 39 (53 %) avaient une lésion résiduelle minime ypT0T1 et ont pu bénéficier d’une surveillance sans proctectomie complémentaire. L’étude montre que l’approche qui repose sur une préservation rectale comportant l’exérèse locale de la cicatrice est oncologiquement sûre puisqu’il n’y avait pas de différence entre les deux groupes en termes de récidive locale (5 % vs 6 % ; p = 0,68), de survie sans récidive à deux ans (78 % vs 76 % ; p = 0,45 ) et de survie globale à deux ans (92 % vs 92 % ; p = 0,92).14,15 L’étude est cependant négative sur le critère de jugement principal (56 % d’événements dans le groupe expérimental vs 46 % dans le groupe contrôle ; p = 0,43). En effet, les malades du groupe préservation qui ont dû subir une chirurgie de rattrapage ont eu de moins bons résultats postopératoires en termes de morbidité.
Pour résumer, les données disponibles montrent donc qu’une stratégie de préservation d’organe réussie est très certainement profitable, mais que, en revanche, en cas d’échec (réponse ou exérèse incomplète ou de repousse locale), les patients pourraient être pénalisés par rapport à une stratégie classique.13,14 Cette approche est par conséquent admise en cas de petit cancer du rectum localement évolué de moins de 4 cm.16
Il s’agit maintenant de déterminer si l’intensification du traitement préopératoire par une chimiothérapie d’induction (avant la radiochimiothérapie) ou de consolidation (après radiochimiothérapie) permettrait d’améliorer le taux de préservation rectale.17
La préservation rectale pourrait aussi être proposée dans des formes plus avancées, mais élargir les critères, donc la population cible, risquerait d’augmenter le recours à la chirurgie de rattrapage, dont les résultats sont décevants.14 Plusieurs études sont actuellement en cours pour apporter des éléments de réponse à ces nouvelles questions (essai GRECCAR 12, OPERA et OPRA)17 [
Éviter l’irradiation pelvienne pour limiter la toxicité à long terme
La radiochimiothérapie préopératoire est utilisée pour limiter le risque de récidive locale des cancers du rectum localement évolués.
Dans l’essai hollandais Ducth TME trial, comparant la chirurgie seule à la chirurgie précédée d’une irradiation pelvienne, celle-ci permettait de réduire le risque de récidive locale à dix ans de 19 à 9 % pour les cancers de stade III, sans effet sur le risque de récidive métastatique.3 L’irradiation pelvienne augmente le risque de séquelles fonctionnelles digestives (augmentation du nombre et fractionnement des selles, impériosités, incontinence) et génito-urinaires (impuissance, troubles trophiques vaginaux, incontinence).5-7 Son utilisation systématique conduit à surtraiter une proportion non négligeable de patients. De plus, le stade tumoral T et la marge circonférentielle sont étroitement liés au risque de récidive locorégional et peuvent être évalués de façon fiable et reproductible sur l’IRM diagnostique préthérapeutique.18
Récemment, l’intérêt d’une chimiothérapie avant (en induction) ou après (en consolidation) la radiochimiothérapie a été démontré pour diminuer le risque de récidive métastatique. Ces deux schémas (induction et consolidation) de ce qui se nomme le traitement néoadjuvant total (TNT) ont été testés et comparés à la radiochimiothérapie préopératoire conventionnelle CAP50 dans deux essais de phase III, confirmant l’efficacité de cette approche sur le risque métastatique.19, 20
L’essai international RAPIDO portant sur 912 malades ayant un cancer du rectum localement évolué a utilisé un schéma de consolidation avec une radiochimiothérapie courte de 5 × 5 Gy suivie d’une chimiothérapie par FOLFOX 9 cycles ou CAPOX 6 cycles.19
L’essai français PRODIGE 23, portant sur 461 malades, a utilisé une chimiothérapie d’induction par FOLFIRINOX 6 cycles, suivie d’une radiochimiothérapie conventionnelle CAP 50.20 Ce dernier schéma d’intensification est à présent adopté comme le nouveau standard de prise en charge des cancers du rectum localement évolués en France. Avec cette nouvelle stratégie thérapeutique, la réduction du risque de récidive métastatique semble liée à la chimiothérapie mais s’associe à une augmentation de la toxicité, quel que soit le schéma de traitement.19, 20 L’approche comportant une chimiothérapie préopératoire sans irradiation pelvienne réduirait également le risque de récidive métastatique tout en limitant la toxicité. Un premier essai de phase III chinois (FORWARC), portant sur 444 malades, a montré qu’une chimiothérapie préopératoire par FOLFOX était associée à un taux de survie équivalant à celui du traitement standard, sans augmenter le risque de récidive locale.21
L’essai intergroupe français NORAD01/GRECCAR 16 compare actuellement la chimiothérapie seule par FOLFIRINOX au traitement néoadjuvant total (FOLFIRINOX + radiochimiothérapie, nouveau standard thérapeutique en cas de cancer du rectum localement évolué).22 Il s’agit d’un essai de non-infériorité sur le critère oncologique (survie sans récidive) mais dont l’objectif est clairement de montrer les avantages de cette approche sur le risque de séquelles à long terme et qui correspond donc à une stratégie de désescalade thérapeutique22 (fig. 3 ).
Dans l’essai hollandais Ducth TME trial, comparant la chirurgie seule à la chirurgie précédée d’une irradiation pelvienne, celle-ci permettait de réduire le risque de récidive locale à dix ans de 19 à 9 % pour les cancers de stade III, sans effet sur le risque de récidive métastatique.3 L’irradiation pelvienne augmente le risque de séquelles fonctionnelles digestives (augmentation du nombre et fractionnement des selles, impériosités, incontinence) et génito-urinaires (impuissance, troubles trophiques vaginaux, incontinence).5-7 Son utilisation systématique conduit à surtraiter une proportion non négligeable de patients. De plus, le stade tumoral T et la marge circonférentielle sont étroitement liés au risque de récidive locorégional et peuvent être évalués de façon fiable et reproductible sur l’IRM diagnostique préthérapeutique.18
Récemment, l’intérêt d’une chimiothérapie avant (en induction) ou après (en consolidation) la radiochimiothérapie a été démontré pour diminuer le risque de récidive métastatique. Ces deux schémas (induction et consolidation) de ce qui se nomme le traitement néoadjuvant total (TNT) ont été testés et comparés à la radiochimiothérapie préopératoire conventionnelle CAP50 dans deux essais de phase III, confirmant l’efficacité de cette approche sur le risque métastatique.19, 20
L’essai international RAPIDO portant sur 912 malades ayant un cancer du rectum localement évolué a utilisé un schéma de consolidation avec une radiochimiothérapie courte de 5 × 5 Gy suivie d’une chimiothérapie par FOLFOX 9 cycles ou CAPOX 6 cycles.19
L’essai français PRODIGE 23, portant sur 461 malades, a utilisé une chimiothérapie d’induction par FOLFIRINOX 6 cycles, suivie d’une radiochimiothérapie conventionnelle CAP 50.20 Ce dernier schéma d’intensification est à présent adopté comme le nouveau standard de prise en charge des cancers du rectum localement évolués en France. Avec cette nouvelle stratégie thérapeutique, la réduction du risque de récidive métastatique semble liée à la chimiothérapie mais s’associe à une augmentation de la toxicité, quel que soit le schéma de traitement.19, 20 L’approche comportant une chimiothérapie préopératoire sans irradiation pelvienne réduirait également le risque de récidive métastatique tout en limitant la toxicité. Un premier essai de phase III chinois (FORWARC), portant sur 444 malades, a montré qu’une chimiothérapie préopératoire par FOLFOX était associée à un taux de survie équivalant à celui du traitement standard, sans augmenter le risque de récidive locale.21
L’essai intergroupe français NORAD01/GRECCAR 16 compare actuellement la chimiothérapie seule par FOLFIRINOX au traitement néoadjuvant total (FOLFIRINOX + radiochimiothérapie, nouveau standard thérapeutique en cas de cancer du rectum localement évolué).22 Il s’agit d’un essai de non-infériorité sur le critère oncologique (survie sans récidive) mais dont l’objectif est clairement de montrer les avantages de cette approche sur le risque de séquelles à long terme et qui correspond donc à une stratégie de désescalade thérapeutique22 (
Personnalisation : analyser la réponse au traitement pour éviter le surtraitement
Dans la prise en charge des patients ayant un cancer du rectum localement évolué, les traitements préopératoires s’accompagnent d’une réponse tumorale. Celle-ci peut être mesurée sur l’imagerie, en particulier l’IRM rectale après traitement, selon un grade de régression (mrTRG).23 L’intensité de la réponse tumorale peut modifier la démarche thérapeutique, quel que soit le stade initial de la tumeur ; la stratégie de préservation rectale en est un exemple, puisqu’une très bonne réponse permet d’éviter la chirurgie d’exérèse. L’utilisation de plus en plus fréquente d’une chimiothérapie d’induction peut aussi faire discuter la suppression de la radiochimiothérapie dans les formes les plus avancées, en cas de très bonne réponse.
L’essai de phase II GRECCAR 4 a évalué, pour la première fois, une stratégie adaptée à la réponse à une chimiothérapie d’induction par FOLFIRINOX pour des cancers du rectum localement évolués avec une marge circonférentielle prédictive nulle, donc non résécables d’emblée.24 Bien que cette étude n’ait pas pu inclure la totalité des malades, la faisabilité d’une chirurgie sans irradiation préopératoire (irradiation pelvienne sélective) en cas de très bonne réponse à la chimiothérapie (réduction de la taille de la tumeur supérieure à 75 %) a été confirmée.24 Plusieurs études de phase III sont en cours pour confirmer l’intérêt de cette approche.
L’essai nord-américain PROSPECT25,26 et l’essai de phase II-III GRECCAR 14 testent une stratégie de personnalisation du traitement préopératoire et une utilisation sélective de la radiochimiothérapie en cas de cancer du rectum localement évolué avec une bonne réponse à la chimiothérapie d’induction (FOLFOX dans l’essai américain, FOLFIRINOX dans l’essai français). Si ces essais étaient positifs, ils valideraient le concept de médecine personnalisée des cancers du rectum et seraient un nouvel exemple de désescalade thérapeutique (fig. 3 ).
L’essai de phase II GRECCAR 4 a évalué, pour la première fois, une stratégie adaptée à la réponse à une chimiothérapie d’induction par FOLFIRINOX pour des cancers du rectum localement évolués avec une marge circonférentielle prédictive nulle, donc non résécables d’emblée.24 Bien que cette étude n’ait pas pu inclure la totalité des malades, la faisabilité d’une chirurgie sans irradiation préopératoire (irradiation pelvienne sélective) en cas de très bonne réponse à la chimiothérapie (réduction de la taille de la tumeur supérieure à 75 %) a été confirmée.24 Plusieurs études de phase III sont en cours pour confirmer l’intérêt de cette approche.
L’essai nord-américain PROSPECT25,26 et l’essai de phase II-III GRECCAR 14 testent une stratégie de personnalisation du traitement préopératoire et une utilisation sélective de la radiochimiothérapie en cas de cancer du rectum localement évolué avec une bonne réponse à la chimiothérapie d’induction (FOLFOX dans l’essai américain, FOLFIRINOX dans l’essai français). Si ces essais étaient positifs, ils valideraient le concept de médecine personnalisée des cancers du rectum et seraient un nouvel exemple de désescalade thérapeutique (
Traitements combinés et allègement thérapeutique
La prise en charge des cancers du rectum a été marquée au cours des deux dernières décennies par une utilisation croissante et combinée des traitements associés à la chirurgie. La radiochimiothérapie préopératoire a permis d’améliorer le contrôle local et la chimiothérapie, dans le cadre d’un traitement néoadjuvant total, et diminue le risque de récidive métastatique. L’inconvénient est une augmentation de la toxicité à court et à long termes. Cependant, le meilleur contrôle et l’efficacité de ces différentes solutions induisent une réponse tumorale qui, selon son intensité, permet d’envisager des possibilités de désescalade thérapeutique. La prise en charge des cancers du rectum évolue actuellement dans ce sens. Compte tenu des nombreuses nouvelles approches qui peuvent être proposées, une discussion pluridisciplinaire est indispensable pour optimiser la prise en charge des patients.
Références
1. Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986;1:1479-82.
2. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345:638-46.
3. van Gijn W, Marijnen CAM, Nagtegaal ID, Meershoek-Klein Kranenbarg E, Putter H, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011;12:575-82.
4. van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, Hop WC, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol 2013;14:210-8.
5. Abdalla S, Benoist S, Lefèvre JH, Penna C, Brouquet A. New treatment strategies for non-metastatic rectal cancer. J Visc Surg 2021:158:497-505.
6. Wiltink LM, Marijnen CAM, Meershoek-Klein Kranenbarg E, van de Velde CJH, Nout RA. A comprehensive longitudinal overview of health-related quality of life and symptoms after treatment for rectal cancer in the TME trial. Acta Oncol 2016;55:502-8.
7. Chen TY, Wiltink LM, Nout RA, Meershoek-Klein Kranenbarg E, Laurberg S, Marijnen CAM, et al. Bowel function 14 years after preoperative short-course radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomized trial. Clin Colorectal Cancer 2015;14:106-14.
8. Rödel C, Martus P, Papadoupolos T, Füzesi L, Klimpfinger M, Fietkau R, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005;23:8688-96.
9. Habr-Gama A, Perez RO, Nadalin W, Sabbaga J, Ribeiro U Jr, Silva e Sousa AH Jr, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg 2004;240:711-7; discussion 717-8.
10. van der Valk MJM, Hilling DE, Bastiaannet E, Meershoek-Klein Kranenbarg E, Beets GL, Figueiredo NL, et al. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. Lancet 2018;391:2537-45.
11. Chadi SA, Malcomson L, Ensor J, Riley RD, Vaccaro CA, Rossi GL, et al. Factors affecting local regrowth after watch and wait for patients with a clinical complete response following chemoradiotherapy in rectal cancer (InterCoRe consortium): an individual participant data meta-analysis. Lancet Gastroenterol Hepatol 2018;3:825-36.
12. Moszkowicz D, Peschaud F, El Hajjam M, Julié C, Beauchet A, Penna C, et al. Can we predict complete or major response after chemoradiotherapy for rectal cancer by noninvasive methods? Results of a prospective study on 61 patients. Am Surg 2014;80:1136-45.
13. van der Sande ME, Figueiredo N, Beets GL. Management and outcome of local regrowths in a watch-and-wait prospective cohort for complete responses in rectal cancer. Ann Surg 2021;274:e1056-62.
14. Rullier E, Rouanet P, Tuech JJ, Valverde A, Lelong B, Rivoire M, et al. Organ preservation for rectal cancer (GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet 2017;390:469-79.
15. Rullier E, Vendrely V, Asselineau J, Rouanet P, Tuech JJ, Valverde A, et al. Organ preservation with chemoradiotherapy plus local excision for rectal cancer: 5-year results of the GRECCAR 2 randomised trial. Lancet Gastroenterol Hepatol 2020;5:465-74.
16. Cotte E, Artru P, Bachet JB, Bibeau F, Christou N, Conroy T, et al. « Cancer du rectum ». Thésaurus national de cancérologie digestive [en ligne]. 2021. Disponible sur : http://www.tncd.org
17. Fokas E, Appelt A, Glynne-Jones R, Beets G, Perez R, Garcia-Aguilar J, et al. International consensus recommendations on key outcome measures for organ preservation after (chemo)radiotherapy in patients with rectal cancer. Nat Rev Clin Oncol 2021;18:5-816.
18. Al-Sukhni E, Milot L, Fruitman M, Beyene J, Victor JC, Schmocker S, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol 2012;19:2212-23.
19. Bahadoer RR, Dijkstra EA, van Etten B, Marijnen CAM, Putter H, Meershoek-Klein Kranenbarg E, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:29-42.
20. Conroy T, Bosset JF, Etienne PL, Rio E, François E, Mesgouez-Nebout N, et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:702-15.
21. Deng Y, Chi P, Lan P, Wang L, Chen W, Cui L, et al. Modified FOLFOX6 with or without radiation versus fluorouracil and leucovorin with radiation in neoadjuvant treatment of locally advanced rectal cancer: initial results of the chinese FOWARC multicenter, open-label, randomized three-arm phase III trial. J Clin Oncol 2016;34:3300-7.
22. Brouquet A, Bachet JB, Huguet F, Karoui M, Artru P, Sabbagh C, et al. NORAD01-GRECCAR16 multicenter phase III non-inferiority randomized trial comparing preoperative modified FOLFIRINOX without irradiation to radiochemotherapy for resectable locally advanced rectal cancer (intergroup FRENCH-GRECCAR- PRODIGE trial). BMC Cancer 2020;20:485.
23. Siddiqui MRS, Gormly KL, Bhoday J, Balyansikova S, Battersby NJ, Chand M, et al. Interobserver agreement of radiologists assessing the response of rectal cancers to preoperative chemoradiation using the MRI tumour regression grading (mrTRG). Clin Radiol 2016;71:854-62.
24. Rouanet P, Rullier E, Lelong B, Maingon P, Tuech JJ, Pezet D, et al. Tailored Treatment Strategy for Locally Advanced Rectal Carcinoma Based on the Tumor Response to Induction Chemotherapy: Preliminary Results of the French Phase II Multicenter GRECCAR4 Trial. Dis Colon Rectum 2017;60:653-63.
25. Schrag D, Weiser MR, Goodman KA, Gonen M, Hollywood E, Cercek A, et al. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol 2014;32:513-8.
26. Schrag D, Weiser M, Saltz L, Mamon H, Gollub M, Basch E, et al. Challenges and solutions in the design and execution of the PROSPECT Phase II/III neoadjuvant rectal cancer trial (NCCTG N1048/Alliance). Clin Trials 2019;16:165-75.
2. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345:638-46.
3. van Gijn W, Marijnen CAM, Nagtegaal ID, Meershoek-Klein Kranenbarg E, Putter H, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011;12:575-82.
4. van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, Hop WC, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol 2013;14:210-8.
5. Abdalla S, Benoist S, Lefèvre JH, Penna C, Brouquet A. New treatment strategies for non-metastatic rectal cancer. J Visc Surg 2021:158:497-505.
6. Wiltink LM, Marijnen CAM, Meershoek-Klein Kranenbarg E, van de Velde CJH, Nout RA. A comprehensive longitudinal overview of health-related quality of life and symptoms after treatment for rectal cancer in the TME trial. Acta Oncol 2016;55:502-8.
7. Chen TY, Wiltink LM, Nout RA, Meershoek-Klein Kranenbarg E, Laurberg S, Marijnen CAM, et al. Bowel function 14 years after preoperative short-course radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomized trial. Clin Colorectal Cancer 2015;14:106-14.
8. Rödel C, Martus P, Papadoupolos T, Füzesi L, Klimpfinger M, Fietkau R, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005;23:8688-96.
9. Habr-Gama A, Perez RO, Nadalin W, Sabbaga J, Ribeiro U Jr, Silva e Sousa AH Jr, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg 2004;240:711-7; discussion 717-8.
10. van der Valk MJM, Hilling DE, Bastiaannet E, Meershoek-Klein Kranenbarg E, Beets GL, Figueiredo NL, et al. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. Lancet 2018;391:2537-45.
11. Chadi SA, Malcomson L, Ensor J, Riley RD, Vaccaro CA, Rossi GL, et al. Factors affecting local regrowth after watch and wait for patients with a clinical complete response following chemoradiotherapy in rectal cancer (InterCoRe consortium): an individual participant data meta-analysis. Lancet Gastroenterol Hepatol 2018;3:825-36.
12. Moszkowicz D, Peschaud F, El Hajjam M, Julié C, Beauchet A, Penna C, et al. Can we predict complete or major response after chemoradiotherapy for rectal cancer by noninvasive methods? Results of a prospective study on 61 patients. Am Surg 2014;80:1136-45.
13. van der Sande ME, Figueiredo N, Beets GL. Management and outcome of local regrowths in a watch-and-wait prospective cohort for complete responses in rectal cancer. Ann Surg 2021;274:e1056-62.
14. Rullier E, Rouanet P, Tuech JJ, Valverde A, Lelong B, Rivoire M, et al. Organ preservation for rectal cancer (GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet 2017;390:469-79.
15. Rullier E, Vendrely V, Asselineau J, Rouanet P, Tuech JJ, Valverde A, et al. Organ preservation with chemoradiotherapy plus local excision for rectal cancer: 5-year results of the GRECCAR 2 randomised trial. Lancet Gastroenterol Hepatol 2020;5:465-74.
16. Cotte E, Artru P, Bachet JB, Bibeau F, Christou N, Conroy T, et al. « Cancer du rectum ». Thésaurus national de cancérologie digestive [en ligne]. 2021. Disponible sur : http://www.tncd.org
17. Fokas E, Appelt A, Glynne-Jones R, Beets G, Perez R, Garcia-Aguilar J, et al. International consensus recommendations on key outcome measures for organ preservation after (chemo)radiotherapy in patients with rectal cancer. Nat Rev Clin Oncol 2021;18:5-816.
18. Al-Sukhni E, Milot L, Fruitman M, Beyene J, Victor JC, Schmocker S, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol 2012;19:2212-23.
19. Bahadoer RR, Dijkstra EA, van Etten B, Marijnen CAM, Putter H, Meershoek-Klein Kranenbarg E, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:29-42.
20. Conroy T, Bosset JF, Etienne PL, Rio E, François E, Mesgouez-Nebout N, et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:702-15.
21. Deng Y, Chi P, Lan P, Wang L, Chen W, Cui L, et al. Modified FOLFOX6 with or without radiation versus fluorouracil and leucovorin with radiation in neoadjuvant treatment of locally advanced rectal cancer: initial results of the chinese FOWARC multicenter, open-label, randomized three-arm phase III trial. J Clin Oncol 2016;34:3300-7.
22. Brouquet A, Bachet JB, Huguet F, Karoui M, Artru P, Sabbagh C, et al. NORAD01-GRECCAR16 multicenter phase III non-inferiority randomized trial comparing preoperative modified FOLFIRINOX without irradiation to radiochemotherapy for resectable locally advanced rectal cancer (intergroup FRENCH-GRECCAR- PRODIGE trial). BMC Cancer 2020;20:485.
23. Siddiqui MRS, Gormly KL, Bhoday J, Balyansikova S, Battersby NJ, Chand M, et al. Interobserver agreement of radiologists assessing the response of rectal cancers to preoperative chemoradiation using the MRI tumour regression grading (mrTRG). Clin Radiol 2016;71:854-62.
24. Rouanet P, Rullier E, Lelong B, Maingon P, Tuech JJ, Pezet D, et al. Tailored Treatment Strategy for Locally Advanced Rectal Carcinoma Based on the Tumor Response to Induction Chemotherapy: Preliminary Results of the French Phase II Multicenter GRECCAR4 Trial. Dis Colon Rectum 2017;60:653-63.
25. Schrag D, Weiser MR, Goodman KA, Gonen M, Hollywood E, Cercek A, et al. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol 2014;32:513-8.
26. Schrag D, Weiser M, Saltz L, Mamon H, Gollub M, Basch E, et al. Challenges and solutions in the design and execution of the PROSPECT Phase II/III neoadjuvant rectal cancer trial (NCCTG N1048/Alliance). Clin Trials 2019;16:165-75.