En France, en 2007, la disponibilité des vaccins contre les infections à papillomavirus humains (HPV) à haut risque Gardasil puis Cervarix a conduit les autorités sanitaires à introduire cette vaccination dans le calendrier vaccinal avec comme objectif la réduction de l’incidence des lésions précancéreuses du col de l’utérus. Le dépistage des lésions précancéreuses par cytologie cervico-utérine gardait tout son intérêt dans la prévention complémentaire contre les cancers du col de l’utérus dans la mesure où ces vaccins ne ciblent qu’une fraction des papillomavirus responsables d’environ 70 % de ces cancers. Suivant l’autorisation de mise sur le marché (AMM) de ces vaccins, les recommandations vaccinales ont évolué. Cependant, la crainte des effets indésirables, s’agissant de nouveaux vaccins, et des messages souvent brouillés à destination des professionnels de santé et du public sur l’intérêt de cette nouvelle vaccination ont conduit à une hésitation vaccinale, voire à une défiance. Cela a eu pour conséquence une couverture vaccinale très insuffisante pour obtenir un intérêt individuel mais aussi indirect et pour évaluer l’impact de la politique vaccinale dans la réduction des infections à papillomavirus à haut risque couvertes par les vaccins. En 2019, soit 12 ans après l’introduction de cette vaccination dans le calendrier vaccinal, la stratégie vaccinale contre les infections à papillomavirus a été à nouveau à l’étude.
Une politique de vaccination définie par le ministère de la Santé
Présenter la politique vaccinale contre les infections à papillomavirus en France, c’est avoir à l’esprit les différentes étapes réglementaires qui conduisent à son élaboration.
Plusieurs étapes définissent la politique vaccinale : tout d’abord le calendrier vaccinal, puis l’évaluation médico-économique, le prix du vaccin, et le suivi du programme de vaccination avec la couverture vaccinale. Le calendrier vaccinal est déterminé par l’élaboration des recommandations vaccinales sur la base d’expertises scientifiques et médico-économiques : les populations à vacciner, les vaccins à utiliser, les schémas vaccinaux. C’est la mission de la Commission technique des vaccinations de la Haute Autorité de santé (HAS) depuis 2017 qui a succédé au Comité technique des vaccinations du Haut Conseil de la santé publique. La seconde étape est l’évaluation médico-économique, avec la fixation du taux de remboursement en prenant en compte le service médical rendu (SMR) et l’amélioration du service médical rendu (ASMR). C’est le domaine de compétence de la Commission de la transparence de la HAS. Le suivi et l’impact du programme de vaccination reposent sur la détermination de la couverture vaccinale, et par l’estimation de son efficacité en conditions réelles d’utilisation par Santé publique France (effectiveness).
Plusieurs étapes définissent la politique vaccinale : tout d’abord le calendrier vaccinal, puis l’évaluation médico-économique, le prix du vaccin, et le suivi du programme de vaccination avec la couverture vaccinale. Le calendrier vaccinal est déterminé par l’élaboration des recommandations vaccinales sur la base d’expertises scientifiques et médico-économiques : les populations à vacciner, les vaccins à utiliser, les schémas vaccinaux. C’est la mission de la Commission technique des vaccinations de la Haute Autorité de santé (HAS) depuis 2017 qui a succédé au Comité technique des vaccinations du Haut Conseil de la santé publique. La seconde étape est l’évaluation médico-économique, avec la fixation du taux de remboursement en prenant en compte le service médical rendu (SMR) et l’amélioration du service médical rendu (ASMR). C’est le domaine de compétence de la Commission de la transparence de la HAS. Le suivi et l’impact du programme de vaccination reposent sur la détermination de la couverture vaccinale, et par l’estimation de son efficacité en conditions réelles d’utilisation par Santé publique France (effectiveness).
Vacciner pour prévenir les lésions génitales précancéreuses
Les infections par les papillomavirus à haut risque sont étiologiquement associées à la quasi-totalité des cancers du col de l’utérus, 90 % des cancers de l’anus, 70 % des cancers du vagin, 50 % des cancers du pénis, 40 % des cancers de la vulve et 20 à 60 % des cancers de l’oropharynx. Les papillomavirus sont très nombreux, caractérisés par une très grande diversité génotypique. Parmi eux, sont définis comme haut risque, c’est-à-dire à haut pouvoir oncogène, les HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59.1 Le type 16 est responsable de la plupart des cas de cancers du col de l’utérus.2 Les HPV 16 et 18 sont détectés dans environ 70 à 80 % des cancers anaux et 80 à 90 % des cancers de l’anus HPV-positifs. Ils sont également responsables de 55 à 60 % des cancers du vagin, 48 % et 40 % respectivement des cancers du pénis et de la vulve. Les papillomavirus à bas risque 6 et 11 sont essentiellement responsables de verrues génitales ou condylomes.
En France, le nombre de cancers potentiellement dus aux papillomavirus est estimé à 6 300 nouveaux cas en 2015 dont 3 000 cas de cancers du col de l’utérus, responsables de 1 100 décès, 1 460 cas de cancers de l’anus dont 75 % survenant chez les femmes.3
En 2007, deux vaccins contre les papillomavirus sont autorisés pour la mise sur le marché. Le vaccin bivalent Cervarix est indiqué selon le résumé des caractéristiques du produit pour la prévention des néoplasies intra-épithéliales cervicales de haut grade (CIN de grades 2 et 3) et du cancer du col de l’utérus dus aux papillomavirus de types 16 et 18. Son indication est fondée sur son efficacité chez les femmes âgées de 15 à 25 ans vaccinées avec Cervarix et sur l’immunogénicité du vaccin chez les jeunes filles et les femmes âgées de 10 à 25 ans.4 Le vaccin quadrivalent Gardasil a des indications plus larges car il est indiqué pour la prévention des dysplasies de haut grade du col de l'utérus (CIN 2-3), des cancers du col de l’utérus, des dysplasies de haut grade de la vulve (VIN 2-3) et des verrues génitales externes (condylomes acuminés) dus aux papillomavirus humains de types 6, 11, 16 et 18. L’indication est fondée sur la démonstration de l’efficacité de Gardasil chez les femmes adultes de 16 à 26 ans et sur la démonstration de l’immunogénicité de Gardasil chez les enfants et adolescents de 9 à 15 ans.5 L’efficacité de la vaccination contre les papillomavirus chez les hommes a fait l’objet d’une méta-analyse en 2018 (v . p. 99 ).
Au vu de leurs AMM, les vaccins Cervarix et Gardasil sont recommandés en 2007 dans le cadre de la stratégie définie par les autorités sanitaires, c’est-à-dire la prévention de la morbidité et de la mortalité des lésions précancéreuses et du cancer du col de l’utérus. La vaccination contre les infections à papillomavirus est recommandée chez les jeunes filles de 14 ans, avec rattrapage chez les jeunes filles et jeunes femmes de 15 à 23 ans révolus (c’est-à-dire avant l’âge de 24 ans) qui n’auraient pas eu de rapports sexuels ou, au plus tard, dans l’année suivant le début de la vie sexuelle, dans la perspective de la prévention des lésions précancéreuses et cancéreuses du col de l’utérus ainsi que de la prévention des condylomes vulvaires pour Gardasil. Ce vaccin est recommandé préférentiellement au vaccin Cervarix car il est composé de deux génotypes additionnels HPV 6 et 11 avec une efficacité vis-à-vis des condylomes acuminés.6
En France, le nombre de cancers potentiellement dus aux papillomavirus est estimé à 6 300 nouveaux cas en 2015 dont 3 000 cas de cancers du col de l’utérus, responsables de 1 100 décès, 1 460 cas de cancers de l’anus dont 75 % survenant chez les femmes.3
En 2007, deux vaccins contre les papillomavirus sont autorisés pour la mise sur le marché. Le vaccin bivalent Cervarix est indiqué selon le résumé des caractéristiques du produit pour la prévention des néoplasies intra-épithéliales cervicales de haut grade (CIN de grades 2 et 3) et du cancer du col de l’utérus dus aux papillomavirus de types 16 et 18. Son indication est fondée sur son efficacité chez les femmes âgées de 15 à 25 ans vaccinées avec Cervarix et sur l’immunogénicité du vaccin chez les jeunes filles et les femmes âgées de 10 à 25 ans.4 Le vaccin quadrivalent Gardasil a des indications plus larges car il est indiqué pour la prévention des dysplasies de haut grade du col de l'utérus (CIN 2-3), des cancers du col de l’utérus, des dysplasies de haut grade de la vulve (VIN 2-3) et des verrues génitales externes (condylomes acuminés) dus aux papillomavirus humains de types 6, 11, 16 et 18. L’indication est fondée sur la démonstration de l’efficacité de Gardasil chez les femmes adultes de 16 à 26 ans et sur la démonstration de l’immunogénicité de Gardasil chez les enfants et adolescents de 9 à 15 ans.5 L’efficacité de la vaccination contre les papillomavirus chez les hommes a fait l’objet d’une méta-analyse en 2018 (
Au vu de leurs AMM, les vaccins Cervarix et Gardasil sont recommandés en 2007 dans le cadre de la stratégie définie par les autorités sanitaires, c’est-à-dire la prévention de la morbidité et de la mortalité des lésions précancéreuses et du cancer du col de l’utérus. La vaccination contre les infections à papillomavirus est recommandée chez les jeunes filles de 14 ans, avec rattrapage chez les jeunes filles et jeunes femmes de 15 à 23 ans révolus (c’est-à-dire avant l’âge de 24 ans) qui n’auraient pas eu de rapports sexuels ou, au plus tard, dans l’année suivant le début de la vie sexuelle, dans la perspective de la prévention des lésions précancéreuses et cancéreuses du col de l’utérus ainsi que de la prévention des condylomes vulvaires pour Gardasil. Ce vaccin est recommandé préférentiellement au vaccin Cervarix car il est composé de deux génotypes additionnels HPV 6 et 11 avec une efficacité vis-à-vis des condylomes acuminés.6
Évolution des recommandations vaccinales et élargissement des indications
Abaissement de l’âge de la vaccination
À partir de 2012, l’âge recommandé a été révisé, avec la vaccination des jeunes filles de 11 à 14 ans et le rattrapage chez celles âgées de 15 à 19 ans révolus. L’abaissement de l’âge de la vaccination a reposé sur les données de persistance de la réponse immune post-vaccination, le fait que la couverture vaccinale était insuffisante 5 ans après l’introduction de la vaccination. En 2011, les données de coadministration avec le vaccin diphtérie-tétanos-polio-coqueluche ont contribué à ce que cette vaccination soit proposée lors du rendez-vous vaccinal dTPca chez les 11-13 ans.7, 8
Vaccination des personnes immunodéprimées
En 2012, compte tenu de la fréquence des infections à papillomavirus, du risque accru de complications génitales dues à ces infections, la vaccination contre les papillomavirus a été recommandée chez les personnes immunodéprimées et aspléniques non ciblées par les recommandations vaccinales en population générale, avec des schémas vaccinaux particuliers, c’est-à-dire un schéma à trois doses pour les filles et les garçons, et l’administration du vaccin Gardasil chez les garçons :9
– chez les garçons et filles de 11 à 19 ans infectés par le virus de l’immunodéficience humaine [VIH]) ;
– chez les garçons et filles de 9 à 19 ans, transplantés d’organe solide ou en attente de transplantation (abaissement de l’âge de la vaccination chez les filles par rapport à la recommandation en population générale) ;
– chez les jeunes filles de 9 à 19 ans en post-greffe de cellules souches hématopoïétiques (abaissement de l’âge de la vaccination chez les filles par rapport à la recommandation en population générale).
– chez les garçons et filles de 11 à 19 ans infectés par le virus de l’immunodéficience humaine [VIH]) ;
– chez les garçons et filles de 9 à 19 ans, transplantés d’organe solide ou en attente de transplantation (abaissement de l’âge de la vaccination chez les filles par rapport à la recommandation en population générale) ;
– chez les jeunes filles de 9 à 19 ans en post-greffe de cellules souches hématopoïétiques (abaissement de l’âge de la vaccination chez les filles par rapport à la recommandation en population générale).
Vaccination ciblée des garçons et des hommes
Compte tenu du fait que la grande majorité des hommes et des femmes sont infectés par des papillomavirus à haut risque au cours de la vie, de l’extension d’AMM des vaccins Gardasil et Cervarix dans la prévention des lésions anales précancéreuses et cancéreuses chez les hommes et les femmes, le Haut Conseil de la santé publique s’est autosaisi en 2016 afin d’étudier la stratégie de prévention chez les garçons des infections à papillomavirus. Une méta-analyse incluant plus de 20 études de 9 pays a montré l’impact indirect de cette vaccination en termes de réduction des lésions précancéreuses chez des personnes non vaccinées alors que la couverture vaccinale était très élevée.10 Or, en France, compte tenu de la faible couverture vaccinale chez les filles et les jeunes femmes (inférieure à 20 %), l’immunité de groupe est insuffisante pour la protection des garçons et des hommes par la vaccination des filles et des jeunes femmes.
Les arguments scientifiques qui ont été pris en considération ont été les suivants : les lésions précancéreuses et cancéreuses liées aux papillomavirus à haut risque sont plus fréquentes chez les hommes ayant des relations sexuelles avec les hommes que chez les hommes hétérosexuels, et ce d’autant que les homosexuels sont infectés par le VIH. Le risque de cancer anal est 20 fois plus élevé chez les homosexuels que chez les hétérosexuels. Les condylomes anaux liés aux HPV 6 et 11 sont le motif de consultation le plus fréquent des homosexuels dans les centres de dépistage des infections sexuellement transmissibles. Les enquêtes lors de la mise en œuvre de programmes de cette vaccination conduites auprès des professionnels de santé, des parents et également des jeunes gens ont montré une relative acceptabilité de cette vaccination chez les enfants. Par ailleurs, seul le vaccin Gardasil a une AMM pour la prévention des lésions précancéreuses anales et des cancers et condylomes anaux. Les analyses médico-économiques ont été également prises en compte. La stratégie de vacciner les garçons à risque (ayant des relations sexuelles avec les hommes) est plus coût-efficace que de proposer la vaccination en population générale, incluant donc les garçons. En effet, les homosexuels sont plus exposés aux infections à papillomavirus, et cette vaccination doit être proposée au début de la vie sexuelle. Le risque de cancers liés aux papillomavirus est beaucoup plus faible chez les hommes que chez les femmes.
Dans la stratégie de prévention des lésions précancéreuses et cancéreuses liées aux papillomavirus à haut risque, la vaccination universelle des garçons n’a pas paru pertinente en termes de santé publique car le cancer anal est très peu fréquent chez les hommes ; les condylomes génitaux malgré leur fréquence sont peu sévères. En revanche, la vaccination contre les infections à papillomavirus chez les homosexuels a été recommandée du fait de la fréquence des lésions génitales, de l’absence de protection indirecte par la vaccination des filles (la vaccination HPV a été recommandée chez les hommes jusqu’à l’âge de 26 ans qui ont eu ou ont des relations sexuelles avec les hommes, âge déterminé par les études d’efficacité de Gardasil chez les hommes. Le bénéfice de cette vaccination est d’autant plus important que le début de l’activité sexuelle est récent et le nombre de partenaires faible. Cette vaccination repose sur l’administration du vaccin Gardasil qui seul a l’AMM pour la prévention des condylomes anaux.11 Cette vaccination selon un schéma vaccinal à trois doses devait être disponible sans frais à charge pour la personne, ni prescription en secteur libéral, dans les centres de santé et les centres gratuits d’information, de dépistage et de diagnostic (CeGIDD) qui sont généralement accessibles à cette population. La mise en œuvre préférentielle de cette recommandation vaccinale par les CeGIDD, c’est-à-dire la prise en charge par ces structures du vaccin, a limité son application et a généré de nombreuses interrogations (vaccination suivant l’orientation sexuelle, accès hétérogène des homosexuels aux CeGIDD, stock très limité de vaccins disponibles dans ces structures). Le vaccin Gardasil pouvait être prescrit en secteur libéral mais dans ce cas non remboursé. Si les médecins généralistes étaient convaincus de l’intérêt de cette recommandation chez les hommes homosexuels, ils ne la proposaient pas systématiquement car ils pouvaient méconnaître l’identité sexuelle de leur patientèle et ils étaient réticents à parler de sexualité avec elle.12 Or plusieurs études ont montré l’impact positif du médecin généraliste dans l’acceptabilité de cette vaccination par la population ciblée par les recommandations vaccinales.13, 14
Les arguments scientifiques qui ont été pris en considération ont été les suivants : les lésions précancéreuses et cancéreuses liées aux papillomavirus à haut risque sont plus fréquentes chez les hommes ayant des relations sexuelles avec les hommes que chez les hommes hétérosexuels, et ce d’autant que les homosexuels sont infectés par le VIH. Le risque de cancer anal est 20 fois plus élevé chez les homosexuels que chez les hétérosexuels. Les condylomes anaux liés aux HPV 6 et 11 sont le motif de consultation le plus fréquent des homosexuels dans les centres de dépistage des infections sexuellement transmissibles. Les enquêtes lors de la mise en œuvre de programmes de cette vaccination conduites auprès des professionnels de santé, des parents et également des jeunes gens ont montré une relative acceptabilité de cette vaccination chez les enfants. Par ailleurs, seul le vaccin Gardasil a une AMM pour la prévention des lésions précancéreuses anales et des cancers et condylomes anaux. Les analyses médico-économiques ont été également prises en compte. La stratégie de vacciner les garçons à risque (ayant des relations sexuelles avec les hommes) est plus coût-efficace que de proposer la vaccination en population générale, incluant donc les garçons. En effet, les homosexuels sont plus exposés aux infections à papillomavirus, et cette vaccination doit être proposée au début de la vie sexuelle. Le risque de cancers liés aux papillomavirus est beaucoup plus faible chez les hommes que chez les femmes.
Dans la stratégie de prévention des lésions précancéreuses et cancéreuses liées aux papillomavirus à haut risque, la vaccination universelle des garçons n’a pas paru pertinente en termes de santé publique car le cancer anal est très peu fréquent chez les hommes ; les condylomes génitaux malgré leur fréquence sont peu sévères. En revanche, la vaccination contre les infections à papillomavirus chez les homosexuels a été recommandée du fait de la fréquence des lésions génitales, de l’absence de protection indirecte par la vaccination des filles (la vaccination HPV a été recommandée chez les hommes jusqu’à l’âge de 26 ans qui ont eu ou ont des relations sexuelles avec les hommes, âge déterminé par les études d’efficacité de Gardasil chez les hommes. Le bénéfice de cette vaccination est d’autant plus important que le début de l’activité sexuelle est récent et le nombre de partenaires faible. Cette vaccination repose sur l’administration du vaccin Gardasil qui seul a l’AMM pour la prévention des condylomes anaux.11 Cette vaccination selon un schéma vaccinal à trois doses devait être disponible sans frais à charge pour la personne, ni prescription en secteur libéral, dans les centres de santé et les centres gratuits d’information, de dépistage et de diagnostic (CeGIDD) qui sont généralement accessibles à cette population. La mise en œuvre préférentielle de cette recommandation vaccinale par les CeGIDD, c’est-à-dire la prise en charge par ces structures du vaccin, a limité son application et a généré de nombreuses interrogations (vaccination suivant l’orientation sexuelle, accès hétérogène des homosexuels aux CeGIDD, stock très limité de vaccins disponibles dans ces structures). Le vaccin Gardasil pouvait être prescrit en secteur libéral mais dans ce cas non remboursé. Si les médecins généralistes étaient convaincus de l’intérêt de cette recommandation chez les hommes homosexuels, ils ne la proposaient pas systématiquement car ils pouvaient méconnaître l’identité sexuelle de leur patientèle et ils étaient réticents à parler de sexualité avec elle.12 Or plusieurs études ont montré l’impact positif du médecin généraliste dans l’acceptabilité de cette vaccination par la population ciblée par les recommandations vaccinales.13, 14
Place de Gardasil 9 dans la prévention des maladies à papillomavirus
Le vaccin Gardasil 9 a obtenu le 10 juin 2015 l’AMM européenne de mise sur le marché chez les filles et les garçons selon un schéma à trois doses à partir de l’âge de 9 ans, puis le 4 avril 2016, selon un schéma à deux doses chez ceux âgés de 9 à 14 ans.
Ce vaccin, composé de cinq génotypes de papillomavirus à haut risque (HPV 31, 33, 45, 52, 58) additionnels par rapport au vaccin Gardasil (HPV 6, 11, 16, 18), est indiqué pour l’immunisation active des personnes à partir de l’âge de 9 ans contre les maladies liées aux papillomavirus : lésions précancéreuses et cancers du col de l’utérus, de la vulve, du vagin et de l’anus, verrues génitales.
Les recommandations de ce vaccin lors de sa disponibilité sur le marché français en 2016 ont été fondées sur :15
– la prévalence des infections à papillomavirus de génotypes 6, 11, 16, 18, 31, 33, 45, 52, 58 inclus dans le vaccin Gardasil 9, qui sont responsables de 90 % des cancers du col de l’utérus, 80 % des lésions malpighiennes intra-épithéliales de haut grade, 70 % des cancers du vagin, 40 % des cancers de la vulve, 85 % des cancers de l’anus et 60 % des cancers du pénis ;
– son efficacité vis-à-vis des infections persistantes dues aux génotypes additionnels 31, 33, 45, 52, 58 et des lésions associées ;
– des études d’immunogénicité en termes de non-infériorité de Gardasil 9 par rapport à Garsasil pour les génotypes communs à ces deux vaccins (HPV 6, 11, 16, 18) ;
– des études de coadministration avec des vaccins combinés de rappel diphtérique (d), tétanique (T), poliomyélite inactivé (P), et coquelucheux acellulaire (ca), compte tenu de l’âge des personnes à vacciner (adolescents et jeunes adultes) ;
– l’acceptabilité de cette vaccination pour les jeunes gens et leurs parents ;
– et comme pour tout médicament et donc vaccin, la tolérance, avec un profil de sécurité satisfaisant, en particulier avec la disponibilité de données post- commercialisation de Gardasil ;
– l’évaluation médico-économique et l’impact en santé publique du vaccin Gardasil 9, très dépendants de la différence de coût de ce vaccin par rapport à Gardasil.
La mise à disposition du vaccin Gardasil 9 n’a pas modifié la stratégie de prévention par la vaccination des infections et des maladies dues aux papillomavirus, au regard de la saisine de la Direction générale de la santé.
Le vaccin Gardasil 9 a été recommandé à partir de 2016 chez les jeunes filles et les jeunes femmes non vaccinées antérieurement selon le schéma à deux doses chez celles âgées de 11 à 14 ans révolus et à trois doses chez celles âgées de 15 à 19 ans révolus. Pour celles ayant reçu un schéma complet avec Gardasil ou Cervarix, il n’a pas été recommandé de revaccination.
En l’absence de données disponibles en termes d’efficacité, d’immunogénicité ou de tolérance sur l’interchangeabilité des vaccins Gardasil ou Cervarix par Gardasil 9, il a été recommandé que la vaccination initiée par Gardasil ou Cervarix soit poursuivie avec le même vaccin.
Chez les hommes homosexuels, il a été recommandé que la vaccination contre les papillomavirus soit aussi initiée avec Gardasil 9 jusqu’à l’âge de 26 ans selon un schéma à trois doses, sans revaccination de ceux ayant déjà reçu un schéma complet avec Gardasil.
Chez les personnes immunodéprimées, le niveau de preuve scientifique est très faible (pas d’études réalisées chez ces personnes). Toutefois, il a été recommandé que ce vaccin selon un schéma à trois doses puisse être administré chez les jeunes filles et les garçons de 11 à 19 ans. Pour les enfants, filles ou garçons, candidats à une transplantation d’organe solide, cette vaccination peut être initiée dès l’âge de 9 ans.
Ce vaccin, composé de cinq génotypes de papillomavirus à haut risque (HPV 31, 33, 45, 52, 58) additionnels par rapport au vaccin Gardasil (HPV 6, 11, 16, 18), est indiqué pour l’immunisation active des personnes à partir de l’âge de 9 ans contre les maladies liées aux papillomavirus : lésions précancéreuses et cancers du col de l’utérus, de la vulve, du vagin et de l’anus, verrues génitales.
Les recommandations de ce vaccin lors de sa disponibilité sur le marché français en 2016 ont été fondées sur :15
– la prévalence des infections à papillomavirus de génotypes 6, 11, 16, 18, 31, 33, 45, 52, 58 inclus dans le vaccin Gardasil 9, qui sont responsables de 90 % des cancers du col de l’utérus, 80 % des lésions malpighiennes intra-épithéliales de haut grade, 70 % des cancers du vagin, 40 % des cancers de la vulve, 85 % des cancers de l’anus et 60 % des cancers du pénis ;
– son efficacité vis-à-vis des infections persistantes dues aux génotypes additionnels 31, 33, 45, 52, 58 et des lésions associées ;
– des études d’immunogénicité en termes de non-infériorité de Gardasil 9 par rapport à Garsasil pour les génotypes communs à ces deux vaccins (HPV 6, 11, 16, 18) ;
– des études de coadministration avec des vaccins combinés de rappel diphtérique (d), tétanique (T), poliomyélite inactivé (P), et coquelucheux acellulaire (ca), compte tenu de l’âge des personnes à vacciner (adolescents et jeunes adultes) ;
– l’acceptabilité de cette vaccination pour les jeunes gens et leurs parents ;
– et comme pour tout médicament et donc vaccin, la tolérance, avec un profil de sécurité satisfaisant, en particulier avec la disponibilité de données post- commercialisation de Gardasil ;
– l’évaluation médico-économique et l’impact en santé publique du vaccin Gardasil 9, très dépendants de la différence de coût de ce vaccin par rapport à Gardasil.
La mise à disposition du vaccin Gardasil 9 n’a pas modifié la stratégie de prévention par la vaccination des infections et des maladies dues aux papillomavirus, au regard de la saisine de la Direction générale de la santé.
Le vaccin Gardasil 9 a été recommandé à partir de 2016 chez les jeunes filles et les jeunes femmes non vaccinées antérieurement selon le schéma à deux doses chez celles âgées de 11 à 14 ans révolus et à trois doses chez celles âgées de 15 à 19 ans révolus. Pour celles ayant reçu un schéma complet avec Gardasil ou Cervarix, il n’a pas été recommandé de revaccination.
En l’absence de données disponibles en termes d’efficacité, d’immunogénicité ou de tolérance sur l’interchangeabilité des vaccins Gardasil ou Cervarix par Gardasil 9, il a été recommandé que la vaccination initiée par Gardasil ou Cervarix soit poursuivie avec le même vaccin.
Chez les hommes homosexuels, il a été recommandé que la vaccination contre les papillomavirus soit aussi initiée avec Gardasil 9 jusqu’à l’âge de 26 ans selon un schéma à trois doses, sans revaccination de ceux ayant déjà reçu un schéma complet avec Gardasil.
Chez les personnes immunodéprimées, le niveau de preuve scientifique est très faible (pas d’études réalisées chez ces personnes). Toutefois, il a été recommandé que ce vaccin selon un schéma à trois doses puisse être administré chez les jeunes filles et les garçons de 11 à 19 ans. Pour les enfants, filles ou garçons, candidats à une transplantation d’organe solide, cette vaccination peut être initiée dès l’âge de 9 ans.
Une couverture vaccinale insuffisante
La mise en œuvre de la politique vaccinale contre les infections à papillomavirus et les lésions associées s’est rapidement heurtée à de nombreux questionnements. Pour les praticiens, quand proposer cette vaccination puisqu’elle était recommandée en 2007 à 14 ans, ce qui instaurait un nouveau rendez-vous vaccinal ? Quelle est l’efficacité de cette vaccination dans la mesure où les cancers du col se développent plusieurs années après les lésions précancéreuses de haut grade ? Que répondre aux familles quant à la sécurité de ces vaccins (nouveaux vaccins avec adjuvants, risque de cette vaccination avec la survenue de maladies dysimmunitaires) ? Pour les familles, quel est l’intérêt de cette vaccination puisque le dépistage du cancer du col par frottis cervico-vaginal est toujours recommandé ? Comment aborder cette vaccination avec le début de la vie sexuelle ?
À cela s’est ajouté le coût de la vaccination. En 2007, le reste à charge avec un schéma à trois doses était non négligeable pour les familles ; le remboursement parl’Assurance maladie étant de 65 % pour un montant par dose de plus de 110 €. Pour Gardasil 9, la Commission de la transparence a statué sur un SMR important pour les populations à qui cette vaccination est recommandée, mais sur l’absence d’amélioration du service médical rendu (ASMR V) par rapport à Gardasil, ce qui a ajouté de la confusion dans les messages.16
Le Comité d’orientation de la concertation citoyenne sur la vaccination présumait en novembre 2016 que la prise en charge intégrale par la collectivité du coût des vaccins serait de nature à améliorer directement la couverture vaccinale contre les papillomavirus et, surtout, marquerait l’engagement des pouvoirs publics dans cette politique.17 Ce comité indiquait aussi que la question de la vaccination universelle incluant les garçons devait être réexaminée.
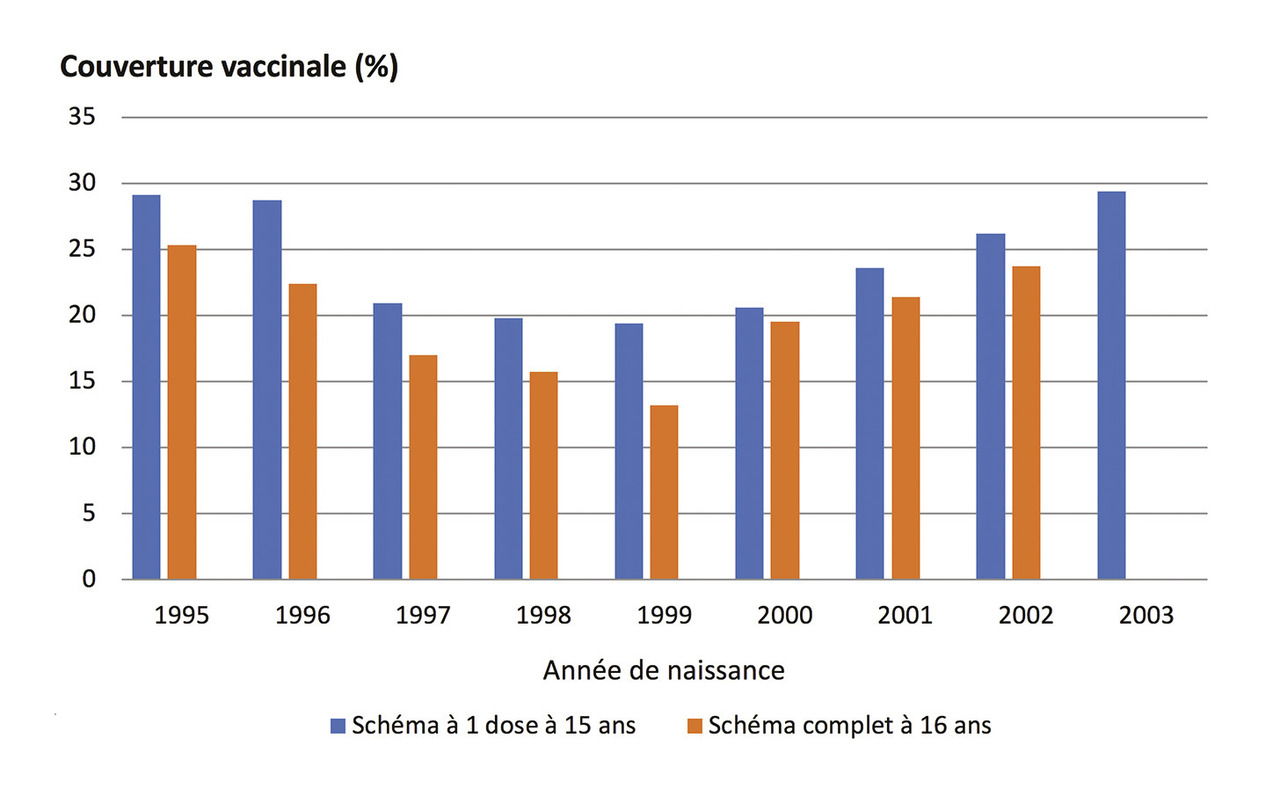
Tous ces points ont participé à une large défiance vis-à-vis de cette vaccination et donc à une couverture vaccinale insuffisante. En France, le suivi de la couverture vaccinale apportée par les vaccins contre les papillomavirus est réalisé à partir de « l’échantillon généraliste des bénéficiaires » (Caisse nationale d’assurance maladie des travailleurs salariés/Santé publique France) chez les jeunes filles éligibles à la vaccination, soit les jeunes filles nées depuis 1993 (14 ans en 2007). En décembre 2018, la couverture vaccinale chez celles âgées de 16 ans (nées en 2002) est de 23,7 % (v. figure ) alors que l’objectif fixé dans le Plan cancer 2014-2019 était d’atteindre une couverture vaccinale de 60 % chez les filles de 11 à 14 ans révolus. Or, depuis l’introduction de cette vaccination dans le calendrier vaccinal, la couverture vaccinale n’a jamais dépassé 30 %, en dépit des preuves de l’efficacité de ces vaccins, en vie réelle, et d’une littérature scientifique indépendante démontrant leur sécurité.14, 18
À cela s’est ajouté le coût de la vaccination. En 2007, le reste à charge avec un schéma à trois doses était non négligeable pour les familles ; le remboursement parl’Assurance maladie étant de 65 % pour un montant par dose de plus de 110 €. Pour Gardasil 9, la Commission de la transparence a statué sur un SMR important pour les populations à qui cette vaccination est recommandée, mais sur l’absence d’amélioration du service médical rendu (ASMR V) par rapport à Gardasil, ce qui a ajouté de la confusion dans les messages.16
Le Comité d’orientation de la concertation citoyenne sur la vaccination présumait en novembre 2016 que la prise en charge intégrale par la collectivité du coût des vaccins serait de nature à améliorer directement la couverture vaccinale contre les papillomavirus et, surtout, marquerait l’engagement des pouvoirs publics dans cette politique.17 Ce comité indiquait aussi que la question de la vaccination universelle incluant les garçons devait être réexaminée.
Tous ces points ont participé à une large défiance vis-à-vis de cette vaccination et donc à une couverture vaccinale insuffisante. En France, le suivi de la couverture vaccinale apportée par les vaccins contre les papillomavirus est réalisé à partir de « l’échantillon généraliste des bénéficiaires » (Caisse nationale d’assurance maladie des travailleurs salariés/Santé publique France) chez les jeunes filles éligibles à la vaccination, soit les jeunes filles nées depuis 1993 (14 ans en 2007). En décembre 2018, la couverture vaccinale chez celles âgées de 16 ans (nées en 2002) est de 23,7 % (
Recommandations de la vaccination dans les autres pays
En 2018, tous les pays d’Europe ont introduit la vaccination contre les papillomavirus dans leurs programmes nationaux, soit dans le cadre de recommandations générales incluant les filles et/ou les garçons, soit uniquement chez les filles19 et selon des classes d’âge différentes. Certains pays ont étendu ou vont étendre cette vaccination chez les garçons. Il s’agit de l’Allemagne, l’Australie, la Croatie, le Danemark, l’Italie, le Liechtenstein, la Norvège, le Royaume-Uni. Tous les pays recommandent cette vaccination au cours de la préadolescence, de l’adolescence, voire à l’âge adulte, de 9 à 26 ans selon les pays, incluant ou non à un programme de rattrapage. Cette vaccination est totalement ou partiellement prise en charge par l’assurance maladie de ces pays avec des exceptions. En Grèce, alors que la vaccination contre les papillomavirus est recommandée en rattrapage chez les femmes de 19-26 ans, elle n’est pas prise en charge. En République tchèque, la vaccination n’est pas remboursée chez les 18 ans et plus. En Pologne et en Roumanie, aucune prise en charge n’est assurée par le système de santé, et cela quelle que soit la classe d’âge des jeunes femmes vaccinées.
En Europe, l’European Centrer for Disease Prevention and Control (ECDC) a ouvert en avril 2019 une large consultation afin de déterminer les critères qui définissent la politique vaccinale vis-à-vis des infections à papillomavirus au niveau des pays européens auprès des citoyens et des associations, des professionnels de santé, des autorités sanitaires. Cette consultation qui s’adresse à un large public (citoyens, associations, professionnels de santé, autorités sanitaires) a pour objectif de produire des documents scientifiques, des éléments de communication concernant les questions relatives à l’efficacité de la vaccination contre les papillomavirus, sa tolérance, mais également des pistes pour améliorer son acceptabilité.20 En effet, la défiance vis-à-vis de cette vaccination se traduisant par des couvertures vaccinales faibles n’est pas seulement observée en France mais aussi en Allemagne, avec une couverture vaccinale inférieure à 50 %, au Danemark où la couverture vaccinale a fortement baissé, passant de 80 % en 2014 à 25 % en 2018. Cependant, dans d’autres pays, cette vaccination ne fait pas l’objet d’une telle défiance, et des couvertures vaccinales supérieures à 60 % sont observées. C’est le cas en Autriche, en Belgique, dans la région des Flandres, en Espagne, en Finlande, en Hongrie, en Islande, à Malte, en Norvège, en Suède et au Royaume-Uni.20
En Angleterre, 10 ans après l’introduction de la vaccination chez les jeunes filles, son impact a été évalué en termes de réduction de 86 % de l’incidence des infections dues aux papillomavirus 16 et 18, avec une couverture vaccinale supérieure à 80 %.
Dans le monde, en 2016, 86 pays ont introduit cette vaccination au niveau national ou régional.21
En Australie, la recommandation de vacciner les filles date de 2007 et celle des garçons de 2013. Cette vaccination, qui peut être réalisée en milieu scolaire, a été acceptée sans difficulté par la population, avec une couverture vaccinale d’au moins 80 %. Cela a eu pour conséquence une réduction de plus de 77 % des génotypes responsables de 75 % des cancers du col de l’utérus, et une diminution de plus de 50 % de l’incidence des lésions précancéreuses cervicales de haut grade chez les jeunes filles de moins de 20 ans.22 Le succès de cette campagne de vaccination ouvre la perspective de l’éradication du cancer du col dans ce pays d’ici une vingtaine d’années.
En Europe, l’European Centrer for Disease Prevention and Control (ECDC) a ouvert en avril 2019 une large consultation afin de déterminer les critères qui définissent la politique vaccinale vis-à-vis des infections à papillomavirus au niveau des pays européens auprès des citoyens et des associations, des professionnels de santé, des autorités sanitaires. Cette consultation qui s’adresse à un large public (citoyens, associations, professionnels de santé, autorités sanitaires) a pour objectif de produire des documents scientifiques, des éléments de communication concernant les questions relatives à l’efficacité de la vaccination contre les papillomavirus, sa tolérance, mais également des pistes pour améliorer son acceptabilité.20 En effet, la défiance vis-à-vis de cette vaccination se traduisant par des couvertures vaccinales faibles n’est pas seulement observée en France mais aussi en Allemagne, avec une couverture vaccinale inférieure à 50 %, au Danemark où la couverture vaccinale a fortement baissé, passant de 80 % en 2014 à 25 % en 2018. Cependant, dans d’autres pays, cette vaccination ne fait pas l’objet d’une telle défiance, et des couvertures vaccinales supérieures à 60 % sont observées. C’est le cas en Autriche, en Belgique, dans la région des Flandres, en Espagne, en Finlande, en Hongrie, en Islande, à Malte, en Norvège, en Suède et au Royaume-Uni.20
En Angleterre, 10 ans après l’introduction de la vaccination chez les jeunes filles, son impact a été évalué en termes de réduction de 86 % de l’incidence des infections dues aux papillomavirus 16 et 18, avec une couverture vaccinale supérieure à 80 %.
Dans le monde, en 2016, 86 pays ont introduit cette vaccination au niveau national ou régional.21
En Australie, la recommandation de vacciner les filles date de 2007 et celle des garçons de 2013. Cette vaccination, qui peut être réalisée en milieu scolaire, a été acceptée sans difficulté par la population, avec une couverture vaccinale d’au moins 80 %. Cela a eu pour conséquence une réduction de plus de 77 % des génotypes responsables de 75 % des cancers du col de l’utérus, et une diminution de plus de 50 % de l’incidence des lésions précancéreuses cervicales de haut grade chez les jeunes filles de moins de 20 ans.22 Le succès de cette campagne de vaccination ouvre la perspective de l’éradication du cancer du col dans ce pays d’ici une vingtaine d’années.
Élargissement de la vaccination aux garçons
En décembre 2019, la politique vaccinale contre les maladies à papillomavirus a été réexaminée par la HAS, en raison de l’insuffisance de la couverture vaccinale qui ne permet pas de protéger indirectement les jeunes hommes et les hétérosexuels comme cela avait été défini dans les programmes vaccinaux précédents.23 Dans le rapport présenté par la HAS, outre l’actualisation des données d’incidence des maladies à papillomavirus chez les femmes et les hommes, de nouveaux arguments ont été pris en compte pour élargir la vaccination aux garçons par rapport à la recommandation de 2016. Il s’agit des données de sécurité des vaccins chez l’homme similaires à ce qui est observé chez la femme, de l’efficacité des vaccins Gardasil et Gardasil 9 chez l’homme jusqu’à 26 ans dans la prévention des condylomes anogénitaux et les lésions précancéreuses de l’anus. Une revue systématique de la littérature conduite en 2017 sur 15 études menées majoritairement aux États-Unis a permis de souligner les critères d’acceptabilité de la vaccination chez les garçons et leurs parents.24 Il s’agit de facteurs individuels : connaissance des maladies liées aux papillomavirus, information sur les vaccins, données de sécurité vaccinale, relation entre le praticien et les garçons et leurs parents. Des critères sociétaux ont été cités : acceptation de la notion de sexualité des enfants par leurs parents, équité en santé sans différence sur le genre. Par ailleurs, il existe une dynamique de cette vaccination en Europe avec l’intégration de la recommandation vaccinale chez les garçons dans de nombreux pays en milieu scolaire. Élargir la vaccination contre les papillomavirus aux garçons va-t-il favoriser la vaccination chez les jeunes filles ? Au vu de ce qui est observé aux États-Unis, la vaccination des garçons recommandée depuis 2011 a eu un impact favorable bien que modéré sur la couverture vaccinale des filles. Bien que l’impact populationnel de la vaccination universelle contre les papillomavirus ne soit pas comparable suivant les politiques vaccinales des pays (définition des maladies liées aux papillomavirus évitables par la vaccination, durée de protection des vaccins, coût des vaccins), la stratégie coût-efficace en France en termes de santé publique reste l’augmentation de la couverture vaccinale chez les filles. La recommandation de la HAS d’élargir la vaccination aux garçons selon le même schéma vaccinal que chez les filles, c’est-à-dire deux doses de Gardasil 9 chez les 11-14 ans révolus et rattrapage jusqu’à 19 ans selon un schéma à trois doses, est accompagnée d’éléments qui doivent favoriser la mise en œuvre de cette vaccination. Le schéma vaccinal chez les hommes homosexuels est maintenu jusqu’à 26 ans (3 doses). Les leviers de cette nouvelle politique vaccinale sont de proposer plus systématiquement cette vaccination par les professionnels de santé, de restaurer la confiance auprès du public et des professionnels de santé (composition et tolérance des vaccins), de faciliter l’accès à la vaccination (prise en charge du coût de la vaccination, augmentation du nombre de structures de santé où cette vaccination peut être proposée). La vaccination universelle contre les papillomavirus va être inscrite au calendrier vaccinal 2020.
Filles et garçons
En France, l’augmentation de la couverture vaccinale des jeunes filles reste la priorité pour la prévention des maladies liées à l’infection par les papillomavirus. Cependant, la politique vaccinale se heurte depuis plus de 10 ans à une défiance globale à l’égard de toute vaccination et aux difficultés d’aborder les questions relatives aux bénéfices de cette vaccination et à la sécurité des vaccins.
Réviser la politique vaccinale avec la recommandation d’étendre la vaccination aux garçons en dehors de toute orientation sexuelle est une des nouvelles recommandations vaccinales inscrites au calendrier vaccinal 2020. L’approche en sciences humaines et sociales est aussi indispensable, avec la disponibilité d’une information large, transparente, pragmatique pour les professionnels de santé et le public, accessible à toutes les catégories socio-économiques. Des efforts d’information et de communication sont amorcés avec la mise à disposition depuis 2017 d’outils en ligne comme le site vaccination-info-service.fr.
Réviser la politique vaccinale avec la recommandation d’étendre la vaccination aux garçons en dehors de toute orientation sexuelle est une des nouvelles recommandations vaccinales inscrites au calendrier vaccinal 2020. L’approche en sciences humaines et sociales est aussi indispensable, avec la disponibilité d’une information large, transparente, pragmatique pour les professionnels de santé et le public, accessible à toutes les catégories socio-économiques. Des efforts d’information et de communication sont amorcés avec la mise à disposition depuis 2017 d’outils en ligne comme le site vaccination-info-service.fr.
Références
1. International Agency for Research on Cancer. Human papillomaviruses. Dans: IARC monographs on the evaluation of carcinogenic risks to humans. Volume 100B. Biological agents. Lyon: IARC; 2012. https://monographs.iarc.fr/iarc-monographs-on-theevaluation-of-carcinogenic-risks-to-humans-20/
2. HPV Information Centre. HPV prevalence estimates - Invasive cervical cancer - Top 10 HPV oncogenic types (Country/Regions). 2018. http://www.hpvcentre.net/datastatistics.php
3. Shield KD, Marant Micallef C, et al. New cancer cases in France in 2015 attributable to infectious agents: a systematic review and meta-analysis. Eur J Epidemiol 2018;33:263-74.
4. European Medicines Agency. EPAR CERVARIX® 2007: www.ema.europa.eu/en/documents/scientific-discussion/CERVARIX®-epar-scientific-discussion_en.pdf
5. European Medicines Agency. EPAR GARDASIL® 2006. www.emea.eu.int/humandocs/PDFs/EPAR/GARDASIL®i®/H-703-PI-fr.pdf
6. Calendrier vaccinal 2008. Avis du Haut Conseil de la santé publique. BEH 2008;16-17. http://beh.santepubliquefrance.fr/beh/2008/16_17/index.htm
7. Haut Conseil de la santé publique. Infections à HPV des jeunes filles : révision de l’âge de vaccination, Avis HCSP, février 2012. http://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=302
8. Calendrier vaccinal 2016. http://socialsante.gouv.fr/IMG/pdf/calendrier_vaccinal_2016.pdf
9. Haut Conseil de santé publique. Vaccinations des personnes immunodéprimées ou aspléniques. Rapport HCSP, décembre 2014 (2e édition). http://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=504
10. Drolet M, Bénard É, Boily MC, et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2015;15:565-80.
11. Haut Conseil de la santé publique. Recommandations vaccinales contre les infections HPV chez les hommes. HCSP, 2016. https://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=553
12. Collange F, Fressard L, Pulcini C, Sebbah R, Peretti-Watel P, Verger P. General practitioners, attitudes and behaviors toward HPV vaccination: A French national survey. Vaccine 2016;34:762-8.
13. Lasset C, Kalecinski J, Regnier V, et al. Practices and opinions regarding HPV vaccination among French general practitioners: evaluation through two crosssectional studies in 2007 and 2010. Int J Public Health 2014;59:519-28.
14. Holman DM, Benard V, Roland KB, Watson M, Liddon N, Stokley S. Barriers to human papillomavirus vaccination among US adolescents: a systematic review of the literature. JAMA Pediatr 2014;168:76-82.
15. Haut Conseil de la santé publique. Prévention des infections à HPV. Place du GARDASIL® 9. Rapport HCSP, 2017. https://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=602
16. Haute Autorité de santé. Avis de la commission de la transparence sur GARDASIL® 9. HAS, 2017. https://www.has-sante.fr/portail/jcms/c_2796800/fr/GARDASIL®i®-9-vaccin-papillomavirus-humain-9-valent
17. Comité d’orientation de la concertation citoyenne sur la vaccination. 2016. Rapport : http://concertation-vaccination.fr/wp-content/uploads/2016/11/Rapport- de-la-concertation-citoyenne-sur-la-vaccination.pdf
18. Chandler R, Juhlin K, Fransson J, Caster O, Edwards R, Noren N. Current safety concerns with human papillomavirus vaccine: a cluster analysis of reports in VigiBase. Drug Saf 2017;40:81-90.
19. European Centre for Disease Prevention and Control. ECDC Vaccine schedule. https://vaccine-schedule.ecdc.europa.eu/Scheduler/ByDisease?SelectedDiseaseId= 38&SelectedCountryIdByDisease=-1
20. European Centre for Disease Prevention and Control. Public consultation on draft guidance for introduction of HPV vaccines in EU countries: focus on 9-valent HPV vaccine and vaccination of boys and people living with HIV. ECDC, 2019. https://ecdc.europa.eu/sites/portal/files/documents/hpv-public-consultation-3-April.pdf
21. Gallagher KE, La Montagne DS, Watson-Jones D. Status of HPV vaccine introduction and barriers. Vaccine 2018;36:4761-7.
22. Brotherton JM, Gertig DM, May C, Chappell G, Saville M. HPV vaccine impact in Australian women: ready for an HPV-based screening program. Med J Aust 2016;204(5):184.
23. Haute Autorité de santé. Élargissement de la vaccination contre les papillomavirus aux garçons. 2019. www.has-sante.fr ou http://bit.ly/2SPwMqP
24. Lacombe-Duncan A, Newman PA, Baiden P. Human papillomavirus vaccine acceptability and decision-making among adolescent boys and parents: a meta-ethnography of qualitative studies. Vaccine 2018;36:2545-58.
2. HPV Information Centre. HPV prevalence estimates - Invasive cervical cancer - Top 10 HPV oncogenic types (Country/Regions). 2018. http://www.hpvcentre.net/datastatistics.php
3. Shield KD, Marant Micallef C, et al. New cancer cases in France in 2015 attributable to infectious agents: a systematic review and meta-analysis. Eur J Epidemiol 2018;33:263-74.
4. European Medicines Agency. EPAR CERVARIX® 2007: www.ema.europa.eu/en/documents/scientific-discussion/CERVARIX®-epar-scientific-discussion_en.pdf
5. European Medicines Agency. EPAR GARDASIL® 2006. www.emea.eu.int/humandocs/PDFs/EPAR/GARDASIL®i®/H-703-PI-fr.pdf
6. Calendrier vaccinal 2008. Avis du Haut Conseil de la santé publique. BEH 2008;16-17. http://beh.santepubliquefrance.fr/beh/2008/16_17/index.htm
7. Haut Conseil de la santé publique. Infections à HPV des jeunes filles : révision de l’âge de vaccination, Avis HCSP, février 2012. http://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=302
8. Calendrier vaccinal 2016. http://socialsante.gouv.fr/IMG/pdf/calendrier_vaccinal_2016.pdf
9. Haut Conseil de santé publique. Vaccinations des personnes immunodéprimées ou aspléniques. Rapport HCSP, décembre 2014 (2e édition). http://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=504
10. Drolet M, Bénard É, Boily MC, et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2015;15:565-80.
11. Haut Conseil de la santé publique. Recommandations vaccinales contre les infections HPV chez les hommes. HCSP, 2016. https://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=553
12. Collange F, Fressard L, Pulcini C, Sebbah R, Peretti-Watel P, Verger P. General practitioners, attitudes and behaviors toward HPV vaccination: A French national survey. Vaccine 2016;34:762-8.
13. Lasset C, Kalecinski J, Regnier V, et al. Practices and opinions regarding HPV vaccination among French general practitioners: evaluation through two crosssectional studies in 2007 and 2010. Int J Public Health 2014;59:519-28.
14. Holman DM, Benard V, Roland KB, Watson M, Liddon N, Stokley S. Barriers to human papillomavirus vaccination among US adolescents: a systematic review of the literature. JAMA Pediatr 2014;168:76-82.
15. Haut Conseil de la santé publique. Prévention des infections à HPV. Place du GARDASIL® 9. Rapport HCSP, 2017. https://www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=602
16. Haute Autorité de santé. Avis de la commission de la transparence sur GARDASIL® 9. HAS, 2017. https://www.has-sante.fr/portail/jcms/c_2796800/fr/GARDASIL®i®-9-vaccin-papillomavirus-humain-9-valent
17. Comité d’orientation de la concertation citoyenne sur la vaccination. 2016. Rapport : http://concertation-vaccination.fr/wp-content/uploads/2016/11/Rapport- de-la-concertation-citoyenne-sur-la-vaccination.pdf
18. Chandler R, Juhlin K, Fransson J, Caster O, Edwards R, Noren N. Current safety concerns with human papillomavirus vaccine: a cluster analysis of reports in VigiBase. Drug Saf 2017;40:81-90.
19. European Centre for Disease Prevention and Control. ECDC Vaccine schedule. https://vaccine-schedule.ecdc.europa.eu/Scheduler/ByDisease?SelectedDiseaseId= 38&SelectedCountryIdByDisease=-1
20. European Centre for Disease Prevention and Control. Public consultation on draft guidance for introduction of HPV vaccines in EU countries: focus on 9-valent HPV vaccine and vaccination of boys and people living with HIV. ECDC, 2019. https://ecdc.europa.eu/sites/portal/files/documents/hpv-public-consultation-3-April.pdf
21. Gallagher KE, La Montagne DS, Watson-Jones D. Status of HPV vaccine introduction and barriers. Vaccine 2018;36:4761-7.
22. Brotherton JM, Gertig DM, May C, Chappell G, Saville M. HPV vaccine impact in Australian women: ready for an HPV-based screening program. Med J Aust 2016;204(5):184.
23. Haute Autorité de santé. Élargissement de la vaccination contre les papillomavirus aux garçons. 2019. www.has-sante.fr ou http://bit.ly/2SPwMqP
24. Lacombe-Duncan A, Newman PA, Baiden P. Human papillomavirus vaccine acceptability and decision-making among adolescent boys and parents: a meta-ethnography of qualitative studies. Vaccine 2018;36:2545-58.
Dans cet article
- Une politique de vaccination définie par le ministère de la Santé
- Vacciner pour prévenir les lésions génitales précancéreuses
- Évolution des recommandations vaccinales et élargissement des indications
- Place de Gardasil 9 dans la prévention des maladies à papillomavirus
- Une couverture vaccinale insuffisante
- Recommandations de la vaccination dans les autres pays
- Élargissement de la vaccination aux garçons
- Filles et garçons