Informer systématiquement tous les patients exposés à une situation à risque
La congélation cellulaire à des fins de préservation consiste à protéger et conserver par refroidissement les cellules, qui peuvent être issues de différents tissus. Ces cellules sont maintenues dans un état de vie et d'animation suspendues à des températures dites cryogéniques dans l’azote liquide (-196 °C) ou dans les vapeurs d’azote (-140 °C). Ces procédures de congélation cellulaire sont utilisées chez l’homme et la femme pour conserver les gamètes (ovocytes ou spermatozoïdes), les embryons ou les tissus germinaux (ovaire ou testicule) en vue d’une utilisation ultérieure dans le cadre d’une assistance médicale à la procréation (AMP).
En 1953, la première grossesse obtenue chez un couple infertile après insémination à l’aide de spermatozoïdes congelés conduit à la création des premières banques de spermatozoïdes humains dans le cadre du don, tout d’abord aux États-Unis et, à partir de 1973, en France.1, 2 L’avènement de la fécondation in vitro (FIV), avec la naissance en 1978 de Louise Brown en Grande- Bretagne, va très rapidement conduire à l’introduction des protocoles de stimulation ovarienne permettant l’obtention simultanée de plusieurs embryons viables en FIV et imposant de mettre au point une procédure de congélation des embryons viables non transférés. Ainsi, en Australie, le premier bébé obtenu après transfert d’embryon décongelé voit le jour en 1984.3 En 1986 a lieu la première naissance obtenue à l’aide d’ovocytes matures congelés par congélation lente4 et, en 1999, après utilisation d’ovocytes matures congelés par congélation ultrarapide ou vitrification.5 En 1996 sont rapportées les premières congélations de fragments de tissu ovarien chez la femme.6 Enfin, les premières congélations de tissu testiculaire chez le garçon prépubère sont décrites en 2007.7
La majorité de ces techniques de congélation, à l’exception de la congélation des tissus germinaux, a été développée dans le cadre de la prise en charge d’une infertilité de couple nécessitant le recours à une AMP intraconjugale ou avec tiers donneur (ovocytes, spermatozoïdes et embryons). Progressivement, ces techniques vont être utilisées pour préserver la fertilité d’hommes ou de femmes qui vont être exposés à un traitement dit gonadotoxique, le plus souvent utilisé dans le champ du cancer, susceptible d’altérer prématurément leur fertilité.
En 1973, la création, en France, du premier centre d’étude et de conservation des œufs et du sperme humains (CECOS) sous la responsabilité du Pr Georges David, va permettre non seulement de créer la première banque de spermatozoïdes congelés en vue de dons mais de proposer également la congélation de spermatozoïdes en vue de préserver la fertilité de huit jeunes hommes adultes avant un traitement du cancer. De nouveaux CECOS vont s’établir dans différents centres hospitaliers universitaires, aboutissant en 1983 à la création de la Fédération des CECOS, constituant le premier réseau national et international pour la prise en charge du don de spermatozoïdes et la préservation de la fertilité de l’homme jeune adulte.1
En 1953, la première grossesse obtenue chez un couple infertile après insémination à l’aide de spermatozoïdes congelés conduit à la création des premières banques de spermatozoïdes humains dans le cadre du don, tout d’abord aux États-Unis et, à partir de 1973, en France.1, 2 L’avènement de la fécondation in vitro (FIV), avec la naissance en 1978 de Louise Brown en Grande- Bretagne, va très rapidement conduire à l’introduction des protocoles de stimulation ovarienne permettant l’obtention simultanée de plusieurs embryons viables en FIV et imposant de mettre au point une procédure de congélation des embryons viables non transférés. Ainsi, en Australie, le premier bébé obtenu après transfert d’embryon décongelé voit le jour en 1984.3 En 1986 a lieu la première naissance obtenue à l’aide d’ovocytes matures congelés par congélation lente4 et, en 1999, après utilisation d’ovocytes matures congelés par congélation ultrarapide ou vitrification.5 En 1996 sont rapportées les premières congélations de fragments de tissu ovarien chez la femme.6 Enfin, les premières congélations de tissu testiculaire chez le garçon prépubère sont décrites en 2007.7
La majorité de ces techniques de congélation, à l’exception de la congélation des tissus germinaux, a été développée dans le cadre de la prise en charge d’une infertilité de couple nécessitant le recours à une AMP intraconjugale ou avec tiers donneur (ovocytes, spermatozoïdes et embryons). Progressivement, ces techniques vont être utilisées pour préserver la fertilité d’hommes ou de femmes qui vont être exposés à un traitement dit gonadotoxique, le plus souvent utilisé dans le champ du cancer, susceptible d’altérer prématurément leur fertilité.
En 1973, la création, en France, du premier centre d’étude et de conservation des œufs et du sperme humains (CECOS) sous la responsabilité du Pr Georges David, va permettre non seulement de créer la première banque de spermatozoïdes congelés en vue de dons mais de proposer également la congélation de spermatozoïdes en vue de préserver la fertilité de huit jeunes hommes adultes avant un traitement du cancer. De nouveaux CECOS vont s’établir dans différents centres hospitaliers universitaires, aboutissant en 1983 à la création de la Fédération des CECOS, constituant le premier réseau national et international pour la prise en charge du don de spermatozoïdes et la préservation de la fertilité de l’homme jeune adulte.1
Préservation de la fertilité : pourquoi, pour qui et comment ?
La préservation de la fertilité s’est initialement développée dans le champ du cancer avant d’être proposée hors de ce champ.
Préservation de la fertilité dans le champ du cancer
Une augmentation de 89 % du nombre de cas de cancer a été observée en France entre 1980 et 2005. À partir de 2005, on note une diminution du taux d’incidence chez l’homme et une stabilisation chez la femme.8 Cependant, la survie après un traitement du cancer s’est considérablement améliorée au cours des 30 dernières années du fait de l’amélioration du diagnostic et de l’efficacité des traitements. Ainsi, le taux de mortalité par cancer diminue régulièrement depuis 1980 tant chez l’homme que chez la femme.8 Chez la femme, le taux de survie à 5 ans, tous cancers confondus, est de 66 %, sensiblement plus élevé par comparaison à l’homme. Cependant, cette survie à 5 ans est proche de 75 % chez l’enfant et l’adolescent.8
L’augmentation de l’efficacité des traitements du cancer s’accompagne d’une augmentation de leur toxicité. Les complications ou les séquelles ne sont pas exceptionnelles chez les patients guéris d’un cancer. Ces séquelles sont extrêmement variables dans leur type, leur intensité et leur retentissement sur la qualité de vie, parmi lesquelles on citera les altérations de la fonction de reproduction, trop souvent oubliées.9 En effet, les gonades constituent une cible de choix de cette toxicité, le testicule étant plus vulnérable que l’ovaire. La cellule germinale immature est la cellule cible de cette toxicité : spermatogonies souches dans les tubes séminifères chez l’homme (avec en cas d’atteinte un risque de non-récupération de la gamétogenèse) et stock d’ovocytes I contenus dans les follicules primordiaux chez la femme. Ainsi, la gonade (ovaire ou testicule) peut être atteinte à la fois au niveau de sa fonction endocrine (follicules ovariens ou cellules de Leydig) et de sa fonction exocrine (élaboration des gamètes matures [ovocytes II ou spermatozoïdes]). Les effets toxiques des traitements sur la gonade et leur intensité dépendent du type de traitement utilisé (radiothérapie, chimiothérapie, chirurgie de la gonade ou du tractus génital, biothérapie, hormonothérapie…), de la dose cumulée reçue et de leur durée. Indépendamment de ces paramètres, le facteur individuel – qui correspond soit à la fonctionnalité de la gonade au moment du traitement, soit à une sensibilité plus importante de celle-ci à l’effet toxique des traitements – est souvent plus difficile à évaluer.9
L’augmentation de l’efficacité des traitements du cancer s’accompagne d’une augmentation de leur toxicité. Les complications ou les séquelles ne sont pas exceptionnelles chez les patients guéris d’un cancer. Ces séquelles sont extrêmement variables dans leur type, leur intensité et leur retentissement sur la qualité de vie, parmi lesquelles on citera les altérations de la fonction de reproduction, trop souvent oubliées.9 En effet, les gonades constituent une cible de choix de cette toxicité, le testicule étant plus vulnérable que l’ovaire. La cellule germinale immature est la cellule cible de cette toxicité : spermatogonies souches dans les tubes séminifères chez l’homme (avec en cas d’atteinte un risque de non-récupération de la gamétogenèse) et stock d’ovocytes I contenus dans les follicules primordiaux chez la femme. Ainsi, la gonade (ovaire ou testicule) peut être atteinte à la fois au niveau de sa fonction endocrine (follicules ovariens ou cellules de Leydig) et de sa fonction exocrine (élaboration des gamètes matures [ovocytes II ou spermatozoïdes]). Les effets toxiques des traitements sur la gonade et leur intensité dépendent du type de traitement utilisé (radiothérapie, chimiothérapie, chirurgie de la gonade ou du tractus génital, biothérapie, hormonothérapie…), de la dose cumulée reçue et de leur durée. Indépendamment de ces paramètres, le facteur individuel – qui correspond soit à la fonctionnalité de la gonade au moment du traitement, soit à une sensibilité plus importante de celle-ci à l’effet toxique des traitements – est souvent plus difficile à évaluer.9
Chez l’homme
Le traitement du cancer a pour conséquence une diminution plus ou moins importante de la production de spermatozoïdes, qui peut conduire à une azoospermie non obstructive pour les traitements les plus toxiques (agents alkylants à forte dose, radiothérapie testiculaire directe, chimiothérapie et/ou radiothérapie avant allo- ou autogreffe de cellules souches hématopoïétiques). La fonction endocrine est plus exceptionnellement altérée.9 La chirurgie du cancer peut également altérer la fertilité de l’homme, comme l’orchidectomie uni- ou bilatérale pour traiter le cancer du testicule ou toute intervention chirurgicale susceptible d’entraîner une anéjaculation ou une éjaculation rétrograde, voire des troubles de l’érection comme la prostatectomie radicale et certains curages ganglionnaires rétropéritonéaux.10Chez la femme
Le traitement du cancer peut retentir sur la fertilité future de la patiente du fait non seulement de la toxicité propre du traitement sur la réserve ovarienne en follicules primordiaux mais aussi du report de la grossesse induit par la durée du traitement et la surveillance post-thérapeutique nécessaire pour autoriser la grossesse et en raison de la plus grande prévalence des désunions de couples dans le contexte de la maladie. La réserve ovarienne de la femme est particulièrement liée à son âge mais varie d’une femme à l’autre pour une même classe d’âge.11 Le traitement du cancer a pour conséquences : une diminution quasi systématique de la réserve ovarienne avec un raccourcissement de la période de fertilité ; la survenue d’une insuffisance ovarienne prématurée avec aménorrhée secondaire pour les patientes les plus âgées ou à faible réserve ovarienne au moment du diagnostic de la maladie ; la radiothérapie pelvienne ou abdominale peut de manière additionnelle altérer la fonctionnalité de l’utérus (utérus radique) et compromettre les chances d’implantation embryonnaire et donc de grossesse. L’ovariectomie uni- ou bilatérale proposée dans le traitement du cancer de l’ovaire, ou autre tumeur pelvienne ou abdominale avec atteinte ovarienne, peut aussi entraver la fertilité de la femme. Les pathologies hématologiques malignes (leucémies aiguës, lymphome malin hodgkinien ou non hodgkinien) et le cancer du sein sont les plus fréquemment rencontrées chez les femmes pubères ayant recours à une préservation de la fertilité, les leucémies aiguës et les tumeurs du système nerveux central chez les jeunes filles prépubères.11Préservation de la fertilité hors champ du cancer
Des traitements médicamenteux gonadotoxiques (agents alkylants, certains traitements immunosuppresseurs…) peuvent également être proposés dans les pathologies hématologiques non malignes, les maladies du système immunitaire… Une préservation de la fertilité peut également être réalisée avant allo- ou autogreffe de cellules souches hématopoïétiques. La chirurgie gonadique est une indication au recours aux techniques de préservation de la fertilité. Enfin, les atteintes congénitales de la gonade, le plus souvent d’origine génétique, peuvent altérer prématurément la production de gamètes matures responsables d’une perte prématurée des spermatogonies souches entraînant une azoospermie non obstructive chez l’homme et des follicules primordiaux entraînant une insuffisance ovarienne prématurée chez la femme.11, 12
Avant la puberté, deux autres indications plus exceptionnelles de préservation de la fertilité, en dehors du contexte de l’allo- ou autogreffe de cellules souches hématopoïétiques, sont représentées par les garçons prépubères ou adolescents ayant un syndrome de Klinefelter ou les garçons prépubères ayant une cryptorchidie, la préservation de la fertilité étant pratiquée lors de l’orchidopexie du testicule de façon uni- ou bilatérale.12
Chez l’homme
Après la puberté, la préservation de la fertilité est ainsi proposée :10 avant toute intervention chirurgicale susceptible d’entraîner une anéjaculation ou une éjaculation rétrograde (résection transuréthrale de la prostate, intervention sur le col de la vessie) ; avant une stérilisation chirurgicale à visée contraceptive (vasectomie) ; en cas d’intervention chirurgicale sur les testicules ou les voies excrétrices spermatiques (tumeur bénigne du testicule, traitement chirurgical de l’orchi-épididymite, torsion testiculaire, cure de cryptorchidie tardive, choc testiculaire, cure de varicocèle) ; après recueil chirurgical de spermatozoïdes dans les voies excrétrices spermatiques dans les azoospermies obstructives ou par biopsie chirurgicale testiculaire dans les azoospermies non obstructives ; en cas d’altérations spermatiques susceptibles de s’aggraver au cours du temps et pouvant conduire à une azoospermie non obstructive (oligozoospermie sévère, dégradation des paramètres spermatiques au cours de la prise en charge en AMP, syndrome de Klinefelter, microdélétion du chromosome Y…).Avant la puberté, deux autres indications plus exceptionnelles de préservation de la fertilité, en dehors du contexte de l’allo- ou autogreffe de cellules souches hématopoïétiques, sont représentées par les garçons prépubères ou adolescents ayant un syndrome de Klinefelter ou les garçons prépubères ayant une cryptorchidie, la préservation de la fertilité étant pratiquée lors de l’orchidopexie du testicule de façon uni- ou bilatérale.12
Chez la femme
Les pathologies de l’ovaire bénignes mais imposant un geste chirurgical doivent systématiquement étudier leur retentissement sur la fertilité future de la femme et poser dans certaines situations l’indication d’une préservation de la fertilité. Il peut s’agir de kystes ovariens unilatéraux ou bilatéraux bénins récidivants nécessitant des kystectomies itératives voire une ovariectomie uni- ou bilatérale, d’une endométriose sévère avec chirurgie répétée, d’endométriomes ovariens récidivants uni- ou bilatéraux, d’une torsion de l’ovaire. Les patientes ayant un syndrome de Turner, une insuffisance ovarienne prématurée ou une histoire familiale d’insuffisance ovarienne prématurée sont également des indications potentielles à la préservation de la fertilité.11Principales techniques de préservation de la fertilité
Préservation de la fertilité masculine
Les différentes techniques de préservation de la fertilité masculine sont présentées dans la figure 1.
La majorité des conservations de spermatozoïdes s’effectuent dans le champ du cancer, principalement avant traitement du cancer du testicule, du lymphome malin hodgkinien ou non hodgkinien et des tumeurs solides.
Chez l’homme pubère (adolescent ou adulte)
Il est théoriquement possible d’effectuer une congélation de spermatozoïdes obtenus après un recueil de sperme par masturbation, dès le stade III de Tanner avec un volume testiculaire supérieur à 5 mL. Néanmoins, en cas d’échec ou de refus de recueil de spermatozoïdes, d’oligozoospermie sévère, d’azoospermie ou de nécrozoospermie,13, 14 une procédure alternative consiste à envisager la biopsie testiculaire avec extraction de spermatozoïdes (Onco-TESE) suivie de leur congélation. Cette Onco-TESE, si elle s’avère négative, peut être associée à la congélation d’une partie du tissu testiculaire, afin de conserver des cellules souches spermatogoniales si elles sont présentes. La congélation de spermatozoïdes doit être effectuée avant la mise en route du traitement gonadotoxique pour éviter dans le cas de la chimiothérapie ou radiothérapie l’effet mutagène sur les spermatozoïdes avec un risque potentiel s’ils sont utilisés dans le cadre d’une AMP sur le conceptus (fausses couches, malformations, anomalies génétiques ou chromosomiques).12 Les spermatozoïdes éjaculés seront utilisables selon les différentes techniques d’AMP (insémination, FIV ou FIV avec micro- injection de spermatozoïde dans l’ovocyte [ICSI]) en fonction du nombre et de la mobilité des spermatozoïdes après décongélation. Les spermatozoïdes issus de la procédure Onco-TESE sont uniquement utilisables en ICSI.La majorité des conservations de spermatozoïdes s’effectuent dans le champ du cancer, principalement avant traitement du cancer du testicule, du lymphome malin hodgkinien ou non hodgkinien et des tumeurs solides.
Chez le garçon prépubère ou pubère
Chez le garçon prépubère ne produisant pas de spermatozoïdes ou le garçon pubère ayant déjà initié son traitement gonadotoxique (chimiothérapie ou radiothérapie) à dose faiblement toxique et n’ayant pas eu la possibilité de conserver ses spermatozoïdes préalablement, l’Onco- TESE n’a pas sa place. Dans la seconde situation, les spermatozoïdes qui sont produits ont subi l’effet mutagène des traitements et ne sont pas utilisables en AMP. La biopsie testiculaire associée à la congélation de fragments de tissu testiculaire semble être une solution acceptable, avec pour objectif une préservation des cellules souches spermatogoniales.12 Il est bien entendu important d’informer les patients et leurs parents, s’ils sont mineurs, que la possible utilisation ultérieure du tissu testiculaire congelé reste à l’heure actuelle du domaine de la recherche. En effet, les différentes modalités d’utilisation envisageables sont actuellement développées sur les modèles animaux, à savoir la maturation in vitro des cellules germinales souches isolées ou maintenues au sein du tissu testiculaire afin de produire in vitro des spermatozoïdes, la transplantation des cellules germinales souches ou la greffe du tissu testiculaire afin de produire in vivo des spermatozoïdes chez le patient guéri.9 Les spermatozoïdes produits in vitro ou in vivo seraient utilisables dans le cadre d’une ICSI. La majorité des conservations de tissu testiculaire chez le garçon prépubaire s’effectuent dans le champ du cancer avant la réalisation d’une allogreffe de cellules souches hématopoïétiques dans le cadre des leucémies aiguës ou d’une autogreffe de cellules souches hématopoïétiques dans le cadre des lymphomes ou des tumeurs du système nerveux central.9Techniques de préservation de la fertilité féminine
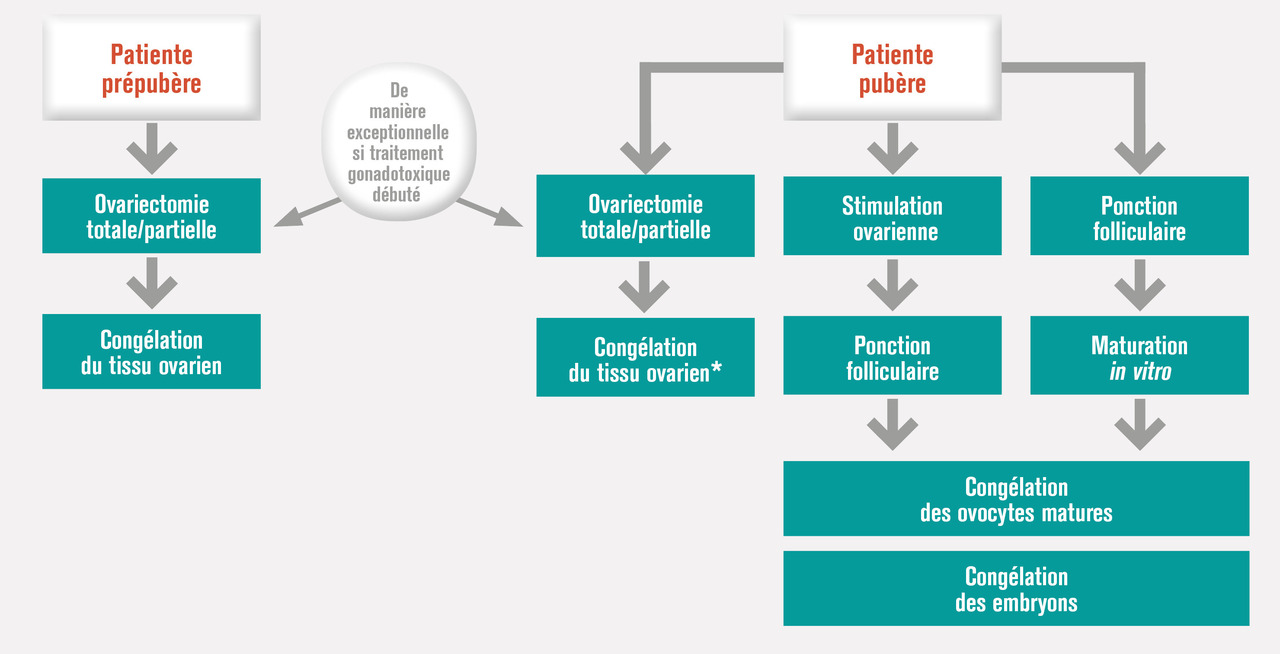
Chez la femme, différentes techniques de préservation de la fertilité sont envisageables de manière isolée ou associée : la congélation des embryons, la congélation d’ovocytes et la congélation du tissu ovarien (fig. 2).11
La congélation d’ovocytes immatures est proposée en complément de la congélation d’ovocytes matures, pour les ovocytes qui ne sont pas matures au moment de la congélation.
Congélation des embryons
Seule méthode dont l’efficacité est prouvée, elle nécessite un recueil d’ovocytes matures, uniquement réalisable chez une patiente pubère qui peut subir une stimulation hormonale de l’ovulation avant la réalisation d’un traitement gonadotoxique. Cette procédure est impossible si le traitement doit être entrepris dans l’urgence, a déjà été initié ou s’il existe une contre-indication à la stimulation ovarienne selon le type de cancer considéré (tumeur hormonosensible aux estrogènes ou à la progestérone). Par ailleurs, cette technique implique l’existence d’un conjoint et d’un projet parental. Elle constitue une procédure de préservation de la fertilité du couple et non de la femme, les embryons conservés ne pouvant être utilisés qu’au sein de ce couple.Congélation d’ovocytes
C’est la technique la plus récente de préservation de la fertilité féminine. Elle s’est largement développée depuis l’utilisation de la technique de vitrification ovocytaire qui améliore considérablement la survie des ovocytes après décongélation et les chances de grossesse après ICSI. Cette procédure est réservée aux femmes pubères, en couple ou célibataires. Elle s’effectue préférentiellement à partir d’ovocytes matures, obtenus dans la majorité des cas après stimulation de l’ovulation ou plus exceptionnellement après maturation in vitro.La congélation d’ovocytes immatures est proposée en complément de la congélation d’ovocytes matures, pour les ovocytes qui ne sont pas matures au moment de la congélation.
Congélation du tissu ovarien
Elle a pour objectif de conserver des follicules ovariens primordiaux situés dans le cortex ovarien. Cette technique est envisageable chez la femme avant et après la puberté. Elle ne nécessite pas de stimulation de l’ovulation et peut être proposée lorsqu'un traitement faiblement gonadotoxique a été débuté. La procédure de congélation du tissu ovarien débute par le prélèvement d’un ovaire entier ou de fragments biopsiques de cortex ovarien. L’intervention est soit réalisée, habituellement par cœlioscopie, spécifiquement pour le prélèvement chirurgical de l’ovaire, soit le plus souvent associée à un geste chirurgical prévu dans le contexte de la maladie (mise en place d’une chambre implantable ou d’un cathéter central, résection d’une masse tumorale…).11 L’utilisation via la greffe orthotopique de fragments de tissu ovarien congelé restaure la fonction ovarienne endocrine de la femme et a déjà permis la naissance de plus d’une centaine d’enfants dans le monde.15 La congélation du tissu ovarien est la seule technique possible chez la femme prépubère mais est également proposée à la femme pubère. De plus, les différentes techniques de préservation de la fertilité peuvent être associées chez la femme pubère, si cela s’avère possible.Loi de bioéthique et Plan cancer
Le développement rapide des techniques d’AMP a conduit le législateur à s’interroger, sur les plans éthique et juridique, sur ces activités médicales qui mettaient en jeu des éléments et produits du corps humain. La mise en place d’un cadre législatif s’est imposée en considérant que celui-ci devait concilier le respect de la dignité de la personne humaine et les exigences des progrès scientifiques. Le 29 juillet 1994 est parue la loi n° 94-654 relative au don et à l’utilisation des éléments et produits du corps humain, à l’assistance médicale à la procréation et au diagnostic prénatal. L’AMP, telle qu’elle a été définie dans la loi, s’entend : « Des pratiques cliniques et biologiques permettant la conception in vitro, le transfert d’embryons et l’insémination artificielle, ainsi que toute technique d’effet équivalent permettant la procréation en dehors du processus naturel ». Les techniques de préservation de la fertilité féminine ou masculine sont donc considérées comme des techniques d’AMP. Cependant, leur inscription précise et spécifique dans la loi de bioéthique comme techniques d’AMP n’a été effectuée que dans la version révisée du 6 août 2004 et a été maintenue dans le texte du 7 juillet 2011. Le code de la santé publique précise dans son article L.2141-11 que « toute personne dont la prise en charge médicale est susceptible d’altérer la fertilité, ou dont la fertilité risque d'être prématurément altérée, peut bénéficier du recueil et de la conservation de ses gamètes ou de ses tissus germinaux, en vue de la réalisation ultérieure, à son bénéfice, d’une assistance médicale à la procréation, ou en vue de la préservation et de la restauration de sa fertilité ». L’arrêté du 30 juin 2017 relatif aux règles de bonnes pratiques cliniques et biologiques d’AMP précise que « toute personne dont la fertilité ultérieure risque d’être altérée, du fait d’une pathologie ou de ses traitements ou dont la fertilité risque d’être prématurément altérée, a accès aux informations concernant les risques pour sa fertilité ultérieure et les possibilités de conservation de gamètes ou de tissu germinaux. Une information loyale, claire et appropriée permet au patient de devenir acteur de sa prise en charge ».
En dehors de considérations médicolégales imposant de proposer la préservation de la fertilité dans les situations à risque sur la fertilité future, la préservation de la fertilité a aussi été incluse dans le Plan cancer 2014-2019 (action 8.1) considérant que les problèmes posés par la fertilité prenaient une place croissante dans la qualité de vie de l’après-cancer. Le Plan cancer en cours prévoit de systématiser l’information des patients concernés, dès la consultation d’annonce de la proposition thérapeutique, sur les risques des traitements du cancer pour leur fertilité ultérieure et sur les possibilités actuelles de préservation de la fertilité. Adaptée à la situation personnelle du patient, cette information doit être réalisée, y compris lorsque le traitement de première intention n’apparaît pas d’emblée comme stérilisant. Lorsque le patient le souhaite, il doit être adressé à un spécialiste compétent en préservation de la fertilité.
Pourtant, les données nationales confirment que moins de 40 % des femmes reçoivent une information systématique sur l’effet toxique du traitement du cancer sur la fertilité future et par conséquent sur les procédures potentielles de préservation de la fertilité, avec 15,8 % des hommes qui ont effectué une conservation de spermatozoïdes et 2,2 % des femmes qui ont bénéficié d’une conservation de tissu ovarien ou d’ovocytes ou d’une FIV en urgence pour congélation embryonnaire.16 Outre le développement et la maîtrise des techniques de préservation de la fertilité, l’amélioration de l’information des patients en amont de la prescription du traitement gonadotoxique apparaît indispensable.
En dehors de considérations médicolégales imposant de proposer la préservation de la fertilité dans les situations à risque sur la fertilité future, la préservation de la fertilité a aussi été incluse dans le Plan cancer 2014-2019 (action 8.1) considérant que les problèmes posés par la fertilité prenaient une place croissante dans la qualité de vie de l’après-cancer. Le Plan cancer en cours prévoit de systématiser l’information des patients concernés, dès la consultation d’annonce de la proposition thérapeutique, sur les risques des traitements du cancer pour leur fertilité ultérieure et sur les possibilités actuelles de préservation de la fertilité. Adaptée à la situation personnelle du patient, cette information doit être réalisée, y compris lorsque le traitement de première intention n’apparaît pas d’emblée comme stérilisant. Lorsque le patient le souhaite, il doit être adressé à un spécialiste compétent en préservation de la fertilité.
Pourtant, les données nationales confirment que moins de 40 % des femmes reçoivent une information systématique sur l’effet toxique du traitement du cancer sur la fertilité future et par conséquent sur les procédures potentielles de préservation de la fertilité, avec 15,8 % des hommes qui ont effectué une conservation de spermatozoïdes et 2,2 % des femmes qui ont bénéficié d’une conservation de tissu ovarien ou d’ovocytes ou d’une FIV en urgence pour congélation embryonnaire.16 Outre le développement et la maîtrise des techniques de préservation de la fertilité, l’amélioration de l’information des patients en amont de la prescription du traitement gonadotoxique apparaît indispensable.
Place des CECOS dans la mise en œuvre de la préservation de la fertilité
En France, la préservation de la fertilité masculine s’est développée depuis près de 45 ans, dès lors que la congélation des spermatozoïdes a été utilisée pour le don de spermatozoïdes. En effet, Georges David a décidé de proposer la congélation des spermatozoïdes comme procédure de préservation de la fertilité pour conserver les spermatozoïdes d’hommes (jeunes adultes ou adolescents) qui allaient recevoir un traitement du cancer. Comme pour le don de spermatozoïdes, les CECOS ont développé des procédures communes de congélation et de conservation des spermatozoïdes, discuté et validé les principales indications nécessitant le recours à la préservation de la fertilité masculine, établi des recommandations pour les jeunes adultes et adolescents9, 13 permettant d'informer et d’orienter les médecins prescripteurs, organisé et participé à des colloques d’information sur ce thème, évalué cette activité au cours du temps au travers du recueil annuel des données réalisé par l’ensemble des CECOS, élaboré des protocoles de recherche et publié des articles nationaux et internationaux sur ce sujet. Plus récemment, le développement des procédures de congélation des tissus germinaux (ovaire ou testicule) et d’ovocytes matures ont élargi les champs de compétences des CECOS, leur permettant de proposer la préservation de la fertilité chez la femme comme chez l’homme quel que soit leur âge. La Fédération des CECOS constitue un réseau unique au niveau national et international dans le domaine de la préservation de la fertilité, avec à disposition une banque de données inégalable sur la thématique de préservation de la fertilité.* La Fédération des CECOS a agi activement pour que la thématique de la préservation de la fertilité soit inscrite dans les trois Plans cancer successifs. Elle a également participé à l'élaboration du rapport conjoint entre l’Agence de la biomédecine et l’Institut national du cancer intitulé Conséquences des traitements des cancers et préservation de la fertilité.** De plus, les CECOS ont mis en place un accueil personnalisé des adolescents, avec l’élaboration d’un guide destiné aux adolescents, en collaboration avec la Ligue contre le cancer.*** Les différentes actions des CECOS dans ce domaine ont permis d'augmenter le nombre d’adolescents qui ont bénéficié d’une préservation de leur fertilité.13 La Fédération des CECOS a apporté sa contribution pour la création d’une réunion de concertation pluridisciplinaire en ligne interrégionale (e-RCP) pour les cas complexes de préservation de la fertilité masculine ou féminine destinées aux spécialistes en médecine et biologie de la reproduction, dont la coordination est assurée par le réseau régional de cancérologie OncoPACA-Corse.
Depuis les huit premiers patients qui ont conservé leurs spermatozoïdes en 1973 au CECOS du Kremlin-Bicêtre, plus de 80 000 patients ont fait appel aux CECOS pour conserver leurs spermatozoïdes, soit en moyenne 4 500 patients par an. Le délai écoulé entre la conservation et l’utilisation peut dépasser les 20 années, soulignant la nécessité d’une infrastructure adaptée à la conservation des échantillons biologiques congelés à long terme. Le taux d’utilisation des paillettes conservées reste faible, avec 8-10 % des patients ayant recours aux spermatozoïdes conservés pour leur projet parental. Une étude du réseau allemand des lymphomes a montré que ce taux pouvait monter jusqu’à 20 %.
Les CECOS ne sont pas simplement des laboratoires de cryobiologie mais des structures pluridisciplinaires associant biologistes et cliniciens donnant leurs conseils sur les indications de préservation de la fertilité, proposant la procédure de préservation de la fertilité la plus adaptée en fonction du sexe du patient et de son âge et assurant le suivi en post-traitement des patients ou patientes qui ont bénéficié d'une préservation de leur fertilité pour les orienter à la fois sur le mode de procréation le plus adapté en fonction de leur fertilité et sur le choix ou non d'arrêter la conservation de leurs gamètes ou tissus germinaux.
Depuis les huit premiers patients qui ont conservé leurs spermatozoïdes en 1973 au CECOS du Kremlin-Bicêtre, plus de 80 000 patients ont fait appel aux CECOS pour conserver leurs spermatozoïdes, soit en moyenne 4 500 patients par an. Le délai écoulé entre la conservation et l’utilisation peut dépasser les 20 années, soulignant la nécessité d’une infrastructure adaptée à la conservation des échantillons biologiques congelés à long terme. Le taux d’utilisation des paillettes conservées reste faible, avec 8-10 % des patients ayant recours aux spermatozoïdes conservés pour leur projet parental. Une étude du réseau allemand des lymphomes a montré que ce taux pouvait monter jusqu’à 20 %.
Les CECOS ne sont pas simplement des laboratoires de cryobiologie mais des structures pluridisciplinaires associant biologistes et cliniciens donnant leurs conseils sur les indications de préservation de la fertilité, proposant la procédure de préservation de la fertilité la plus adaptée en fonction du sexe du patient et de son âge et assurant le suivi en post-traitement des patients ou patientes qui ont bénéficié d'une préservation de leur fertilité pour les orienter à la fois sur le mode de procréation le plus adapté en fonction de leur fertilité et sur le choix ou non d'arrêter la conservation de leurs gamètes ou tissus germinaux.
UNE PLACE CROISSANTE
La préservation de la fertilité féminine ou masculine prend une place de plus en plus importante dans les activités d’AMP et doit être anticipée et envisagée dans toutes les situations médicales ou chirurgicales qui risquent d’altérer prématurément la fertilité. Elle passe par une information préalable et systématique de tous les patients exposés à une situation à risque.
Notes* https//
www. cecos.org
** https://www.agence-biomedecine.fr/AMP***
https://www.ligue-cancer.net