Les tumeurs malignes de l’ovaire peuvent être réparties en trois groupes : cancers épithéliaux de l’ovaire (représentant 90 % des tumeurs ovariennes), tumeurs frontières et tumeurs rares.
Les tumeurs ovariennes sont classées selon leur stade FIGO (Fédération internationale de gynécologie et obstétrique) [
La moyenne d’âge d’apparition des tumeurs épithéliales de l’ovaire est de 64 ans. Cependant, 12,1 % de ces tumeurs sont diagnostiquées avant 44 ans, notamment chez les patientes porteuses de mutations constitutives délétères des gènes BRCA1 ou BRCA2. La survie à cinq ans dans les stades précoces 1A et 1B est de 91 % tous statuts génétiques confondus. Les tumeurs frontières et les tumeurs rares de l’ovaire sont diagnostiquées plus fréquemment chez des femmes en âge de procréer : par exemple, l’âge moyen au diagnostic des tumeurs germinales est compris entre 18 à 30 ans.1
La question de la préservation de la fertilité chez les jeunes femmes ayant un désir parental est donc centrale. Tout patient qui se voit proposer un traitement pouvant potentiellement altérer sa fertilité doit en être informé avant le début du traitement ; il peut bénéficier de techniques de préservation de la fertilité, selon le code de la santé publique et la loi de bioéthique.
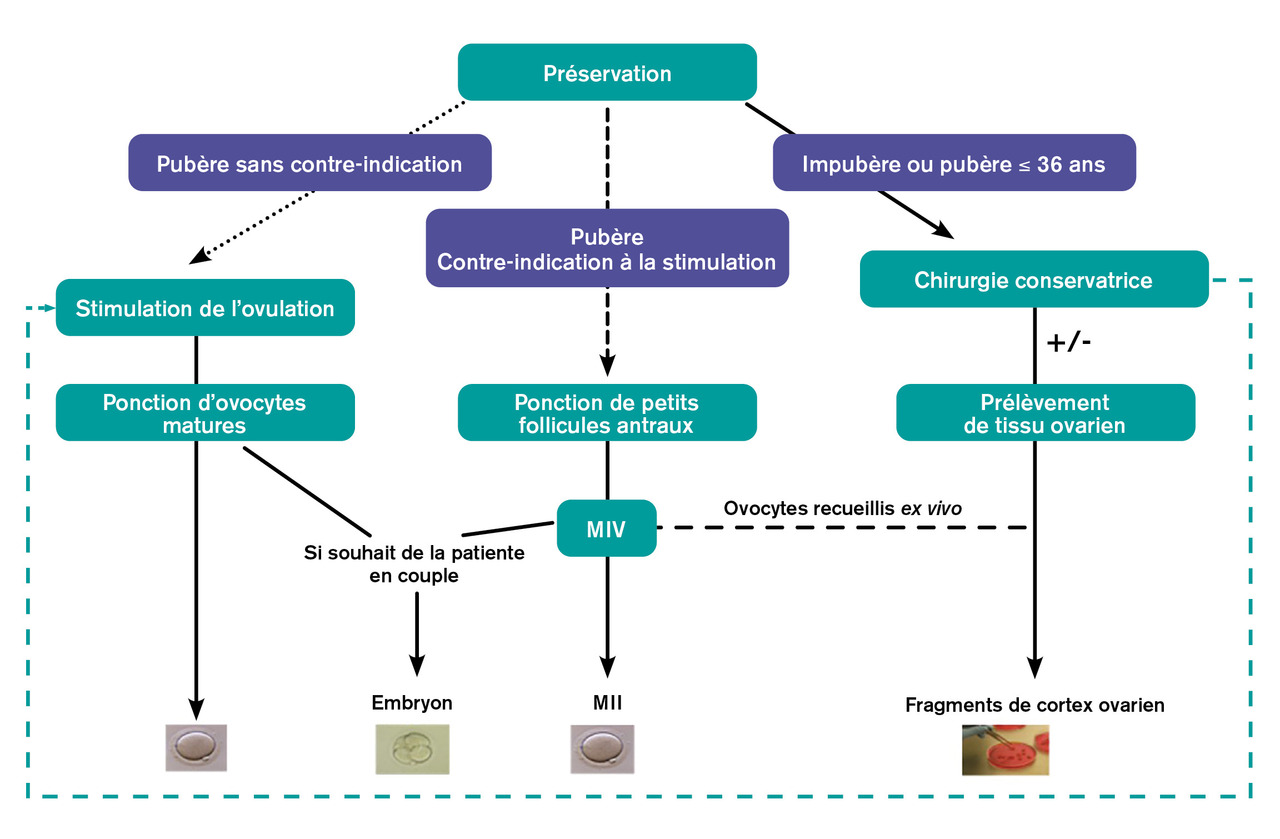
Dans le cadre des lésions ovariennes, la préservation de la fertilité dépend principalement des modalités de la chirurgie : tenter de limiter l’extension du geste, lorsque cela est possible. La cryopréservation de gamètes ou de tissu ovarien peut être proposée dans certains cas. La cryoconservation ovocytaire peut faire suite à une ponction ovarienne après stimulation ovarienne, ou à une maturation in vitro (MIV) d’ovocytes recueillis immatures. Enfin, les ovocytes matures obtenus peuvent être mis en fécondation, afin de cryoconserver des embryons, si la patiente est en couple et a un projet parental (
Le recueil ovocytaire après stimulation ovarienne est la stratégie pour laquelle on dispose du recul le plus important puisqu’il s’agit des techniques utilisées en fécondation in vitro (FIV) depuis quarante ans, ayant permis la naissance de plus de 20 millions d’individus dans le monde. Toutefois, il nécessite du temps (environ deux semaines) et expose à une élévation des œstrogènes, ce qui peut être indésirable en contexte oncologique et a fortiori en cas de tumeur hormonodépendante. Le recueil ovocytaire sans stimulation n’expose pas à ces inconvénients. En revanche, le taux moyen de maturation ovocytaire in vitro (MIV) est de 50 %, rendant cette approche moins efficace. Enfin, quel que soit le protocole de recueil utilisé, les chances de naissance par ovocyte mature congelé sont globalement de 6,4 %, mais elles varient avec l’âge de la patiente au moment du prélèvement.2
La congélation de fragments de cortex ovarien permet, lors de la réimplantation orthotopique ultérieure, la récupération des fonctions endocrine et exocrine, mais il subsiste un risque inconnu de réintroduire des cellules malignes. Elle est parfois proposée en cas de tumeur ovarienne, dans l’espoir que les avancées scientifiques futures permettront de détecter les cellules tumorales par un moyen indirect sans destruction des fragments, ou de réaliser une maturation ovocytaire ex vivo à partir du cortex ovarien.3
Tumeurs frontières de l’ovaire : la préservation de la fertilité indiquée pour 1 femme sur 3
La moyenne d’âge au diagnostic des tumeurs frontières ovariennes (TFO) est de 45 ans. Une indication de préservation de fertilité est envisageable chez un tiers des femmes en raison de leur jeune âge.
Le pronostic de ces tumeurs est globalement très bon, avec un risque de récidive tardif. Le traitement de référence des TFO comporte une annexectomie bilatérale, une cytologie péritonéale, une omentectomie infracolique, des biopsies péritonéales et une appen-dicectomie en cas de TFO mucineuse et d’appendice macroscopiquement suspect.
Traitement chirurgical le plus conservateur possible
Chez les femmes jeunes, le traitement conservateur est possible en cas de tumeur de stade I ou II sans implants invasifs : le geste chirurgical consiste alors en une annexectomie unilatérale ou une kystectomie associée à des biopsies péritonéales à la recherche d’implants invasifs. Un tiers des patientes qui souhaitaient être enceintes après traitement conservateur l’ont été ; aucune différence n’a été retrouvée entre une annexectomie unilatérale et une kystectomie.
Dans le cadre d’une atteinte ovarienne bilatérale, la fertilité est mieux préservée avec une kystectomie bilatérale qu’avec une annexectomie unilatérale et une kystectomie controlatérale. Cependant, le risque de récidive est légèrement plus élevé, sans impact sur la survie globale. La survenue d’une grossesse ultérieure n’a pas d’impact sur le risque de récidive.4
Cryopréservation de gamètes ou de tissu ovarien, en complément
Une préservation de fertilité par congélation de gamètes peut être proposée à la suite d’un traitement chirurgical conservateur, après discussion en réunion de concertation pluridisciplinaire (RCP).
Cette technique complémentaire doit être systématiquement proposée pour les TFO séreuses (risque de récidive de 30 %) ou en cas d’atteinte bilatérale. En l’absence de critères histologiques péjoratifs (type micropapillaire, micro-invasion, implants invasifs ou non), une stimulation ovarienne est possible. Il n’y a pas de recommandations établies pour les tumeurs unilatérales traitées par kystectomie seule.
En cas de récidive d’une TFO, une préservation de la fertilité par stimulation ovarienne peut être envisagée si l’histologie initiale ne présentait pas de critères péjoratifs et si l’imagerie n’est pas suspecte. Dans le cas contraire, une MIV ou une congélation de cortex peut être discutée au cas par cas avec le réseau national des cancers gynécologiques rares, notamment celui des tumeurs malignes rares de l’ovaire (GINECO-TMRO : Groupe d’investigateurs national des études des cancers ovariens et du sein-Tumeurs malignes rares de l’ovaire).4
Accord d’experts pour les tumeurs rares (non épithéliales) de l’ovaire
Les tumeurs rares de l’ovaire atteignent les femmes jeunes (18-30 ans). En l’absence de données de la littérature disponibles dans ce cadre, le centre expert national français GINECO-TMRO a émis des recommandations de prise en charge selon la méthode Delphi*.4
Tumeurs des cordons sexuels : préservation de fertilité seulement pour les formes très peu évoluées
Les tumeurs des cordons sexuels (TCS) sont des tumeurs hormonodépendantes, elles comprennent les tumeurs de la granulosa, de Sertoli-Leydig, des gynandroblastomes, des tumeurs à cellules stéroïdiennes.
Le traitement conservateur ne peut être proposé que sur les tumeurs de stade IA.
Aucune donnée n’est disponible sur l’impact de la stimulation par l’hormone de stimulation folliculaire (FSH), mais un rôle délétère est possible, sauf pour les tumeurs de la granulosa pour lesquelles une stimulation postopératoire est envisageable en cas de stade IA. Pour les autres tumeurs rares non épithéliales des cordons sexuels, la stimulation ovarienne n’est pas recommandée.
Tumeurs germinales malignes : annexectomie et chimiothérapie
Les tumeurs germinales malignes (TGM) sont des tumeurs non hormonodépendantes. Elles regroupent les dysgerminomes, les tératomes immatures, les tumeurs vitellines, les carcinomes embryonnaires, les choriocarcinomes et les tumeurs germinales mixtes.
Leur traitement repose sur une annexectomie unilatérale pour les tumeurs localisées. En cas de stade localement avancé, une chirurgie conservatrice peut être discutée pour les jeunes patientes. Toutefois, une chimiothérapie systématique par BEP (bléomycine, étoposide et cisplatine) – quel que soit le stade – est nécessaire pour éviter les récidives.
La préservation de la fertilité est alors proposée dans le cadre de cette association annexectomie et chimiothérapie, bien que cette dernière ait peu d’impact décrit sur la fertilité.
Cancer épithélial de l’ovaire : rare chez les femmes non ménopausées
Le cancer ovarien de type épithélial représente la grande majorité des cancers ovariens. Il est composé de nombreux sous-types histologiques (en majorité séreux de haut grade, endométrioïdes, à cellules claires, mucineux et séreux de bas grade). Le traitement de référence consiste en une chirurgie de stadification comprenant une annexectomie bilatérale, une hystérectomie, une appendicectomie, une omentectomie, des biopsies péritonéales, un curage ganglionnaire rétropéritonéal ainsi qu’une chimiothérapie selon le stade.
Cette pathologie est généralement diagnostiquée chez la femme ménopausée, dans plus de 70 % des cas à un stade avancé (stade III ou IV).
Chirurgie conservatrice possible pour les rares cas de la femme jeune ?
La question de la préservation de la fertilité se pose rarement, et uniquement chez les patientes jeunes non ménopausées ayant un désir de grossesse. Dans ce cas, la prise en charge des stades précoces repose avant tout sur une chirurgie conservatrice de l’utérus et de l’annexe controlatérale. Les données de la littérature sont limitées du fait de la rareté de ces cas, et une extrapolation de données suisses mène à une estimation de 52 patientes concernées par an en France.5
Pour les stades localisés (stade II), le taux de survie à cinq ans est de 92 %,1 et il est possible de proposer un traitement conservateur à type d’annexectomie unilatérale ou kystectomie sans hystérectomie. En revanche, en cas de stade II, le risque de récidive est de 42,8 %. La chirurgie conservatrice n’est donc pas envisageable.
Indépendamment du type de chirurgie retenu, le risque de récidive augmente selon les stades : au stade IC1, il est de 9 % ; au stade IC2 de 14 % ; au stade IC3 de 23 %. Les recommandations de l’Institut national du cancer (INCa) de 20195 servent de guide pour ces prises en charge complexes (
Stratégies complémentaires : prudence !
Concernant les stratégies complémentaires de préservation de la fertilité par congélation de gamètes dans le cadre du cancer épithélial de l’ovaire de type séreux, aucune recommandation n’a été émise devant l’absence de données suffisantes sur la congélation de cortex ovarien, la MIV, la stimulation ovarienne.
La prise en charge doit ainsi être discutée individuellement en « RCP tumeur rare » dans le réseau GINECO-TMRO.5
La prudence est systématique pour les tumeurs séreuses de bas grade et endométrioïdes, qui semblent hormonodépendantes, contre-indiquant la stimulation ovarienne.4
Dans le cas particulier des femmes porteuses de mutation constitutive délétère des gènes BRCA1 ou BRCA2, les seules données disponibles concernent les patientes indemnes de cancer : la stimulation ovarienne est possible pour elles et n’augmenterait pas l’incidence de cancer ovarien.6
La congélation de cortex n’est pas recommandée, devant le risque de réimplantation de lésions occultes (environ 15 % des pièces d’annexectomie prophylactique).
Résultats encourageants pour la cryopréservation d’ovocytes ou de tissu ovarien
Seules deux cohortes ont étudié la cryopréservation d’ovocytes ou de tissu ovarien dans le cadre de la prise en charge d’une tumeur de l’ovaire.
Dans l’étude multicentrique du réseau FertiPROTEKT, en moyenne 7,3 ± 8,3 ovocytes ont pu être recueillis après stimulation ovarienne chez les patientes atteintes de cancer de l’ovaire.7
Dans l’étude menée au sein de l’institut universitaire de cancérologie (IUC) Sorbonne Université et incluant 43 patientes, 50 % de la cohorte a pu bénéficier d’une congélation ovocytaire (en moyenne 12,3 ± 12,8 ovocytes par cycle de stimulation ; au moins 10 ovocytes matures congelés chez 52,6 % des patientes), et 14 % d’une congélation de tissu ovarien (en moyenne 22 fragments).2 Ce travail a également montré l’amélioration de l’information des patientes avec le temps (67 % de consultations préopératoires dédiées à la fertilité en 2019, contre 0 % en 2013) et l’intérêt des patientes pour ces stratégies de cryopréservation (seules 28,6 % des patientes ont refusé cette prise en charge).
Intégrer la possibilité d’une cryo- préservation d’ovocytes et/ou de cortex ovarien dans le plan de soin
La stratégie de préservation de la fertilité dans le cadre d’un cancer de l’ovaire est fondée sur des données encore peu nombreuses, synthétisées par l’INCa en 2019 dans le cadre des cancers épithéliaux ovariens,1 et le référentiel national du réseau GINECO-TMRO5 pour les tumeurs rares ou frontières. Lorsque le bilan d’extension permet d’envisager une chirurgie conservatrice, la possibilité d’une cryopréservation de gamètes ou de tissu ovarien doit être discutée en RCP de recours avant information de la patiente. Depuis quelques années, les patientes sont mieux informées de ces stratégies.2 Les données disponibles encouragent à augmenter les propositions de cryopréservation d’ovocytes et/ou de tissu ovarien.
Choix de la méthode de préservation de la fertilité selon le type de tumeur ovarienne
Toute décision de préservation de la fertilité doit être discutée en réunion de concertation pluridisciplinaire (RCP) de recours.
La patiente doit être prévenue du risque de récidive augmenté en cas de chirurgie conservatrice.
Pour les tumeurs frontières de l’ovaire : chirurgie conservatrice envisageable dans les stades I et II sans implants invasifs. Un complément par stimulation ovarienne est possible après la chirurgie de stadification.
Pour les tumeurs rares : discuter au cas par cas en RCP de recours.
Pour les cancers épithéliaux de l’ovaire : chirurgie conservatrice envisageable dans les stades IA (quel que soit le sous-type), ou IC1-2 pour les tumeurs séreuses de bas grade (toujours après une stadification péritonéale et ganglionnaire négative).
Il n’existe pas de recommandations sur les stratégies complémentaires de préservation de la fertilité après chirurgie conservatrice.
1. Geoffron S, Lier A, Kermadec E de, Sermondade N, Varinot J, Thomassin-Naggara I, et al. Fertility preservation in women with malignant and borderline ovarian tumors: Experience of the French ESGO-certified center and pregnancy-associated cancer network (CALG). Gynecologic Oncology 2021;161(3):817-24.
2. Cobo A, García-Velasco JA, Coello A, Domingo J, Pellicer A, Remohí J. Ovocyte vitrification as an efficient option for elective fertility preservation. Fertility and Sterility 2016;105(3):755-764.e8.
3. McLaughlin M, Albertini DF, Wallace WHB, Anderson RA, Telfer EE. Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system. Molecular Human Reproduction 2018;24(3):135-42.
4. Rousset-Jablonski C, Selle F, Adda-Herzog E, Planchamp F, Selleret L, Pomel C, et al. Préservation de la fertilité, contraception et traitement hormonal de la ménopause chez les femmes traitées pour tumeurs malignes rares de l’ovaire : recommandations du réseau national dédié aux cancers gynécologiques rares (TMRO/GINECO). Bulletin du Cancer 2018;105(3):299-314.
5. Uzan C, Courbiere B, Chabbert-Buffet N. Tumeurs épithéliales de l’ovaire : préservation de la fertilité. Article rédigé sur la base de la recommandation nationale de bonnes pratiques cliniques en cancérologie intitulée « Conduites à tenir initiales devant des patientes atteintes d’un cancer épithélial de l’ovaire » élaborée par FRANCOGYN, CNGOF, SFOG, GINECO-ARCAGY sous l’égide du CNGOF et labellisée par l’INCa. Gynécologie Obstétrique Fertilité & Sénologie 2019;47(2):180-6.
6. Huber D, Seitz S, Kast K, Emons G, Ortmann O. Use of fertility treatments in BRCA1/2 mutation carriers and risk for ovarian and breast cancer: a systematic review. Arch Gynecol Obstet 2020;302(3):715-20.
7. VonWolff M, Bruckner T, Strowitzki T, Germeyer A. Fertility preservation: ovarian response to freeze oocytes is not affected by different malignant diseases— an analysis of 992 stimulations, J Assist Reprod Genet 2018;35:1713-19.
Dans cet article
- Tumeurs frontières de l’ovaire : la préservation de la fertilité indiquée pour 1 femme sur 3
- Accord d’experts pour les tumeurs rares (non épithéliales) de l’ovaire
- Cancer épithélial de l’ovaire : rare chez les femmes non ménopausées
- Résultats encourageants pour la cryopréservation d’ovocytes ou de tissu ovarien
- Intégrer la possibilité d’une cryo- préservation d’ovocytes et/ou de cortex ovarien dans le plan de soin

 Encadrés
Encadrés