Les implants composant une prothèse totale de la hanche ont pour but de remplacer la fonction de l’articulation lésée et devenue non fonctionnelle. Du fait de son anatomie et de sa cinématique, la hanche constitue une articulation facilement reproductible par une articulation sphérique artificielle.
Quatre éléments différents composent une prothèse totale de hanche (fig. 1 ) :
– la cupule acétabulaire métallique ou en polyéthylène qui est mise en place dans le cotyle osseux ;
– l’insert généralement en polyéthylène ou en céramique qui est placé dans les cas où une cupule acétabulaire métallique est mise en place ;
– la tige fémorale métallique qui est insérée dans le canal médullaire fémoral ;
– la tête fémorale prothétique qui se place sur la tige fémorale et s’articule avec l’insert.
Quatre éléments différents composent une prothèse totale de hanche (
– la cupule acétabulaire métallique ou en polyéthylène qui est mise en place dans le cotyle osseux ;
– l’insert généralement en polyéthylène ou en céramique qui est placé dans les cas où une cupule acétabulaire métallique est mise en place ;
– la tige fémorale métallique qui est insérée dans le canal médullaire fémoral ;
– la tête fémorale prothétique qui se place sur la tige fémorale et s’articule avec l’insert.
Composants de la prothèse
Les matériaux composant les implants sont biocompatibles, c’est-à-dire qu’ils n’induisent pas d’altération ou de réponses indésirables au sein du tissu osseux environnant.
Cupule acétabulaire
Les différents implants acétabulaires disponibles sur le marché sont de géométries globales relativement proches. Hémisphériques, elles sont parfaitement adaptées à la forme de la cavité acétabulaire en permettant d’assurer un maximum de contact, tout en nécessitant un minimum de sacrifices osseux.
L’objectif principal est d’assurer la bonne stabilité de la cupule dans laquelle s’articulera la nouvelle hanche prothétique.
L’objectif principal est d’assurer la bonne stabilité de la cupule dans laquelle s’articulera la nouvelle hanche prothétique.
Tige fémorale
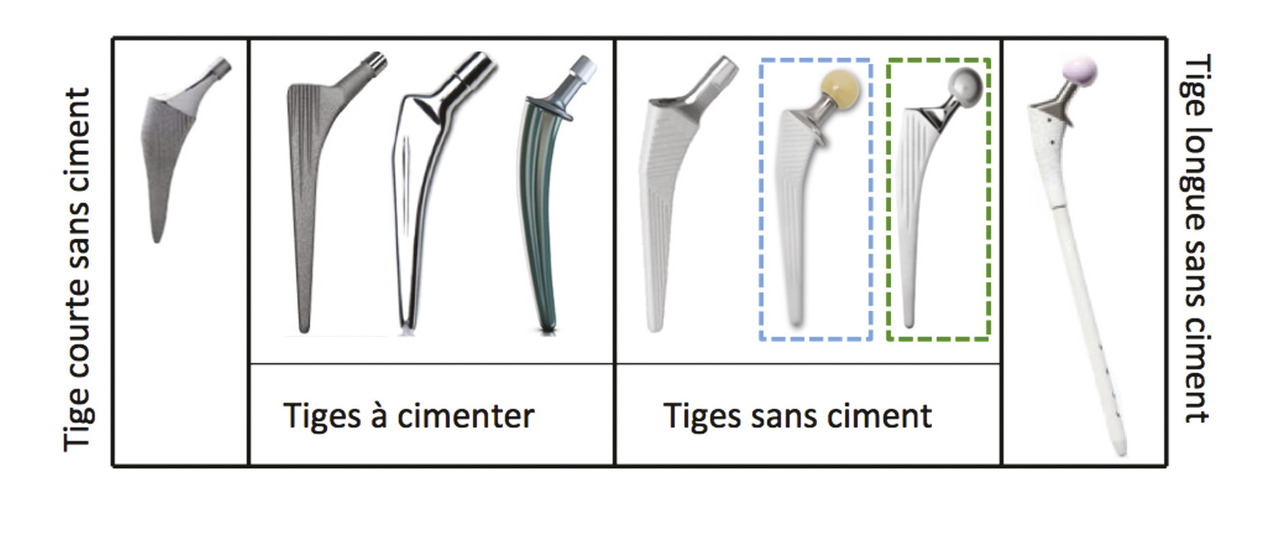
Contrairement aux cupules acétabulaires, il existe un grand nombre de différences entre les tiges fémorales disponibles sur le marché (fig. 2 ). Leurs multiples géométries se fondent sur des arguments expérimentaux ou biomécaniques. Elles varient notamment en fonction de leur courbure ou de leur degré de remplissage du fût fémoral dans les plans frontaux et/ou sagittaux. On peut aussi distinguer les tiges à collerette et les tiges sans collerette. L’utilisation d’une tige avec collerette permet théoriquement de réduire le risque de survenue d’un enfoncement secondaire de l’implant.
En plus des tiges fémorales dites « standard », on peut citer les tiges fémorales courtes, cherchant à diminuer l’importance du matériel mis en place et les risques de mauvaise répartition des contraintes en diminuant la quantité de contact entre la prothèse et l’os. Les tiges longues sont quant à elles généralement utilisées dans le cadre des reprises chirurgicales de prothèse totale de la hanche.
Quel que soit le fabricant utilisé par le chirurgien, chaque gamme de prothèse est fournie avec plusieurs tailles différentes, avec différentes largueurs et longueurs de tige ainsi que des diamètres de cupules croissants (généralement de 44 à 60 mm). Cela a pour objectif de permettre pour chaque modèle de procéder à la mise en place de l’implant le plus adapté à l’anatomie du patient.
En plus des tiges fémorales dites « standard », on peut citer les tiges fémorales courtes, cherchant à diminuer l’importance du matériel mis en place et les risques de mauvaise répartition des contraintes en diminuant la quantité de contact entre la prothèse et l’os. Les tiges longues sont quant à elles généralement utilisées dans le cadre des reprises chirurgicales de prothèse totale de la hanche.
Quel que soit le fabricant utilisé par le chirurgien, chaque gamme de prothèse est fournie avec plusieurs tailles différentes, avec différentes largueurs et longueurs de tige ainsi que des diamètres de cupules croissants (généralement de 44 à 60 mm). Cela a pour objectif de permettre pour chaque modèle de procéder à la mise en place de l’implant le plus adapté à l’anatomie du patient.
Mode de fixation et ostéo-intégration
Prothèses cimentées
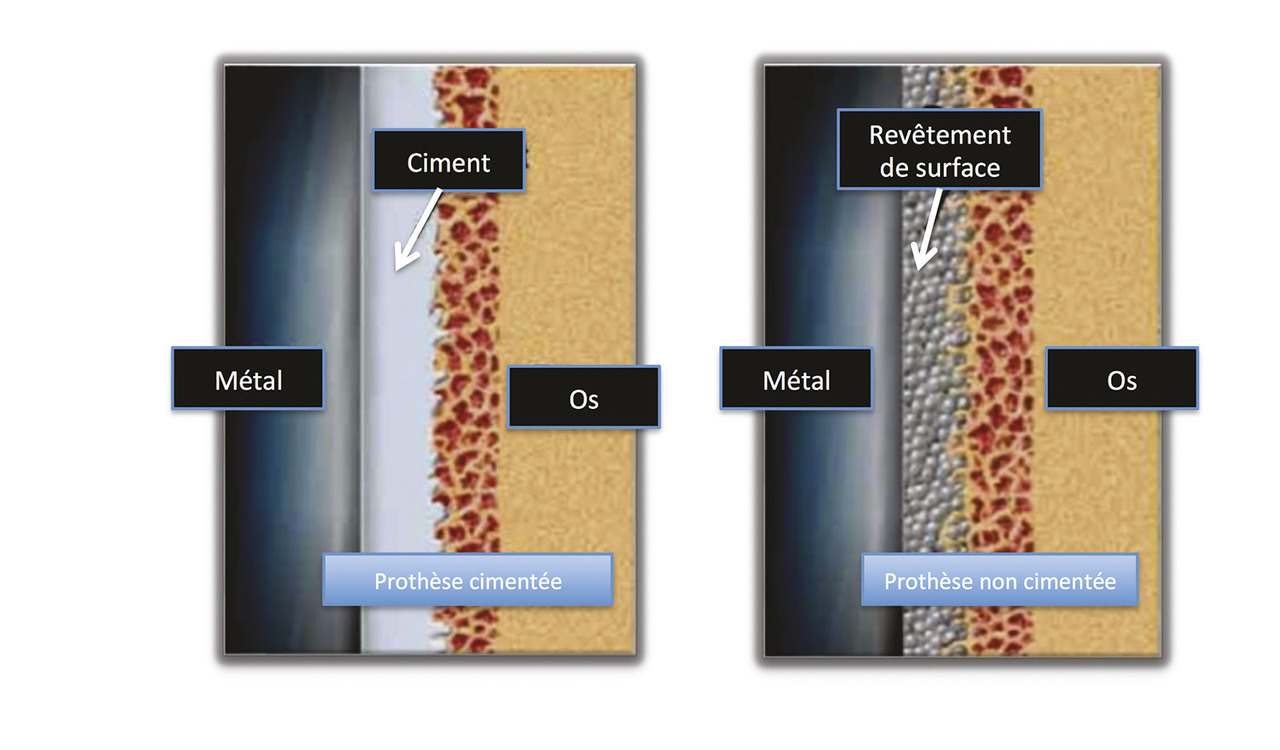
Les prothèses cimentées sont fixées dans l’os au moyen de ciment acrylique (fig. 3 ). Cependant, avec le temps, des débris d’usure secondaires au fonctionnement de la prothèse peuvent alors être libérés et migrer dans les différents espaces entre l’implant, le ciment et l’os. Ce phénomène, cause d’inflammation, d’ostéolyse et de descellements aseptiques peut aboutir in fine à la mobilisation de la prothèse. Cela explique la durée de vie limité de ces prothèses.
Prothèses non cimentées
Elles sont fondées sur le principe de l’ancrage osseux d’un implant au sein d’une cavité osseuse de taille légèrement inférieure à lui, permettant d’obtenir une jonction mécanique dite en « press-fit » (fig. 3 ). Ces implants ayant un revêtement bioactif (en général un revêtement d’hydroxyapatite, qui est reconnu chimiquement par l’os) ont pour objectif de relier de façon directe et durable les implants métalliques à leur support osseux, via le phénomène d’ostéo-intégration.
Ce processus biologique actif nécessite que le patient ait un os sain, avec une bonne densité osseuse et une vascularisation suffisante. Ainsi, en cas d’ostéolyse ou encore de nécrose post-radique, les implants sans ciment sont contre-indiqués.
Les fractures périprothétiques représentent le principal risque de prothèses. Leur taux va de 0,1 à 27,8 %,1 avec comme principaux facteurs de risque : le sexe féminin, l’ostéoporose, la chirurgie de reprise ou les voies d’abord mini-invasives.2
Le principal avantage de ce type d’implant est une durée de vie théoriquement plus longue grâce à la diminution de la distance os-implant permettant de diminuer les phénomènes d’usure entre l’implant et son support osseux.
Si les prothèses non cimentées présentent un bon taux de succès, leur taux de descellement est similaire à 10 ans avec les prothèses cimentées et, jusqu’à présent, aucune preuve d’une efficacité supérieure des implants non cimentés n’a pu être établie.3
Ce processus biologique actif nécessite que le patient ait un os sain, avec une bonne densité osseuse et une vascularisation suffisante. Ainsi, en cas d’ostéolyse ou encore de nécrose post-radique, les implants sans ciment sont contre-indiqués.
Les fractures périprothétiques représentent le principal risque de prothèses. Leur taux va de 0,1 à 27,8 %,1 avec comme principaux facteurs de risque : le sexe féminin, l’ostéoporose, la chirurgie de reprise ou les voies d’abord mini-invasives.2
Le principal avantage de ce type d’implant est une durée de vie théoriquement plus longue grâce à la diminution de la distance os-implant permettant de diminuer les phénomènes d’usure entre l’implant et son support osseux.
Si les prothèses non cimentées présentent un bon taux de succès, leur taux de descellement est similaire à 10 ans avec les prothèses cimentées et, jusqu’à présent, aucune preuve d’une efficacité supérieure des implants non cimentés n’a pu être établie.3
Notions spécifiques
Diamètre de la tête fémorale
Plus le diamètre de la tête fémorale prothétique augmente, plus la distance à effectuer avant que la tête ne sorte de la cupule acétabulaire augmente également. Cela a donc pour conséquence de diminuer le risque de luxation. A contrario, les têtes de diamètre trop important risquent de provoquer une usure et donc un descellement plus rapide des implants.
Le choix du diamètre de la tête mise en place résulte donc de la recherche d’un compromis entre risque de luxation et risque d’usure précoce.
Le choix du diamètre de la tête mise en place résulte donc de la recherche d’un compromis entre risque de luxation et risque d’usure précoce.
Couple de frottement
Le couple de frottement correspond à l’interface où les matériaux viennent s’articuler entre le composant fémoral et le composant acétabulaire. Les couples de frottement actuellement les plus utilisés sont les couples métal-polyéthylène, métal-métal, céramique-céramique ou encore céramique-polyéthylène.
Les couples métal-métal ne sont presque plus utilisés du fait de complications spécifiques (la métallose, correspondant à une pseudotumeur provoquant des ostéolyses ou le relâchement d’ions métalliques pouvant aboutir à des complications systémiques).
Le couple tête en métal-cotyle en polyéthylène est fréquemment utilisé et a l’avantage d’être moins coûteux mais l’inconvénient d’avoir une durée de vie plus faible, en raison du phénomène d’usure secondaire de relâchement de microparticules, à l’origine de descellements.
Les couples céramique-céramique ont une résistance à l’usure plus importante que le couple métal-polyé-thylène et ont donc une durée de vie théoriquement supérieure. Ils sont cependant plus coûteux et ont des complications propres telles la fracture de céramique (ce matériau étant plus résistant à l’usure mais moins résistant à la casse) ou l’apparition de bruit de « grincement » (squeaking) à la marche.
Leur utilisation reste donc généralement limitée aux sujets actifs, avec une espérance de vie estimée à plus de 20 ans ou chez les sujets jeunes.
Enfin, le couple céramique-polyéthylène présente certes un degré d’usure inférieur au couple métal-polyéthylène, mais des cas de rupture de la tête prothétique, parfois même sans choc, ont été décrits.
Les couples métal-métal ne sont presque plus utilisés du fait de complications spécifiques (la métallose, correspondant à une pseudotumeur provoquant des ostéolyses ou le relâchement d’ions métalliques pouvant aboutir à des complications systémiques).
Le couple tête en métal-cotyle en polyéthylène est fréquemment utilisé et a l’avantage d’être moins coûteux mais l’inconvénient d’avoir une durée de vie plus faible, en raison du phénomène d’usure secondaire de relâchement de microparticules, à l’origine de descellements.
Les couples céramique-céramique ont une résistance à l’usure plus importante que le couple métal-polyé-thylène et ont donc une durée de vie théoriquement supérieure. Ils sont cependant plus coûteux et ont des complications propres telles la fracture de céramique (ce matériau étant plus résistant à l’usure mais moins résistant à la casse) ou l’apparition de bruit de « grincement » (squeaking) à la marche.
Leur utilisation reste donc généralement limitée aux sujets actifs, avec une espérance de vie estimée à plus de 20 ans ou chez les sujets jeunes.
Enfin, le couple céramique-polyéthylène présente certes un degré d’usure inférieur au couple métal-polyéthylène, mais des cas de rupture de la tête prothétique, parfois même sans choc, ont été décrits.
Place des implants spéciaux
Des implants spécifiquement destinés à réduire le risque de luxation ont été développés avec entre autres les cotyles rétentifs, notamment utilisé aux États-Unis. Le dispositif cependant le plus fréquemment utilisé en France est la cupule à double mobilité (fig. 4 ). Cet implant est composé d’une tête mobile au sein d’un polyéthylène sphérique mobile s’articulant librement dans une cupule métallique mise en place dans l’acétabulum. Cela a pour conséquence d’augmenter l’amplitude de mouvement possible avant qu’un éventuel conflit à l’origine d’une luxation ne se produise.
Malgré une durée de vie théoriquement plus limitée par rapport aux cupules standard, leur indication en première intention s’est élargie aux patients à risque de luxation (patients obèses ou ayant des pathologies neurologiques, par exemple).
Apparues depuis une dizaine d’années, les prothèses sur mesure sont des implants réalisés à partir d’un système d’imagerie 3D. Une tomodensitométrie permettant d’effectuer une planification 3D est réalisée puis envoyée auprès d’ingénieurs. Si le temps de conception est long (environ 6 semaines), il est également important de noter que le coût à la fois de la conception et de l’intervention est beaucoup plus important. Ces implants sont spécifiquement adaptés aux patients ayant d’importantes dysplasies de la hanche ou dans le cadre des reprises.
Malgré une durée de vie théoriquement plus limitée par rapport aux cupules standard, leur indication en première intention s’est élargie aux patients à risque de luxation (patients obèses ou ayant des pathologies neurologiques, par exemple).
Apparues depuis une dizaine d’années, les prothèses sur mesure sont des implants réalisés à partir d’un système d’imagerie 3D. Une tomodensitométrie permettant d’effectuer une planification 3D est réalisée puis envoyée auprès d’ingénieurs. Si le temps de conception est long (environ 6 semaines), il est également important de noter que le coût à la fois de la conception et de l’intervention est beaucoup plus important. Ces implants sont spécifiquement adaptés aux patients ayant d’importantes dysplasies de la hanche ou dans le cadre des reprises.
Voies d’abord de la hanche
La voie d’abord correspond aux différentes étapes chirurgicales pour accéder à la zone anatomique d’intérêt en passant par les divers plans musculo-aponévrotiques. Au niveau de la hanche, de nombreuses voies d’abord ont été décrites.
Le choix de la voie d’abord nécessite de prendre en compte les complications possibles (risque de luxation ou complications nerveuses) mais également les contraintes techniques pouvant être liées au matériel ou au malade (patients obèses).
C’est elle qui définit la possibilité d’exposition en peropératoire permettant à la fois d’éviter les malpositions d’implant et une reproductibilité de pose. L’aspect esthétique de l’incision peut également être discuté avec le patient mais reste un facteur ne devant pas influencer la stratégie chirurgicale.
Si la question de la voie d’abord utilisée était communément une question de choix personnel du chirurgien, celui-ci utilisant préférentiellement la voie d’abord qu’il connaît et pratique le mieux et le plus souvent, elle devient une question récurrente de la part des patients lors des consultations de programmation chirurgicale, les patients ayant accès, via internet ou les réseaux sociaux, à de plus en plus d’informations concernant cette chirurgie.
Schématiquement, et d’une manière non exhaustive, il est possible de séparer en trois sous-groupes les principales voies d’abord utilisées : la voie d’abord postérieure, les voies latérales, et la voie antérieure.
Le choix de la voie d’abord nécessite de prendre en compte les complications possibles (risque de luxation ou complications nerveuses) mais également les contraintes techniques pouvant être liées au matériel ou au malade (patients obèses).
C’est elle qui définit la possibilité d’exposition en peropératoire permettant à la fois d’éviter les malpositions d’implant et une reproductibilité de pose. L’aspect esthétique de l’incision peut également être discuté avec le patient mais reste un facteur ne devant pas influencer la stratégie chirurgicale.
Si la question de la voie d’abord utilisée était communément une question de choix personnel du chirurgien, celui-ci utilisant préférentiellement la voie d’abord qu’il connaît et pratique le mieux et le plus souvent, elle devient une question récurrente de la part des patients lors des consultations de programmation chirurgicale, les patients ayant accès, via internet ou les réseaux sociaux, à de plus en plus d’informations concernant cette chirurgie.
Schématiquement, et d’une manière non exhaustive, il est possible de séparer en trois sous-groupes les principales voies d’abord utilisées : la voie d’abord postérieure, les voies latérales, et la voie antérieure.
Voie d’abord postérieure
La voie d’abord postérieure est la plus utilisée dans le monde. Reconnue comme techniquement plus facile, que cela soit dans l’apprentissage ou dans l’exposition des structures anatomiques du patient, elle présente l’inconvénient de devoir généralement sectionner des structures musculotendineuses, les muscles pelvitrochantériens qui sont rotateurs externes de hanche. Il s’agit donc d’une voie non anatomique pouvant être à risque de provoquer une déstabilisation de la hanche, majorant donc le risque de luxation.
Une des principales complications redoutées de cette voie est le risque potentiel de lésion du nerf sciatique, réversible ou non, pouvant avoir des conséquences fonctionnelles graves.
Une des principales complications redoutées de cette voie est le risque potentiel de lésion du nerf sciatique, réversible ou non, pouvant avoir des conséquences fonctionnelles graves.
Voie d’abord antérieure
La voie d’abord antérieure a la spécificité de ne sectionner aucune structure anatomique. Cependant, elle est connue pour être plus exigeante, avec une mauvaise exposition lors du temps fémoral majorant dans les études le risque de fracture fémorale en peropératoire.
Cette voie est de plus à risque de lésion du nerf cutané latéral de la cuisse, pouvant provoquer une atteinte sensitive dans son territoire à type d’anesthésie ou de méralgie.
Les avantages de cette voie ont cependant pu être démontrés, avec une réduction de la durée d’hospitalisation4 ainsi qu’une récupération fonctionnelle postopératoire plus rapide.5 Le taux de complications n’est pas augmenté avec l’utilisation de cette voie.6
Cette voie est de plus à risque de lésion du nerf cutané latéral de la cuisse, pouvant provoquer une atteinte sensitive dans son territoire à type d’anesthésie ou de méralgie.
Les avantages de cette voie ont cependant pu être démontrés, avec une réduction de la durée d’hospitalisation4 ainsi qu’une récupération fonctionnelle postopératoire plus rapide.5 Le taux de complications n’est pas augmenté avec l’utilisation de cette voie.6
Autres voies d’abord
La trochantérotomie est une voie latérale réalisée au moyen d'une coupe osseuse du grand trochanter, où s’insère notamment le muscle moyen fessier, qui est l’élément primordial de la balance musculaire permettant l’équilibre du bassin à la marche.
Généralement réservée aux reprises chirurgicales de prothèse totale de la hanche, elle permet une très bonne exposition chirurgicale à la fois du fémur et du cotyle, facilitant considérablement les possibilités de reconstruction osseuse. Elle implique cependant une ostéosynthèse de la coupe osseuse effectuée afin de réinsérer l’éventail fessier.
L’obtention de la bonne consolidation osseuse passe donc par la nécessité de différer l’appui du côté opéré pour une durée minimale de 45 jours afin d’éviter un déplacement secondaire ou une pseudarthrose. Son indication en première intention est devenue rare.
La voie antérolatérale de Hardinge est une voie nécessitant la désinsertion des muscles fessiers. Si elle donne une bonne exposition de l’articulation et présente un taux faible de luxation, l’utilisation de cannes est souvent recommandée pendant quelques semaines afin de permettre la cicatrisation. Cette voie est de moins en moins utilisée.
Les voies d’abord mini-invasives correspondent surtout à une définition conceptuelle. Elles ne se résument pas à une incision de petite taille mais doivent être comprises comme des voies d’abord cherchant à optimiser les suites opératoires en réalisant le moins de lésions chirurgicales de passage au niveau des structures musculotendineuses du patient. L’exemple de la voie antérieure entre donc parfaitement dans cette définition.
Généralement réservée aux reprises chirurgicales de prothèse totale de la hanche, elle permet une très bonne exposition chirurgicale à la fois du fémur et du cotyle, facilitant considérablement les possibilités de reconstruction osseuse. Elle implique cependant une ostéosynthèse de la coupe osseuse effectuée afin de réinsérer l’éventail fessier.
L’obtention de la bonne consolidation osseuse passe donc par la nécessité de différer l’appui du côté opéré pour une durée minimale de 45 jours afin d’éviter un déplacement secondaire ou une pseudarthrose. Son indication en première intention est devenue rare.
La voie antérolatérale de Hardinge est une voie nécessitant la désinsertion des muscles fessiers. Si elle donne une bonne exposition de l’articulation et présente un taux faible de luxation, l’utilisation de cannes est souvent recommandée pendant quelques semaines afin de permettre la cicatrisation. Cette voie est de moins en moins utilisée.
Les voies d’abord mini-invasives correspondent surtout à une définition conceptuelle. Elles ne se résument pas à une incision de petite taille mais doivent être comprises comme des voies d’abord cherchant à optimiser les suites opératoires en réalisant le moins de lésions chirurgicales de passage au niveau des structures musculotendineuses du patient. L’exemple de la voie antérieure entre donc parfaitement dans cette définition.
Que retenir des voies d’abord ?
Dans les études à long terme, aucune voie d’abord n’a pu démontrer sa supériorité par rapport à une autre, expliquant la diversité des voies d’abord utilisées. Il est nécessaire d’arriver à faire la part des choses entre ce qui correspond à de vraies conclusions scientifiques et ce qui semble être plutôt une question d’influence de la part des industries et du marketing.
Si les abords mini-invasifs ont l’avantage d’être effectués au moyen de cicatrices de plus petite taille, celles-ci sont généralement à risque similaire de provoquer des lésions musculaires ou encore nerveuses, notamment chez un opérateur moins expérimenté. Il ne faut donc pas tomber dans le piège de conclure que la voie d’abord puisse être en rapport avec le résultat fonctionnel à court et surtout long terme.
Il est primordial que le chirurgien orthopédiste choisisse avant tout d’effectuer la voie d’abord qu’il maîtrise et qu’il a l’habitude d’utiliser afin de procéder à l’implantation optimale des différents composants de la prothèse, qui est le seul garant de la pérennité de cette dernière.
Le choix doit donc être uniquement fondé sur l’expérience du chirurgien, sur les comorbidités du patient et ses demandes fonctionnelles.
Si les abords mini-invasifs ont l’avantage d’être effectués au moyen de cicatrices de plus petite taille, celles-ci sont généralement à risque similaire de provoquer des lésions musculaires ou encore nerveuses, notamment chez un opérateur moins expérimenté. Il ne faut donc pas tomber dans le piège de conclure que la voie d’abord puisse être en rapport avec le résultat fonctionnel à court et surtout long terme.
Il est primordial que le chirurgien orthopédiste choisisse avant tout d’effectuer la voie d’abord qu’il maîtrise et qu’il a l’habitude d’utiliser afin de procéder à l’implantation optimale des différents composants de la prothèse, qui est le seul garant de la pérennité de cette dernière.
Le choix doit donc être uniquement fondé sur l’expérience du chirurgien, sur les comorbidités du patient et ses demandes fonctionnelles.
Références
1. Ponzio DY, Shahi A, Park AG, Purtill JJ. Intraoperative proximal femoral fracture in primary cementless total hip arthroplasty. J Arthroplasty 2015;30:1418-22.
2. Lindahl H. Epidemiology of periprosthetic femur fracture around a total hip arthroplasty. Injury 2007;38:651-4.
3. Illgen R 2nd, Rubash HE. The optimal fixation of the cementless acetabular component in primary total hip arthroplasty. J Am Acad Orthop Surg 2002;10:43-56.
4. Nakata K, Nishikawa M, Yamamoto K, Hirota S, Yoshikawa H. A clinical comparative study of the direct anterior with mini-posterior approach: two consecutive series. J Arthroplasty 2009;24:698-704.
5. Barrett WP, Turner SE, Leopold JP. Prospective randomized study of direct anterior vs postero-.-lateral approach for total hip arthroplasty. J Arthroplasty 2013;28:1634-8.
6. Barnett SL, Peters DJ, Hamilton WG, Ziran NM, Gorab RS, Matta JM. Is the anterior approach safe? Early complication rate associated with 5090 consecutive primary total hip arthroplasty procedures performed using the anterior approach. J Arthroplasty 2016;31:2291-4.
2. Lindahl H. Epidemiology of periprosthetic femur fracture around a total hip arthroplasty. Injury 2007;38:651-4.
3. Illgen R 2nd, Rubash HE. The optimal fixation of the cementless acetabular component in primary total hip arthroplasty. J Am Acad Orthop Surg 2002;10:43-56.
4. Nakata K, Nishikawa M, Yamamoto K, Hirota S, Yoshikawa H. A clinical comparative study of the direct anterior with mini-posterior approach: two consecutive series. J Arthroplasty 2009;24:698-704.
5. Barrett WP, Turner SE, Leopold JP. Prospective randomized study of direct anterior vs postero-.-lateral approach for total hip arthroplasty. J Arthroplasty 2013;28:1634-8.
6. Barnett SL, Peters DJ, Hamilton WG, Ziran NM, Gorab RS, Matta JM. Is the anterior approach safe? Early complication rate associated with 5090 consecutive primary total hip arthroplasty procedures performed using the anterior approach. J Arthroplasty 2016;31:2291-4.