Les premières trithérapies antirétrovirales (1996) se sont rapidement vu attribuer un effet indésirable inattendu : le syndrome lipodystrophique, associant une atrophie du tissu adipeux sous-cutané du visage et des membres à une accumulation centrale de graisse (adipomastie, « bosse de bison », graisse abdominale périviscérale). On a relié cette anomalie de répartition des graisses à la toxicité adipocytaire des premiers antirétroviraux, la lipoatrophie résultant de la toxicité mitochondriale d’inhibiteurs nucléosidiques de la transcriptase inverse (INTI), comme la stavudine ou la zidovudine, la lipohypertrophie résultant des perturbations métaboliques et inflammatoires induites par les inhibiteurs de protéase alors utilisés.
Un phénomène nouveau
Ce problème avait disparu avec les molécules sans toxicité mitochondriale (ténofovir, abacavir, lamivudine, emtricitabine) ni impact métabolique direct (darunavir, atazanavir, inhibiteurs non nucléosidiques de la transcriptase inverse, premiers inhibiteurs de l’intégrase). En effet, le syndrome lipodystrophique n’apparaît pas, même après des années de traitement par des associations de nucléosides « modernes » (ténofovir/emtricitabine, abacavir/lamivudine), quel que soit le troisième médicament choisi parmi les molécules précédemment citées. Cependant, depuis 2017, des études observationnelles et randomisées ont révélé un phénomène nouveau de prise de poids excessive, contemporain de l’introduction de nouvelles anti-intégrases (dolutégravir et bictégravir) et d’une nouvelle prodrogue du ténofovir, le ténofovir alafénamide (« TAF »), dont l’utilisation réduit de 90 % l’exposition systémique au ténofovir par rapport au ténofovir disoproxyl fumarate (« TDF »).
Ce phénomène s’inscrit dans une tendance à long terme, avec des déterminants multiples. Une récente méta-analyse1 a porté sur 8 études randomisées consacrées aux traitements antirétroviraux de première ligne, publiées entre 2003 et 2015, reflétant les évolutions thérapeutiques. Elle a constaté que la prise de poids des personnes traitées, à 48 semaines de suivi, a augmenté au cours du temps. Elle a aussi pu identifier, par une analyse multivariable, les facteurs non médicamenteux associés au risque de prise de poids significative (supérieure ou égale à 10 %) : taux initial de lymphocytes CD4 bas (inférieur à 200/µL), charge virale élevée (supérieure à 100 000 copies ARN/mL), indice de masse corporelle normal (par comparaison à l’obésité), sexe féminin et ethnie africaine ou afro-américaine. Dans la classe des INTI, le ténofovir et l’abacavir étaient bien sûr plus fortement associés à la prise de poids que la zidovudine, mais le TAF y était également plus fortement associé que l’abacavir et… le TDF ! Enfin, le dolutégravir et le bictégravir étaient plus fortement associés à la prise de poids que l’éfavirenz.
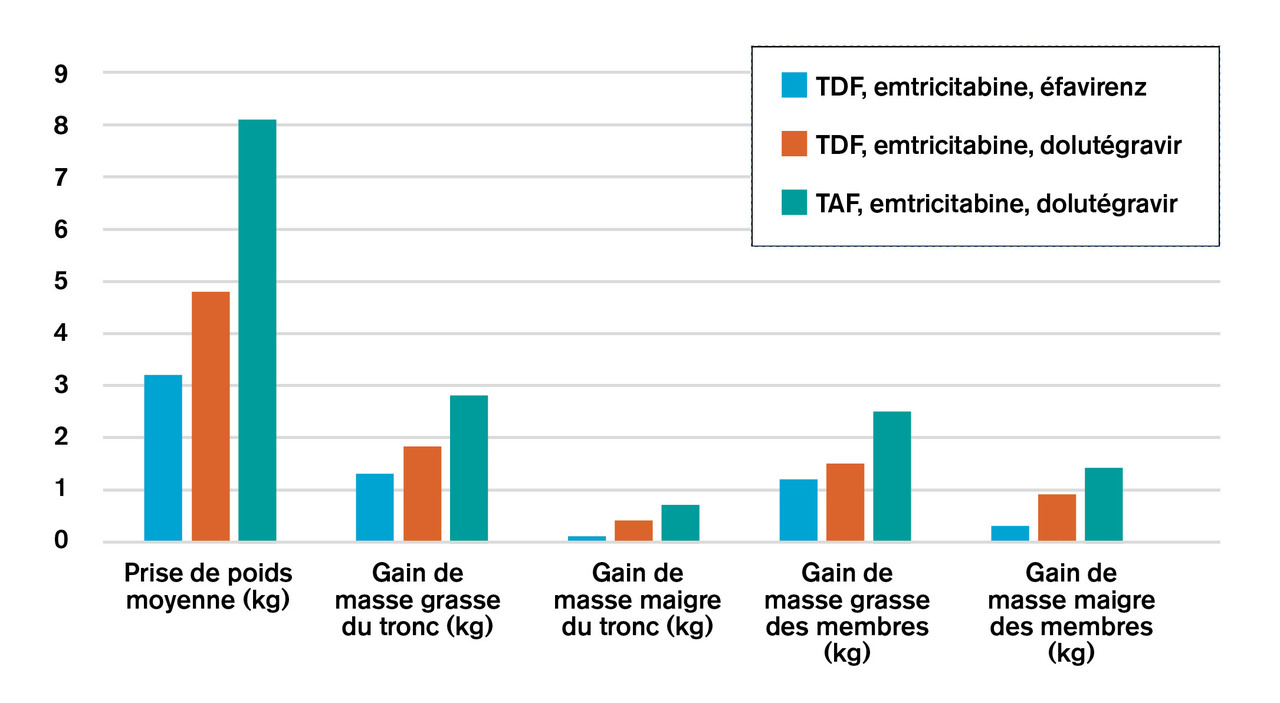
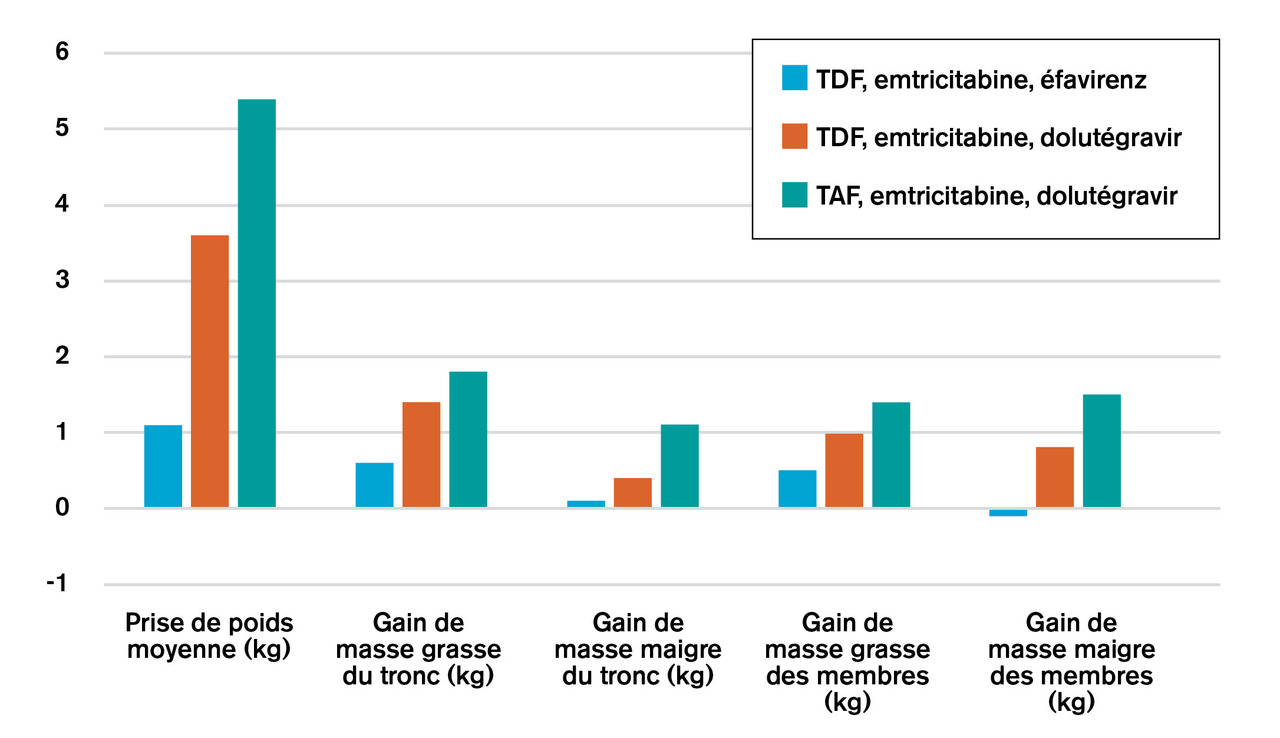
Il semble donc que, chez certains patients, une prise de poids excessive résulterait de l’exposition aux anti-intégrases de 2e génération et au TAF. Ainsi, l’étude ADVANCE2 a comparé, en Afrique du Sud, trois traitements de 1re ligne : une association « classique » de TDF, emtricitabine et éfavirenz (n = 351), une association « moderne » de TAF, emtricitabine et dolutégravir (n = 351), et une association « intermédiaire » de TDF, emtricitabine et dolutégravir (n = 351). Le résultat est clair : le gain de poids à 96 semaines allait croissant, du traitement le plus classique au traitement le plus moderne, effet nettement plus marqué chez les femmes (fig. 1 et 2 ). Notons que la prise de poids était harmonieuse, ce qui est très différent du syndrome lipodystrophique historique.
Ce phénomène s’inscrit dans une tendance à long terme, avec des déterminants multiples. Une récente méta-analyse1 a porté sur 8 études randomisées consacrées aux traitements antirétroviraux de première ligne, publiées entre 2003 et 2015, reflétant les évolutions thérapeutiques. Elle a constaté que la prise de poids des personnes traitées, à 48 semaines de suivi, a augmenté au cours du temps. Elle a aussi pu identifier, par une analyse multivariable, les facteurs non médicamenteux associés au risque de prise de poids significative (supérieure ou égale à 10 %) : taux initial de lymphocytes CD4 bas (inférieur à 200/µL), charge virale élevée (supérieure à 100 000 copies ARN/mL), indice de masse corporelle normal (par comparaison à l’obésité), sexe féminin et ethnie africaine ou afro-américaine. Dans la classe des INTI, le ténofovir et l’abacavir étaient bien sûr plus fortement associés à la prise de poids que la zidovudine, mais le TAF y était également plus fortement associé que l’abacavir et… le TDF ! Enfin, le dolutégravir et le bictégravir étaient plus fortement associés à la prise de poids que l’éfavirenz.
Il semble donc que, chez certains patients, une prise de poids excessive résulterait de l’exposition aux anti-intégrases de 2e génération et au TAF. Ainsi, l’étude ADVANCE2 a comparé, en Afrique du Sud, trois traitements de 1re ligne : une association « classique » de TDF, emtricitabine et éfavirenz (n = 351), une association « moderne » de TAF, emtricitabine et dolutégravir (n = 351), et une association « intermédiaire » de TDF, emtricitabine et dolutégravir (n = 351). Le résultat est clair : le gain de poids à 96 semaines allait croissant, du traitement le plus classique au traitement le plus moderne, effet nettement plus marqué chez les femmes (
Lié à un surcroît d’efficacité ?
Il est difficile de proposer un schéma physiopathologique, mais quelques hypothèses ont été avancées quant au rôle des anti-intégrases.3 Un antagonisme in vitro du dolutégravir sur le récepteur de la mélanocortine-4 pourrait expliquer un effet orexigène, en particulier en présence de taux de leptine élevés, une caractéristique des femmes. Un effet direct sur le métabolisme adipocytaire, des effets neurologiques centraux, une modification du microbiote ou de la perméabilité intestinale ont également été évoqués, sans véritables données pour soutenir ces hypothèses.
L’effet du TAF sur le poids, comparé à celui du TDF, est encore plus difficile à expliquer car il se produit alors que l’exposition systémique au ténofovir est divisée par 10 ! Une meilleure pénétration dans les cellules mononuclées et une plus longue demi-vie intracellulaire sont peut-être des pistes à explorer. L’influence de la génétique mitochondriale (« haplogroupes », différents entre Européens et Africains) a été évoquée.3
À l’inverse, on pourrait aussi envisager le problème différemment. Tout d’abord, la prise d’un premier traitement antirétroviral, quel qu’il soit, même le plus toxique pour la mitochondrie et l’adipocyte, entraîne une prise de poids initiale, traduisant un « retour à la santé » via la réduction de l’inflammation liée à la réplication virale : c’est seulement ensuite qu’apparaîtra un éventuel syndrome lipodystrophique, avec sa part de lipoatrophie. De plus, l’éfavirenz (un ancien médicament) semble plutôt limiter la prise de poids, particulièrement chez les « métaboliseurs lents », porteurs d’un polymorphisme du CYP2B6 qui augmente l’exposition au médicament.3 On pourrait donc formuler une hypothèse provocatrice selon laquelle le gain de poids excessif observé avec les nouveaux médicaments serait en réalité dû à l’absence des effets limitant la prise de poids des médicaments plus anciens…
L’effet du TAF sur le poids, comparé à celui du TDF, est encore plus difficile à expliquer car il se produit alors que l’exposition systémique au ténofovir est divisée par 10 ! Une meilleure pénétration dans les cellules mononuclées et une plus longue demi-vie intracellulaire sont peut-être des pistes à explorer. L’influence de la génétique mitochondriale (« haplogroupes », différents entre Européens et Africains) a été évoquée.3
À l’inverse, on pourrait aussi envisager le problème différemment. Tout d’abord, la prise d’un premier traitement antirétroviral, quel qu’il soit, même le plus toxique pour la mitochondrie et l’adipocyte, entraîne une prise de poids initiale, traduisant un « retour à la santé » via la réduction de l’inflammation liée à la réplication virale : c’est seulement ensuite qu’apparaîtra un éventuel syndrome lipodystrophique, avec sa part de lipoatrophie. De plus, l’éfavirenz (un ancien médicament) semble plutôt limiter la prise de poids, particulièrement chez les « métaboliseurs lents », porteurs d’un polymorphisme du CYP2B6 qui augmente l’exposition au médicament.3 On pourrait donc formuler une hypothèse provocatrice selon laquelle le gain de poids excessif observé avec les nouveaux médicaments serait en réalité dû à l’absence des effets limitant la prise de poids des médicaments plus anciens…
Une notion à intégrer
Quoi qu’il en soit, il faut suivre les cohortes de patients recevant du TAF et des anti-intégrases de 2e génération pour apprécier les éventuelles conséquences métaboliques de cette prise de poids, lorsqu’elle existe. La prescription de ces médicaments doit désormais intégrer cette notion, ce d’autant que des profils de risque semblent se dessiner. En parallèle, enfin, il est fondamental de conserver son bon sens clinique, qui permet bien souvent de déceler un autre facteur de prise de poids, parmi les nombreuses causes possibles, chez un(e) patient(e) sous traitement antirétroviral, quel qu’il soit.
Références
1. Sax PE, Erlandson KM, Lake JE, McComsey GA, Orkin C, Esser S, et al. Weight gain following initiation of antiretroviral therapy : risk factors in randomized comparative trials. Clin Infect Dis. 2020;71:1379-89.
2. Venter WDF, Sokhela S, Simmons B, Moorhouse M, Fairlie L, Mashabane N, et al. Dolutegravir with emtricitabine and tenofovir alafenamide or tenofovir disoproxyl fumarate versus efavirenz, emtrictabine, and tenofovir disoproxyl fumarate for initial treatment of HIV-1 infection (ADVANCE): week 96 results from a randomised, phase 3, non-inferiority trial. Lancet HIV. 2020;7:e666-76.
3. Lake JE, Trevillyan J. Impact of integrase inhibitors and tenofovir alafenamide on weight gain in people with HIV. Curr Opin HIV AIDS. 2021;16:148-51.
2. Venter WDF, Sokhela S, Simmons B, Moorhouse M, Fairlie L, Mashabane N, et al. Dolutegravir with emtricitabine and tenofovir alafenamide or tenofovir disoproxyl fumarate versus efavirenz, emtrictabine, and tenofovir disoproxyl fumarate for initial treatment of HIV-1 infection (ADVANCE): week 96 results from a randomised, phase 3, non-inferiority trial. Lancet HIV. 2020;7:e666-76.
3. Lake JE, Trevillyan J. Impact of integrase inhibitors and tenofovir alafenamide on weight gain in people with HIV. Curr Opin HIV AIDS. 2021;16:148-51.