L’anévrysme de l’aorte abdominale est une dilatation permanente de l’artère, avec une perte de parallélisme des parois, qui aboutit à une augmentation de diamètre de plus de 50 %, par rapport au diamètre d’amont. Un anévrysme aortique est défini par un diamètre supérieur à 30 mm. Dans la majorité des cas, les anévrysmes de l’aorte abdominale sont situés au niveau de l’aorte sous-rénale, mais ils peuvent s’étendre en amont, c’est-à-dire en regard de la portion d’aorte donnant naissance aux artères digestives et rénales (anévrysmes dits « complexes »), ou en aval, au niveau des artères iliaques (anévrysmes aorto-iliaques). Au sein des anévrysmes de l’aorte abdominale, on observe dans la plupart des cas un thrombus endoluminal, accolé à la paroi aortique. Ce thrombus est une entité biologiquement active, qui participe à la physiopathologie de la maladie anévrysmale.1
De multiples causes, dominées par l’athérosclérose
Plus de 90 % des anévrysmes sont associés à l’athérosclérose. L’existence de formes familiales doit faire suspecter, dans certains cas, une composante génétique. Dans 5 à 10 % des cas, d’autres causes sont identifiées : dystrophies héréditaires du tissu conjonctif (maladie de Marfan, maladie d’Ehlers-Danlos), dissection aortique, maladies inflammatoires (de Takayasu, de Behçet et plus rarement de Horton), anévrysme infectieux ou mycotique (par contiguïté ou hématogène), anévrysme post-traumatique. Les spécificités de ces formes ne seront pas abordées dans ce texte.
Les principaux facteurs de risque sont le tabagisme, l’hypertension artérielle, l’âge, l’hérédité et le sexe masculin.2 La prévalence des anévrysmes de l’aorte abdominale augmente avec l’âge, est supérieure chez l’homme (4 à 6 hommes pour une femme) et atteint 3 à 8 % pour les hommes de plus de 65 ans. Entre 75 et 84 ans, elle est de 12 % pour les hommes et de 5 % pour les femmes.3 Cette prédominance masculine tend à s’estomper avec l’âge et l’augmentation de la consommation de tabac.
Les principaux facteurs de risque sont le tabagisme, l’hypertension artérielle, l’âge, l’hérédité et le sexe masculin.2 La prévalence des anévrysmes de l’aorte abdominale augmente avec l’âge, est supérieure chez l’homme (4 à 6 hommes pour une femme) et atteint 3 à 8 % pour les hommes de plus de 65 ans. Entre 75 et 84 ans, elle est de 12 % pour les hommes et de 5 % pour les femmes.3 Cette prédominance masculine tend à s’estomper avec l’âge et l’augmentation de la consommation de tabac.
Le risque principal est la rupture
L’altération des composants de la média (fibres de collagène, raréfaction de fibres élastiques) entraîne la dilatation qui progresse selon la loi de Laplace.
Le risque principal est la rupture, qui augmente avec le diamètre et la vitesse de croissance de l’anévrysme. Il est estimé à 1,1 % par an entre 40 et 49 mm et à 3,3 % par an entre 50 et 59 mm ; il peut atteindre 30 à 50 % par an pour des anévrysmes de plus de 80 mm.4
Le risque de rupture des petits anévrysmes (< 40 mm) est environ 4 fois plus élevé chez les femmes, à diamètre équivalent. Ainsi, le taux de rupture chez les femmes ayant un anévrysme de l’aorte abdominale de 45 mm est identique à celui des hommes dont l’anévrysme mesure 55 mm.5
La rupture d’anévrysme de l’aorte abdominale est associée à une mortalité pouvant atteindre 80 %, justifiant un traitement chirurgical préventif électif, quelle que soit la technique utilisée, à partir de 55 mm de diamètre chez l’homme, 50 mm chez la femme ou si la croissance dépasse 10 mm en un an.6 Un anévrysme de l’aorte abdominale symptomatique ou compliqué doit être traité indépendamment de tout critère de taille.
Le risque principal est la rupture, qui augmente avec le diamètre et la vitesse de croissance de l’anévrysme. Il est estimé à 1,1 % par an entre 40 et 49 mm et à 3,3 % par an entre 50 et 59 mm ; il peut atteindre 30 à 50 % par an pour des anévrysmes de plus de 80 mm.4
Le risque de rupture des petits anévrysmes (< 40 mm) est environ 4 fois plus élevé chez les femmes, à diamètre équivalent. Ainsi, le taux de rupture chez les femmes ayant un anévrysme de l’aorte abdominale de 45 mm est identique à celui des hommes dont l’anévrysme mesure 55 mm.5
La rupture d’anévrysme de l’aorte abdominale est associée à une mortalité pouvant atteindre 80 %, justifiant un traitement chirurgical préventif électif, quelle que soit la technique utilisée, à partir de 55 mm de diamètre chez l’homme, 50 mm chez la femme ou si la croissance dépasse 10 mm en un an.6 Un anévrysme de l’aorte abdominale symptomatique ou compliqué doit être traité indépendamment de tout critère de taille.
Une pathologie habituellement silencieuse qui justifie un dépistage ciblé
Le plus souvent asymptomatique, l’anévrysme de l’aorte abdominale est découvert fortuitement lors d’un examen d’imagerie, réalisé pour une autre indication, ou suspecté à la palpation d’une masse para-ombilicale battante.
L’anévrysme symptomatique est une urgence
Le caractère douloureux de l’anévrysme doit faire suspecter une rupture imminente. La douleur est abdominale ou lombaire, spontanée ou déclenchée par la palpation de la masse abdominale. Le patient doit alors être transféré rapidement dans un service de chirurgie vasculaire pour une prise en charge adaptée.
La rupture d’un anévrysme de l’aorte abdominale associe une douleur abdominale ou lombaire et un choc hémorragique. Le transfert médicalisé en extrême urgence vers un centre de chirurgie vasculaire est alors indispensable. Si l’état hémodynamique le permet, un angioscanner abdominal est réalisé, pour confirmer le diagnostic et préciser la localisation de l’anévrysme de l’aorte abdominale par rapport aux artères rénales. L’étude de l’anatomie de l’anévrysme permet également de choisir la modalité thérapeutique la plus adaptée, exclusion par endoprothèse ou mise à plat chirurgicale, compte tenu de l’expertise de l’équipe et de l’équipement du centre.
L’anévrysme peut aussi se rompre dans une structure de voisinage. On parle de fistule aortodigestive lorsque cette rupture se produit dans le duodénum, entraînant une hémorragie digestive basse et/ou haute, d’intensité variable. La rupture dans la veine cave inférieure (fistule aortocave) peut être responsable d’une insuffisance cardiaque à débit élevé et/ou de thrombose des axes veineux iliaques, avec, à l’auscultation, un souffle continu à renforcement systolique.
Enfin, l’anévrysme de l’aorte abdominale peut être diagnostiqué au cours de l’exploration d’embolies artérielles des membres inférieurs. Il s’agit dans la plupart des cas d’embolies très distales (syndrome de l’orteil bleu) de fragments fibrinocruoriques provenant du thrombus anévrysmal.
La rupture d’un anévrysme de l’aorte abdominale associe une douleur abdominale ou lombaire et un choc hémorragique. Le transfert médicalisé en extrême urgence vers un centre de chirurgie vasculaire est alors indispensable. Si l’état hémodynamique le permet, un angioscanner abdominal est réalisé, pour confirmer le diagnostic et préciser la localisation de l’anévrysme de l’aorte abdominale par rapport aux artères rénales. L’étude de l’anatomie de l’anévrysme permet également de choisir la modalité thérapeutique la plus adaptée, exclusion par endoprothèse ou mise à plat chirurgicale, compte tenu de l’expertise de l’équipe et de l’équipement du centre.
L’anévrysme peut aussi se rompre dans une structure de voisinage. On parle de fistule aortodigestive lorsque cette rupture se produit dans le duodénum, entraînant une hémorragie digestive basse et/ou haute, d’intensité variable. La rupture dans la veine cave inférieure (fistule aortocave) peut être responsable d’une insuffisance cardiaque à débit élevé et/ou de thrombose des axes veineux iliaques, avec, à l’auscultation, un souffle continu à renforcement systolique.
Enfin, l’anévrysme de l’aorte abdominale peut être diagnostiqué au cours de l’exploration d’embolies artérielles des membres inférieurs. Il s’agit dans la plupart des cas d’embolies très distales (syndrome de l’orteil bleu) de fragments fibrinocruoriques provenant du thrombus anévrysmal.
Quand dépister ?
En France, un dépistage ciblé des anévrysmes de l’aorte abdominale par écho-Doppler est recommandé par la Haute Autorité de santé depuis 2012 chez les hommes âgés de 65 à 75 ans, fumeurs ou anciens fumeurs, et de 50 à 75 ans, en cas d’antécédent familial d’anévrysme de l’aorte abdominale au premier degré.7
Écho-Doppler et angioscanner impliqués dans la stratégie de surveillance
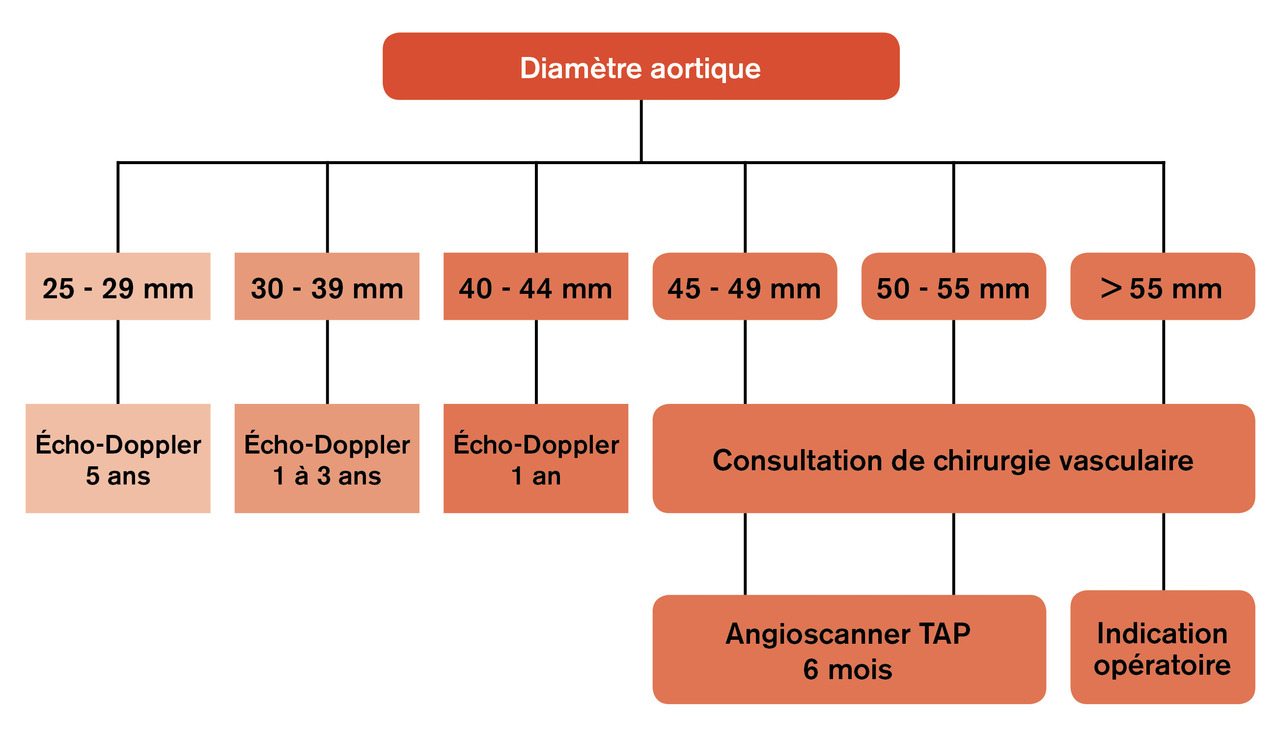
L’écho-Doppler de l’aorte abdominale est l’examen de référence pour dépister et surveiller de petits anévrysmes. Il permet de mesurer le diamètre maximal antério-postérieur de l’aorte abdominale, qui déterminera la fréquence et les modalités de surveillance (fig. 1 ).
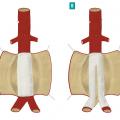
L’angioscanner thoraco-abdomino-pelvien est l’examen préthérapeutique de référence. Il permet d’étudier la morphologie aortique, en définissant les caractéristiques anatomiques de l’anévrysme, et de dépister un anévrysme thoracique associé. Ainsi peut-on différencier les anévrysmes strictement sous-rénaux des anévrysmes dits « complexes » de l’aorte abdominale (fig. 2 ). Enfin, il s’agit de l’examen de première intention pour toute situation d’urgence.
L’angio-IRM peut remplacer l’angioscanner en cas de contre-indication. L’artériographie n’a plus aucune place dans cette indication.
L’angioscanner thoraco-abdomino-pelvien est l’examen préthérapeutique de référence. Il permet d’étudier la morphologie aortique, en définissant les caractéristiques anatomiques de l’anévrysme, et de dépister un anévrysme thoracique associé. Ainsi peut-on différencier les anévrysmes strictement sous-rénaux des anévrysmes dits « complexes » de l’aorte abdominale (
L’angio-IRM peut remplacer l’angioscanner en cas de contre-indication. L’artériographie n’a plus aucune place dans cette indication.
Bilan d’extension de la maladie athéromateuse et anévrysmale
À l’occasion de la découverte d’un anévrysme de l’aorte abdominale, un bilan complémentaire est nécessaire. Il doit rechercher des facteurs de risque cardiovasculaire (hypertension artérielle, dyslipidémie) et d’autres localisations de la maladie athéromateuse (coronaropathie, artériopathie périphérique). Le bilan d’extension de la maladie anévrysmale doit éliminer un anévrysme poplité (associé dans 30 % des cas) et un anévrysme de l’aorte thoracique.
Classification des anévrysmes de l'aorte abdominale
L’anévrysme de l’aorte abdominale est dit « sous-rénal » lorsque la dilatation débute en aval des artères rénales. On parle d’anévrysmes complexes de l’aorte abdominale lorsque la dilatation est située au niveau ou au-dessus des artères rénales (fig. 2 ).
La prise en charge comporte plusieurs volets
Le traitement médical repose sur le contrôle du tabagisme et une prise en charge des autres facteurs de risque cardiovasculaire. Un traitement antiagrégant plaquettaire doit être institué, le plus souvent associé à une statine.
Objectif chirurgical : prévenir la rupture
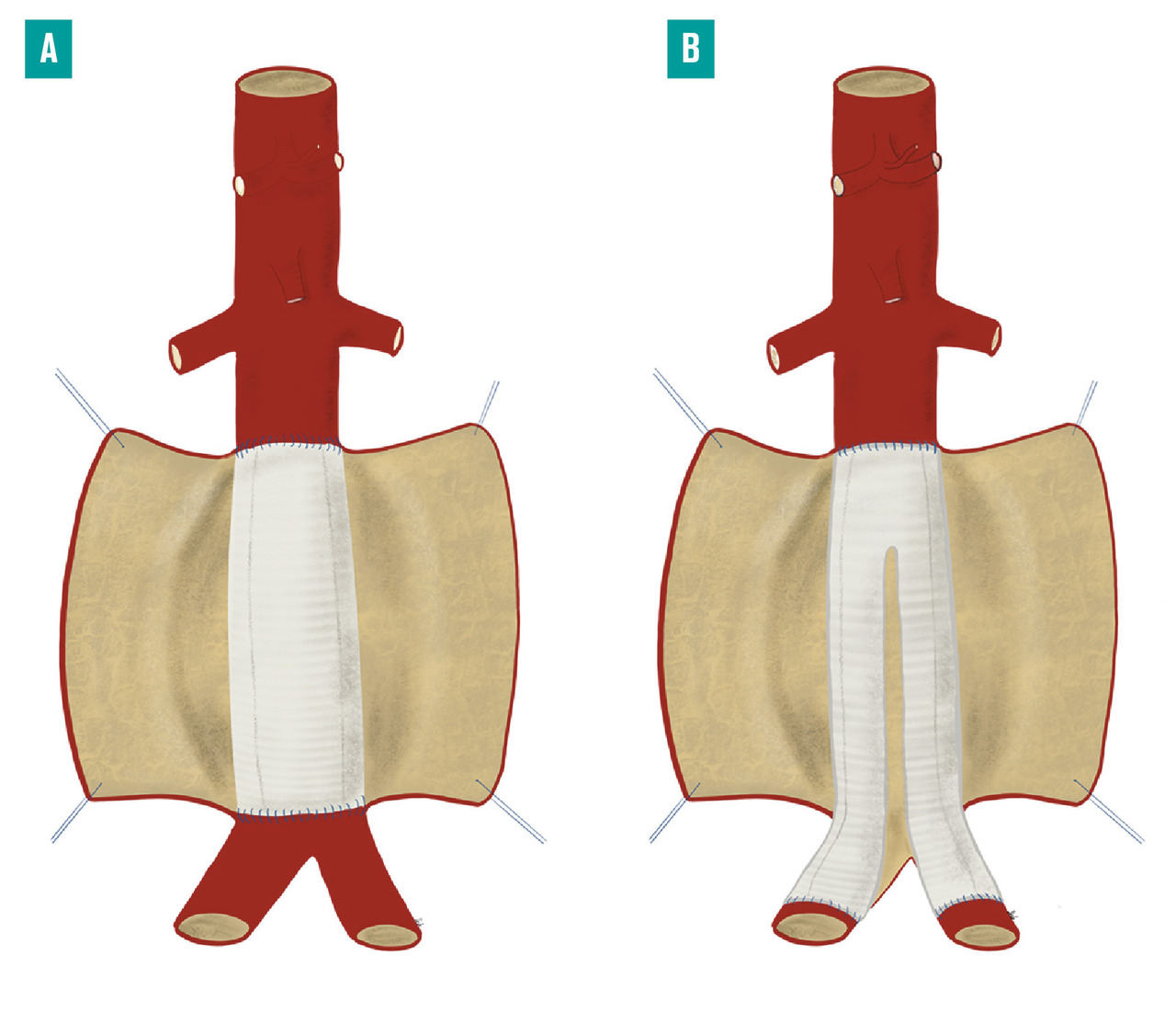
Le traitement chirurgical repose sur l’exclusion de la zone anévrysmale du flux circulatoire par deux techniques différentes : la mise à plat-greffe ou l’exclusion endovasculaire.
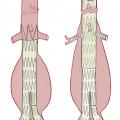
fig. 3A ), afin de remplacer le segment aortique anévrysmal par une prothèse vasculaire en polyester ou en polytétrafluoroéthylène. La mise à plat permet d’extraire le thrombus anévrysmal et de ligaturer les ostia des artères lombaires, naissant de la face postérieure de l’anévrysme. L’étendue de la réparation et le niveau de clampage aortique dépendent de l’étendue de l’anévrysme. Dans la plupart des cas, ce dernier est strictement sous-rénal et l’intervention peut être réalisée sans que la perfusion des artères rénales et digestives ne soit temporairement interrompue, limitant ainsi le risque de complication postopératoire. En cas d’extension de l’anévrysme aux artères iliaques, une prothèse bifurquée aorto-bi-iliaque est utilisée (fig. 3B ). Cette technique réalise une exclusion définitive de l’anévrysme, avec un faible taux de mortalité péri-opératoire (2 à 7 %).8
La mise à plat-greffe peut aussi être réalisée par laparoscopie ou laparoscopie robot-assistée, ce qui réduit les douleurs postopératoires, la durée de séjour et le risque de complications pariétales, tout en conservant les bénéfices du remplacement de l’aorte anévrysmale. Cette technique n’est pratiquée que dans un nombre limité de centres experts.
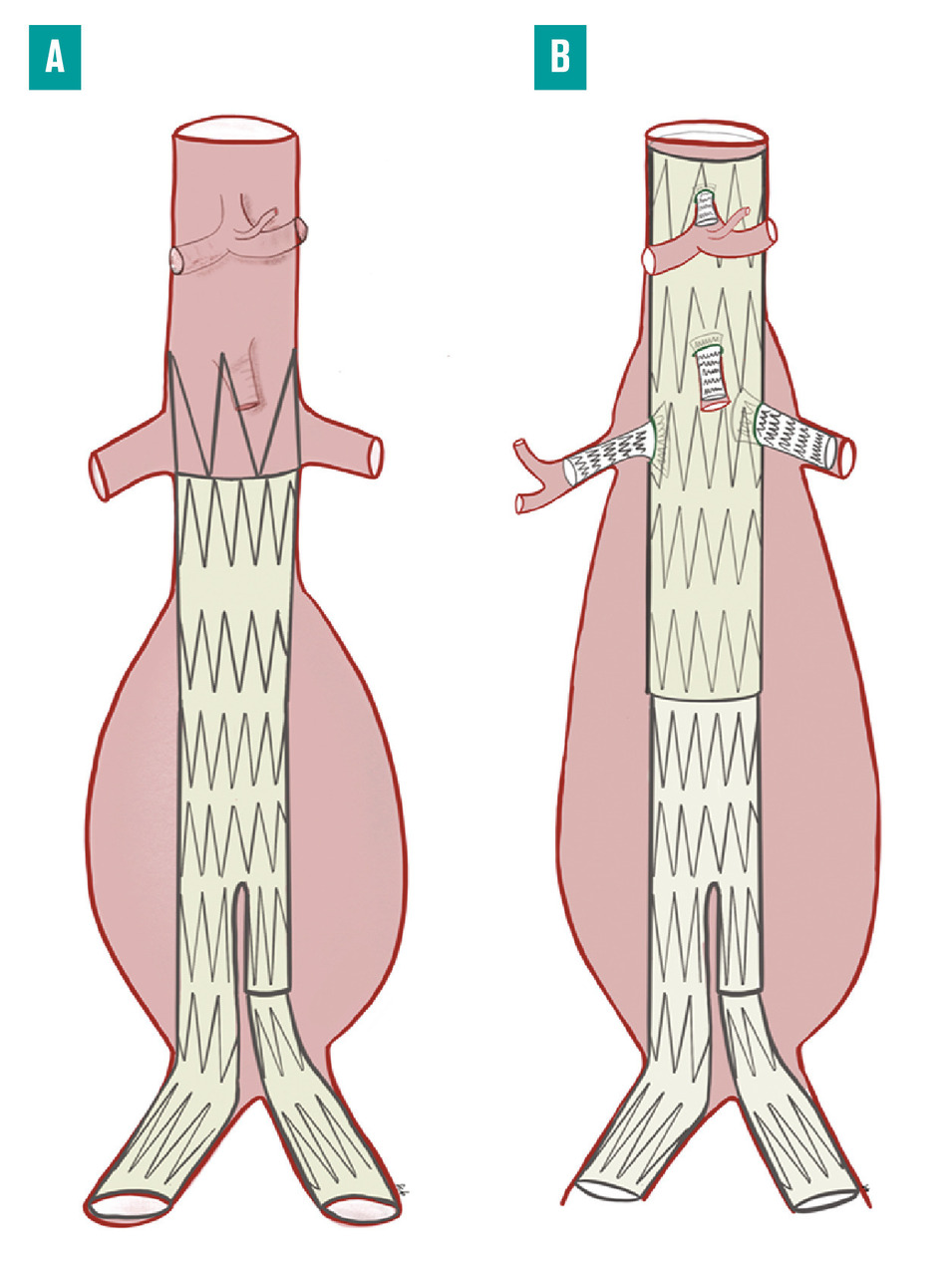
fig. 4A ). Dans la majorité des cas, la pose de cette endoprothèse est réalisable par voie percutanée, via les artères fémorales, ce qui rend la technique très peu invasive. La faisabilité et l’efficacité de cette méthode sont conditionnées par des critères anatomiques particuliers. En effet, pour exclure l’anévrysme de la circulation, l’endoprothèse doit être placée entre deux portions d’artères saines, ce qui permet son ancrage et de garantir l’étanchéité de l’exclusion anévrysmale. Ces « collets » proximaux et distaux ne doivent pas comporter de thrombus mural circonférentiel ni de calcifications majeures. De plus, le collet proximal dont les bords sont parallèles, doit mesurer au moins 15 mm. Cette longueur nécessaire est allongée à 20 mm si le collet décrit une angulation de 40 à 60°.6
L’anévrysme étant laissé en place, une surveillance régulière postopératoire est indispensable pour vérifier l’absence d’endofuite (persistance d’un flux sanguin dans l’anévrysme) qui peut provenir d’un défaut d’étanchéité proximale ou distale (endofuite de type I), d’un reflux des artères collatérales (artères lombaires, artère mésentérique inférieure) dans le sac anévrysmal (endofuite de type II) ou d’un défaut d’étanchéité entre les différents composants de l’endoprothèse (endofuite de type III). Si les endofuites de type II (les plus fréquentes) présentent un risque de complication relativement faible, elles nécessitent néanmoins une surveillance plus rapprochée de l’évolution du diamètre aortique. Les endofuites de type I ou III doivent, quant à elles, être considérées comme des échecs du traitement endovasculaire, justifiant une consultation spécialisée et une réintervention.
Chez les patients à faible risque chirurgical, les données à long terme confirment un nombre de réinterventions significativement supérieur après traitement par voie endovasculaire, par rapport à la chirurgie conventionnelle (à 15 ans, respectivement 32,9 % versus 14,7 %).
La chirurgie conventionnelle est le traitement de référence des anévrysmes de l’aorte abdominale chez les patients à faible risque chirurgical. Le traitement endovasculaire est proposé aux patients à risque chirurgical standard, uniquement si les critères anatomiques le permettent. En cas d’abdomen dit « hostile » (antécédent de chirurgie abdominale, stomie, rein en fer à cheval…), le traitement endovasculaire sera préféré.
Mise à plat-greffe par laparotomie ou laparoscopie
La chirurgie conventionnelle par mise à plat-greffe nécessite une laparotomie ou une lombotomie et un clampage aortique (La mise à plat-greffe peut aussi être réalisée par laparoscopie ou laparoscopie robot-assistée, ce qui réduit les douleurs postopératoires, la durée de séjour et le risque de complications pariétales, tout en conservant les bénéfices du remplacement de l’aorte anévrysmale. Cette technique n’est pratiquée que dans un nombre limité de centres experts.
Voie endovasculaire : exclure l’anévrysme puis vérifier l’absence d’endofuites
La chirurgie endovasculaire consiste à exclure l’anévrysme en implantant une endoprothèse aorto-bi-iliaque (EVAR : EndoVascular Aneurysm Repair ;L’anévrysme étant laissé en place, une surveillance régulière postopératoire est indispensable pour vérifier l’absence d’endofuite (persistance d’un flux sanguin dans l’anévrysme) qui peut provenir d’un défaut d’étanchéité proximale ou distale (endofuite de type I), d’un reflux des artères collatérales (artères lombaires, artère mésentérique inférieure) dans le sac anévrysmal (endofuite de type II) ou d’un défaut d’étanchéité entre les différents composants de l’endoprothèse (endofuite de type III). Si les endofuites de type II (les plus fréquentes) présentent un risque de complication relativement faible, elles nécessitent néanmoins une surveillance plus rapprochée de l’évolution du diamètre aortique. Les endofuites de type I ou III doivent, quant à elles, être considérées comme des échecs du traitement endovasculaire, justifiant une consultation spécialisée et une réintervention.
Chez les patients à faible risque chirurgical, les données à long terme confirment un nombre de réinterventions significativement supérieur après traitement par voie endovasculaire, par rapport à la chirurgie conventionnelle (à 15 ans, respectivement 32,9 % versus 14,7 %).
Indication opératoire et choix de la technique
Une indication opératoire est posée en cas d’anévrysme de l’aorte abdominale asymptomatique, dont le plus grand diamètre est supérieur à 5,5 cm chez l’homme et 5 cm chez la femme, ou qui a augmenté de 1 cm en un an. Un anévrysme de l’aorte abdominale symptomatique ou compliqué doit être traité quelle que soit sa taille.La chirurgie conventionnelle est le traitement de référence des anévrysmes de l’aorte abdominale chez les patients à faible risque chirurgical. Le traitement endovasculaire est proposé aux patients à risque chirurgical standard, uniquement si les critères anatomiques le permettent. En cas d’abdomen dit « hostile » (antécédent de chirurgie abdominale, stomie, rein en fer à cheval…), le traitement endovasculaire sera préféré.
Cas particulier des anévrysmes complexes
Concernant la chirurgie conventionnelle des anévrysmes para-, juxta- ou suprarénaux, un clampage aortique au-dessus du niveau des artères rénales (suprarénal), voire des artères digestives, sera nécessaire. Cette chirurgie peut comprendre, en plus de la mise à plat-greffe, une réimplantation des artères digestives et/ou rénales dans la prothèse aortique, de façon directe ou indirecte, par l’intermédiaire d’un court segment prothétique. Si la durabilité de ce type d’intervention est très bonne, le risque de complications majeures digestives et/ou rénales postopératoires impose une sélection des patients. Ainsi, cette option est réservée aux personnes à faible risque chirurgical, et réalisée par une équipe chirurgicale entraînée.
Afin d’adapter l’exclusion endovasculaire à l’anatomie des anévrysmes aortiques complexes, des endoprothèses fenêtrées ont été développées. Celles-ci intègrent des orifices ou des branches, placées selon l’anatomie propre du patient. Des stents couverts sont alors déployés entre les fenêtres ou les branches et les artères digestives et/ou rénales, pour assurer l’étanchéité du montage (fig. 4B ). Le temps de conception et de fabrication de ces prothèses sur mesure (8-10 semaines) rend impossible leur utilisation en urgence.
Ainsi, pour les anévrysmes rompus, symptomatiques ou très volumineux, des endoprothèses fenêtrées/branchées prêtes à l’emploi ont été conçues pour correspondre à près de 70 % des patients. En cas d’urgence, le chirurgien peut confectionner lui-même des fenestrations sur une endoprothèse standard. Cela requiert un degré d’expertise élevé, s’agissant d’étudier précisément la position des ostia des artères digestives et rénales en 3D, sur les reconstructions de l’angioscanner, et de les reporter sur l’endoprothèse.
D’autres techniques endovasculaires de sauvetage permettent de maintenir la perméabilité des artères collatérales, malgré la couverture de leur ostium par l’endoprothèse. Ces techniques consistent à assembler de diverses façons des endoprothèses et des stents disponibles (cheminées, périscopes, sandwiches), pour tenter d’obtenir une étanchéité du sac anévrysmal aortique, tout en laissant perméables les artères collatérales.
Afin d’adapter l’exclusion endovasculaire à l’anatomie des anévrysmes aortiques complexes, des endoprothèses fenêtrées ont été développées. Celles-ci intègrent des orifices ou des branches, placées selon l’anatomie propre du patient. Des stents couverts sont alors déployés entre les fenêtres ou les branches et les artères digestives et/ou rénales, pour assurer l’étanchéité du montage (
Ainsi, pour les anévrysmes rompus, symptomatiques ou très volumineux, des endoprothèses fenêtrées/branchées prêtes à l’emploi ont été conçues pour correspondre à près de 70 % des patients. En cas d’urgence, le chirurgien peut confectionner lui-même des fenestrations sur une endoprothèse standard. Cela requiert un degré d’expertise élevé, s’agissant d’étudier précisément la position des ostia des artères digestives et rénales en 3D, sur les reconstructions de l’angioscanner, et de les reporter sur l’endoprothèse.
D’autres techniques endovasculaires de sauvetage permettent de maintenir la perméabilité des artères collatérales, malgré la couverture de leur ostium par l’endoprothèse. Ces techniques consistent à assembler de diverses façons des endoprothèses et des stents disponibles (cheminées, périscopes, sandwiches), pour tenter d’obtenir une étanchéité du sac anévrysmal aortique, tout en laissant perméables les artères collatérales.
Références
1. Sakalihasan N, Limet R, Defawe OD. Abdominal aortic aneurysm. Lancet. 2005;365(9470):1577‑89.
2. Lederle FA, Johnson GR, Wilson SE, Chute EP, Hye RJ, Makaroun MS, et al. The aneurysm detection and management study screening program: validation cohort and final results. Aneurysm Detection and Management Veterans Affairs Cooperative Study Investigators. Arch Intern Med. 2000;160(10):1425‑30.
3. Singh K, Bønaa KH, Jacobsen BK, Bjørk L, Solberg S. Prevalence of and risk factors for abdominal aortic aneurysms in a population-based study : The Tromsø Study. Am J Epidemiol. 2001;154(3):236‑44.
4. Brown LC, Powell JT. Risk factors for aneurysm rupture in patients kept under ultrasound surveillance. UK Small Aneurysm Trial Participants. Ann Surg. 1999;230(3):289‑96; discussion 296-7.
5. Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. Eur J Vasc Endovasc Surg. 2019;57(1):8‑93.
6. Haute Autorité de santé. Évaluation des endoprothèses aortiques abdominales utilisées pour le traitement des anévrismes de l’aorte abdominale sous-rénale non rompus. 2020. Disponible sur : https://www.has-sante.fr/upload/docs/application/pdf/2021-03/rapport_endoprothese_aortique_abdominale_dm-eval_235.pdf
7. Haute Autorité de santé. Anévrismes de l’aorte abdominale : proposer un dépistage ciblé. Mise à jour 2019. Disponible sur : https://www.has-sante.fr/jcms/pprd_2974773/fr/anevrismes-de-l-aorte-abdominale-proposer-un-depistage-cible
8. Zarins CK, Harris EJ. Operative repair for aortic aneurysms: the gold standard. J Endovasc Surg. 1997;4(3):232‑41.
2. Lederle FA, Johnson GR, Wilson SE, Chute EP, Hye RJ, Makaroun MS, et al. The aneurysm detection and management study screening program: validation cohort and final results. Aneurysm Detection and Management Veterans Affairs Cooperative Study Investigators. Arch Intern Med. 2000;160(10):1425‑30.
3. Singh K, Bønaa KH, Jacobsen BK, Bjørk L, Solberg S. Prevalence of and risk factors for abdominal aortic aneurysms in a population-based study : The Tromsø Study. Am J Epidemiol. 2001;154(3):236‑44.
4. Brown LC, Powell JT. Risk factors for aneurysm rupture in patients kept under ultrasound surveillance. UK Small Aneurysm Trial Participants. Ann Surg. 1999;230(3):289‑96; discussion 296-7.
5. Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. Eur J Vasc Endovasc Surg. 2019;57(1):8‑93.
6. Haute Autorité de santé. Évaluation des endoprothèses aortiques abdominales utilisées pour le traitement des anévrismes de l’aorte abdominale sous-rénale non rompus. 2020. Disponible sur : https://www.has-sante.fr/upload/docs/application/pdf/2021-03/rapport_endoprothese_aortique_abdominale_dm-eval_235.pdf
7. Haute Autorité de santé. Anévrismes de l’aorte abdominale : proposer un dépistage ciblé. Mise à jour 2019. Disponible sur : https://www.has-sante.fr/jcms/pprd_2974773/fr/anevrismes-de-l-aorte-abdominale-proposer-un-depistage-cible
8. Zarins CK, Harris EJ. Operative repair for aortic aneurysms: the gold standard. J Endovasc Surg. 1997;4(3):232‑41.
Dans cet article
- De multiples causes, dominées par l’athérosclérose
- Le risque principal est la rupture
- Une pathologie habituellement silencieuse qui justifie un dépistage ciblé
- Écho-Doppler et angioscanner impliqués dans la stratégie de surveillance
- La prise en charge comporte plusieurs volets
- Cas particulier des anévrysmes complexes