Un risque de toxicité
Le nombre d’indications pour l’utilisation de ces molécules ne cesse de croître (études évaluant l’association des immunothérapies aux thérapies ciblées ou à la chimiothérapie), ce qui potentiellement expose un nombre croissant de patients à ces toxicités.
Caractéristiques générales des toxicités des immunothérapies anticancéreuses
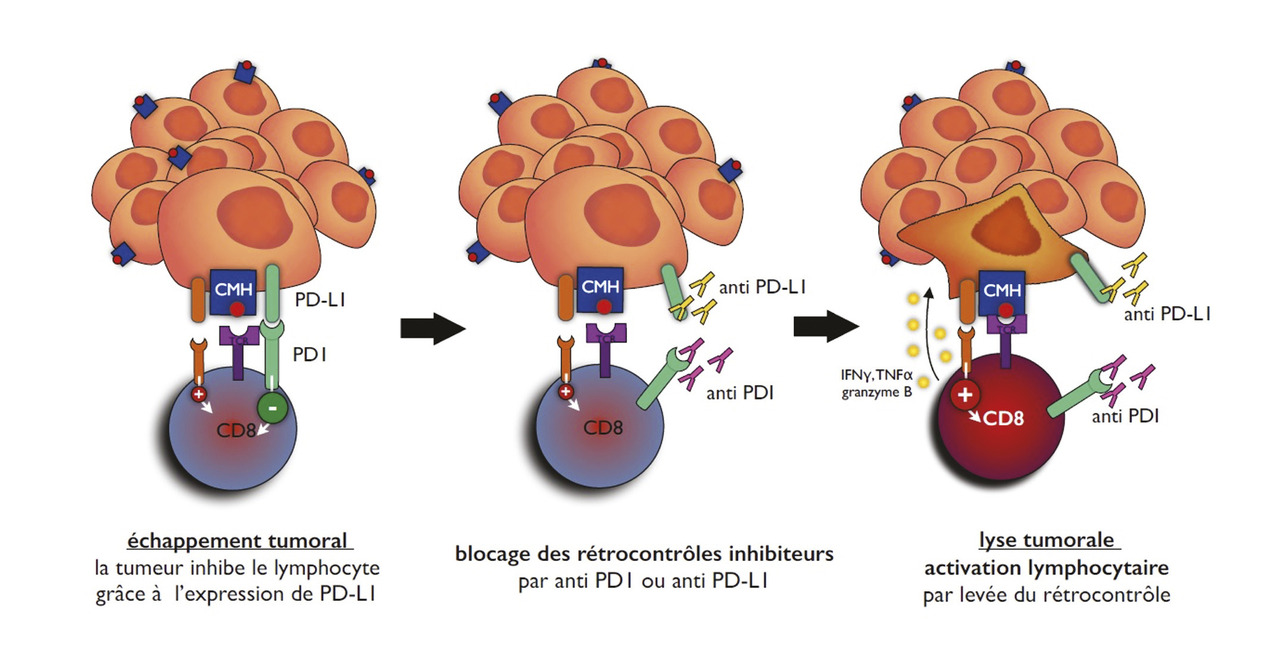
Quelle que soit leur cible, les inhibiteurs du contrôle immunitaire (anti-CTLA4, anti-PD1 et anti-PD-L1) ont un spectre de toxicité similaire, avec cependant des différences en termes de fréquences. Globalement, les toxicités – quelle que soit leur sévérité – affectent environ 60 % des patients.
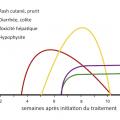
Les effets indésirables liés aux anti-CTLA4 sont plus sévères que ceux rencontrés avec les anti-PD1/PD-L1 : 30 % de toxicités grade 3-4 contre 15 % environ.3 Ils peuvent théoriquement atteindre tous les organes, ce qui se traduit par un spectre de toxicités particulièrement large (
Délai d’apparition et sévérité
Sous anti-PD1, les effets indésirables sont moins fréquents et moins sévères (10 % de toxicité grade > 3) et surviennent en moyenne dans les 6 premiers mois suivant l’initiation du traitement.
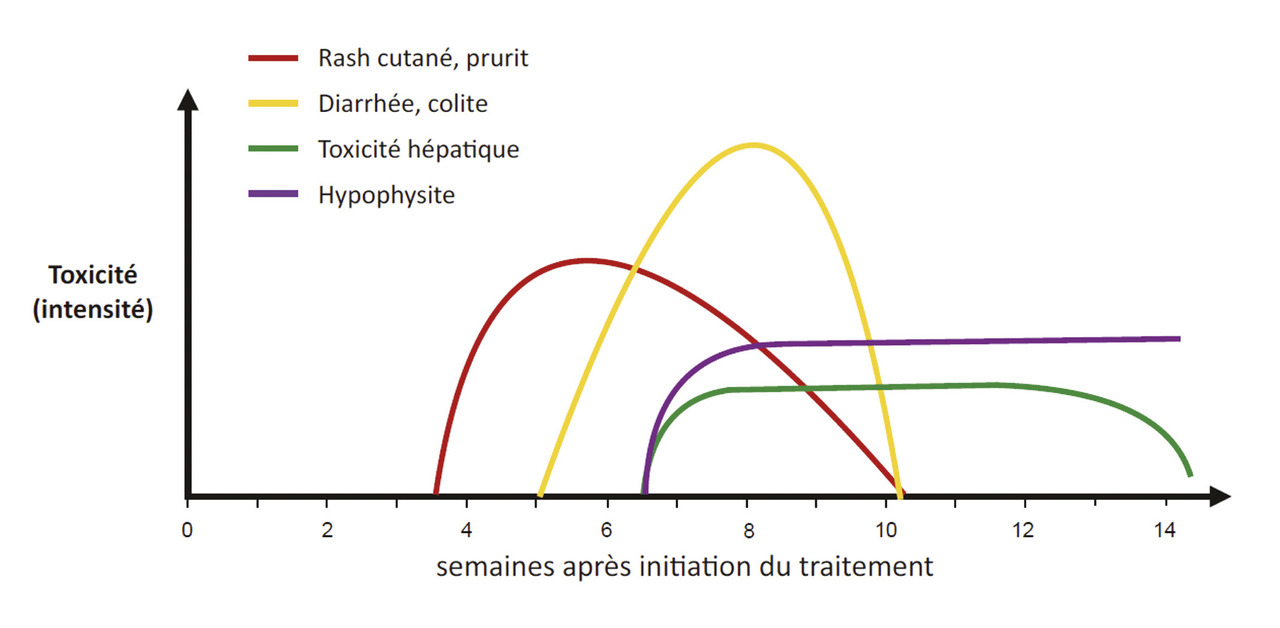
Comparativement, on observe plus de diarrhées, de rashs cutanés ou d’hypophysites avec les anti-CTLA4 et plus de pneumopathies, d’hypothyroïdies ou d’arthralgies avec les anti-PD1.
L’association en combinaison des immunothérapies anti-CTLA4 et anti-PD1 double la fréquence des toxicités sévères avec près de 60 % de toxicités grade 3-4 ; les effets indésirables considérés jusque-là comme rares en monothérapie (
Une des particularités des effets indésirables liés à l’immunothérapie est qu’ils peuvent survenir de façon retardée après le début de l’immunothérapie, voire plusieurs mois après l’arrêt du traitement (
Prise en charge générale des effets indésirables de l’immunothérapie
La plupart des effets indésirables sont peu sévères et peuvent être traités symptomatiquement. Cependant, certains peuvent directement menacer le pronostic vital et nécessitent une reconnaissance précoce pour une prise en charge adaptée.
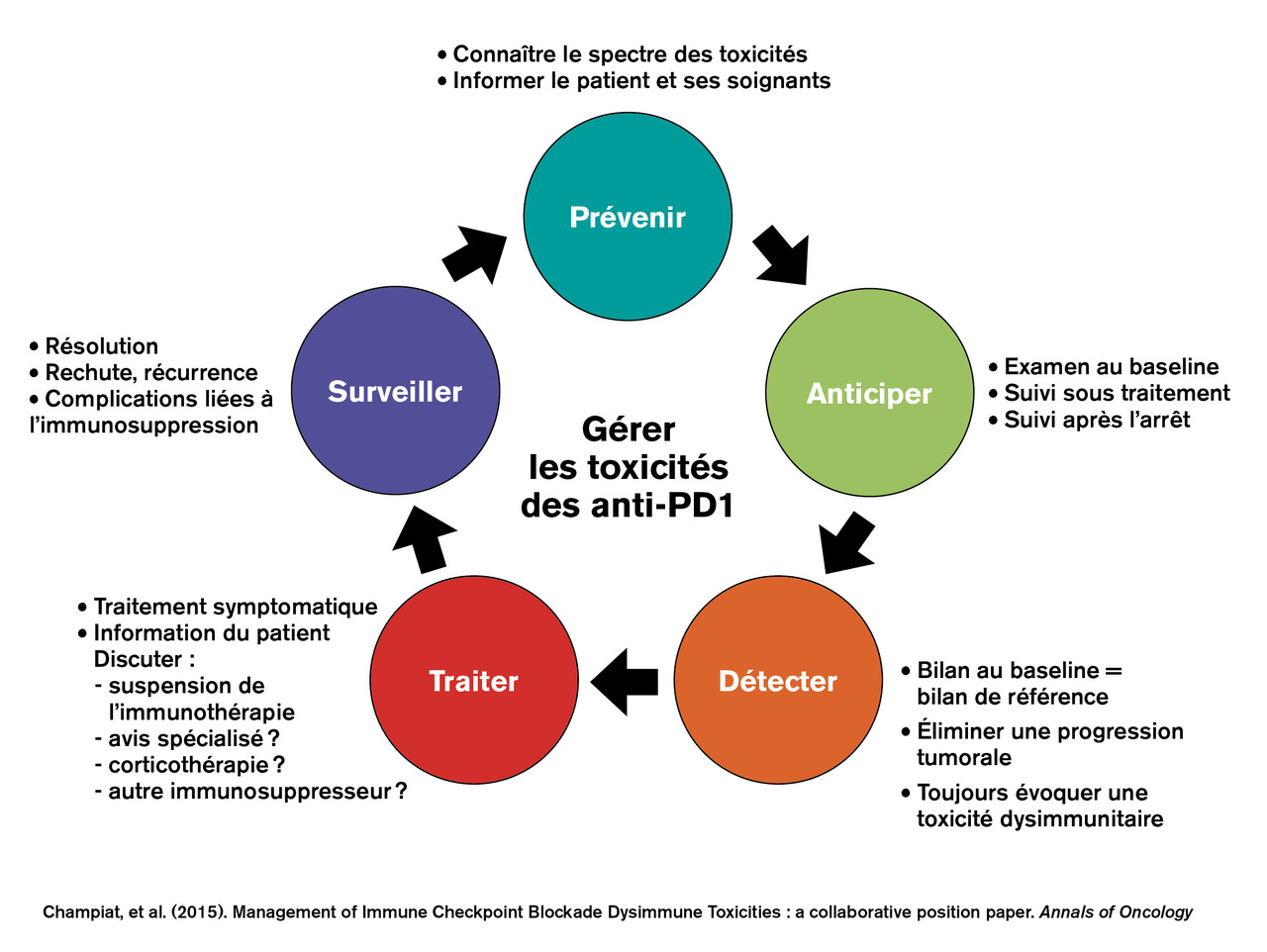
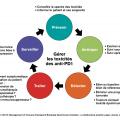
Les grands principes de la prise en charge des toxicités liées aux immunothérapies reposent sur cinq piliers proposés en 2015 à l’institut Gustave-Roussy : prévenir, anticiper, détecter, traiter, surveiller.6
Prévenir
Anticiper
Rechercher des facteurs de risque
Avant l’initiation de l’immunothérapie, il est recommandé de rechercher tout antécédent personnel ou familial de pathologie auto-immune, d’infection virale (virus des hépatites B [VHB] et C [VHC], virus de l’immunodéficience humaine [VIH]) ou mycobactérienne chronique (tuberculose)* qui risquerait de s’aggraver sous traitement. En pratique, il convient de rechercher à l’interrogatoire des rhumatismes d’horaire inflammatoire, des diarrhées chroniques, un psoriasis, des troubles endocriniens (diabète, dysthyroïdie), ou tout autre antécédent de « maladie chronique », ou « prise de corticoïdes ou d’anti-inflammatoires au long cours » qui pourrait s’avérer être une maladie auto-immune. À ce jour, la plupart des essais ont exclu les patients avec ce type d’antécédents personnels. Cependant, les séries de cas rapportées semblent montrer qu’un traitement par immunothérapie peut être envisagé malgré un risque de poussées accru ou de survenue d’autres effets indésirables.7, 8 Les antécédents de maladies auto-immunes ou inflammatoires ne doivent pas contre-indiquer systématiquement la mise sous immunothérapie. Cependant, le rapport bénéfice-risque est à discuter au cas par cas avec le patient selon la sévérité et les risques associés. Si elle est envisagée, l’immunothérapie doit s’accompagner d’une surveillance plus rapprochée et multidisciplinaire. Les données disponibles chez les patients infectés par le VIH, l’hépatite C ou B montrent un profil de tolérance similaire mais sur de petits effectifs.9, 10Bilan préthérapeutique
Le bilan préthérapeutique clinique et paraclinique (De façon systématique avant la mise sous anti-PD-1, le bilan paraclinique doit comprendre un hémogramme, un bilan hépatique (aspartate et alanine aminotransférase, gamma glutamyl-transférases, phosphatases alcalines et bilirubine), un ionogramme sanguin, une créatininémie, une glycémie à jeun, une bandelette urinaire. Une évaluation de la fonction thyroïdienne doit être réalisée en raison de la fréquence des dysthyroïdies avec un dosage de la thyréostimuline et de la T4.
Une imagerie pulmonaire récente (tomodensitométrie en coupe fine) doit être disponible afin de servir de référence s’il survenait une toxicité pulmonaire.
La réalisation des sérologies virales pour le VIH, le VHB et le VHC fait partie des bonnes pratiques cliniques avant mise sous traitement anticancéreux. Toute anomalie présente sur ce bilan préthérapeutique doit être explorée et prise en charge de façon appropriée.
La recherche d’auto-anticorps systématique (comme les antinucléaires, anti-thyroperoxydases, anti-thyroglobulines…) n’est actuellement pas recommandée et fait l’objet d’études.
En cas de traitement par anti-CTLA4 et en raison du risque plus important d’hypophysite, il est recommandé d’ajouter une évaluation des différents axes hormonaux antéhypophysaires : dosage de l’hormone corticotrope (ACTH) et cortisolémie à 8 h, dosage de l’hormone folliculo-stimulante (FSH), de l’hormone lutéinisante (LH) et testostéronémie. Le dosage de l’amylase et de la lipase est également préconisé si une combinaison d’immunothérapie anti-PD1 + anti-CTLA4 est envisagée en raison du risque plus fréquent de pancréatite.
Détecter : rester attentif tout au long du traitement et après l’arrêt de l’immunothérapie
En cas d’événement indésirable, il convient de garder en tête que la cause la plus fréquente reste la progression tumorale : une évaluation tumorale par imagerie est donc souvent nécessaire. Le diagnostic différentiel infectieux doit être fréquemment recherché, avec des prélèvements à visée bactériologique ou virale, ce d’autant qu’une corticothérapie peut être envisagée. Enfin, le diagnostic d’une toxicité liée à l’immunothérapie doit être systématiquement suspecté en se rappelant qu’un même symptôme peut être révélateur de pathologies auto-immunes différentes (par exemple, une dyspnée peut révéler une pneumopathie inflammatoire mais aussi un épanchement pleural ou péricardique, une myocardite…).
Traiter
En cas de difficultés diagnostiques, la suspension de l’immunothérapie doit être privilégiée afin de ne pas risquer d’aggraver un potentiel effet indésirable. En dehors des toxicités endocriniennes contrôlées par un traitement substitutif, la plupart des toxicités liées à l’immunothérapie nécessitent une suspension au moins temporaire de l’immunothérapie jusqu’à ce que la toxicité disparaisse. Dans le cas de toxicités sévères (grade 3 ou 4) ou modérées mais non résolutives malgré un traitement adapté, il est recommandé d’arrêter définitivement l’immunothérapie concernée.
Le traitement de première intention de nombreux effets indésirables repose sur une corticothérapie systémique, habituellement 1 mg/kg/j maintenue jusqu’au contrôle de la toxicité, suivie d’une décroissance progressive par paliers successifs pendant au moins 1 mois en raison du risque de rechute à l’arrêt des corticoïdes.
Certaines toxicités dépassant souvent le domaine de spécialisation du praticien, il convient de recourir facilement à un avis spécialisé afin d’optimiser le bilan diagnostique et la prise en charge thérapeutique.
Plusieurs guidelines ont été proposées pour la prise en charge des différents effets indésirables. Les recommandations de prise en charge actuellement publiées ne reposent que sur un consensus d’experts, car aucune étude prospective n’a permis à ce jour de comparer les différentes modalités proposées.6
Surveiller
Une décroissance trop rapide de la corticothérapie peut favoriser une rechute de l’effet indésirable et nécessiter alors de remonter à une forte dose de corticoïde afin de réaliser une décroissance encore plus progressive. Par ailleurs, certains patients peuvent également développer de nouvelles toxicités liées à l’immunothérapie.
En cas de résistance au traitement, un avis spécialisé doit être recherché pour rechercher des diagnostics différentiels et discuter de l’intérêt d’un immunosuppresseur (comme les anti-tumor necrosis factor [TNF] pour les colites sévères résistant aux corticoïdes). Une des pistes futures est l’utilisation des inhibiteurs de Janus kinases, de nouvelles molécules utilisées par voie orale pour le traitement de la polyarthrite rhumatoïde. Ces dernières ont été utilisées au cas par cas, avec une certaine efficacité dans les colites et les arthrites secondaires à l’immunothérapie.11
La mise sous corticothérapie au long cours (≥ 1 mg/kg/j pendant au moins 1 mois) ou tout autre immunosuppresseur expose le patient au risque d’infection opportuniste. Dans ces situations, il convient d’instaurer une prophylaxie par triméthoprime-sulfaméthoxazole et de rester attentif en cas de signes infectieux (risque d’infections fongiques).
En général, la reprise de l’immunothérapie est envisageable en cas de toxicité peu sévère (grade ≤ 2), une fois que la toxicité a disparu ou s’est améliorée à un grade 1. Pour les toxicités plus sévères (grade 3 ou 4), la reprise de l’immunothérapie doit être discutée en réunion de concertation pluridisciplinaire (RCP) ImmunoTOX (v. infra) car il s’agit habituellement d’une contre-indication. Toute reprise d’immunothérapie doit se faire dans le cadre d’une surveillance rapprochée car elle expose au risque de rechute de la toxicité antérieure, voire à la survenue de nouvelles toxicités.
Des toxicités complexes
De nombreuses questions restent actuellement sans réponse, et la coopération entre les différents réseaux ImmunoTOX paraît essentielle pour améliorer les connaissances9 et ainsi optimiser la prise en charge des patients.
Bilan recommandé avant mise sous immunothérapie
• Hémogramme
• Bilan hépatique : ASAT, ALAT, GGT, PAL et bilirubine
• Ionogramme sanguin, créatininémie, glycémie à jeun, bandelette urinaire
• TSH, T4
• Imagerie pulmonaire
• Sérologies virales VIH, VHB, VHC
En cas de traitement par anti-CTLA4, ajouter : ACTH et cortisolémie à 8h, FSH, LH, testostéronémie
En cas d’association anti-CTLA4 et anti-PD1, ajouter : amylase et lipase
Prise en charge spécifique des toxicités les plus fréquentes des anti-PD1
Asthénie
Incidence : anti-CTLA4 : 15-30 % ; anti-PD1 : 15-35 % ; anti-CTLA4+anti-PD1 : 40 %
Grade 3-4 : anti-CTLA4 : 1 % ; anti-PD1 : 1 % ; anti-CTLA4+anti-PD1 : < 5 %.
Le plus souvent, la cause de l’asthénie n’est pas identifiée, elle peut cependant être révélatrice de nombreux effets indésirables liés à l’immunité, en particulier endocriniens, mais également pulmonaires, neurologiques, hématologiques ou cardiaques.
Diagnostic : fatigue inhabituelle, avec retentissement sur les activités de la vie quotidienne.
Rechercher des signes associés pouvant orienter vers un diagnostic spécifique : dyspnée, faiblesse ou douleur musculaire, douleurs articulaires, fatigabilité à l’effort, douleur thoracique, ralentissement psychomoteur, confusion.
Signes de gravité : fatigue ne cédant pas avec le repos, interférant avec les activités instrumentales (grade 2) ou élémentaires (grade 3) de la vie quotidienne.
Diagnostics à rechercher :
◗ Causes habituelles en cancérologie : progression tumorale, douleur, iatrogénie médicamenteuse (opiacés, anxiolytiques…)
◗ Sepsis
◗ Toxicités dysimmunitaires :
● endocrinologiques : hypothyroïdie, insuffisance surrénalienne, diabète, hypophysite
● neurologiques : encéphalite, Guillain-Barré, myasthénie
● hématologique : anémie hémolytique
● respiratoire : pneumonie inflammatoire
● cardiaque : myocardite
Bilan diagnostique : en l’absence de cause évidente et d’asthénie prolongée ou grade ≥ 2
◗ ECG, bandelette urinaire
◗ Hémogramme, CRP, ionogramme, urée, créatininémie, bilan hépatique, calcémie, albuminémie, glycémie à jeun, CPK, électrophorèse des protides
◗ Bilan endocrinien : cortisolémie à 8 h, TSH, T4
Rash cutané
Incidence : anti-CTLA4 : 24 % ; anti-PD1 : 15 % ; anti-CTLA4+anti-PD1 : 40 %
Grade 3-4 : anti-CTLA4 ou anti-PD1 : < 3 % ; anti-CTLA4+anti-PD1 : < 5 %
Survenue la plupart du temps dans les premières semaines.
Diagnostic : classiquement, rash maculopapuleux affectant le tronc et/ou les membres, +/- prurigineux.
Signes de gravité : atteinte muqueuse, sensation de brûlure ou de tension cutanée, fièvre > 39 °C, anomalies biologiques, décollement de l’épiderme, éruption bulleuse, rapidité de la diffusion.
Diagnostics différentiels : toxidermie liée à un autre toxique, infection virale aiguë, dermatite de contact, vascularite
Bilan : en cas de sévérité, tableau inhabituel, absence de réponse au traitement de première intention
◗ hémogramme, ionogramme et bilan hépatique ; hémocultures si fièvre
◗ biopsie cutanée
Prise en charge thérapeutique
◗ Rash peu sévère (grade 1-2)
● émollient
● traitement local par dermocorticoïdes
● antihistaminiques en cas de prurit
● poursuite possible de l’immunothérapie
◗ Rash avec signes de gravité (grade 3-4) ou absence de réponse au traitement
● poursuite du traitement local
● prise en charge spécialisée systématique
● corticothérapie systémique orale voire IV 1-2 mg/kg
Diarrhées
Incidence : anti-CTLA4 : 30 % ; anti-PD1 : 15 % ; anti-CTLA4+anti-PD1 : 40 %
Grade 3-4 : anti-CTLA4 : 6 % ; anti-PD1 : 2-3 % ; anti-CTLA4+anti-PD1 : 9 %
Diagnostic : augmentation de la fréquence, de l’abondance ou modification de la consistance des selles par rapport au transit habituel.
Signes de colite associés : douleurs abdominales, émissions glairo-sanglantes.
Signes de gravité : déshydratation, défense, contracture, sepsis, iléus.
Diagnostics différentiels : infection bactérienne entéropathogène, infection à Clostridium difficile, entéropathie d’origine cancéreuse, diarrhée postantibiotique, hyperthyroïdie
Bilan :
◗ hémogramme, CRP, ionogramme, urée, créatininémie, bilan hépatique
◗ TSH, T4
◗ Coproculture avec recherche de Clostridium difficile
◗ Selon la gravité : imagerie digestive (TDM), sigmoïdo-/colonoscopie, à discuter avec l’avis du spécialiste
Prise en charge thérapeutique
◗ Diarrhées grade 1 : < 3 selles liquides par jour en plus du transit habituel, absence de signes de gravité
● Traitement symptomatique par ralentisseur de transit, réhydratation orale
● Surveillance rapprochée
● Poursuite possible de l’immunothérapie
● Si persistance > 14 j ou aggravation : suspendre l’immunothérapie, corticothérapie orale 0,5-1 mg/kg/j à débuter sans attendre la réalisation d’une exploration endoscopique spécialisée
◗ Diarrhées grade 2 : 4 à 6 selles par jour en plus du transit habituel ou présence de signes de colite
● Suspendre l’immunothérapie
● Traitement symptomatique par ralentisseur de transit, réhydratation orale
● Surveillance rapprochée 2 fois par semaine
● Si persistance > 3 j ou aggravation : corticothérapie orale 0,5-1 mg/kg/j à débuter sans attendre la réalisation d’une exploration endoscopique spécialisée
◗ Diarrhées grade 3-4 : > 6 selles par jour en plus du transit habituel ou présence de signes de gravité
● Hospitalisation avec isolement contact jusqu’à élimination d’une infection
● Corticothérapie IV 1-2 mg/kg/j
● Mise au repos digestif
● Arrêt de l’immunothérapie
● Imagerie digestive (TDM)
● Avis spécialisé systématique avec réalisation d’une endoscopie digestive
● Avis chirurgical en cas de signe de colite
● En l’absence d’amélioration à 72 heures de la corticothérapie ou aggravation, envisager la mise sous anti-TNF (infliximab)
Hypothyroïdie
Incidence : anti-CTLA4 : 1-5 % ; anti-PD1 : 5-10 % ; anti-CTLA4+anti-PD1 : 20 %
Sévérité exceptionnellement > grade 2.
Diagnostic : le plus souvent asymptomatique, réalisé sur le bilan de routine devant une élévation de la TSH avec une T4 normale ou diminuée.
Symptômes éventuellement associés : asthénie, prise de poids, constipation, frilosité, anorexie, bradycardie, ralentissement psychomoteur, myalgies, troubles de l’humeur.
Signes de gravité : retentissement sur la vie quotidienne, retentissement cardiovasculaire, myxoedème.
Bilan :
◗ Répéter TSH et T3, T4
◗ ECG en cas de facteurs de risque cardiovasculaires
◗ Échographie thyroïdienne
◗ Recherche d’auto-anticorps : anti-thyroperoxydase, anti-thyroglobuline
Un avis spécialisé est nécessaire en cas d’auto-anticorps positifs ou d’anomalie à l’échographie (nodules).
Prise en charge thérapeutique
◗ En l’absence de symptôme : recontrôler la TSH à chaque cycle
◗ En cas de symptômes ou TSH > 10
● suspendre l’immunothérapie si symptômes, le temps de la normalisation
● initier un traitement substitutif par L-thyroxine
Toxicité hépatique
Incidence : anti-CTLA4 ou anti-PD1 : 5-10 % ; anti-CTLA4+anti-PD1 : 25-30 %
Grade 3-4 : anti-CTLA4 ou anti-PD1 : 1-2 % ; anti-CTLA4 + anti-PD1 : 15 %.
Diagnostic : le plus souvent asymptomatique, réalisé sur le bilan de routine devant une élévation des transaminases ou une cholestase biologique.
Signes de gravité : encéphalopathie, fièvre, coagulopathie, bilirubine > 10 N.
Diagnostics différentiels : progression tumorale, autre toxique (alcool, autre médicament…), infection virale, obstruction biliaire.
Bilan : à adapter selon la gravité
◗ Imagerie hépatique
◗ TP, TCA, fibrinogène, facteur V, albumine
◗ Sérologies virales des hépatites A, B et C ; PCR hépatite E
◗ Recherche d’auto-anticorps : antinucléaires, anti-ADN, anti-mitochondrie, anti-LKM, anti-LC1
◗ Bilan martial
Prise en charge thérapeutique
◗ Grade 1 : transaminases ≤ 3 N
● arrêt des potentiels hépatotoxiques
● surveillance biologique hebdomadaire, poursuite possible de l’immunothérapie
◗ Grade 2 : transaminases > 3N - ≤ 5N
● bilan complet
● interruption de l’immunothérapie
● surveillance du bilan biologique 2 fois par semaine
● si aggravation du bilan hépatique, corticothérapie orale 1 mg/kg/j après avis spécialisé et discussion d’une biopsie hépatique
◗ Grade 3-4 : transaminases > 5N ou signes de gravité
● avis spécialisé et discussion d’une biopsie hépatique
● corticothérapie IV 1-2 mg/kg/j
● arrêt de l’immunothérapie
● surveillance du bilan biologique quotidien
● en cas de corticorésistance, envisager un autre immunosuppresseur (mycophénolate)
Toxicité pulmonaire
Incidence : anti-CTLA4 : 1-4 % ; anti-PD1 : 3-5 % ; anti-CTLA4+anti-PD1 : 10 %.
Grade 3-4 : anti-CTLA4 : < 2 % ; anti-PD1 : < 3 % ; anti-CTLA4+anti-PD1 : < 3 %.
Diagnostic : dyspnée, toux, découverte fortuite à l’imagerie.
Signes de gravité : dyspnée de repos, fièvre, douleur thoracique, oxygénodépendance, détresse respiratoire.
Diagnostics différentiels : embolie pulmonaire, progression tumorale, infection pulmonaire, décompensation BPCO, insuffisance cardiaque ; autre toxicité dysimmunitaire : épanchement pleural, péricardite et myocardite, myasthénie, Guillain-Barré.
Bilan :
◗ Hémogramme, CRP
◗ Hémoculture, antigénurie pneumocoque et légionelle, +/- ECBC
◗ Scanner thoracique coupes fines avec injection
◗ Avis spécialisé systématique pour discuter :
● EFR avec mesure de la DLCO
● fibroscopie bronchique avec LBA
Prise en charge thérapeutique
◗ Grade 1 : asymptomatique
● surveillance rapprochée avec avis spécialisé
● poursuite possible de l’immunothérapie
◗ Grade 2 : symptomatique mais non oxygénodépendant
● suspension de l’immunothérapie
● avis spécialisé rapide pour réalisation fibroscopie avec LBA
● si signes en faveur d’une infection, débuter une antibiothérapie probabiliste à large spectre
● en l’absence d’argument infectieux ou d’amélioration à 48 heures : débuter une corticothérapie 1 mg/kg/j
◗ Grade ≥ 3 : oxygénodépendant ou signes de gravité
● hospitalisation, oxygénothérapie et avis réanimation
● arrêt de l’immunothérapie
● avis spécialisé en urgence pour réalisation fibroscopie avec LBA
● débuter sans tarder une corticothérapie IV 2-4 mg/kg/j associée le plus souvent à une couverture infectieuse par antibiothérapie probabiliste à large spectre
● en l’absence d’amélioration à 48 heures ou en cas d’aggravation, envisager la mise sous un autre immunosuppresseur (cyclophosphamide, mycophénolate)
Pour suivre l’actualité des publications scientifiques concernant les toxicités des immunothérapies
Liens de l’application
https://play.google.com/store/apps/details?id=com.iledesmedias.mpo
Demande d’avis en RCP ImmunoTOX à Gustave Roussy
Contact : rcp.itox@gustaveroussy.fr
Actualité
2. Burke KP, Grebinoski S, Sharpe AH, Vignali DAA. Understanding adverse events of immunotherapy: A mechanistic perspective. J Exp Med 2021;218:e20192179.
3. Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer 2016;54:139‑48.
4. Weber JS, Dummer R, Pril V de, Lebbé C, Hodi FS. Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab. Cancer 2013;119:1675‑82.
5. Martins F, Sofiya L, Sykiotis GP, et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16:563‑80.
6. Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol 2016;27:559‑74.
7. Danlos F-X, Voisin AL, Dyevre V, et al. Safety and efficacy of anti-programmed death 1 antibodies in patients with cancer and pre-existing autoimmune or inflammatory disease. Eur J Cancer 2018;91:21‑9.
8. Johnson DB, Sullivan RJ, Ott PA, et al. Ipilimumab therapy in patients with advanced melanoma and preexisting autoimmune disorders. JAMA Oncol 2016;2:234‑40.
9. Uldrick TS, Gonçalves PH, Abdul-Hay M, et al. Assessment of the safety of pembrolizumab in patients with HIV and advanced cancer-a phase 1 study. JAMA Oncol 2019;5:1332-9.
10. Pertejo-Fernandez A, Ricciuti B, Hammond SP, et al. Safety and efficacy of immune checkpoint inhibitors in patients with non-small cell lung cancer and hepatitis B or hepatitis C infection. Lung Cancerl 2020;145:181‑5.
11. Esfahani K, Hudson M, Batist G. Tofacitinib for refractory immune-related colitis from PD-1 therapy. N Engl J Med 2020;382:2374‑5.
12. Application mobile Gustave-Roussy pour la gestion des toxicités liées aux immunothérapies. Ces recommandations sont intégrées dans l’onglet « Immunothérapie » du Manuel pratique d’oncologie de Gustave-Roussy, application mobile destinée aux médecins, téléchargeable gratuitement sur App Store et sur Google Play (conduite à tenir, prise en charge des différentes toxicités, contact du spécialiste référent...).

 Encadrés
Encadrés