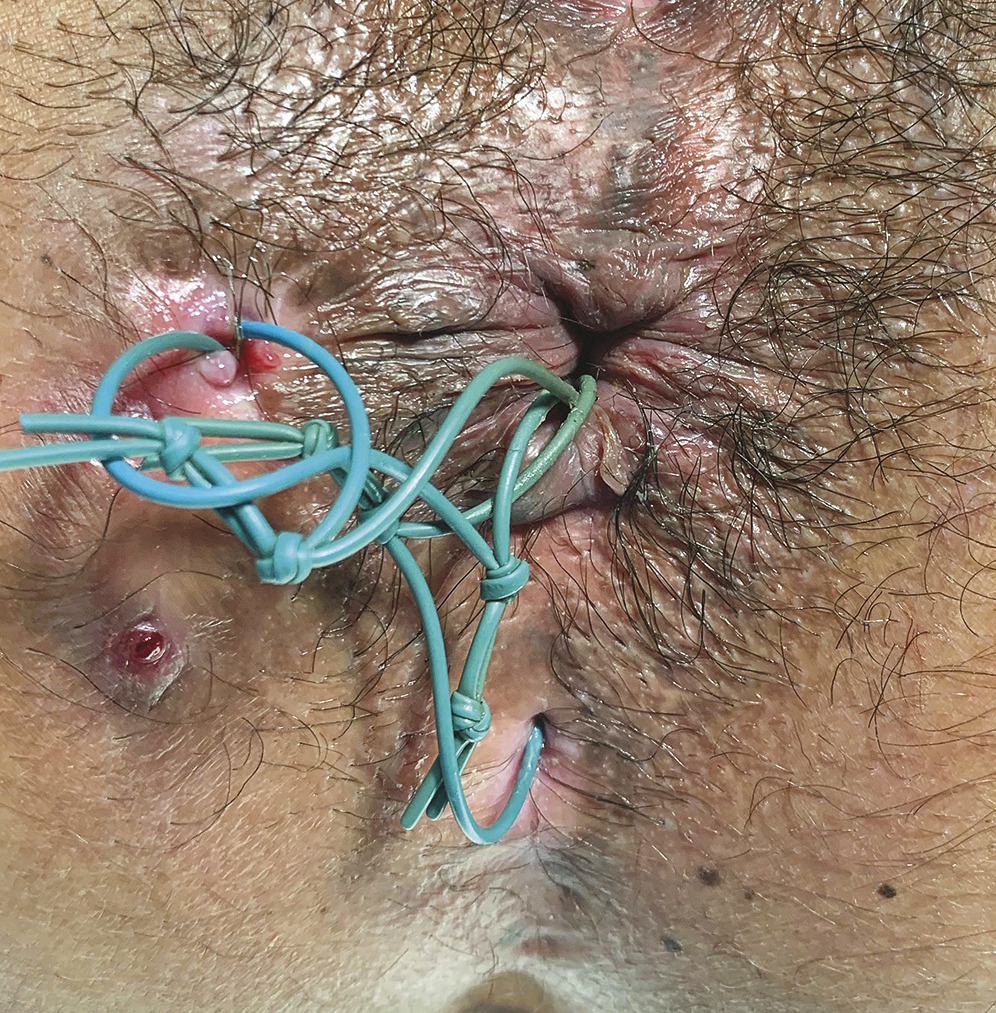
Les lésions anopérinéales de la maladie de Crohn regroupent l’ensemble des lésions attribuées à la maladie touchant le bas rectum, le canal anal, la peau périanale et la cloison rectovaginale. Les lésions anopérinéales affecteraient environ un tiers des patients au cours de l’évolution de leur maladie de Crohn.1 Elles peuvent même être inaugurales et survenir avant l’apparition de l’atteinte luminale dans 5 à 10 % des cas.1 Elles ont une valeur pronostique péjorative, affectent de manière significative la qualité de vie des patients et augmentent le coût et l’utilisation du système de santé.1 Les lésions élémentaires anatomiques sont classées en lésions primaires, secondaires et tertiaires selon la classification de Cardiff (classification UFS pour Ulcérations fistules sténoses) [tableau 1 ].2 Les lésions secondaires (fig. 1 ) qui sont abordées dans cet article sont considérées comme l’infection d’une lésion ulcérée primaire ; elles peuvent néanmoins également évoluer de manière indépendante.
Sur le plan physiopathologique, la transition épithéliale-mésenchymateuse secondaire à la rupture de la barrière épithéliale avec une réaction inflammatoire locale et une sécrétion surtout de TGFβ (transforming growth factor β, facteur de croissance transformant) représente le point essentiel du développement d’une fistule anale de la maladie de Crohn. Les parois fistuleuses constituées de myofibroblastes sont responsables de la sécrétion d’enzymes de remodelage de la matrice extracellulaire, telles que les métalloprotéinases, qui participent à la destruction des tissus avoisinants.3
Sur le plan physiopathologique, la transition épithéliale-mésenchymateuse secondaire à la rupture de la barrière épithéliale avec une réaction inflammatoire locale et une sécrétion surtout de TGFβ (transforming growth factor β, facteur de croissance transformant) représente le point essentiel du développement d’une fistule anale de la maladie de Crohn. Les parois fistuleuses constituées de myofibroblastes sont responsables de la sécrétion d’enzymes de remodelage de la matrice extracellulaire, telles que les métalloprotéinases, qui participent à la destruction des tissus avoisinants.3
Quelle prise en charge thérapeutique ?
Le traitement d’une atteinte fistuleuse anopérinéale de la maladie de Crohn est complexe et multidisciplinaire, avec une prise en charge médico-chirurgicale impliquant au minimum un gastroentérologue, un proctologue chirurgical et un radiologue.
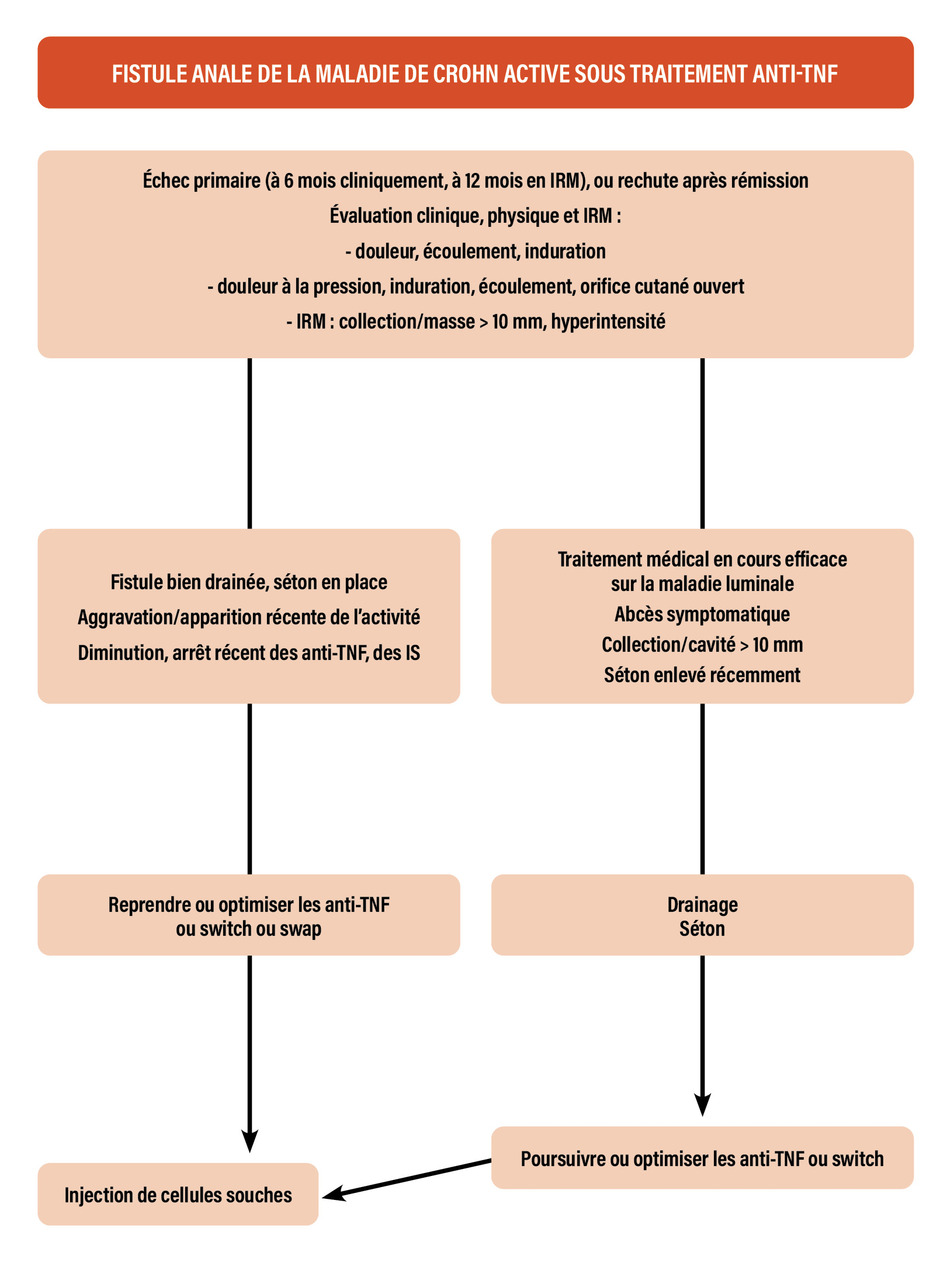
Le drainage des fistules et des abcès par un séton est la première étape chirurgicale. Ensuite, un traitement médical rapide doit être instauré, fondé sur un anti-tumor necrosis factor (TNF alpha), au mieux de l’infliximab en combothérapie avec un immunosuppresseur si l’atteinte est complexe. Ce traitement doit être le plus souvent optimisé pour obtenir des taux résiduels de médicament particulièrement élevés nécessaires en cas d’atteinte anopérinéale.4
Enfin se pose la question de l’ablation du séton. Une imagerie par résonance magnétique (IRM) de contrôle avant cette dernière étape permet de s’assurer de la qualité du drainage et de la réponse thérapeutique. Le simple retrait du séton peut se faire en consultation et donne en moyenne un taux de rémission de 30 à 40 %.5 Les données récentes sont en faveur de l’adjonction d’une technique de fermeture chirurgicale afin d’améliorer ce taux de rémission bas après simple retrait.6
Pour cela, il existe de nombreuses techniques de fermeture (tableau 2 )7 dont l’efficacité est finalement limitée et dont l’impact sur la continence anale est non négligeable.
La colle biologique et le plug sont désormais délaissés du fait d’un risque de récidive important.8
Le lambeau d’avancement rectal et la ligature intersphinctérienne du trajet fistuleux (LIFT) semblent avoir un taux d’efficacité meilleur (entre 40 et 65 %) mais nécessitent des compétences techniques, notamment en cas de trajet profond (LIFT) ; elles ne sont praticables qu’en cas d’orifice interne unique et nécessitent une muqueuse rectale de bonne qualité (lambeau). En l’occurrence, un taux d’incontinence anale non négligeable de 10 % a été associé au lambeau, et les derniers résultats de la LIFT incitent à la prudence. Les résultats des dernières techniques comme le laser FiLaC (fistula laser closure), Permacol, le clip Ovesco et la VAAFT (video-assisted anal fistula treatment) semblent encourageants, mais les données sont issues de séries rétrospectives, de faible effectif et non comparatives.
Les cellules souches mésenchymateuses (CSM) d’origine adipocytaire ont obtenu une autorisation et ont été mises sur le marché en France en 2020 à la suite de leurs résultats positifs dans le traitement des fistules anales complexes de la maladie de Crohn en échec des biothérapies. Cette thérapie cellulaire donne un espoir supplémentaire de guérison chez des patients souvent en situation d’impasse thérapeutique.
Le drainage des fistules et des abcès par un séton est la première étape chirurgicale. Ensuite, un traitement médical rapide doit être instauré, fondé sur un anti-tumor necrosis factor (TNF alpha), au mieux de l’infliximab en combothérapie avec un immunosuppresseur si l’atteinte est complexe. Ce traitement doit être le plus souvent optimisé pour obtenir des taux résiduels de médicament particulièrement élevés nécessaires en cas d’atteinte anopérinéale.4
Enfin se pose la question de l’ablation du séton. Une imagerie par résonance magnétique (IRM) de contrôle avant cette dernière étape permet de s’assurer de la qualité du drainage et de la réponse thérapeutique. Le simple retrait du séton peut se faire en consultation et donne en moyenne un taux de rémission de 30 à 40 %.5 Les données récentes sont en faveur de l’adjonction d’une technique de fermeture chirurgicale afin d’améliorer ce taux de rémission bas après simple retrait.6
Pour cela, il existe de nombreuses techniques de fermeture (
La colle biologique et le plug sont désormais délaissés du fait d’un risque de récidive important.8
Le lambeau d’avancement rectal et la ligature intersphinctérienne du trajet fistuleux (LIFT) semblent avoir un taux d’efficacité meilleur (entre 40 et 65 %) mais nécessitent des compétences techniques, notamment en cas de trajet profond (LIFT) ; elles ne sont praticables qu’en cas d’orifice interne unique et nécessitent une muqueuse rectale de bonne qualité (lambeau). En l’occurrence, un taux d’incontinence anale non négligeable de 10 % a été associé au lambeau, et les derniers résultats de la LIFT incitent à la prudence. Les résultats des dernières techniques comme le laser FiLaC (fistula laser closure), Permacol, le clip Ovesco et la VAAFT (video-assisted anal fistula treatment) semblent encourageants, mais les données sont issues de séries rétrospectives, de faible effectif et non comparatives.
Les cellules souches mésenchymateuses (CSM) d’origine adipocytaire ont obtenu une autorisation et ont été mises sur le marché en France en 2020 à la suite de leurs résultats positifs dans le traitement des fistules anales complexes de la maladie de Crohn en échec des biothérapies. Cette thérapie cellulaire donne un espoir supplémentaire de guérison chez des patients souvent en situation d’impasse thérapeutique.
Quelle place pour la thérapie cellulaire ?
Qu’est-ce qu’une thérapie cellulaire et plus particulièrement une cellule souche ?
La thérapie cellulaire repose sur la transplantation de cellules saines, dans le but de remplacer des cellules malades, de réparer ou de régénérer un organe ou un tissu de l’organisme. Ces cellules sont obtenues la plupart du temps à partir de cellules souches.9
Une cellule souche est une cellule immature possédant deux principales propriétés spécifiques :
– autorenouvellement dans un environnement approprié pour maintenir un pool quasi constant de cellules tout au long de la vie ;
– différenciation, c’est-à-dire capacité à donner naissance, dans un environnement spécifique, à des cellules matures avec des fonctions déterminées telles que les cellules du foie, de la peau, du cœur, etc.
Une cellule souche est une cellule immature possédant deux principales propriétés spécifiques :
– autorenouvellement dans un environnement approprié pour maintenir un pool quasi constant de cellules tout au long de la vie ;
– différenciation, c’est-à-dire capacité à donner naissance, dans un environnement spécifique, à des cellules matures avec des fonctions déterminées telles que les cellules du foie, de la peau, du cœur, etc.
Quel est le mode d’action des cellules souches ?
Les CSM ont une action anti-inflammatoire et immunomodulatrice grâce à un effet paracrine incluant des sécrétomes et des vésicules extracellulaires.9,10 Cet effet paracrine est en outre responsable d’une signalisation cellulaire par un mécanisme de plasticité, c’est-à-dire une capacité de migration d’un état différencié à un autre. Les CSM ont également des propriétés prolifératives, antiapoptotiques et proangiogéniques. Grâce à tous ces effets associés à des effets antioxydants, antibactériens, antiviraux et antitumoraux, les CSM permettent une réparation des tissus endommagés. Enfin, elles ont un statut immuno-évasif dû à l’absence d’expression de complexe d’histocompatibilité majeure (CMH) II, de molécules costimulantes B7-1 et d’une faible expression de CMH I.
Quelles cellules souches sont utilisées en pratique ?
Plusieurs types de cellules souches sont disponibles : totipotentes, pluripotentes, multipotentes et unipotentes. Pour des raisons éthiques, pratiques (possibilité d’extraction chez l’adulte) et de capacité de différenciation en plusieurs types cellulaires, ce sont les cellules souches multipotentes qui sont utilisées en pratique clinique.
Deux sources de cellules souches multipotentes
Les cellules souches multipotentes hématopoïétiques ont été tout d’abord utilisées dans la greffe de moelle osseuse. Puis ce sont les CSM multipotentes (mésenchymateuses = du mésoderme = du tissu conjonctif) qui ont occupé davantage le terrain. Elles sont retrouvées dans presque tous les tissus du corps et en particulier le stroma de la moelle osseuse, l’os, le périoste, le foie fœtal, le tissu adipeux et le muscle. Dans les études, elles sont extraites de deux sources principales : la moelle osseuse et le tissu adipeux. Par rapport aux CSM issues de la moelle osseuse, les CSM d’origine adipocytaire sont plus faciles à extraire, 100 à 500 fois plus riches en cellules et ont 10 % de spécificité d’immunophénotypage, pouvant expliquer une meilleure efficacité in vitro. En effet, elles semblent avoir un taux de réplication plus élevé et plus prolongé en culture, être associées à une stabilité morphologique et génétique plus longue (quel que soit l’âge du donneur) et ont un meilleur pouvoir anti-inflammatoire et antiangiogénique. Enfin, elles expriment encore moins le CMH I (complexe majeur d’histocompatibilité) et les molécules costimulatrices du CMH que celles issues de la moelle osseuse, ce qui pourrait diminuer le risque de rejet.9,10CSM d’origine adipocytaire
Les CSM d’origine adipocytaire sont obtenues en plusieurs étapes : liposuccion, centrifugation du tissu adipeux, puis digestion enzymatique permettant d’obtenir la fraction vasculaire stromale (FVS). Ce produit est un mélange de cellules hématopoïétiques, endothéliales, vasculaires, musculaires lisses, fibroblastiques, immatures et de CSM. Les CSM sont par la suite sélectionnées grâce à leur pouvoir d’adhésion à une surface en plastique, puis mises en culture et en expansion.CSM autologues
Le prélèvement des CSM peut se réaliser sur le patient lui-même, on parle alors de cellules souches autologues. Malgré une tendance à privilégier ce type de CSM pour des raisons évidentes d’histocompatibilité, leur production est plus contraignante, car elle nécessite une liposuccion chirurgicale qui est une procédure invasive supplémentaire chez des sujets malades souvent multiopérés, parfois en situation inflammatoire et nutritionnelle précaire. La qualité des cellules extraites peut être également altérée par l’âge du patient lui-même et par ses traitements. Ensuite, la procédure de recueil, d’extraction puis de mise en culture n’est généralement pas standardisée.
CSM hétérologues
Les CSM peuvent également provenir d’autres personnes « donneuses ». On parle alors de CSM hétérologues ou allogéniques. En raison des contraintes précitées avec les CSM autologues, les CSM allogéniques se sont largement développées, avec des avantages de traçabilité en termes de stérilité, de maintien des propriétés et des fonctions, et de standardisation du nombre des cellules et des lots. En outre, la plupart des CSM n’expriment pas les molécules costimulatrices du CMH II et très peu du CMH I, et les résultats des premières études se montrent rassurants en matière de réactions de rejet immédiat ou d’immunisation secondaire. Ensuite, l’approche allogénique permet une constitution de banques de cellules auprès d’un « donneur universel », permettant un accès à un plus grand nombre de patients. Cette approche allogénique paraît in fine la plus compatible avec une production industrielle permettant l’obtention d’une AMM.9, 10
CSM dans la maladie de Crohn
Quelle indication ?
Les CSM allogéniques d’origine adipocytaire disponibles sous le nom de darvadstrocel (Alofisel) ont reçu une AMM européenne en 2019 et sont commercialisées en France dans le traitement des fistules anopérinéales complexes de la maladie de Crohn en échec d’une biothérapie chez un patient ayant une maladie luminale non active ou légèrement active. Les dernières recommandations françaises de pratique clinique les proposent en cas de fistule active malgré un traitement médico-chirurgical optimisé (Modalités pratiques d’utilisation
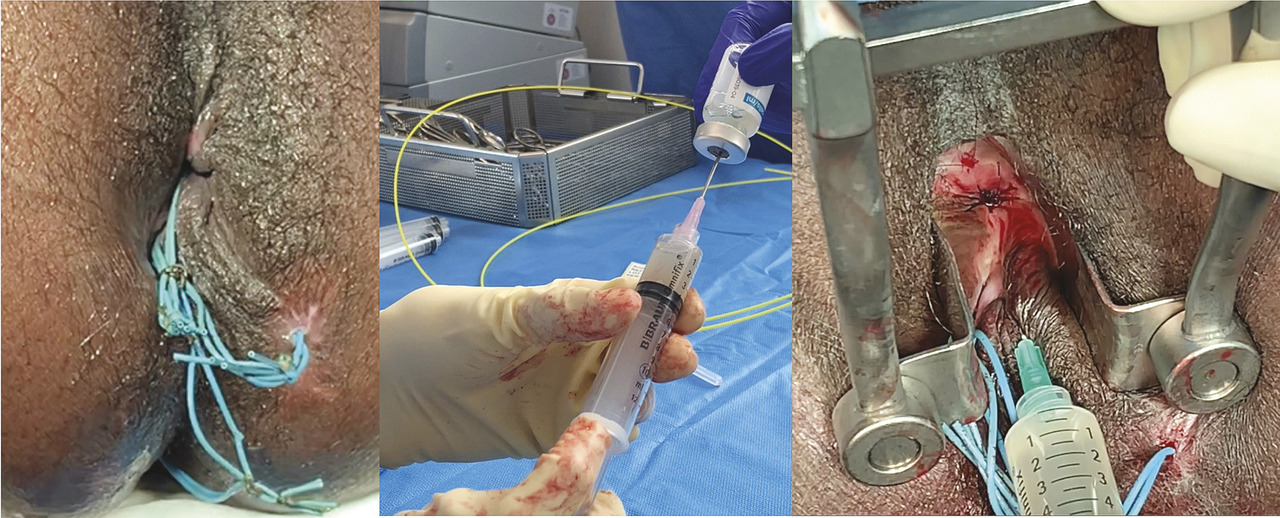
La décision de l’injection se prend en général en réunion de concertation multidisciplinaire impliquant au moins un gastroentérologue assurant l’optimisation du traitement médical, un proctologue chirurgical et un radiologue s’assurant de l’absence de collection résiduelle à l’IRM. La commande du produit doit se faire au moins seize jours avant la programmation du patient au bloc opératoire. Les CSM sont réceptionnées le jour même de l’injection et ont une durée de vie limitée à partir de leur déstockage et décongélation (20 heures à leur réception). Ceci complexifie la procédure de programmation, avec un risque de perte du produit et un impact financier en cas d’annulation du patient à la dernière minute. Certains programment donc un patient en « back up » le jour même pour éviter ce type de problèmes. Avant l’injection elle-même, une phase d’exploration sous anesthésie est conseillée afin de s’assurer de l’absence de diverticule résiduel non drainé et de préparer le trajet par un brossage et un lavage. La phase d’injection est programmée sous anesthésie, en moyenne quinze jours à un mois après cette exploration. Après ablation du ou des sétons, une injection sous-muqueuse de la moitié du produit est réalisée au niveau de l’orifice interne de la fistule après sa fermeture par un ou plusieurs points en X. En alternative, la technique de fermeture peut être un lambeau muqueux ou musculo-muqueux selon la taille de l’orifice interne et les habitudes du proctologue (Avec quels résultats ?
Plusieurs essais de phase I et II ont été tout d’abord menés avec des CSM allogéniques d’origine adipocytaire.9 L’analyse de ces études montre une grande disparité concernant la méthodologie (uni- ou multicentrique, prospective ou rétrospective, contrôlée ou non, etc.), le type de cellules et de préparations utilisées (autologues, allogéniques, fraction vasculaire stromale), la quantité de cellules injectées, le mode d’injection (intra- et/ou périfistuleux, en une ou plusieurs injections), la procédure éventuellement associée (colle biologique, plug), les traitements systémiques concomitants, les moyens d’évaluation (uniquement clinique, clinique et radiologique [IRM]), le moment d’évaluation (de 4 à 156 semaines après l’injection) et enfin la définition même de la rémission. Le taux de guérison dans ces études variait de 46 à 90 %. Des effets indésirables ont été rapportés chez 0 à 30 % des patients (en moyenne autour de 15 %), principalement des proctalgies, abcès ou fistules.L’étude ADMIRE de phase III, contrôlée, randomisée, multicentrique, en double aveugle a comparé l’injection de 120 millions de CSM d’origine adipocytaire versus placebo dans des fistules anopérinéales complexes de la maladie de Crohn en échec du traitement médical. Seuls les patients présentant une maladie luminale en rémission ou modérément active, sans rectite active, sans sténose rectale, sans fistule rectovaginale et sans stomie ont été inclus. Les critères de jugement étaient aussi bien cliniques (fermeture de l’orifice [ou des orifices] externe[s] attestée par l’absence de douleur ou d’écoulement à la pression) que radiologiques (absence d’abcès de plus de 20 mm en IRM). Les résultats à S24 et à S52 étaient significativement en faveur des CSM.12 Les résultats rétrospectifs à trois ans de cette étude montraient un maintien de la rémission chez les patients injectés dans un peu plus de la moitié des cas, avec des résultats toujours en faveur des CSM même si la quantité d’effet s’était amoindrie et n’était plus significative, pouvant poser la question de l’intérêt de nouvelles injections.13
D’autres études ont évalué l’efficacité des CSM issues de la moelle osseuse dans le traitement de fistules anopérinéales réfractaires de la maladie de Crohn avec des effectifs limités et des résultats à peu près similaires.
À notre connaissance, aucune étude n’a comparé directement les effets in vivo des CSM d’origine adipocytaire à celles issues de la moelle osseuse dans cette indication.9
Concernant les fistules ano-recto-vaginales, qui ont été exclues de l’étude ADMIRE, les quelques études disponibles avec un effectif faible ont rapporté des résultats décevants et confirment une fois de plus la difficulté de la prise en charge de ce type de fistules.14
En vraie vie, trois études ont été publiées15-17 depuis la commercialisation du darvadstrocel. Les effectifs étaient limités et les méthodes d’évaluation non standardisées, mais les résultats semblaient prometteurs (efficacité de 64 à 68 %) avec un bon profil d’innocuité.
Dans le service de proctologie médico-chirurgicale du groupe hospitalier Paris Saint-Joseph, une étude18 a été menée auprès des 27 premiers patients injectés et suivis pendant un an. Une réponse clinique a été obtenue chez 85,2 % des patients et radiologique chez 69,2 % des patients. De surcroît, la qualité de vie, évaluée par le score spécifique « CAF-QoL » (Crohn’s anal fistula quality of life scale),19 s’est significativement améliorée chez tous les patients traités, mais, à un an, cette amélioration était significativement plus marquée en cas de rémission clinico-radiologique complète.
Une autre étude, présentée dans plusieurs congrès en 2022 (JFHOD, ESCP et UEGW*), a été menée, de façon bicentrique à Paris et Rennes, chez un plus grand nombre de patients (n = 46). Elle a montré un taux de réponse clinique de 74 % et radiologique de 88 %. Le phénotype inflammatoire (par rapport aux deux autres phénotypes, sténosant et fistulisant) de la maladie selon la classification de Montréal était le seul facteur indépendant de réponse clinique.
Quelles perspectives pour l’utilisation des cellules souches ?
L’évolution s’oriente vers des stratégies de sélection des donneurs, du site du prélèvement et de préconditionnement selon le site d’injection. Les données en vraie vie permettront également une meilleure sélection des patients qui pourraient bénéficier de ce type de traitement afin d’optimiser les résultats et de limiter le coût lié à ce type de thérapie. Enfin, des alternatives moins contraignantes qui ne nécessitent pas le passage par la phase de culture et d’expansion comme le tissu adipeux micro- ou nanofragmenté, le plasma riche en plaquettes et la fraction vasculaire stromale sont en cours de développement. Toutefois, les résultats de certaines études utilisant ces produits sont encore trop préliminaires pour pouvoir en tirer des conclusions formelles, surtout qu’il n’y a pas encore d’études « head-to-head » versus CSM pures.Place des CSM acquise mais à affiner dans le traitement des fistules anopérinéales de la maladie de Crohn
Le traitement des fistules anopérinéales de la maladie de Crohn représente un vrai défi et nécessite une prise en charge médico-chirurgicale multidisciplinaire avec une première étape de drainage, une deuxième étape de traitement médical reposant en priorité sur des anti-TNF alpha et enfin une troisième et dernière étape de fermeture chirurgicale.
Les diverses techniques classiques de fermeture disponibles ont une efficacité limitée, nécessitent des compétences techniques et ont pour certaines un impact sur la continence anale. La thérapie cellulaire est une nouvelle option thérapeutique émergente qui apporte un espoir supplémentaire chez des patients souvent en situation d’impasse thérapeutique. Les CSM allogéniques d’origine adipocytaire sont commercialisées et remboursées en France depuis 2020. Les résultats préliminaires en vraie vie sont satisfaisants, et le profil d’innocuité semble bon. Mais ces résultats doivent être confirmés à plus long terme, et le profil optimal des patients pouvant bénéficier de cette thérapie onéreuse doit être identifié.
Les diverses techniques classiques de fermeture disponibles ont une efficacité limitée, nécessitent des compétences techniques et ont pour certaines un impact sur la continence anale. La thérapie cellulaire est une nouvelle option thérapeutique émergente qui apporte un espoir supplémentaire chez des patients souvent en situation d’impasse thérapeutique. Les CSM allogéniques d’origine adipocytaire sont commercialisées et remboursées en France depuis 2020. Les résultats préliminaires en vraie vie sont satisfaisants, et le profil d’innocuité semble bon. Mais ces résultats doivent être confirmés à plus long terme, et le profil optimal des patients pouvant bénéficier de cette thérapie onéreuse doit être identifié.
* JFHOD : Journées francophones d’hépato-gastroentérologie et d’oncologie digestive ; ESCP : European Society of Coloproctology ; UEGW : United European Gastroenterology Week
Références
1. Gecse KB, Sebastian S, de Hertogh G, Yassin NA, Kotze PG, Reinisch W, et al. Results of the fifth scientific workshop of the ECCO [II]: Clinical aspects of perianal fistulising Crohn’s disease-the unmet needs. J Crohns Colitis 2016;10(7):758-65.
2. Hughes LE. Clinical classification of perianal Crohn’s disease. Dis Colon Rectum 1992;35(10):928-32.
3. Bruckner RS, Spalinger MR, Barnhoorn MC, Feakins R, Fuerst A, Jehle EC, et al. Contribution of CD3+CD8- and CD3+CD8+ T cells to TNF-α overexpression in Crohn disease-associated perianal fistulas and induction of epithelial-mesenchymal transition in HT-29 Cells. Inflamm Bowel Dis 2021;27(4):538-49.
4. Yarur AJ, Kanagala V, Stein DJ, Czul F, Quitero MA, Agrawal D, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017;45(7):933-40.
5. Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004;350(9):876-85.
6. Meima-van Praag EM, van Rijn KL, Wasmann KATGM, Snijder HJ, Stoker J, D’Haens GR, et al. Short-term anti-TNF therapy with surgical closure versus anti-TNF therapy in the treatment of perianal fistulas in Crohn’s disease (PISA-II): A patient preference randomised trial. Lancet Gastroenterol Hepatol 2022;7(7):617-26.
7. Zabot GP, Cassol O, Saad-Hossne R, Bemelman W. Modern surgical strategies for perianal Crohn’s disease. World J Gastroenterol 2020;26(42):6572-81.
8. Adamina M, Bonovas S, Raine T, Spinelli A, Warusavitarne J, Armuzzi A, et al. ECCO Guidelines on therapeutics i n Crohn’s disease: Surgical treatment. J Crohns Colitis 2020;14(2):155-68.
9. Buscail E, Le Cosquer G, Gross F, et al. Adipose-derived stem cells in the treatment of perianal fistulas in Crohn’s disease: Rationale, clinical results and perspectives. Int J Mol Sci 2021;22(18):9967.
10. Ben-Ami E, Berrih-Aknin S, Miller A. Mesenchymal stem cells as an immunomodulatory therapeutic strategy for autoimmune diseases. Autoimmun Rev 2011;10(7):410-5.
11. Bouchard F, Pigot F, Siproudhis L, de Parades V, Abramovitz L, Staumont G, et al. Prise en charge des fistules ano-périnéales au cours de la maladie de Crohn, actualisation 2021 du consensus de la Société nationale française de colo-proctologie. Hépato-Gastro & Oncologie Digestive 2021;28(9):1052-9.
12. Panés, J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, et al. Long-term efficacy and safety of stem cell therapy (Cx601) for complex perianal fistulas in patients with Crohn’s disease. Gastroenterology 2018;154(5):1334-42.
13. Panés J, Bouma G, Ferrante M, Kucharzik T, Nachury M, de la Portilla de Juan F, et al. INSPECT: A retrospective study to evaluate long-term effectiveness and safety of darvadstrocel in patients with perianal fistulizing Crohn’s disease treated in the ADMIRE-CD trial. Inflamm Bowel Dis 2022:28(11):1737-45.
14. García-Arranz M, Herreros MD, González-Gómez C, de la Quintana P, Guadalajara H, Georgiey-Hristoy T, et al. Treatment of Crohn’s-related rectovaginal fistula with allogeneic expanded-adipose derived stem cells: A phase I-IIa clinical trial. Stem Cells Transl Med 2016;5(11):1441-6.
15. Schwandner O. Stem cell injection for complex anal fistula in Crohn’s disease: A single-center experience. World J Gastroenterol 2021;27(24):3643-53.
16. Cabalzar-Wondberg D, Turina M, Biedermann L, Rogler G, Schreiner P. Allogeneic expanded adipose-derived mesenchymal stem cell therapy for perianal fistulas in Crohn’s disease: A case series. Colorectal Dis 2021;23(6):1444-50.
17. Furukawa S, Mizushima T, Nakaya R, Shibata M, Yamaquchi T, Watanabe K, et al. Darvadstrocel for complex perianal fistulas in Japanese adults with Crohn’s disease: A phase III study. J Crohns Colitis 2022;jjac144.
18. Fathallah N, Akaffou M, Haouari MA, Spindler L, Alam A, Barré A, et al. Deep remission improves the quality of life of patients with Crohn’s disease and anoperineal fistula treated with darvadstrocel: Results of a French pilot study. Tech Coloproctol 2023. Epub ahead of print.
19. Adegbola SO, Dibley L, Sahnan K, Wade T, Veriee A, Sawyer R, et al. Development and initial psychometric validation of a patient-reported outcome measure for Crohn’s perianal fistula: The Crohn’s anal fistula quality of life (CAF-QoL) scale. Gut 2021;70(9):1649-56.
2. Hughes LE. Clinical classification of perianal Crohn’s disease. Dis Colon Rectum 1992;35(10):928-32.
3. Bruckner RS, Spalinger MR, Barnhoorn MC, Feakins R, Fuerst A, Jehle EC, et al. Contribution of CD3+CD8- and CD3+CD8+ T cells to TNF-α overexpression in Crohn disease-associated perianal fistulas and induction of epithelial-mesenchymal transition in HT-29 Cells. Inflamm Bowel Dis 2021;27(4):538-49.
4. Yarur AJ, Kanagala V, Stein DJ, Czul F, Quitero MA, Agrawal D, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017;45(7):933-40.
5. Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004;350(9):876-85.
6. Meima-van Praag EM, van Rijn KL, Wasmann KATGM, Snijder HJ, Stoker J, D’Haens GR, et al. Short-term anti-TNF therapy with surgical closure versus anti-TNF therapy in the treatment of perianal fistulas in Crohn’s disease (PISA-II): A patient preference randomised trial. Lancet Gastroenterol Hepatol 2022;7(7):617-26.
7. Zabot GP, Cassol O, Saad-Hossne R, Bemelman W. Modern surgical strategies for perianal Crohn’s disease. World J Gastroenterol 2020;26(42):6572-81.
8. Adamina M, Bonovas S, Raine T, Spinelli A, Warusavitarne J, Armuzzi A, et al. ECCO Guidelines on therapeutics i n Crohn’s disease: Surgical treatment. J Crohns Colitis 2020;14(2):155-68.
9. Buscail E, Le Cosquer G, Gross F, et al. Adipose-derived stem cells in the treatment of perianal fistulas in Crohn’s disease: Rationale, clinical results and perspectives. Int J Mol Sci 2021;22(18):9967.
10. Ben-Ami E, Berrih-Aknin S, Miller A. Mesenchymal stem cells as an immunomodulatory therapeutic strategy for autoimmune diseases. Autoimmun Rev 2011;10(7):410-5.
11. Bouchard F, Pigot F, Siproudhis L, de Parades V, Abramovitz L, Staumont G, et al. Prise en charge des fistules ano-périnéales au cours de la maladie de Crohn, actualisation 2021 du consensus de la Société nationale française de colo-proctologie. Hépato-Gastro & Oncologie Digestive 2021;28(9):1052-9.
12. Panés, J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, et al. Long-term efficacy and safety of stem cell therapy (Cx601) for complex perianal fistulas in patients with Crohn’s disease. Gastroenterology 2018;154(5):1334-42.
13. Panés J, Bouma G, Ferrante M, Kucharzik T, Nachury M, de la Portilla de Juan F, et al. INSPECT: A retrospective study to evaluate long-term effectiveness and safety of darvadstrocel in patients with perianal fistulizing Crohn’s disease treated in the ADMIRE-CD trial. Inflamm Bowel Dis 2022:28(11):1737-45.
14. García-Arranz M, Herreros MD, González-Gómez C, de la Quintana P, Guadalajara H, Georgiey-Hristoy T, et al. Treatment of Crohn’s-related rectovaginal fistula with allogeneic expanded-adipose derived stem cells: A phase I-IIa clinical trial. Stem Cells Transl Med 2016;5(11):1441-6.
15. Schwandner O. Stem cell injection for complex anal fistula in Crohn’s disease: A single-center experience. World J Gastroenterol 2021;27(24):3643-53.
16. Cabalzar-Wondberg D, Turina M, Biedermann L, Rogler G, Schreiner P. Allogeneic expanded adipose-derived mesenchymal stem cell therapy for perianal fistulas in Crohn’s disease: A case series. Colorectal Dis 2021;23(6):1444-50.
17. Furukawa S, Mizushima T, Nakaya R, Shibata M, Yamaquchi T, Watanabe K, et al. Darvadstrocel for complex perianal fistulas in Japanese adults with Crohn’s disease: A phase III study. J Crohns Colitis 2022;jjac144.
18. Fathallah N, Akaffou M, Haouari MA, Spindler L, Alam A, Barré A, et al. Deep remission improves the quality of life of patients with Crohn’s disease and anoperineal fistula treated with darvadstrocel: Results of a French pilot study. Tech Coloproctol 2023. Epub ahead of print.
19. Adegbola SO, Dibley L, Sahnan K, Wade T, Veriee A, Sawyer R, et al. Development and initial psychometric validation of a patient-reported outcome measure for Crohn’s perianal fistula: The Crohn’s anal fistula quality of life (CAF-QoL) scale. Gut 2021;70(9):1649-56.