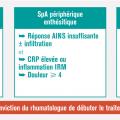
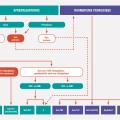
Elle est conditionnée par un diagnostic précoce dont tout retard aggrave le pronostic
La spondyloarthrite est une entité qui regroupe la spondylarthrite ankylosante, le rhumatisme psoriasique, les manifestations articulaires associées aux entérocolopathies inflammatoires chroniques (maladie de Crohn, rectocolite hémorragique), les arthrites réactionnelles, un sous-groupe de rhumatismes chroniques infantiles, et des formes indifférenciées (v. p. 730).1
Nouveaux concepts de prise en charge des spondyloarthrites
Prise en charge précoce
L’intérêt d’une prise en charge précoce des spondyloarthrites a été particulièrement bien démontré dans le cas du rhumatisme psoriasique dont il est en effet apparu qu’un retard de traitement de seulement 6 mois aggravait le pronostic fonctionnel et structural. De fait, du dépistage précoce par le médecin traitant ou le dermatologue d’une atteinte rhumatologique chez les patients ayant un psoriasis dépendent la rapidité de la prise en charge rhumatologique et donc le pronostic de la maladie. Des questionnaires sont proposés, encore en cours de validation, pour aider au dépistage fiable et à l’aiguillage des patients vers le rhumatologue.2
Approche « treat to target »
L’approche « treat to target », initialement instaurée en rhumatologie dans la polyarthrite rhumatoïde, a été récemment proposée pour la prise en charge des spondyloarthrites.3 Le niveau de preuve de l’intérêt de cette approche de contrôle étroit de l’activité de la maladie avec un objectif thérapeutique exigeant fixé dès la mise sous traitement a été établi pour le rhumatisme psoriasique.
Comorbidités et nécessité d’une prise en charge globale
En plus des pathologies associées aux spondyloarthrites, certaines comorbidités sont indépendamment associées aux spondyloarthrites, en particulier les affections cardiovasculaires ou le syndrome dysmétabolique, l’ostéoporose et la fibromyalgie, ce qui justifie d’en faire le diagnostic et leur prise en charge dans une approche multidisciplinaire.
La revue systématique de la littérature concernant les médicaments abordés dans ce paragraphe figure dans les différentes recommandations récentes, internationales4, 5 et nationales.6
La revue systématique de la littérature concernant les médicaments abordés dans ce paragraphe figure dans les différentes recommandations récentes, internationales4, 5 et nationales.6
Traitements symptomatiques
Anti-inflammatoires non stéroïdiens
Les anti-inflammatoires non stéroïdiens (AINS) représentent la classe thérapeutique la plus utilisée dans cette maladie. Leur efficacité dans l’ensemble des spondyloarthrites est reconnue de longue date, à telle enseigne qu’elle figure parmi des systèmes de critères de classification (critères d’Amor,7 critères de l’Assessment in SpondyloArthritis international Society [ASAS]8). Ces traitements réduisent la douleur, améliorent la mobilité rachidienne et peuvent être à l’origine d’une diminution de l’inflammation biologique quelle que soit l’ancienneté ou le type périphérique ou axial de la spondyloarthrite. L’effet structural de ralentissement de l’ossification sous-ligamentaire et de l’ankylose est possible mais non démontré.
Compte tenu de l’activité variable de la maladie au cours du temps, la prise d’AINS est actuellement proposée « à la demande », en choisissant les jours de prise et la dose quotidienne ainsi que sa répartition en fonction de la symptomatologie clinique. Ainsi on débute par un AINS à sa dose maximale et avec une répartition optimisée en fonction de la demi-vie de la molécule pour couvrir la deuxième moitié de la nuit et le petit matin. Cela permet de tester en quelques jours l’efficacité et la tolérance du médicament, puis en cas de réponse favorable, majoritaire, de commencer une dégression de la posologie, en adoptant la dose « à la demande ». À l’inverse, en cas d’insuffisance d'efficacité, il peut être procédé à un changement d’AINS.
L’utilisation des AINS est souvent limitée en durée ou en posologie par leur tolérance, en particulier par la fréquence des effets indésirables digestifs.
Les coxibs, AINS spécifiques de la cyclo-oxygénase de type 2, réduisent (sans les annuler) les complications digestives hautes graves, sont susceptibles d’améliorer une partie de la tolérance, mais ils ont le même profil de risque que les AINS classiques pour le tube digestif bas, pour le rein et l’appareil cardiovasculaire. Des antalgiques dont la prescription est compatible avec celle des AINS peuvent être associés ponctuellement pour lutter contre une douleur résiduelle.
Compte tenu de l’activité variable de la maladie au cours du temps, la prise d’AINS est actuellement proposée « à la demande », en choisissant les jours de prise et la dose quotidienne ainsi que sa répartition en fonction de la symptomatologie clinique. Ainsi on débute par un AINS à sa dose maximale et avec une répartition optimisée en fonction de la demi-vie de la molécule pour couvrir la deuxième moitié de la nuit et le petit matin. Cela permet de tester en quelques jours l’efficacité et la tolérance du médicament, puis en cas de réponse favorable, majoritaire, de commencer une dégression de la posologie, en adoptant la dose « à la demande ». À l’inverse, en cas d’insuffisance d'efficacité, il peut être procédé à un changement d’AINS.
L’utilisation des AINS est souvent limitée en durée ou en posologie par leur tolérance, en particulier par la fréquence des effets indésirables digestifs.
Les coxibs, AINS spécifiques de la cyclo-oxygénase de type 2, réduisent (sans les annuler) les complications digestives hautes graves, sont susceptibles d’améliorer une partie de la tolérance, mais ils ont le même profil de risque que les AINS classiques pour le tube digestif bas, pour le rein et l’appareil cardiovasculaire. Des antalgiques dont la prescription est compatible avec celle des AINS peuvent être associés ponctuellement pour lutter contre une douleur résiduelle.
Infiltrations de dérivés cortisoniques
Les infiltrations de dérivés cortisoniques sont un traitement ponctuel d’une ou quelques arthrites ou de certaines enthésites persistantes sous AINS ou malgré un traitement de fond bien conduit. Leur nombre doit être limité pour éviter les complications liées au passage systémique des corticoïdes. La nécessité de répéter les infiltrations traduit en général l’insuffisance du traitement et la nécessité d’ajouter un traitement de fond synthétique ou biologique suivant les cas.
Corticothérapie per os
La corticothérapie orale n’a quasiment pas de place dans les formes axiales de spondyloarthrites. Dans les formes articulaires périphériques, elle peut parfois être utilisée, transitoirement, avec prudence et à petite dose, par exemple à visée symptomatique transitoire en attendant l’efficacité d’un traitement de fond chez un patient ayant une forme très active. En effet, la corticothérapie expose à de nombreuses complications, d’autant plus si elle est prolongée, ainsi qu’à un éventuel rebond du psoriasis à l’arrêt.
Traitements de fond
Traitements de fond synthétiques conventionnels
(conventional synthetic disease-modifying antirheumatic drugs [csDMARD])
Méthotrexate
Le méthotrexate n’a pas démontré son efficacité sur la symptomatologie axiale ni articulaire périphérique des spondyloarthrites. Néanmoins, des études non randomisées, de type « vraie vie », sont en faveur d’une efficacité symptomatique du méthotrexate pour le rhumatisme psoriasique périphérique conduisant à le recommander en première intention du fait également de son action favorable sur le psoriasis. Il n’a pas de place, en revanche, pour traiter les manifestations axiales ou enthésitiques des spondyloarthrites. La posologie initiale est souvent de 15 mg/semaine, mais elle est adaptée en fonction de la tolérance et de l’efficacité jusqu’à une dose maximum de 25 mg/semaine. La voie parentérale, en général sous- cutanée, a une meilleure biodisponibilité et peut être préférée ou succéder à la forme per os. La tolérance, les précautions d’usage, la surveillance biologique de ce traitement sont les mêmes que dans la polyarthrite rhumatoïde.Léflunomide
Le léflunomide n’a démontré son efficacité clinique et n’a une autorisation de mise sur le marché (AMM) que pour l’atteinte articulaire du rhumatisme psoriasique. Son effet sur le psoriasis apparaît cependant marginal. Il n’a pas de place dans la prise en charge des manifestations axiales ou enthésitiques des spondyloarthrites.Sulfasalazine
La sulfasalazine a une efficacité clinique supérieure, dans plusieurs études randomisées, à celle d’un placebo dans le rhumatisme psoriasique articulaire périphérique. Elle peut donc être prescrite dans le rhumatisme psoriasique articulaire périphérique (sans AMM), après avoir éliminé un déficit en glucose-6-phosphate déshydrogénase (G6PD) dans les populations à risque. Elle n’a pas de place pour traiter les manifestations axiales ou enthésitiques des spondyloarthrites.Traitements de fond biologiques
(biological disease-modifying antirheumatic drugs [bDMARD] ou biomédicaments)
Ces médicaments s’administrent par voie sous-cutanée sauf l’infliximab qui s’administre par voie intraveineuse en perfusion de 1 à 2 heures en hôpital de jour. Il n’y a jamais eu d’étude les comparant, il n’est donc pas possible de recommander une molécule plutôt qu’une autre pour son efficacité. Le choix de chaque traitement doit être discuté avec le patient pour prendre en compte, selon ses propres contraintes, le mode et le rythme d’administration préférables selon les médicaments mais également la présence d’atteintes extra-articulaires. Ainsi, l’existence d’une MICI active ou d’uvéites répétées fait préférer un anticorps monoclonal. Enfin, les biosimilaires semblent avoir le même profil de tolérance et d’efficacité que les traitements de référence pour un prix inférieur.
Malgré leur efficacité importante, les anti-TNFα connaissent des échecs d’emblée chez environ un quart à un tiers des patients, mais également des échecs secondaires, ou des échappements.
La tolérance est comparable à celle observée dans d’autres indications (polyarthrite rhumatoïde), avec au premier plan le risque infectieux, justifiant dans le bilan préalable la recherche d’une tuberculose latente selon les recommandations officielles. Le bilan préalable et les éléments de surveillance et de gestion des différentes situations peuvent être téléchargés sur www.cri-net.com.
Le profil de tolérance est bon, le bilan préalable et les éléments de surveillance et de gestion des différentes situations sont similaires aux anti-TNFα (www.cri-net.com).
Le profil de tolérance est bon, comparable à celui des autres biomédicaments, avec une légère augmentation du risque des candidoses (muqueuses essentiellement). Le bilan préalable et les éléments de surveillance et de gestion des différentes situations sont similaires à ceux des anti-TNFα (www.cri-net.com). Un deuxième anti-IL17A, l’ixékizumab, déjà commercialisé en France pour le psoriasis sévère, est en attente de prix en France dans le rhumatisme psoriasique après une extension d’AMM européenne dans cette indication.
Concernant ces anti-IL17, des essais dans la maladie de Crohn ont mis en évidence la possibilité d’une poussée de la maladie, ce qui a interrompu le développement de cette classe dans cette indication. Cela amène à ne pas recourir en première intention à ces molécules en cas de MICI associée à la spondyloarthrite.
Anti-tumor necrosis factor alpha
Les anti-tumor necrosis factor alpha (anti-TNFα) sont prescrits depuis le début des années 2000 dans la spondylarthrite ankylosante et le rhumatisme psoriasique, puis dans les formes de spondyloarthrites axiales non radiographiques. Ils ont tous (adalimumab, certolizumab pegol, étanercept, golimumab et infliximab) une efficacité reconnue sur l’atteinte axiale de la spondylarthrite ankylosante et sur les atteintes périphériques du rhumatisme psoriasique (arthrites périphériques, enthésites, dactylites), ainsi que sur l’inflammation biologique éventuelle. Études et « données de vraie vie » confirment leur action sur toutes les formes d’atteintes rhumatologiques de la sphère spondyloarthrite ; la seule restriction pour le moment concerne les spondyloarthrites non radiographiques sans signe inflammatoire objectif (protéine C-réactive [CRP] normale et absence d’inflammation à l’imagerie par résonance magnétique [IRM]), où la preuve d’efficacité n’est pas apportée, ce qui a conduit à ne pas inclure ces formes dans les AMM des spondyloarthrites. Les anti-TNFα sont également actifs sur les manifestations extra-articulaires (psoriasis, uvéites, maladies inflammatoires chroniques de l’intestin [MICI], sauf pour l’étanercept dans ce dernier cas). Ils ont de plus une action de ralentissement des dommages structuraux articulaires dans les formes articulaires périphériques de rhumatisme psoriasique. Ces actions se traduisent par une amélioration prouvée du pronostic fonctionnel et de la qualité de vie des patients.Ces médicaments s’administrent par voie sous-cutanée sauf l’infliximab qui s’administre par voie intraveineuse en perfusion de 1 à 2 heures en hôpital de jour. Il n’y a jamais eu d’étude les comparant, il n’est donc pas possible de recommander une molécule plutôt qu’une autre pour son efficacité. Le choix de chaque traitement doit être discuté avec le patient pour prendre en compte, selon ses propres contraintes, le mode et le rythme d’administration préférables selon les médicaments mais également la présence d’atteintes extra-articulaires. Ainsi, l’existence d’une MICI active ou d’uvéites répétées fait préférer un anticorps monoclonal. Enfin, les biosimilaires semblent avoir le même profil de tolérance et d’efficacité que les traitements de référence pour un prix inférieur.
Malgré leur efficacité importante, les anti-TNFα connaissent des échecs d’emblée chez environ un quart à un tiers des patients, mais également des échecs secondaires, ou des échappements.
La tolérance est comparable à celle observée dans d’autres indications (polyarthrite rhumatoïde), avec au premier plan le risque infectieux, justifiant dans le bilan préalable la recherche d’une tuberculose latente selon les recommandations officielles. Le bilan préalable et les éléments de surveillance et de gestion des différentes situations peuvent être téléchargés sur www.cri-net.com.
Ustékinumab
L’ustékinumab est un anticorps monoclonal bloquant la sous-unité p40 commune aux interleukines (IL) 12 et 23 qui s’administre par voie sous-cutanée. La démonstration de son efficacité structurale et clinique a été obtenue dans le rhumatisme psoriasique articulaire périphérique ; l’amélioration porte sur les symptômes et signes articulaires mais également sur les enthésites et dactylites. Par ailleurs, l’efficacité du médicament sur le psoriasis a été établie, ainsi que plus récemment dans la maladie de Crohn, deux autres atteintes où il dispose d’une AMM. Son efficacité est, en revanche, insuffisante dans la spondylarthrite ankylosante, restreignant son AMM (en rhumatologie) au rhumatisme psoriasique.Le profil de tolérance est bon, le bilan préalable et les éléments de surveillance et de gestion des différentes situations sont similaires aux anti-TNFα (www.cri-net.com).
Sécukinumab
Le sécukinumab est le premier agent anti-IL17 (anticorps monoclonal anti-IL17A) disponible dans la spondylarthrite ankylosante mais également dans le rhumatisme psoriasique articulaire périphérique. Il s’administre par voie sous-cutanée. Son développement clinique l’a tout d’abord imposé comme un traitement très efficace du psoriasis avant de s’étendre aux atteintes axiales des spondylarthrites ankylosantes, des atteintes articulaires périphériques, des enthésites et des dactylites du rhumatisme psoriasique.Le profil de tolérance est bon, comparable à celui des autres biomédicaments, avec une légère augmentation du risque des candidoses (muqueuses essentiellement). Le bilan préalable et les éléments de surveillance et de gestion des différentes situations sont similaires à ceux des anti-TNFα (www.cri-net.com). Un deuxième anti-IL17A, l’ixékizumab, déjà commercialisé en France pour le psoriasis sévère, est en attente de prix en France dans le rhumatisme psoriasique après une extension d’AMM européenne dans cette indication.
Concernant ces anti-IL17, des essais dans la maladie de Crohn ont mis en évidence la possibilité d’une poussée de la maladie, ce qui a interrompu le développement de cette classe dans cette indication. Cela amène à ne pas recourir en première intention à ces molécules en cas de MICI associée à la spondyloarthrite.
Autres biomédicaments utilisés dans la polyarthrite rhumatoïde
En dehors de l’abatacept qui a montré une amélioration significative, comparé au placebo, dans le rhumatisme psoriasique articulaire périphérique, et qui a une AMM dans cette indication mais sans remboursement, les autres biomédicaments utilisés dans la polyarthrite rhumatoïde n’ont donc pas de place aujourd’hui dans le traitement des spondyloarthrites : le tocilizumab et le sarilumab (deux anti-IL6) ont montré leur absence d’efficacité dans la spondylarthrite ankylosante dans des essais contrôlés, et le rituximab (anti-CD20) ou l’anakinra (anti-IL1) n’ont fait l’objet que d’études ouvertes de petite taille ou de cas isolés, sans développement ultérieur.« Petites molécules »
(targeted synthetic disease-modifying antirheumatic drugs [tsDMARD])
La tolérance de l’aprémilast est apparue satisfaisante dans ces études, les effets indésirables les plus souvent observés sont des diarrhées, des nausées, des céphalées, et des infections respiratoires hautes. Une augmentation progressive de la posologie est préconisée pour diminuer leur apparition (surtout la diarrhée). Sa prescription chez les patients avec des antécédents de dépression doit être prudente car 1 % des patients (vs 0,8 % sous placebo) ont eu un syndrome dépressif, 0,3 % une dépression sévère, une interruption de traitement du fait d’une dépression est intervenue chez 0,2 % des patients (vs 0 % sous placebo).
Aprémilast
Cet inhibiteur de la phosphodiestérase 4 module l’expression du TNFα, de l’IL17 et de l’IL10 par le biais de l’AMP cyclique. En rhumatologie, l’efficacité de l’aprémilast, clinique mais non structurale, a été mise en évidence dans le rhumatisme psoriasique articulaire périphérique uniquement. C’est pourquoi son AMM en rhumatologie est le rhumatisme psoriasique en échec d’au moins un traitement de fond. Il est efficace et approuvé également dans le psoriasis.La tolérance de l’aprémilast est apparue satisfaisante dans ces études, les effets indésirables les plus souvent observés sont des diarrhées, des nausées, des céphalées, et des infections respiratoires hautes. Une augmentation progressive de la posologie est préconisée pour diminuer leur apparition (surtout la diarrhée). Sa prescription chez les patients avec des antécédents de dépression doit être prudente car 1 % des patients (vs 0,8 % sous placebo) ont eu un syndrome dépressif, 0,3 % une dépression sévère, une interruption de traitement du fait d’une dépression est intervenue chez 0,2 % des patients (vs 0 % sous placebo).
« Petites molécules » en développement
Les anti-Jak kinases déjà disponibles dans la polyarthrite rhumatoïde (tofacitinib, baricitinib) sont en développement très avancé dans le rhumatisme psoriasique articulaire périphérique ; le tofacitinib a d’ailleurs obtenu une extension d’AMM dans cette indication en juin 2018.Stratégies thérapeutiques
Ces stratégies sont bien développées dans des recommandations européennes et françaises récentes.4-6
Objectifs
Les objectifs des traitements dans les formes axiales des spondyloarthrites sont avant tout le contrôle des poussées inflammatoires de la maladie, la lutte contre les douleurs et l’enraidissement et le maintien de la capacité fonctionnelle, allant avec une amélioration de la qualité de vie et la conservation de l’insertion socioprofessionnelle. Dans le rhumatisme psoriasique articulaire périphérique, l’objectif est de plus de prévenir ou ralentir les lésions radiographiques de la maladie.
Principes généraux du traitement
Ces principes reposent sur les concepts récents déjà vus (diagnostic précoce, contrôle étroit et rapproché de l’activité de la maladie, diagnostic et prise en charge des comorbidités), sur le recours au rhumatologue le plus précocement possible pour confirmer le diagnostic et guider la prise en charge globale, sur l’information et l’éducation du patient, sur le recours à la rééducation, rarement à la chirurgie ; notons que les formes sévères peuvent relever d’une prise en charge à 100 % à travers une reconnaissance d’ALD 30.
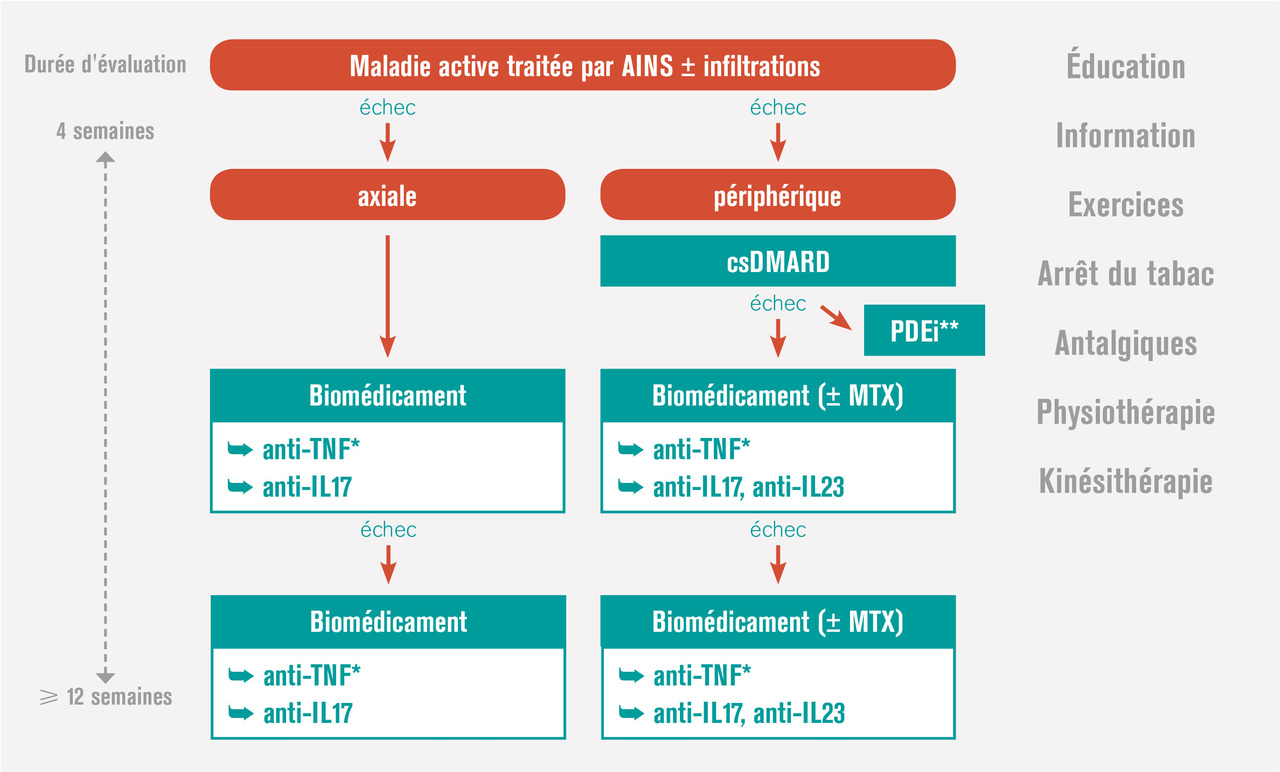
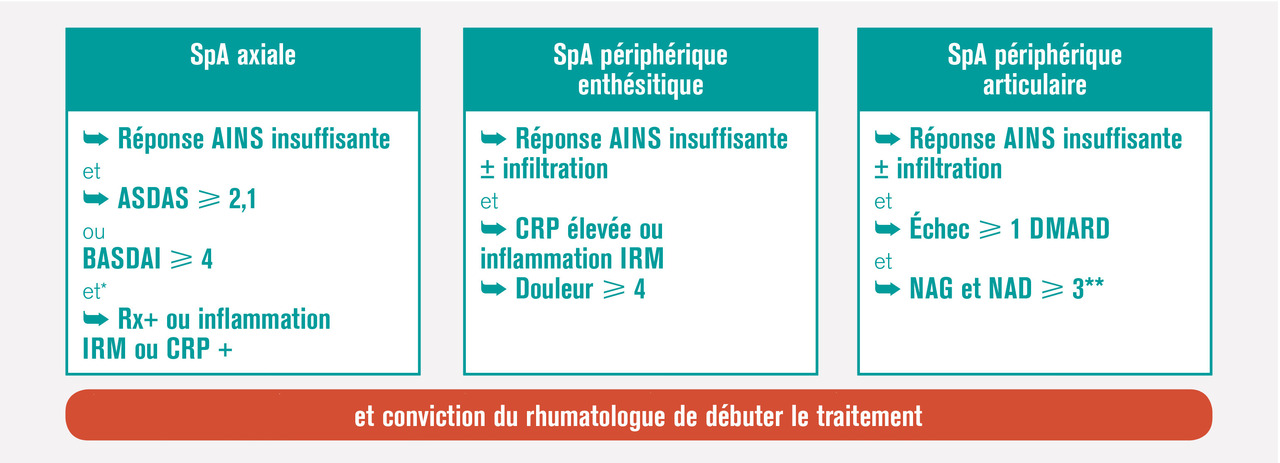
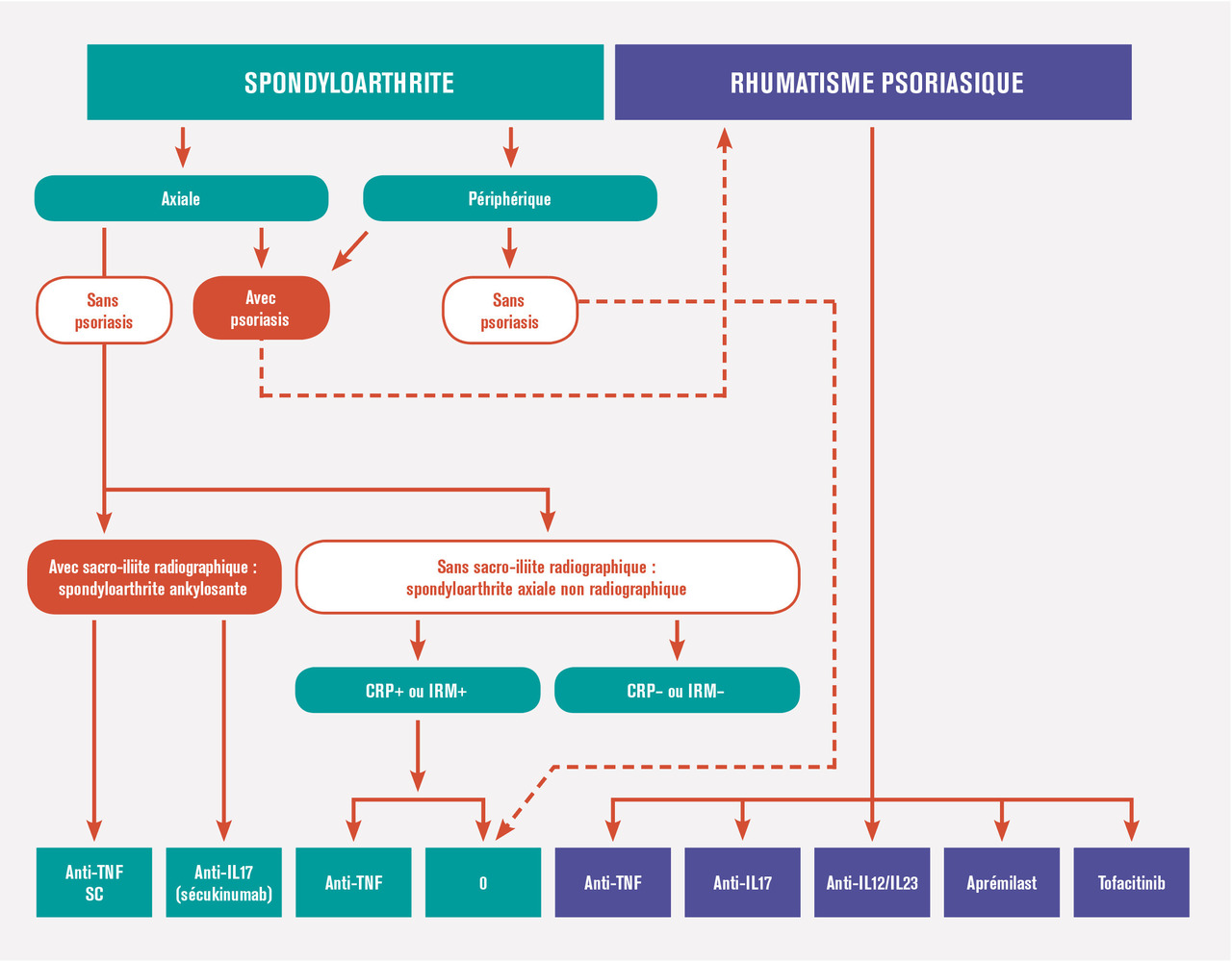
Traitement médicamenteux en fonction du phénotype de l’atteinte rhumatologique
les cas (sauf contre-indication formelle), les AINS sont proposés en première intention.
Des études comparatives entre ces nouvelles molécules ainsi que des études de stratégies thérapeutiques sont nécessaires pour définir la stratégie thérapeutique optimale.
Dans les formes axiales, isolées ou non
En cas d’échec ou de non-tolérance des AINS prescrits de façon optimale, on s’oriente vers un biomédicament (bDMARD) : dans la spondyloarthrite axiale radiographique (ou spondylarthrite ankylosante), on prescrit un anti-TNFα ou un anti-IL17, le plus souvent un anti-TNFα encore aujourd’hui, puis si besoin un deuxième anti-TNFα ou un anti-IL17. Dans les spondyloarthrites axiales non radiographiques et sans psoriasis, seuls les anti-TNFα en sous-cutané peuvent être envisagés s'il existe un signe objectif d’inflammation (CRP élevée ou signes à l’IRM).Devant une atteinte articulaire périphérique avec psoriasis, ou rhumatisme psoriasique articulaire périphérique
Dans ce cas les AINS peuvent éventuellement être associés aux injections locales de stéroïdes. En cas d’échec (patient n’atteignant pas la rémission ou au moins la faible activité de la maladie) ou d’emblée devant une atteinte sévère (nombreuses synovites, présence d’un syndrome inflammatoire biologique, atteinte structurale) peut être proposé un traitement de fond synthétiques conventionnel (csDMARD) [méthotrexate, sulfasalazine ou léflunomide). Le médicament de référence est le méthotrexate, tout particulièrement quand coexiste une atteinte cutanée ou unguéale. Rappelons ici qu’il ne faut pas prendre de retard à l’instauration de ce traitement de fond et ne pas masquer la symptomatologie derrière une corticothérapie orale délétère. Si le méthotrexate n’obtient pas la rémission ou au moins un très bon contrôle de la maladie, l’instauration d’un biomédicament doit être discutée, là encore sans retard. Comme rapporté plus haut, les biomédicaments qui ont fait la preuve de leur efficacité dans cette indication sont les anti-TNFα, les anti-IL17 et un anti-IL12 et 23. Ils peuvent tous les trois être prescrits en première ligne de biomédicament, mais le recul étant moindre avec ces deux derniers types de molécules, le premier est en généralement encore un anti-TNFα . En cas d’échec, on discute un second anti-TNFα ou plutôt de changer de mécanisme d’action pour un anti-IL17, ou anti-IL12 ou 23. L’intérêt de la bithérapie csDMARD (en particulier méthotrexate) plus bDMARD par rapport à la monothérapie bDMARD reste débattu. La place de l’aprémilast est moins bien définie. En France, la Haute Autorité de santé place l’aprémilast dans le traitement du rhumatisme psoriasique actif chez les patients adultes ayant une réponse insuffisante ou une intolérance à un traitement de fond antérieur, « en association » avec un csDMARD, « lorsqu’une biothérapie n’est pas envisagée ». Compte tenu de l’absence d’étude sur l’effet structural de l’aprémilast, il paraît en effet préférable devant une forme érosive, ou en cas de facteurs de mauvais pronostic, de faire appel aux biomédicaments dont l’effet structural a été établi.Des études comparatives entre ces nouvelles molécules ainsi que des études de stratégies thérapeutiques sont nécessaires pour définir la stratégie thérapeutique optimale.
Dans les formes enthésitiques isolées
Les AINS sont le traitement de première intention. Certaines localisations peuvent bénéficier d’une infiltration corticoïde. En cas d’échec, les anti-TNFα sont les seuls biomédicaments à avoir démontré leur efficacité au cours d’une étude randomisée dans cette indication. En cas d’atteinte enthésitique avec psoriasis, le sécukinumab, l’ustékinumab et l’aprémilast semblent aussi avoir aussi un intérêt.En cas de dactylite avec psoriasis
Les traitements proposés peuvent être les traitements de fond synthétiques conventionnels ou les infiltrations locales de corticoïdes en première intention. Même s’il n’existe pas d’étude dédiée aux dactylites rebelles avec les biomédicaments ou l’aprémilast, ces traitements peuvent être envisagés dans ces situations, attitude soutenue par les critères secondaires des études pivots. Ces attitudes peuvent être élargies aux dactylites isolées rebelles sans psoriasis, en tenant compte du fait qu’il peut s’agir d’une prescription hors AMM.Traitement en fonction des éventuelles pathologies associées
En cas d’atteinte cutanée associée
Le méthotrexate peut être envisagé d’emblée sur les rhumatismes psoriasiques avec atteinte cutanée associée si celle-ci est invalidante ou étendue étant donné l’efficacité du méthotrexate sur le psoriasis cutané. En cas d’échec du méthotrexate, peuvent être envisagés, en général, un anti-TNFα, voire l’aprémilast, les anti-IL17 ou anti-IL12 et 23.En cas de maladie de Crohn ou de rectocolite hémorragique associée
En cas de MICI associée, les AINS sont en général contre-indiqués, ou ne peuvent pas constituer le « projet thérapeutique durable » des manifestations rhumatologiques. On a donc souvent et rapidement recours à un traitement de fond synthétique conventionnel ou à un biomédicament.En cas d’uvéites associées
Références
1. Claudepierre P, Wendling D, Breban M, Goupillle P, Dougados M. Ankylosing spondylitis, spondyloarthropathy, spondyloarthritis, or spondylarthritis: what's in a name? Joint Bone Spine 2012;79:534-5.
2. Bachelez H, Claudepierre P, Boulinguez S. Early detection of psoriatic arthritis: which tools are most practical? Ann Dermatol Venereol 2011;138(6 Suppl 1):H6-9.
3. Smolen JS, Schöls M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018;77:3-17.
4. van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76:978-91.
5. Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499-510.
6. Wendling D, Lukas C, Prati C, et al. 2017 Update of French Society for Rheumatology (SFR) Recommendations about the everyday management of patients with spondyloarthritis. Joint Bone Spine 2018;85:275-84.
7. Amor B, Dougados M, Mijiyawa M. Criteria of the classification of spondylarthropathies. Rev Rhum Mal Osteoart 1990;57:85-9.
8. Rudwaleit M, van der Heijde D, Landewé R, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25-31.
2. Bachelez H, Claudepierre P, Boulinguez S. Early detection of psoriatic arthritis: which tools are most practical? Ann Dermatol Venereol 2011;138(6 Suppl 1):H6-9.
3. Smolen JS, Schöls M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018;77:3-17.
4. van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76:978-91.
5. Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499-510.
6. Wendling D, Lukas C, Prati C, et al. 2017 Update of French Society for Rheumatology (SFR) Recommendations about the everyday management of patients with spondyloarthritis. Joint Bone Spine 2018;85:275-84.
7. Amor B, Dougados M, Mijiyawa M. Criteria of the classification of spondylarthropathies. Rev Rhum Mal Osteoart 1990;57:85-9.
8. Rudwaleit M, van der Heijde D, Landewé R, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25-31.