Les brûlures graves sont celles qui menacent le pronostic fonctionnel du blessé, et surtout celles qui menacent son pronostic vital par leur étendue, leur profondeur ou leur localisation, par leur association à des lésions d’inhalation de fumée, à une intoxication ou à un traumatisme, ou par le terrain du patient.
Leur prise en charge relève d’une structure hospitalière disposant d’une équipe spécialisée dédiée. C’est en effet un défi multidisciplinaire à quatre dimensions : locale par le traitement des plaies, y compris chirurgical ; générale par la réanimation, la lutte contre l’infection, et l’analgésie ; psychologique dès que possible ; et de réhabilitation, à commencer précocement.
Leur prise en charge relève d’une structure hospitalière disposant d’une équipe spécialisée dédiée. C’est en effet un défi multidisciplinaire à quatre dimensions : locale par le traitement des plaies, y compris chirurgical ; générale par la réanimation, la lutte contre l’infection, et l’analgésie ; psychologique dès que possible ; et de réhabilitation, à commencer précocement.
Physiopathologie appliquée
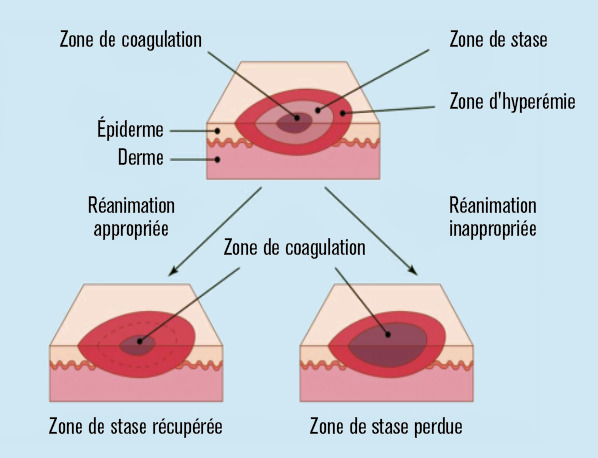
Le potentiel d’auto-aggravation signe les brûlures graves. Localement, les brûlures présentent typiquement des zones concentriques1 de nécrose par coagulation, de stase ischémique, et d’hyperémie inflammatoire (fig. 1). Outre l’effraction de la barrière cutanée, la toxicité des nécroses entraîne une inflammation qui s’exporte en un syndrome de réponse inflammatoire systémique majeur, prolongé et dépendant de la dose de brûlure. Il en résulte une maladie générale caractérisée par une plasmorragie maximale dans les premières heures et responsable d’un choc hypovolémique, par une immunodépression et par un hypercatabolisme extrême pouvant durer plusieurs mois. Cumulé au risque infectieux sévère, l’ensemble expose aux défaillances d’organes et à l’approfondissement des lésions locales. Les enjeux principaux de la prise en charge sont donc, d’une part, de prévenir et de traiter les défaillances d’organes et les complications infectieuses et, d’autre part, d’éliminer les nécroses et de restituer une barrière cutanée intègre au plus tôt.
Aspects préhospitaliers
Le refroidissement précoce et prolongé des brûlures à l’eau fraîche par les témoins ou les secouristes est efficace pour limiter l’approfondissement des brûlures. Il est limité aux brûlures peu étendues (15 % maximum) et ne doit pas refroidir le brûlé.
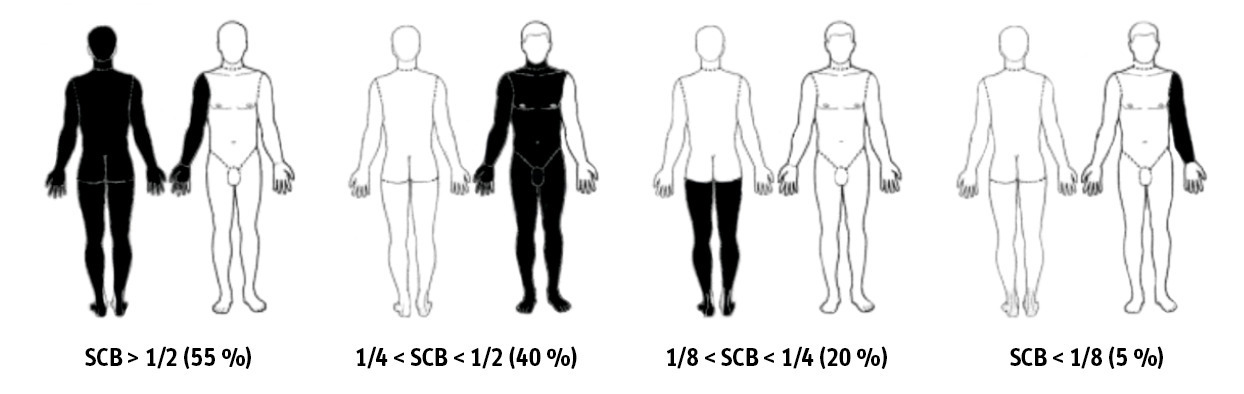
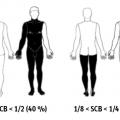
Les objectifs centraux de la prise en charge préhospitalière sont l’évaluation correcte de la gravité des brûlures, pour permettre une orientation optimale, et la mise en sécurité du patient. Celle-ci repose sur la sécurisation des voies aériennes, un abord vasculaire fiable, le début de la réanimation hydroélectrolytique, l’analgésie, voire la sédation, et la prévention de l’hypothermie, avec un emballage sec au moins isotherme des brûlures. Les principes sont les mêmes que pour la prise en charge hospitalière initiale, mais on utilise ici un outil simplifié pour estimer la surface cutanée brûlée, la série des moitiés :2 la surface du corps est divisée par moitiés successives, face avant-face arrière 1/2, soit 50 % chacune ; pour chaque face, haut-bas 1/4, soit 25 % chacune ; enfin, dernière subdivision gauche-droite 1/8, soit 10 à 15 % chacune (fig. 2 ).
Les objectifs centraux de la prise en charge préhospitalière sont l’évaluation correcte de la gravité des brûlures, pour permettre une orientation optimale, et la mise en sécurité du patient. Celle-ci repose sur la sécurisation des voies aériennes, un abord vasculaire fiable, le début de la réanimation hydroélectrolytique, l’analgésie, voire la sédation, et la prévention de l’hypothermie, avec un emballage sec au moins isotherme des brûlures. Les principes sont les mêmes que pour la prise en charge hospitalière initiale, mais on utilise ici un outil simplifié pour estimer la surface cutanée brûlée, la série des moitiés :2 la surface du corps est divisée par moitiés successives, face avant-face arrière 1/2, soit 50 % chacune ; pour chaque face, haut-bas 1/4, soit 25 % chacune ; enfin, dernière subdivision gauche-droite 1/8, soit 10 à 15 % chacune (
Prise en charge générale du brûlé grave
Le traitement général du brûlé grave,3, 4 déterminé par la physiopathologie, est long et exigeant.
Réanimation initiale
La réanimation des 48 premières heures doit pouvoir débuter en milieu non spécialisé.5, 6 Un avis spécialisé à distance est sollicité au plus tôt, en vue d’organiser le transfert en conditions optimales.
v . p.1 078 ). L’examen clinique systématique recherche les lésions associées en prenant garde à quatre pièges fréquents (tableau 1).
Les chirurgies et pansements requièrent des anesthésies générales fréquentes, privilégiant le gamma-hydroxybutyrate de sodium ou la kétamine en cas d’instabilité. La pharmacocinétique du brûlé grave se caractérise par des volumes de distribution et des clairances très augmentés, imposant des posologies majorées. La succinylcholine est contre-indiquée après 2 jours (risque d’arrêt cardiaque hyperkaliémique). Hors des pansements de sites donneurs imprégnés d’anesthésiques locaux, l’anesthésie locorégionale est souvent impossible vu les multiples sites à traiter.
Évaluation diagnostique
L’étendue et la profondeur des brûlures sont évaluées précisément (Réanimation hémodynamique
Pour les surfaces cutanées brûlées de 15 % et plus, la plasmorragie doit être compensée par une expansion volémique. L’abord veineux privilégie les zones saines et les voies profondes en raison du risque de déplacement secondaire des voies périphériques ou intra-osseuses sous l’effet de l’œdème. Le Ringer Lactate est le soluté de référence pour éviter l’acidose hyperchlorémique. Une supplémentation en albumine est réalisée pour les surfaces cutanées brûlées de 30 % et plus. La réanimation peut être orientée par l’une des nombreuses formules indicatives existantes, comme celle du service de santé des armées (tableau 2), mais doit impérativement être titrée selon la réponse physiologique. L’objectif est une expansion volémique préservant la perfusion tissulaire périphérique, sans sur-remplissage délétère (œdème aigu, en particulier pulmonaire, syndromes compartimentaux). En pratique, on cible 0,5 mL/kg de diurèse horaire et la correction de l’éventuelle hyperlactatémie, en limitant le bas débit ou l’hémoconcentration, et en acceptant une précharge-dépendance résiduelle. L’utilisation de catécholamines, strictement limitée pour ne pas aggraver les nécroses cutanées par vasoconstriction, est ajustée au profil hémodynamique monitoré : vasoconstriction intense et hypokinésie dans les premières heures, puis vasoplégie hyperkinétique s’installant seulement vers la 24e heure.Voies aériennes et ventilation
L’intubation trachéale est indiquée avant l’obstruction des voies aériennes en cas de brûlures profondes de la face ou circulaires du cou, de dysphonie, ou de surface cutanée brûlée supérieure à 50 % faisant anticiper un syndrome œdémateux majeur. Elle est discutée en cas de risque d’obstruction moins marqué. Elle est relayée par une trachéotomie percutanée précoce si une ventilation prolongée est anticipée. La ventilation est protectrice.Analgésie, sédation, anesthésie
La douleur liée aux brûlures est corrélée à leur étendue. Initialement faible ou absente sur les zones brûlées au 3e degré, elle augmente avec l’inflammation et la tachyphylaxie. Associé ou non à une sédation, son traitement multimodal repose sur la morphine ou ses dérivés, titrés et associés à leurs adjuvants comme la clonidine ou la kétamine à faible dose, et aux antalgiques de palier 1 ou 2 à visée d’épargne. La très probable implication de la kétamine dans des complications hépatiques graves, en cours d’investigation approfondie, a conduit à en restreindre les indications et les durées d’utilisation pour réduire les doses d’exposition cumulées.Les chirurgies et pansements requièrent des anesthésies générales fréquentes, privilégiant le gamma-hydroxybutyrate de sodium ou la kétamine en cas d’instabilité. La pharmacocinétique du brûlé grave se caractérise par des volumes de distribution et des clairances très augmentés, imposant des posologies majorées. La succinylcholine est contre-indiquée après 2 jours (risque d’arrêt cardiaque hyperkaliémique). Hors des pansements de sites donneurs imprégnés d’anesthésiques locaux, l’anesthésie locorégionale est souvent impossible vu les multiples sites à traiter.
Compléments et poursuite de la réanimation
Lutte contre l’hypothermie
Le réchauffement des locaux, des solutés et du malade est essentiel en raison du risque d’hypothermie lié à la dysrégulation thermique et aux déperditions par évaporation, réduites aussi par les pansements occlusifs. Cette préoccupation reste constante jusqu’à restauration de l’intégrité cutanée.Prise en charge nutritionnelle
L’hypercatabolisme majore considérablement la dépense énergétique. La nutrition entérale, précoce et prolongée, limite la dénutrition. Elle est guidée par calorimétrie indirecte idéalement, et à défaut elle est ajustée aux besoins estimés.7 C’est la meilleure prophylaxie de l’ulcère de stress. Une supplémentation en vitamines, C et E notamment, et en éléments traces complète ce traitement.Inhalation de fumées et intoxications associées
Les lésions d’inhalation de fumées sont diagnostiquées par fibroscopie bronchique, au plus tôt sans retarder le transfert en milieu spécialisé. Outre la ventilation protectrice, elles sont traitées par des toilettes bronchiques fibroscopiques itératives pour éliminer les suies, et par des aérosols d’héparine, mucolytiques (N-acétylcystéine) et si besoin par des bêtamimétiques à visée bronchodilatatrice.L’intoxication cyanhydrique, suspectée devant un coma ou un choc d’emblée ou une hyperlactatémie à plus de 8 mmol/L, est traitée par hydroxocobalamine au plus tôt. L’intoxication oxycarbonée relève de l’oxygénothérapie normobare. Le rapport bénéfice-risque de l’oxygénothérapie hyperbare est en effet douteux ici du fait du risque de retard à la réanimation et aux soins locaux des brûlures.
Lutte contre l’infection
L’infection est la première cause de mortalité du brûlé. Les infections de brûlures sont prévenues par des précautions d’hygiène renforcées et des traitements locaux anti-infectieux. Leur diagnostic et leur traitement sont bien codifiés, avec un principe central : à infection locale, traitement local.8 Ainsi, l’antibioprophylaxie initiale est proscrite, et les anti-infectieux systémiques réservés au sepsis documenté. Une rigueur totale dans le maniement des anti-infectieux est en effet capitale, du fait de la menace particulière des résistances pour ces patients à haut risque. Pour l’avenir, elle justifie d’explorer chez eux des alternatives novatrices, comme la phagothérapie.9Traitement local des brûlures
Le traitement local des brûlures repose sur les pansements itératifs et la chirurgie. La chirurgie du brûlé grave en phase aiguë est centrée sur les urgences et le recouvrement cutané.10
Urgences chirurgicales du brûlé
La chirurgie urgente des éventuels traumatismes associés prime sur la brûlure. L’abord à travers la zone brûlée est possible. La classique stérilité initiale de la brûlure pendant quelques heures dépend en fait du contexte : pour protéger la voie d’abord de l’infection, il faut parfois parer le tissu brûlé en regard. En cas de fracture en zone brûlée, l’exofixation est préférée à l’ostéosynthèse ; elle facilite en outre les soins locaux ultérieurs des brûlures.
Les incisions de décharge ou escarrotomies ne concernent que la peau brûlée, atteignant sans le franchir le fascia qui recouvre le plan musculaire. Elles sont pratiquées avant la 8e heure en cas de brûlures profondes (3e degré, voire 2e degré profond) circonférentielles au niveau :
– du cou, pour éviter l’obstruction des voies aériennes supérieures et la compression vasculaire ;
– du thorax, pour restaurer la compliance pariétale thoracique ;
– de l’abdomen, pour éviter l'hypertension intra-abdominale et le syndrome compartimental abdominal ;
– des membres, pour éviter une ischémie aiguë. Sur la main, des incisions radiaires sont réalisées dans les vallées intermétacarpiennes du dorsum et deux incisions au bord ulnaire et radial de chaque doigt en préservant les commissures interdigitales, de reconstruction toujours difficile.
Les fasciotomies ou aponévrotomies sont pratiquées sur les membres tant supérieurs qu’inférieurs en cas de syndrome de loges par brûlures électriques, fracture sous brûlure, ou défaut d’escarrotomie. Elles doivent concerner toutes les loges du segment de membre concerné.
Les incisions de décharge ou escarrotomies ne concernent que la peau brûlée, atteignant sans le franchir le fascia qui recouvre le plan musculaire. Elles sont pratiquées avant la 8e heure en cas de brûlures profondes (3e degré, voire 2e degré profond) circonférentielles au niveau :
– du cou, pour éviter l’obstruction des voies aériennes supérieures et la compression vasculaire ;
– du thorax, pour restaurer la compliance pariétale thoracique ;
– de l’abdomen, pour éviter l'hypertension intra-abdominale et le syndrome compartimental abdominal ;
– des membres, pour éviter une ischémie aiguë. Sur la main, des incisions radiaires sont réalisées dans les vallées intermétacarpiennes du dorsum et deux incisions au bord ulnaire et radial de chaque doigt en préservant les commissures interdigitales, de reconstruction toujours difficile.
Les fasciotomies ou aponévrotomies sont pratiquées sur les membres tant supérieurs qu’inférieurs en cas de syndrome de loges par brûlures électriques, fracture sous brûlure, ou défaut d’escarrotomie. Elles doivent concerner toutes les loges du segment de membre concerné.
Pansements de brûlures
Les pansements itératifs sont essentiels dans le traitement des plaies. Un pansement idéal serait antimicrobien, antalgique, hémostatique, procicatrisant, anti-inflammatoire, non adhérent, occlusif, et souple pour permettre la mobilisation. En pratique, certaines de ces propriétés sont priorisées selon la phase évolutive, la chirurgie éventuelle et le statut infectieux local. Typiquement se succèdent des pansements antiseptiques (sulfadiazine argentique, chlorhexidine), des pansements vaselinés favorisant la granulation, enfin des interfaces non adhérentes protégeant le néo-épiderme.
Chirurgie de recouvrement cutané
Sauf exception, le principe de l’excision-greffe précoce des brûlures profondes prévaut, conditionnée par la surface corporelle brûlée et par la disponibilité en sites non brûlés donneurs de peau saine. L’excision-greffe précoce a démontré son efficacité sur la survie, la limitation du risque infectieux, la réduction des pertes sanguines et la réduction de la durée d’hospitalisation.
Dans les cas les plus graves, on utilise des substituts cutanés temporaires. Les allogreffes, cryopréservées ou glycérolées, issues de dons d’organes et de tissus de sujets en mort encéphalique ou d’autres donneurs décédés, assurent une couverture transitoire en attendant la disponibilité de sites donneurs d’autogreffes, ou servent de pansement biologique de sites donneurs précieux ou de protection mécanique de greffes de peau mince expansées à mailles larges. Les xénogreffes, de derme porcin (EZ derm) notamment, peuvent être une alternative dans ces indications.
Les cultures d’épiderme autologue sont une technique d’exception, utilisable au-delà de 60 % de surface brûlée au 3e degré, avec pour principaux problèmes la lourdeur logistique de leur mise en œuvre, leur fragilité liée à l’immaturité de la jonction dermo-épidermique, source d’ulcérations itératives au moindre frottement pendant plusieurs mois au moins, et leur coût très élevé.
Dans les brûlures profondes avec destruction complète du derme, des substituts dermiques artificiels définitifs permettent de construire un néoderme pour améliorer la qualité de vie (souplesse de la peau), en particulier au niveau des zones fonctionnelles (face, mains) mais également lors d’expositions tendineuses ou ostéo-articulaires limitées, sous réserve d’un sous-sol bien vascularisé. Il s’agit de matrices tridimensionnelles riches en collagène d’origine animale, bovine ou porcine. Les dermes artificiels sont vascularisés depuis leur sous-sol et colonisés par des fibroblastes et des cellules de l’inflammation, conduisant à la formation d’un néoderme proche de l’original. Selon l’épaisseur du derme artificiel utilisé (1-2 mm), une greffe de peau mince (0,2-0,3 mm) est respectivement mise en place dans le même temps opératoire, ou après une phase de 15 jours à 3 semaines nécessaire à la vascularisation de la trame collagénique. Leurs inconvénients sont leur coût élevé et surtout la fréquence de leurs surinfections. On évite donc leur utilisation en cas de colonisation du site receveur, spécialement à germes multirésistants.
Lorsque le sous-sol après parage est impropre à la greffe ou présente une exposition tendineuse ou ostéo-articulaire étendue, il faut utiliser des lambeaux, structures uni- ou pluritissulaires à vascularisation propre, locaux, régionaux ou prélevés à distance du site receveur. Ils sont pédiculés ou au contraire libres, c’est-à-dire avec des anastomoses microchirurgicales. Outre le risque d’échec de la technique, ils augmentent la rançon cicatricielle : l’enjeu est donc de reconstruire sans détruire.
À l’extrême, il n’y a parfois aucune solution de couverture. Il faut alors réaliser une amputation de raison ou de nécessité, en particulier en cas d’électrisation avec quasi-momification d’un membre, de dégâts pluritissulaires au-delà de toute ressource thérapeutique, ou de choc septique sur infection distale invasive. Les enjeux principaux sont alors d’anticiper la réhabilitation et l’appareillage dans une concertation pluridisciplinaire, et de prévenir et traiter la douleur pour éviter un cercle vicieux associant douleur, inflammation, rétractions et limitations de mobilité.
Au total, la prise en charge hospitalière des brûlés graves, longue et complexe, exige une équipe multidisciplinaire en centre spécialisé. Elle doit cependant pouvoir débuter de manière optimale dans un hôpital de proximité, spécialement en cas d’afflux de victimes. Ses progrès ont transformé le pronostic vital et fonctionnel des blessés même les plus graves. Couplée à la réhabilitation et à l’accompagnement psychologique et social, elle rend pleinement possible leur réinsertion.
Parage
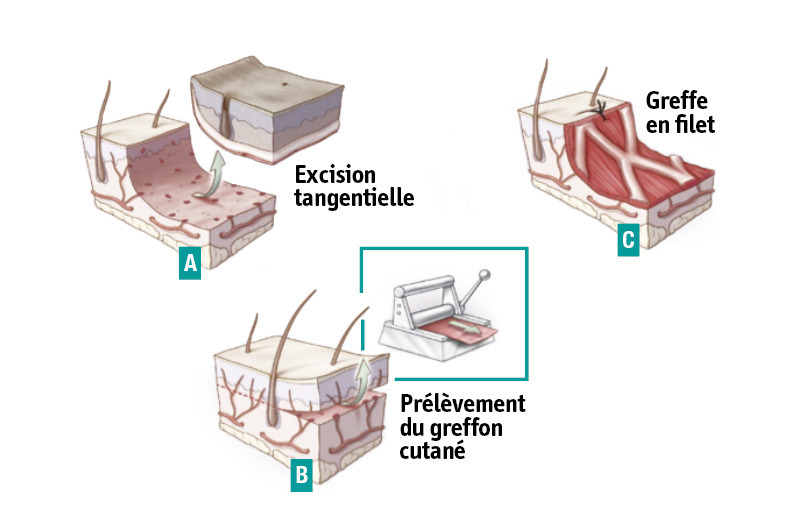
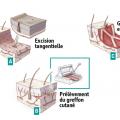
Le parage des zones brûlées est effectué selon deux méthodes : l’excision tangentielle, réalisée au dermatome à main de Lagrot (ou de Watson pour les Anglo-Saxons), préserve tout ou une partie du derme ; l’avulsion cutanéo-graisseuse, réalisée au bistouri électrique pour limiter les pertes sanguines, va jusqu’à l’aponévrose dans les brûlures plus profondes (3e degré ou carbonisation).Greffes de peau
La couverture cutanée est assurée à partir des sites donneurs de peau saine restants du sujet brûlé. Au stade aigu, des autogreffes de peau mince (0,2 à 0,3 mm), pleine ou expansée en filet sont réalisées (fig. 3). Au stade des séquelles, on préfère les autogreffes de peau totale, moins sujettes à rétraction secondaire, sous réserve de disponibilité de sites donneurs adéquats : plis inguinaux, région sus-claviculaire, face interne des bras. L’excision et la greffe sont souvent menées dans le même temps opératoire, dans les 10 jours après la brûlure, au maximum sur 20 % de la surface corporelle totale. Cela est relativement simple pour des surfaces limitées (10- 30 %) avec de larges zones cutanées saines offrant une réserve de sites donneurs de greffons. Pour des brûlures plus étendues, le capital cutané sain est insuffisant pour permettre ces greffes en un temps. On peut alors recourir à des excisions-greffes successives et surtout à des techniques particulières d’amplification des greffons de peau mince, les microgreffes en pastilles (technique de Meek, Humeca), afin d’augmenter la surface couverte au prix d’une rançon cicatricielle accentuée.Dans les cas les plus graves, on utilise des substituts cutanés temporaires. Les allogreffes, cryopréservées ou glycérolées, issues de dons d’organes et de tissus de sujets en mort encéphalique ou d’autres donneurs décédés, assurent une couverture transitoire en attendant la disponibilité de sites donneurs d’autogreffes, ou servent de pansement biologique de sites donneurs précieux ou de protection mécanique de greffes de peau mince expansées à mailles larges. Les xénogreffes, de derme porcin (EZ derm) notamment, peuvent être une alternative dans ces indications.
Les cultures d’épiderme autologue sont une technique d’exception, utilisable au-delà de 60 % de surface brûlée au 3e degré, avec pour principaux problèmes la lourdeur logistique de leur mise en œuvre, leur fragilité liée à l’immaturité de la jonction dermo-épidermique, source d’ulcérations itératives au moindre frottement pendant plusieurs mois au moins, et leur coût très élevé.
Dans les brûlures profondes avec destruction complète du derme, des substituts dermiques artificiels définitifs permettent de construire un néoderme pour améliorer la qualité de vie (souplesse de la peau), en particulier au niveau des zones fonctionnelles (face, mains) mais également lors d’expositions tendineuses ou ostéo-articulaires limitées, sous réserve d’un sous-sol bien vascularisé. Il s’agit de matrices tridimensionnelles riches en collagène d’origine animale, bovine ou porcine. Les dermes artificiels sont vascularisés depuis leur sous-sol et colonisés par des fibroblastes et des cellules de l’inflammation, conduisant à la formation d’un néoderme proche de l’original. Selon l’épaisseur du derme artificiel utilisé (1-2 mm), une greffe de peau mince (0,2-0,3 mm) est respectivement mise en place dans le même temps opératoire, ou après une phase de 15 jours à 3 semaines nécessaire à la vascularisation de la trame collagénique. Leurs inconvénients sont leur coût élevé et surtout la fréquence de leurs surinfections. On évite donc leur utilisation en cas de colonisation du site receveur, spécialement à germes multirésistants.
Lorsque le sous-sol après parage est impropre à la greffe ou présente une exposition tendineuse ou ostéo-articulaire étendue, il faut utiliser des lambeaux, structures uni- ou pluritissulaires à vascularisation propre, locaux, régionaux ou prélevés à distance du site receveur. Ils sont pédiculés ou au contraire libres, c’est-à-dire avec des anastomoses microchirurgicales. Outre le risque d’échec de la technique, ils augmentent la rançon cicatricielle : l’enjeu est donc de reconstruire sans détruire.
À l’extrême, il n’y a parfois aucune solution de couverture. Il faut alors réaliser une amputation de raison ou de nécessité, en particulier en cas d’électrisation avec quasi-momification d’un membre, de dégâts pluritissulaires au-delà de toute ressource thérapeutique, ou de choc septique sur infection distale invasive. Les enjeux principaux sont alors d’anticiper la réhabilitation et l’appareillage dans une concertation pluridisciplinaire, et de prévenir et traiter la douleur pour éviter un cercle vicieux associant douleur, inflammation, rétractions et limitations de mobilité.
Au total, la prise en charge hospitalière des brûlés graves, longue et complexe, exige une équipe multidisciplinaire en centre spécialisé. Elle doit cependant pouvoir débuter de manière optimale dans un hôpital de proximité, spécialement en cas d’afflux de victimes. Ses progrès ont transformé le pronostic vital et fonctionnel des blessés même les plus graves. Couplée à la réhabilitation et à l’accompagnement psychologique et social, elle rend pleinement possible leur réinsertion.
Références
1. Hettiaratchy S, Dziewulski P. ABC of burns: pathophysiology and types of burns. BMJ 2004;328:1427.
2. Smith JJ, Malyon AD, Scerri GV, Burge TS. A comparison of serial halving and the rule of nines as a pre-hospital assessment tool in burns. Br J Plast Surg 2005;58:957-67.
3. Bittner EA, Shank E, Woodson L, Martyn JAJ. Acute and perioperative care of the burn-injured patient. Anesthesiology 2015;122:448-64.
4. Rowan MP, Cancio LC, Elster EA, et al. Burn wound healing and treatment: review and advancements. Crit Care 2015;19:243.
5. Jault P, Donat N, Leclerc T, et al. Les premières heures du brûlé grave. J Eur Urgences Réanimation 2012;24:138-46.
6. Legrand M, Guttormsen AB, Berger MM. Ten tips for managing critically ill burn patients: follow the RASTAFARI! Intensive Care Med 2015;41:1107-9.
7. Rousseau AF, Losser MR, Ichai C, Berger MM. ESPEN endorsed recommendations: Nutritional therapy in major burns. Clin Nutr 2013;32:497-502.
8. Ravat F, Le Floch R, Vinsonneau C, et al. Antibiotics and the burn patient. Burns 2011;37:16-26.
9. Jault P, Leclerc T, Jennes S, et al. Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. Lancet Infect Dis 2018. DOI:10.1016/S1473-3099(18)30482-1.
10. Baus A, Combes F, Lakhel A, et al. Chirurgie des brûlures graves au stade aigu [article 45-157]. EMC- Tech Chir- Chir Plast Reconstr Esthet 2017;12:1-24.
11. Orgill DP. Excision and skin grafting of thermal burns. N Engl J Med 2009;360:893-901.
2. Smith JJ, Malyon AD, Scerri GV, Burge TS. A comparison of serial halving and the rule of nines as a pre-hospital assessment tool in burns. Br J Plast Surg 2005;58:957-67.
3. Bittner EA, Shank E, Woodson L, Martyn JAJ. Acute and perioperative care of the burn-injured patient. Anesthesiology 2015;122:448-64.
4. Rowan MP, Cancio LC, Elster EA, et al. Burn wound healing and treatment: review and advancements. Crit Care 2015;19:243.
5. Jault P, Donat N, Leclerc T, et al. Les premières heures du brûlé grave. J Eur Urgences Réanimation 2012;24:138-46.
6. Legrand M, Guttormsen AB, Berger MM. Ten tips for managing critically ill burn patients: follow the RASTAFARI! Intensive Care Med 2015;41:1107-9.
7. Rousseau AF, Losser MR, Ichai C, Berger MM. ESPEN endorsed recommendations: Nutritional therapy in major burns. Clin Nutr 2013;32:497-502.
8. Ravat F, Le Floch R, Vinsonneau C, et al. Antibiotics and the burn patient. Burns 2011;37:16-26.
9. Jault P, Leclerc T, Jennes S, et al. Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. Lancet Infect Dis 2018. DOI:10.1016/S1473-3099(18)30482-1.
10. Baus A, Combes F, Lakhel A, et al. Chirurgie des brûlures graves au stade aigu [article 45-157]. EMC- Tech Chir- Chir Plast Reconstr Esthet 2017;12:1-24.
11. Orgill DP. Excision and skin grafting of thermal burns. N Engl J Med 2009;360:893-901.