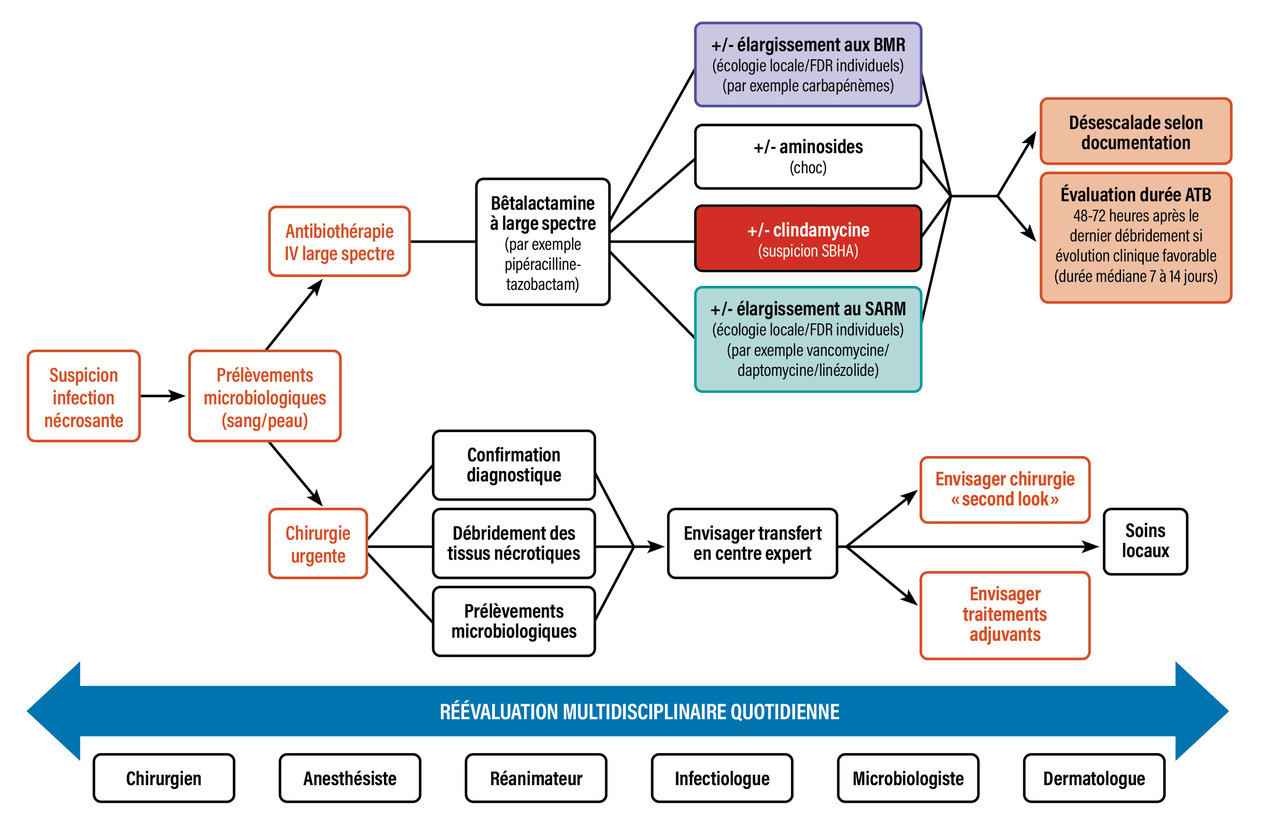
Les infections de la peau et des tissus mous sont très fréquentes dans la population générale,1 mais ne représentent que 2 % des infections amenant les patients en réanimation.2 Parmi ces formes graves, les deux tiers sont des infections nécrosantes, imposant une prise en charge chirurgicale urgente. Le tiers d’infections graves non nécrosantes le sont soit par l’association à un choc toxinique en cas d’infection streptococcique (plus rarement staphylococcique), soit par leur localisation engageant le pronostic fonctionnel (notamment les infections cervico-faciales), soit par leur retentissement systémique sur des terrains fragiles. Sont abordées ici les dermohypodermites bactériennes nécrosantes-fasciites nécrosantes (DHBN-FN), dont la prise en charge est la plus spécifique (figure ).
Malgré la diversité des présentations cliniques, des terrains sous-jacents et des bactéries impliquées, les éléments majeurs de prise en charge de toutes les DHBN-FN sont communs : antibiothérapie à large spectre et surtout débridement chirurgical urgent des tissus nécrosés.3 Du fait de la rareté de ces infections, moins de cinq études randomisées interventionnelles ont été publiées à ce jour,4 et le principal facteur pronostique modifiable identifié est le délai de prise en charge chirurgicale.5
La prise en charge est hospitalière et multidisciplinaire, et l’accès à un centre expérimenté pourrait améliorer le pronostic.6
Malgré la diversité des présentations cliniques, des terrains sous-jacents et des bactéries impliquées, les éléments majeurs de prise en charge de toutes les DHBN-FN sont communs : antibiothérapie à large spectre et surtout débridement chirurgical urgent des tissus nécrosés.3 Du fait de la rareté de ces infections, moins de cinq études randomisées interventionnelles ont été publiées à ce jour,4 et le principal facteur pronostique modifiable identifié est le délai de prise en charge chirurgicale.5
La prise en charge est hospitalière et multidisciplinaire, et l’accès à un centre expérimenté pourrait améliorer le pronostic.6
Chirurgie : diagnostique et thérapeutique
La chirurgie a un rôle majeur à la fois diagnostique et thérapeutique. En effet, elle permet le diagnostic positif de l’infection nécrosante, l’évaluation de son extension et, dans un second temps, le débridement thérapeutique des tissus nécrotiques, clé de voûte de la prise en charge.
Le délai avant chirurgie est le principal facteur pronostique modifiable connu, avec un sur-risque de mortalité lorsqu’il excède six à douze heures après l’admission.5 Le facteur majeur contribuant à ce délai est le retard diagnostique et à la décision chirurgicale, mais des facteurs logistiques comme la mise à disponibilité des blocs opératoires en urgence pourraient être améliorés.7
La chirurgie de débridement initiale est considérée comme un geste de chirurgie générale, pouvant être réalisée par tout chirurgien,8 mais un transfert, en l’absence de plateau médico-technique adéquat, peut parfois s’avérer nécessaire.9
Une réévaluation multidisciplinaire quotidienne, avec nouvelle exploration chirurgicale en cas de doute sur la viabilité de certaines régions, doit être envisagé dans les soixante-douze premières heures. Ce « second look » permet de diagnostiquer des infections nécrosantes alors que la première exploration chirurgicale était rassurante dans 15 % des cas, ou de compléter le débridement des tissus nécrotiques.3, 10
Le délai avant chirurgie est le principal facteur pronostique modifiable connu, avec un sur-risque de mortalité lorsqu’il excède six à douze heures après l’admission.5 Le facteur majeur contribuant à ce délai est le retard diagnostique et à la décision chirurgicale, mais des facteurs logistiques comme la mise à disponibilité des blocs opératoires en urgence pourraient être améliorés.7
La chirurgie de débridement initiale est considérée comme un geste de chirurgie générale, pouvant être réalisée par tout chirurgien,8 mais un transfert, en l’absence de plateau médico-technique adéquat, peut parfois s’avérer nécessaire.9
Une réévaluation multidisciplinaire quotidienne, avec nouvelle exploration chirurgicale en cas de doute sur la viabilité de certaines régions, doit être envisagé dans les soixante-douze premières heures. Ce « second look » permet de diagnostiquer des infections nécrosantes alors que la première exploration chirurgicale était rassurante dans 15 % des cas, ou de compléter le débridement des tissus nécrotiques.3, 10
Antibiothérapie probabiliste
Ces infections bactériennes sont polymicrobiennes dans plus de la moitié des cas incluant, au-delà du streptocoque bêtahémolytique du groupe A (SBHA) et du staphylocoque, des entérobactéries, des anaérobies et des bactéries non fermentantes (voir le Focus « Microbiologie des infections cutanées graves », p. 160 ).11
Les dernières recommandations françaises, publiées en 2000 et proposant l’utilisation de l’association amoxicilline-clavulanate semblent caduques devant ces données microbiologiques récentes, hormis pour les formes cervico-faciales dont l’épidémiologie microbiologique est particulière (voir le Focus « Spécificités des atteintes cervico-faciales et abdominopérinéales »,p. 150 ).12
Il n’existe aucune donnée permettant de favoriser une molécule plutôt qu’une autre, mais l’antibiothérapie probabiliste doit comprendre au minimum une bêtalactamine intraveineuse à large spectre active sur les cocci à Gram positif, les bacilles à Gram négatif et les anaérobies, par exemple l’association pipéracilline-tazobactam.13
L’utilisation de carbapénèmes ou de glycopeptide est réservée aux patients ayant des facteurs de risque habituels d’acquisition de germes résistants (long séjour ou soins de suite, hémodialyse chronique, portage connu).3
L’adjonction de clindamycine est courante,11 fondée sur un mécanisme d’action par inhibition de la synthèse protéique avec un possible effet « antitoxinique » ; en effet, un streptocoque du groupe A est identifié dans la moitié des DHBN-FN. Malgré des données rétrospectives encourageantes dans les infections invasives à streptocoque du groupe A au sens large, le bénéfice de la clindamycine n’a cependant pas pu être confirmé dans les DHBN-FN. Devant un coût et une toxicité acceptables, la plupart des experts recommandent néanmoins son utilisation en traitement probabiliste.3 Le linézolide pourrait être une alternative, mais peu de données cliniques sont disponibles.14
Les indications des différentes molécules antibiotiques utilisées et leurs posologies sont résumées dans letableau .
Concernant la durée de l’antibiothérapie, les seules données disponibles suggèrent qu’un arrêt quarante-huit à soixante-douze heures après la dernière résection chirurgicale, moyennant une évolution clinique locale et systémique favorable, n’est pas inférieur à un traitement plus prolongé.15,16 La durée médiane d’antibiothérapie totale varie entre sept et quatorze jours.
Les dernières recommandations françaises, publiées en 2000 et proposant l’utilisation de l’association amoxicilline-clavulanate semblent caduques devant ces données microbiologiques récentes, hormis pour les formes cervico-faciales dont l’épidémiologie microbiologique est particulière (voir le Focus « Spécificités des atteintes cervico-faciales et abdominopérinéales »,
Il n’existe aucune donnée permettant de favoriser une molécule plutôt qu’une autre, mais l’antibiothérapie probabiliste doit comprendre au minimum une bêtalactamine intraveineuse à large spectre active sur les cocci à Gram positif, les bacilles à Gram négatif et les anaérobies, par exemple l’association pipéracilline-tazobactam.13
L’utilisation de carbapénèmes ou de glycopeptide est réservée aux patients ayant des facteurs de risque habituels d’acquisition de germes résistants (long séjour ou soins de suite, hémodialyse chronique, portage connu).3
L’adjonction de clindamycine est courante,11 fondée sur un mécanisme d’action par inhibition de la synthèse protéique avec un possible effet « antitoxinique » ; en effet, un streptocoque du groupe A est identifié dans la moitié des DHBN-FN. Malgré des données rétrospectives encourageantes dans les infections invasives à streptocoque du groupe A au sens large, le bénéfice de la clindamycine n’a cependant pas pu être confirmé dans les DHBN-FN. Devant un coût et une toxicité acceptables, la plupart des experts recommandent néanmoins son utilisation en traitement probabiliste.3 Le linézolide pourrait être une alternative, mais peu de données cliniques sont disponibles.14
Les indications des différentes molécules antibiotiques utilisées et leurs posologies sont résumées dans le
Concernant la durée de l’antibiothérapie, les seules données disponibles suggèrent qu’un arrêt quarante-huit à soixante-douze heures après la dernière résection chirurgicale, moyennant une évolution clinique locale et systémique favorable, n’est pas inférieur à un traitement plus prolongé.15,16 La durée médiane d’antibiothérapie totale varie entre sept et quatorze jours.
Mesures adjuvantes discutées au cas par cas
Des mesures dites « adjuvantes », faute de données robustes, peuvent être discutées au cas par cas dans la suite de la prise en charge.
L’administration d’immunoglobulines polyvalentes à visée antitoxinique semble avoir un effet bénéfique au cours du choc toxique streptococcique, mais il n’existe pas de confirmation de ce bénéfice au cours des DHBN-FN.17
De même, l’utilisation de l’oxygénothérapie hyperbare n’est pas systématiquement recommandée, et un transfert vers un centre en disposant ne doit certainement pas retarder le reste de la prise en charge.3
La moitié des patients nécessite une admission en réanimation, avec prise en charge des défaillances d’organes associées.18
Enfin, les larges débridements cutanés imposent des soins locaux par des équipes paramédicales entraînées, et impliquent fréquemment une greffe de peau à distance. L’utilisation des pansements en pression négative semble intéressante19 et est actuellement évaluée dans le cadre d’un programme hospitalier de recherche clinique (PHRC) national (NCT05071443).
L’administration d’immunoglobulines polyvalentes à visée antitoxinique semble avoir un effet bénéfique au cours du choc toxique streptococcique, mais il n’existe pas de confirmation de ce bénéfice au cours des DHBN-FN.17
De même, l’utilisation de l’oxygénothérapie hyperbare n’est pas systématiquement recommandée, et un transfert vers un centre en disposant ne doit certainement pas retarder le reste de la prise en charge.3
La moitié des patients nécessite une admission en réanimation, avec prise en charge des défaillances d’organes associées.18
Enfin, les larges débridements cutanés imposent des soins locaux par des équipes paramédicales entraînées, et impliquent fréquemment une greffe de peau à distance. L’utilisation des pansements en pression négative semble intéressante19 et est actuellement évaluée dans le cadre d’un programme hospitalier de recherche clinique (PHRC) national (NCT05071443).
Le transfert en centre expérimenté ne doit pas retarder la prise en charge
Pour les praticiens interrogés dans une enquête au sein de services de réanimation européens, les principaux éléments participant au retard de prise en charge étaient le retard diagnostique, le retard à la décision d’intervention chirurgicale et les difficultés d’accès au bloc opératoire.7 Cette enquête rapportait des différences entre les équipes déclarant prendre en charge plus ou moins de trois DHBN-FN par an. Ceci concernait notamment la disponibilité d’experts dermatologues, chirurgiens ou réanimateurs ainsi que du plateau technique. Plus encore, une étude observationnelle française suggère une mortalité plus faible dans ces centres dits à « haut volume ».6 Ces données sont à mettre en balance avec le risque de retard au premier geste chirurgical potentiellement associé à un transfert interhospitalier,8 mais les données les plus récentes sont rassurantes.6,20 Enfin, la mise en place de protocoles multidisciplinaires de prise en charge à l’échelle locale semble intéressante.18, 21
Suivi spécifique pour éviter les récidives
Le suivi des patients ayant souffert d’une DHBN-FN doit être spécifique. Un premier épisode de DHBN-FN est un facteur de risque de récidive,22 et les autres facteurs favorisants doivent être pris en charge, avec une vigilance particulière en cas de nouvelle infection cutanée. Concernant les infections à streptocoque du groupe A, les données manquent sur l’intérêt de l’éradication d’un éventuel portage ou d’une prophylaxie dans l’entourage, bien que celle-ci soit recommandée aux États-Unis et en Angleterre, et en France chez les sujets à risque d’infections invasives.23 Enfin, une amputation est nécessaire pour 15 % des patients ; la majorité nécessite une greffe de peau ; les séquelles physiques et psychologiques lourdes justifient un suivi adapté (voir l’article « Prévention des séquelles des infections cutanées graves, reconstruction et réhabilitation », p. 165 )...24
Prise en charge hospitalière fondée sur la chirurgie en urgence et l’antibiothérapie à large spectre
La prise en charge des DHBN-FN doit être hospitalière et multidisciplinaire. Elle repose sur deux piliers simples : une antibiothérapie à large spectre et un débridement chirurgical urgent des tissus nécrotiques. Le délai avant cette chirurgie est le principal facteur pronostique modifiable, et la mise en place de protocoles multidisciplinaires ou le transfert en centres expérimentés pourrait être bénéfique. Une réévaluation quotidienne et multidisciplinaire au lit du malade s’impose une fois le diagnostic évoqué, avec parfois une nouvelle exploration chirurgicale. Les séquelles physiques et psychologiques lourdes nécessitent un suivi adapté.
Références
1. Miller LG, Eisenberg DF, Liu H, Chang CL, Wang Y, Luthra R, et al. Incidence of skin and soft tissue infections in ambulatory and inpatient settings, 2005-2010. BMC Infect Dis 2015;15:362.
2. Cranendonk DR, van Vught LA, Wiewel MA, Cremer OL, Horn J, Bonten MJ, et al. Clinical characteristics and outcomes of patients with cellulitis requiring intensive care. JAMA Dermatol 2017;153(6):578-82.
3. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59(2):e10-52.
4. Hua C, Bosc R, Sbidian E, De Prost N, Hughes C, Jabre P, et al. Interventions for necrotizing soft tissue infections in adults. Cochrane Skin Group, editor. Cochrane Database Syst Rev 2018;5(5):CD011680.
5. Boyer A, Vargas F, Coste F, Saubusse E, Castaing Y, Gbikpi-Benissan G, et al. Influence of surgical treatment timing on mortality from necrotizing soft tissue infections requiring intensive care management. Intensive Care Med 2009;35(5):847-53.
6. Audureau E, Hua C, de Prost N, Hemery F, Decousser JW, Bosc R, et al. Mortality of necrotizing fasciitis: Relative influence of individual and hospital-level factors, a nationwide multilevel study, France, 2007-12. Br J Dermatol 2017;177(6):1575-82.
7. Henri Mondor Hospital Necrotizing Fasciitis Group, de Prost N, Sbidian E, Chosidow O, Brun-Buisson C, Amathieu R. Management of necrotizing soft tissue infections in the intensive care unit: Results of an international survey. Intensive Care Med 2015;41(8):1506-8.
8. Holena DN, Mills AM, Carr BG, Wirtalla C, Sarani B, Kim PK, et al. Transfer status: A risk factor for mortality in patients with necrotizing fasciitis. Surgery 2011;150(3):363-70.
9. Endorf FW, Klein MB, Mack CD, Jurkovich GJ, Rivara FP. Necrotizing soft-tissue infections: Differences in patients treated at burn centers and non-burn centers. J Burn Care Res 2008;29(6):933-8.
10. Howell EC, Keeley JA, Kaji AH, Deane MR, Kim DY, Putnam B, et al. Chance to cut: Defining a negative exploration rate in patients with suspected necrotizing soft tissue infection. Trauma Surg Acute Care Open 2019;4(1):e000264.
11. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241-51.
12. SPILF et SFD. Conférence de consensus. Érysipèle et fasciite nécrosante: prise en charge. Med Mal Inf 2000;30:241-5.
13. Urbina T, Razazi K, Ourghanlian C, Woerther PL, Chosidow O, Lepeule R, et al. Antibiotics in necrotizing soft tissue infections. Antibiotics (Basel) 2021;10(9):1104.
14. Cortés-Penfield N, Ryder JH. Should linezolid replace clindamycin as the adjunctive antimicrobial of choice in group a streptococcal necrotizing soft tissue infection and toxic shock syndrome? A focused debate. Clin Infect Dis 2022;ciac720.
15. Kenneally AM, Warriner Z, VanHoose JD, Ali D, McCleary EJ, Davenport DL, et al. Evaluation of antibiotic duration after surgical debridement of necrotizing soft tissue infection. Surg Infect (Larchmt) 2022;23(4):357-63.
16. Terzian WTH, Nunn AM, Call EB, Bliss SE, Swinarska JT, Rigdon J, et al. Duration of antibiotic therapy in necrotizing soft tissue infections: Shorter is safe. Surg Infect (Larchmt) 2022;23(5):430-5.
17. Madsen MB, Hjortrup PB, Hansen MB, Lange T, Norrby-Teglund A, Hyldegaard O, et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): A randomised, blinded, placebo-controlled trial. Intensive Care Med 2017;43(11):1585-93.
18. Urbina T, Hua C, Sbidian E, Bosc R, Tomberli F, Lepeule R, et al. Impact of a multidisciplinary care bundle for necrotizing skin and soft tissue infections: A retrospective cohort study. Ann Intensive Care 2019;9(1):123.
19. Huang WS, Hsieh SC, Hsieh CS, Schoung JY, Huang T. Use of vacuum-assisted wound closure to manage limb wounds in patients suffering from acute necrotizing fasciitis. Asian J Surg 2006;29(3):135-9.
20. Ingraham AM, Jung HS, Liepert AE, Warner-Hillard C, Greenberg CC, Scarborough JE. Effect of transfer status on outcomes for necrotizing soft tissue infections. J Surg Res 2017;220:372-8.
21. Gatti M, Gasparini LE, Laratta M, Sigurtà A, Rossi A, Brioschi P, et al. Intensive multidisciplinary management in critical care patients affected by severe necrotizing soft tissue infections: A cooperative method to improve the efficacy of treatment. Eur J Clin Microbiol Infect Dis 2019;38(6):1153-62.
22. Traineau H, Charpentier C, Lepeule R, Ingen-Housz-Oro S, Hersant B, Urbina T, de Prost N, Hua C, Chosidow O. First-year recurrence rate of skin and soft tissue infections following an initial necrotizing soft tissue infection of the lower extremities: a retrospective cohort study of 93 patients. J Am Acad Dermatol. 2023 Jan 23:S0190-9622(23)00088-9.
23. Conseil supérieur d’hygiène publique de France. Avis du 18 novembre 2005 relatif à la conduite à tenir autour d’un ou plusieurs cas, d’origine communautaire, d’infections invasives à Streptococcus pyogenes (ou streptocoques du groupe A).
24. Urbina T, Canoui-Poitrine F, Hua C, Layese R, Alves A, Ouedraogo R, et al. Long-term quality of life in necrotizing soft-tissue infection survivors: A monocentric prospective cohort study. Ann Intensive Care 2021;11(1):102.
25. Hua C, Urbina T, Bosc R, Parks T, Sriskandan S, de Prost N, et al. Necrotising soft-tissue infections. Lancet Infect Dis 2022;S1473-3099(22)00583-7.
2. Cranendonk DR, van Vught LA, Wiewel MA, Cremer OL, Horn J, Bonten MJ, et al. Clinical characteristics and outcomes of patients with cellulitis requiring intensive care. JAMA Dermatol 2017;153(6):578-82.
3. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59(2):e10-52.
4. Hua C, Bosc R, Sbidian E, De Prost N, Hughes C, Jabre P, et al. Interventions for necrotizing soft tissue infections in adults. Cochrane Skin Group, editor. Cochrane Database Syst Rev 2018;5(5):CD011680.
5. Boyer A, Vargas F, Coste F, Saubusse E, Castaing Y, Gbikpi-Benissan G, et al. Influence of surgical treatment timing on mortality from necrotizing soft tissue infections requiring intensive care management. Intensive Care Med 2009;35(5):847-53.
6. Audureau E, Hua C, de Prost N, Hemery F, Decousser JW, Bosc R, et al. Mortality of necrotizing fasciitis: Relative influence of individual and hospital-level factors, a nationwide multilevel study, France, 2007-12. Br J Dermatol 2017;177(6):1575-82.
7. Henri Mondor Hospital Necrotizing Fasciitis Group, de Prost N, Sbidian E, Chosidow O, Brun-Buisson C, Amathieu R. Management of necrotizing soft tissue infections in the intensive care unit: Results of an international survey. Intensive Care Med 2015;41(8):1506-8.
8. Holena DN, Mills AM, Carr BG, Wirtalla C, Sarani B, Kim PK, et al. Transfer status: A risk factor for mortality in patients with necrotizing fasciitis. Surgery 2011;150(3):363-70.
9. Endorf FW, Klein MB, Mack CD, Jurkovich GJ, Rivara FP. Necrotizing soft-tissue infections: Differences in patients treated at burn centers and non-burn centers. J Burn Care Res 2008;29(6):933-8.
10. Howell EC, Keeley JA, Kaji AH, Deane MR, Kim DY, Putnam B, et al. Chance to cut: Defining a negative exploration rate in patients with suspected necrotizing soft tissue infection. Trauma Surg Acute Care Open 2019;4(1):e000264.
11. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241-51.
12. SPILF et SFD. Conférence de consensus. Érysipèle et fasciite nécrosante: prise en charge. Med Mal Inf 2000;30:241-5.
13. Urbina T, Razazi K, Ourghanlian C, Woerther PL, Chosidow O, Lepeule R, et al. Antibiotics in necrotizing soft tissue infections. Antibiotics (Basel) 2021;10(9):1104.
14. Cortés-Penfield N, Ryder JH. Should linezolid replace clindamycin as the adjunctive antimicrobial of choice in group a streptococcal necrotizing soft tissue infection and toxic shock syndrome? A focused debate. Clin Infect Dis 2022;ciac720.
15. Kenneally AM, Warriner Z, VanHoose JD, Ali D, McCleary EJ, Davenport DL, et al. Evaluation of antibiotic duration after surgical debridement of necrotizing soft tissue infection. Surg Infect (Larchmt) 2022;23(4):357-63.
16. Terzian WTH, Nunn AM, Call EB, Bliss SE, Swinarska JT, Rigdon J, et al. Duration of antibiotic therapy in necrotizing soft tissue infections: Shorter is safe. Surg Infect (Larchmt) 2022;23(5):430-5.
17. Madsen MB, Hjortrup PB, Hansen MB, Lange T, Norrby-Teglund A, Hyldegaard O, et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): A randomised, blinded, placebo-controlled trial. Intensive Care Med 2017;43(11):1585-93.
18. Urbina T, Hua C, Sbidian E, Bosc R, Tomberli F, Lepeule R, et al. Impact of a multidisciplinary care bundle for necrotizing skin and soft tissue infections: A retrospective cohort study. Ann Intensive Care 2019;9(1):123.
19. Huang WS, Hsieh SC, Hsieh CS, Schoung JY, Huang T. Use of vacuum-assisted wound closure to manage limb wounds in patients suffering from acute necrotizing fasciitis. Asian J Surg 2006;29(3):135-9.
20. Ingraham AM, Jung HS, Liepert AE, Warner-Hillard C, Greenberg CC, Scarborough JE. Effect of transfer status on outcomes for necrotizing soft tissue infections. J Surg Res 2017;220:372-8.
21. Gatti M, Gasparini LE, Laratta M, Sigurtà A, Rossi A, Brioschi P, et al. Intensive multidisciplinary management in critical care patients affected by severe necrotizing soft tissue infections: A cooperative method to improve the efficacy of treatment. Eur J Clin Microbiol Infect Dis 2019;38(6):1153-62.
22. Traineau H, Charpentier C, Lepeule R, Ingen-Housz-Oro S, Hersant B, Urbina T, de Prost N, Hua C, Chosidow O. First-year recurrence rate of skin and soft tissue infections following an initial necrotizing soft tissue infection of the lower extremities: a retrospective cohort study of 93 patients. J Am Acad Dermatol. 2023 Jan 23:S0190-9622(23)00088-9.
23. Conseil supérieur d’hygiène publique de France. Avis du 18 novembre 2005 relatif à la conduite à tenir autour d’un ou plusieurs cas, d’origine communautaire, d’infections invasives à Streptococcus pyogenes (ou streptocoques du groupe A).
24. Urbina T, Canoui-Poitrine F, Hua C, Layese R, Alves A, Ouedraogo R, et al. Long-term quality of life in necrotizing soft-tissue infection survivors: A monocentric prospective cohort study. Ann Intensive Care 2021;11(1):102.
25. Hua C, Urbina T, Bosc R, Parks T, Sriskandan S, de Prost N, et al. Necrotising soft-tissue infections. Lancet Infect Dis 2022;S1473-3099(22)00583-7.
Dans cet article
- Chirurgie : diagnostique et thérapeutique
- Antibiothérapie probabiliste
- Mesures adjuvantes discutées au cas par cas
- Le transfert en centre expérimenté ne doit pas retarder la prise en charge
- Suivi spécifique pour éviter les récidives
- Prise en charge hospitalière fondée sur la chirurgie en urgence et l’antibiothérapie à large spectre