La fibrillation atriale (FA) s’accompagne d’une fréquence cardiaque irrégulière et dans la grande majorité des cas rapide. Cette tachycardie est symptomatique chez plus de 70 % des patients et est associée à un risque accru d’insuffisance cardiaque et de décès.1 Une prise en charge rythmologique est donc nécessaire afin d’améliorer les symptômes et le pronostic des patients. Elle peut s’envisager de deux façons distinctes :
– soit on décide de respecter la FA, et le traitement consiste alors à en contrôler la fréquence ventriculaire, c’est la stratégie de contrôle de la fréquence ;
– soit on décide de rétablir et de maintenir le rythme normal du cœur (rythme sinusal), c’est la stratégie de contrôle du rythme.
– soit on décide de respecter la FA, et le traitement consiste alors à en contrôler la fréquence ventriculaire, c’est la stratégie de contrôle de la fréquence ;
– soit on décide de rétablir et de maintenir le rythme normal du cœur (rythme sinusal), c’est la stratégie de contrôle du rythme.
Définitions
La FA paroxystique est une fibrillation se terminant spontanément en moins de 7 jours. On y inclut également les FA récentes réduites dans la première semaine.
La FA persistante est une fibrillation dont la durée est supérieure à 7 jours se régularisant spontanément ou après cardioversion. On parle de FA persistante de longue durée pour une durée supérieure à 1 an.
La FA permanente est celle que le médecin et le patient n’ont pas choisi de réduire. Le trouble du rythme est donc respecté.
Une cardiopathie est dite rythmique lorsque l’insuffisance cardiaque ou l’altération de la fraction d’éjection ventriculaire gauche (FEVG) a pour principale cause un trouble du rythme.
La FA persistante est une fibrillation dont la durée est supérieure à 7 jours se régularisant spontanément ou après cardioversion. On parle de FA persistante de longue durée pour une durée supérieure à 1 an.
La FA permanente est celle que le médecin et le patient n’ont pas choisi de réduire. Le trouble du rythme est donc respecté.
Une cardiopathie est dite rythmique lorsque l’insuffisance cardiaque ou l’altération de la fraction d’éjection ventriculaire gauche (FEVG) a pour principale cause un trouble du rythme.
Stratégie de contrôle de la fréquence
Elle concerne les patients en FA permanente et ceux en FA persistante en attente d’une cardioversion. Le principe d’une stratégie de contrôle de la fréquence cardiaque est de diminuer le nombre de dépolarisations atriales susceptibles de conduire aux ventricules via le nœud atrioventriculaire. Tous les médicaments dépresseurs de la conduction atrioventriculaire vont donc pouvoir être utilisés. L’objectif est d’obtenir une fréquence ventriculaire au repos inférieure à 110 batt/min. L’autre solution est d’interrompre radicalement la propagation de ces dépolarisations en réalisant une ablation par radiofréquence de la jonction atrioventriculaire, ce qui nécessite au préalable l’implantation d’un stimulateur cardiaque.
Stratégie médicamenteuse
Les différents traitements impliqués dans le contrôle de fréquence sont les bêtabloquants, les inhibiteurs calciques bradycardisants, la digoxine et l’amiodarone (tableau 1 ).
Les bêtabloquants bloquent l’activité sympathique via leur action sur les récepteurs b1. Ils sont contre-indiqués principalement en cas d’asthme et de bloc atrioventriculaire de haut grade. Ils sont prescrits en première intention.
Les inhibiteurs calciques bradycardisants (diltiazem et vérapamil) sont des antiarythmiques de classe IV de la classification de Vaughan Williams. Ils ralentissent la conduction dans le nœud atrioventriculaire par blocage des canaux calciques des cellules nodales. Ils sont une alternative en cas de contre-indication aux bêtabloquants.
La digoxine diminue la conduction nodale par effet parasympathique. Elle est peu utilisée et nécessite un dosage de la digoxinémie tous les 3 mois.
La cordarone, bien que plutôt utilisée pour maintenir le rythme sinusal, peut également être prescrite pour ralentir la conduction atrioventriculaire et est utile en cas d’insuffisance cardiaque. Les effets indésirables sont fréquents, et un contrôle de la thyréostimuline doit être réalisé tous les 6 mois.
Ces médicaments sont les mêmes qu’ils soient utilisés en phase aiguë ou au long cours. Ils peuvent être prescrits seuls ou en association (bêtabloquants-digoxine, inhibiteurs calciques-digoxine, bêtabloquants-cordarone). Les associations bêtabloquants-inhibiteurs calciques bradycardisants et cordarone-inhibiteurs calciques bradycardisants sont contre-indiquées. En cas d’insuffisance cardiaque aiguë, seules la cordarone et la digoxine sont recommandées. En cas d’altération de la FEVG inférieure à 40 % mais sans signe de décompensation aiguë, seuls la cordarone, la digoxine et certains bêtabloquants (carvédilol, bisoprolol, nébivolol, métoprolol débutés par leur plus petit dosage) peuvent être utilisés.
Les bêtabloquants bloquent l’activité sympathique via leur action sur les récepteurs b1. Ils sont contre-indiqués principalement en cas d’asthme et de bloc atrioventriculaire de haut grade. Ils sont prescrits en première intention.
Les inhibiteurs calciques bradycardisants (diltiazem et vérapamil) sont des antiarythmiques de classe IV de la classification de Vaughan Williams. Ils ralentissent la conduction dans le nœud atrioventriculaire par blocage des canaux calciques des cellules nodales. Ils sont une alternative en cas de contre-indication aux bêtabloquants.
La digoxine diminue la conduction nodale par effet parasympathique. Elle est peu utilisée et nécessite un dosage de la digoxinémie tous les 3 mois.
La cordarone, bien que plutôt utilisée pour maintenir le rythme sinusal, peut également être prescrite pour ralentir la conduction atrioventriculaire et est utile en cas d’insuffisance cardiaque. Les effets indésirables sont fréquents, et un contrôle de la thyréostimuline doit être réalisé tous les 6 mois.
Ces médicaments sont les mêmes qu’ils soient utilisés en phase aiguë ou au long cours. Ils peuvent être prescrits seuls ou en association (bêtabloquants-digoxine, inhibiteurs calciques-digoxine, bêtabloquants-cordarone). Les associations bêtabloquants-inhibiteurs calciques bradycardisants et cordarone-inhibiteurs calciques bradycardisants sont contre-indiquées. En cas d’insuffisance cardiaque aiguë, seules la cordarone et la digoxine sont recommandées. En cas d’altération de la FEVG inférieure à 40 % mais sans signe de décompensation aiguë, seuls la cordarone, la digoxine et certains bêtabloquants (carvédilol, bisoprolol, nébivolol, métoprolol débutés par leur plus petit dosage) peuvent être utilisés.
Stratégie ablative
Une solution plus radicale et définitive mais très efficace est d’implanter au patient un stimulateur cardiaque avec une ou deux sondes ventriculaires et de réaliser une ablation de la jonction atrioventriculaire. Le principal avantage est la maîtrise parfaite de la fréquence cardiaque alors imposée par le stimulateur cardiaque. Le principal inconvénient est la dépendance à ce stimulateur cardiaque, qui peut être problématique en cas d’infection imposant une extraction du matériel ou en cas de déplacement ou de dysfonctionnement de la sonde ventriculaire, et l’éventuelle évolution vers une insuffisance cardiaque (mauvaise tolérance de la stimulation monoventriculaire droite). Pour ces raisons, cette stratégie est plutôt envisagée en deuxième intention et chez des patients plus âgés.
Stratégie de contrôle du rythme
Le principe d’une stratégie de contrôle du rythme est de réaliser une cardioversion, qu’elle soit médicamenteuse ou électrique, puis de prévenir les récidives soit par un traitement médicamenteux, soit par une technique ablative.
Cardioversion de la FA
Elle consiste à restaurer le rythme sinusal soit par administration d’un traitement antiarythmique (flécaïnide, propafénone, amiodarone, ibutilide), soit le plus souvent en France par la réalisation d’un choc électrique externe, soit par la combinaison des deux. Une anticoagulation efficace doit avoir été menée 3 semaines auparavant, ou une imagerie cardiaque (échographie cardiaque transœsophagienne ou scanner cardiaque) doit avoir éliminé un thrombus dans les cavités cardiaques, dès lors que la FA dure depuis plus de 48 heures.
La réduction médicamenteuse (tableau 2 ) est possible par voie intraveineuse ou per os. La technique « pill in the pocket » consiste à prendre une dose de charge per os de flécaïnide ou propafénone pour réduire la FA. L’utilisation de l’amiodarone per os est communément admise en France. Le vernakalant (antiarythmique de classe III, intraveineux) est également indiqué dans la cardioversion médicamenteuse de la FA mais n’a pas obtenu l’autorisation de mise sur le marché (AMM) en France.
Le choc électrique externe est réalisé sous anesthésie générale, synchronisé à l’onde T (pour éviter tout risque proarythmique), en l’absence d’hypokaliémie et classiquement après arrêt de la digoxine depuis 48 heures. Son efficacité peut être renforcée par la prescription préalable d’un antiarythmique.
La réduction médicamenteuse (
Le choc électrique externe est réalisé sous anesthésie générale, synchronisé à l’onde T (pour éviter tout risque proarythmique), en l’absence d’hypokaliémie et classiquement après arrêt de la digoxine depuis 48 heures. Son efficacité peut être renforcée par la prescription préalable d’un antiarythmique.
Prévention des récidives de FA
Les médicaments antiarythmiques (tableau 3)
La flécaïnide et la propafénone sont des antiarythmiques de classe I qui agissent en bloquant les canaux sodiques entrants rapides. La propafénone a également une action bêtabloquante modérée. Le sotalol et l’amiodarone sont des antiarythmiques de classe III. Le sotalol a une action bêtabloquante et inhibe également certains canaux potassiques. L’amiodarone a une action sur plusieurs canaux simultanément et une action bêtabloquante. La dronédarone, prescrite dans certains pays, n’a plus d’AMM en France.Leur prescription s’envisage chez des patients avec une FA paroxystique, ou après cardioversion chez des patients avec une FA persistante. Les associations d’antiarythmiques sont contre-indiquées dans la FA. En revanche, l’association d’un bêtabloquant à la flécaïnide est conseillée (habitude typiquement française…) pour éviter une conduction atrioventriculaire rapide d’un flutter atrial en 1:1 au ventricule (du fait d’un cycle allongé par l’antiarythmique). L’éducation thérapeutique est essentielle pour éviter le mésusage de ces traitements.
Ablation de la FA
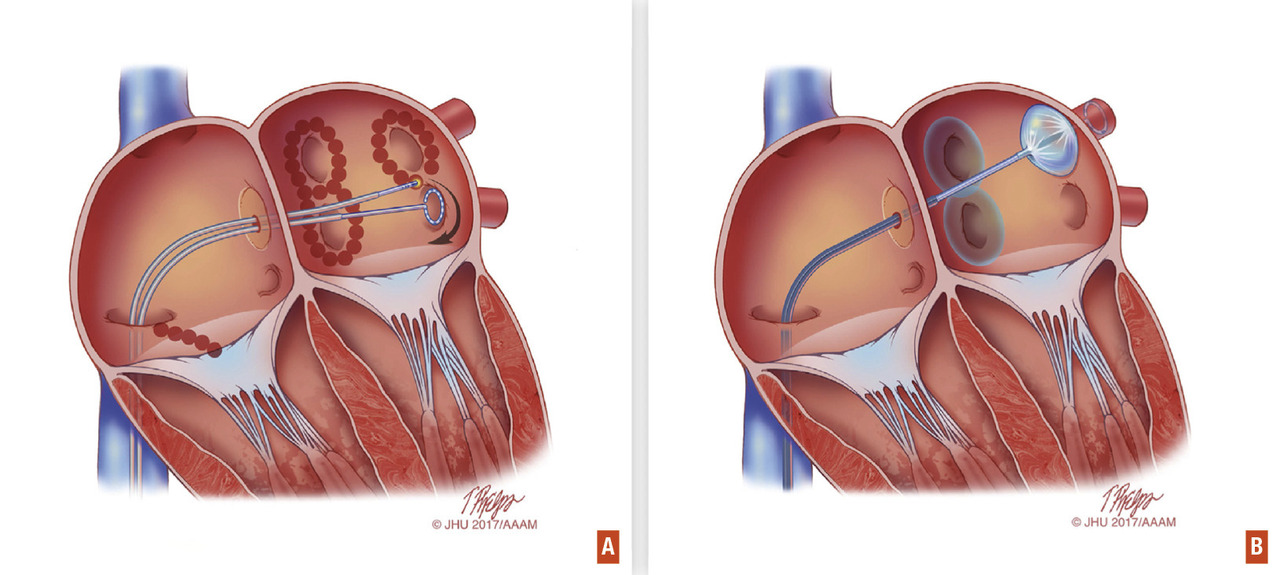
Il y a 20 ans, les travaux de nos collègues bordelais montraient l’existence de gâchettes électriques initiatrices dans les veines pulmonaires capables de déclencher la FA.4 Depuis, l’isolation des veines pulmonaires (via une ablation par cathéter de ce trouble du rythme) a pris un essor considérable. Cette croissance s’explique par la maturité qu’a désormais atteinte cette technique et sa supériorité par rapport aux traitements pharmacologiques pour maintenir le rythme sinusal à moyen et long terme.5Sur le plan technique, l’isolation des veines pulmonaires est la pierre angulaire de la procédure d’ablation, qu’elle soit paroxystique ou persistante.3 Après ponction veineuse fémorale, un cathéter est introduit dans l’oreillette gauche par ponction transeptale. Puis les connexions électriques entre les veines pulmonaires et l’oreillette gauche sont détruites par « brûlure ». L’ablation peut être réalisée par cryothérapie ou par radiofréquence (
Cette approche reste cependant centrée sur l’ablation des principaux foyers déclencheurs de la FA mais n’inclut pas l’ablation d’éventuels foyers extraveineux pulmonaires ni ceux du substrat atrial qui peut jouer un rôle dans le maintien de la FA. La nécessité de réaliser d’autres lésions en plus de l’isolation des veines pulmonaires fait actuellement toujours débat. Le taux de succès à un an de l’ablation de la FA est évalué entre 66 et 90 % dans la FA paroxystique, à 70 % dans la FA persistante et n’excède pas 50 % dans la FA persistante de longue durée.8 Il est d’autant plus important que la FA est récente et que le patient est jeune.
Il est parfois nécessaire de réaliser plusieurs procédures pour obtenir un résultat satisfaisant. Les principales complications, dont la fréquence n’excède pas 3 %, sont les problèmes liés à la ponction fémorale, l’accident vasculaire cérébral (AVC), la tamponnade et la fistule atrio-œsophagienne. Bien que plus invasive, l’ablation de la fibrillation peut également être réalisée chirurgicalement, notamment en cas d’indication concomitante de chirurgie cardiaque (pontage ou remplacement valvulaire). Ces ablations chirurgicales, qui consistaient initialement à cloisonner empiriquement les oreillettes, s’inspirent désormais beaucoup plus des ablations endocavitaires.
L’ablation de la FA permet indiscutablement d’améliorer la qualité de vie des patients. Concernant l’impact sur la survie, l’étude CABANA,9 publiée récemment, a échoué à démontrer un effet significatif de l’ablation de la FA par rapport à un traitement médical sur le critère de jugement principal incluant mortalité, AVC invalidants, hémorragies graves ou arrêts cardiaques après 5 ans de suivi. Cependant, l’étude a été réalisée en intention de traiter et devant des taux de cross over importants entre les deux groupes, les investigateurs mettent en avant l’analyse en fonction du traitement effectivement reçu, où une réduction de 33 % du critère de jugement principal est alors observée.
Les recommandations européennes de 20203 préconisent la réalisation d’une ablation de la FA en cas de fibrillation symptomatique et récidivante sous traitement antiarythmique (classe I, niveau de preuve A) ou en alternative au traitement pharmacologique en cas de fibrillation paroxystique symptomatique après évaluation de la balance bénéfices-risques (classe IIa-B). Elles donnent une indication de classe I-B en cas de fibrillation persistante compliquée de cardiopathie rythmique, et IIa-B en cas d’insuffisance cardiaque ou d’altération de la FEVG.
Quelle stratégie privilégier : contrôle du rythme ou de la fréquence ?
En phase aiguë
En dehors d’une situation de défaillance hémodynamique où une cardioversion est réalisée en urgence, la stratégie de contrôle de fréquence est celle la plus communément adoptée en phase aiguë car la plus simple et la plus sûre à mettre en œuvre. La plus simple car elle ne nécessite pas d’avoir vérifié la bonne observance du traitement anticoagulant les trois semaines précédentes ni d’avoir réalisé une imagerie cardiaque. La plus sûre par rapport à une stratégie de contrôle du rythme car le maniement des traitements antiarythmiques est plus délicat en phase aiguë. De plus, il est admis que 60 à 70 % des FA récentes vont se réduire spontanément, et une stratégie d’attente, à savoir de contrôle de fréquence en attendant la régularisation, est légitime.
Stratégie à long terme
Jusqu’à la fin des années 1990, l’attitude classique était d’utiliser des médicaments antiarythmiques pour réduire la FA et maintenir le rythme sinusal aussi longtemps que possible, et de choisir de ralentir la fibrillation permanente lorsque celle-ci était trop évoluée. Cependant, la reconnaissance au cours des années 1990 du risque lié aux médicaments antiarythmiques et notamment de leurs effets proarythmiques a rendu progressivement cette question du choix de la bonne stratégie inéluctable. Plusieurs études cliniques ont alors été menées pour savoir laquelle de ces deux stratégies serait la plus bénéfique aux patients. La question a été tranchée par l’étude AFFIRM10, puis par quatre autres études très voisines effectuées de façon presque simultanée. Ces cinq études ont ainsi pu être regroupées lors de méta-analyses,11 et ont conclu, sur un total de 5 239 patients, à une équivalence des deux stratégies en termes de morbi-mortalité. Cependant, à la fin du suivi de ces études, 10 et 35 % des patients du groupe « ralentir » bénéficiaient toujours du rythme sinusal, contre seulement 38 à 63 % des patients du groupe « réduire », traduisant l’inefficacité des médicaments antiarythmiques. De plus, l’existence d’un rythme sinusal était indiscutablement un facteur de bon pronostic, alors que l’existence d’un traitement anti- arythmique était au contraire un facteur de mauvais pronostic. Ce résultat paradoxal faisait penser que « rien ne vaut le rythme sinusal », mais sans les médicaments antiarythmiques. Ce constat devrait donc théoriquement être favorable aux techniques d’ablation en termes de survie, même si les preuves formelles manquent encore.
La décision finale quant à la meilleure stratégie sera donc adoptée au cas par cas en tenant compte des symptômes et de l’âge du patient, de l’existence d’une cardiomyopathie et de la tolérance au traitement.
Chez l’insuffisant cardiaque
Dans la FA persistante avec insuffisance cardiaque ou cardiomyopathie, une stratégie de cardioversion est privilégiée dans un premier temps pour éviter toute dégradation de l’état hémodynamique des patients. Pour prévenir les récidives, l’amiodarone est le seul traitement antiarythmique utilisable. L’alternative est, là aussi, l’ablation de la FA, dont l’efficacité était supérieure à l’amiodarone dans l’étude AATAC.12 L’étude AF-CHF13 n’avait en 2008 pas montré de supériorité d’une stratégie médicamenteuse de contrôle du rythme chez les patients insuffisants cardiaques en FA par rapport à une stratégie de contrôle de fréquence en termes de survenue de décès de cause cardiovasculaire. Une des principales limites de cette étude est que les patients avec une cardiopathie rythmique étaient exclus bien qu’étant les plus à même de bénéficier d’une stratégie de contrôle du rythme. Or plus la FA est causale dans la genèse de l’insuffisance cardiaque (typiquement la cardiomyopathie rythmique), plus la stratégie du contrôle du rythme sera bénéfique.14 Les résultats récents de l’étude CASTLE-AF15 ont montré la supériorité d’une stratégie ablative par rapport à un traitement conventionnel en termes de mortalité totale et d’hospitalisation pour insuffisance cardiaque dans cette population d’insuffisants cardiaques. L’étude CAMERA-MRI16 a montré la supériorité, en termes de récupération de la FEVG, d’une ablation de la FA par rapport à un traitement médical chez des patients ayant une cardiopathie rythmique.La décision finale quant à la meilleure stratégie sera donc adoptée au cas par cas en tenant compte des symptômes et de l’âge du patient, de l’existence d’une cardiomyopathie et de la tolérance au traitement.
Tenir compte des symptômes
Une stratégie de contrôle du rythme doit être envisagée chez les patients en FA dès lors qu’ils sont symptomatiques car ils bénéficient le plus d’un maintien en rythme sinusal, ainsi que chez les insuffisants cardiaques afin d’éviter l’aggravation de leur cardiopathie, surtout lorsqu’il s’agit d’une cardiomyopathie rythmique. La stratégie ablative est la plus efficace pour permettre le maintien en rythme sinusal, mais son bénéfice sur la survie reste à démontrer. Chez les patients asymptomatiques, une stratégie de contrôle de fréquence est privilégiée. Toutefois, une stratégie initiale (lors du 1er épisode) de retour en rythme sinusal est conseillée car elle permet de faire la part des symptômes revenant à la FA, ce qui est parfois délicat à apprécier avant la régularisation, chez des patients ayant adapté leur rythme de vie à leur arythmie.
Références
1. Stewart S, Hart CL, Hole DJ, Mc Murray JJV. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002;113: 359-64.
2. Van Gelder IC, Rienstra M, Harry, Crijns HJGM, et al. Rate control in atrial fibrillation. Lancet 2016; 388:818-28.
3. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020 Aug 29:ehaa612. doi: 10.1093/eurheartj/ehaa612.
4. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66.
5. Calkins H, Reynolds MR, Spector P, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009;2:349-61.
6. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2018;20:157-208.
7. Kuck KH, Brugada J, Fürnkranz A, et al. Cryoballoon or radiofrequency ablation for paroxysmal atrial fibrillation. N Engl J Med 2016;374:2235-45.
8. Ha ACT, Wijeysundera HA, Birnie DH, Verma A. Real-world outcomes, complications, and cost of catheter-based ablation for atrial fibrillation: an update. Curr Opin Cardiol 2017;32:47-52.
9. Packer DL, Mark DB, Robb RA, et al. Effect of catheter ablation vs antiarrhythmic drug therapy on mortality, stroke, bleeding, and cardiac arrest among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA 2019;321:1261-74.
10. Wyse DG, Waldo AL, DiMarco JP, et al. The atrial fibrillation follow-up investigation of rhythm management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:1825-33.
11. De Denus S, Sanoski CA, Carlsson J, et al. Rate vs rhythm control in patients with atrial fibrillation. A meta-analysis. Arch Intern Med 2005;165:258-62.
12. Di Biase L, Mohanty P, Mohanty S, et al. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC multicenter randomized trial . Circulation 2016;133:1637-44.
13. Roy D, Talajic M, Nattel S, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008;358:2667-77.
14. Marijon E, Le Heuzey JY, Connolly S, et al.; RE-LY investigators. Causes of death and influencing factors in patients with atrial fibrillation: a competing-risk analysis from the randomized evaluation of long-term anticoagulant therapy study. Circulation 2013;128:2192-201.
15. Marrouche NF, Brachmann J, Andresen D, et al. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018;378:417-27.
16. Prabhu S, Taylor AJ, Costello BT, et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction. J Am Coll Cardiol 2017;70:1949-61.
2. Van Gelder IC, Rienstra M, Harry, Crijns HJGM, et al. Rate control in atrial fibrillation. Lancet 2016; 388:818-28.
3. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020 Aug 29:ehaa612. doi: 10.1093/eurheartj/ehaa612.
4. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66.
5. Calkins H, Reynolds MR, Spector P, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009;2:349-61.
6. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2018;20:157-208.
7. Kuck KH, Brugada J, Fürnkranz A, et al. Cryoballoon or radiofrequency ablation for paroxysmal atrial fibrillation. N Engl J Med 2016;374:2235-45.
8. Ha ACT, Wijeysundera HA, Birnie DH, Verma A. Real-world outcomes, complications, and cost of catheter-based ablation for atrial fibrillation: an update. Curr Opin Cardiol 2017;32:47-52.
9. Packer DL, Mark DB, Robb RA, et al. Effect of catheter ablation vs antiarrhythmic drug therapy on mortality, stroke, bleeding, and cardiac arrest among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA 2019;321:1261-74.
10. Wyse DG, Waldo AL, DiMarco JP, et al. The atrial fibrillation follow-up investigation of rhythm management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:1825-33.
11. De Denus S, Sanoski CA, Carlsson J, et al. Rate vs rhythm control in patients with atrial fibrillation. A meta-analysis. Arch Intern Med 2005;165:258-62.
12. Di Biase L, Mohanty P, Mohanty S, et al. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC multicenter randomized trial . Circulation 2016;133:1637-44.
13. Roy D, Talajic M, Nattel S, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008;358:2667-77.
14. Marijon E, Le Heuzey JY, Connolly S, et al.; RE-LY investigators. Causes of death and influencing factors in patients with atrial fibrillation: a competing-risk analysis from the randomized evaluation of long-term anticoagulant therapy study. Circulation 2013;128:2192-201.
15. Marrouche NF, Brachmann J, Andresen D, et al. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018;378:417-27.
16. Prabhu S, Taylor AJ, Costello BT, et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction. J Am Coll Cardiol 2017;70:1949-61.