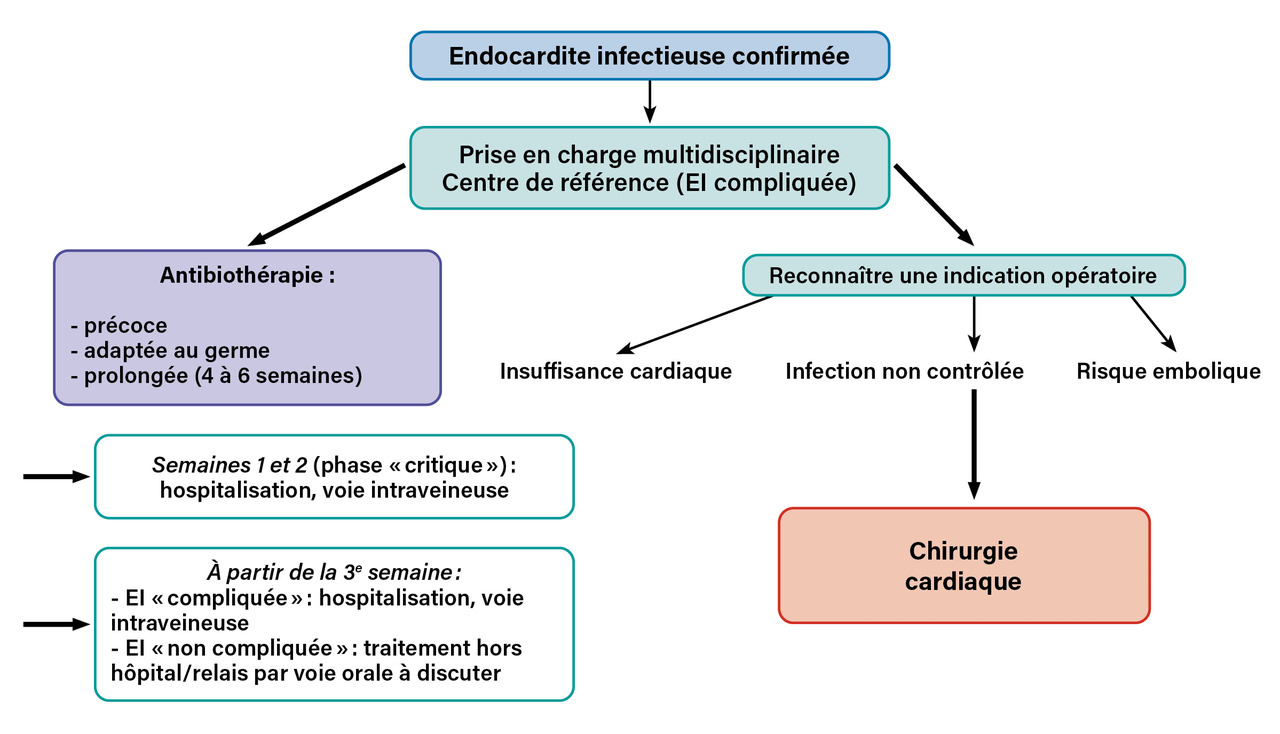
Le traitement de l’endocardite infectieuse (EI) repose sur deux thérapeutiques essentielles : l’antibiothérapie adaptée au germe responsable de l’EI et, lorsqu’elle est indiquée, la réalisation d’une chirurgie cardiaque (figure ). La prise en charge des patients par une équipe multidisciplinaire est recommandée depuis plusieurs années. Cette équipe doit intégrer des cardiologues, des infectiologues, des chirurgiens cardiaques, des anesthésistes, des médecins nucléaires et, lorsque cela est nécessaire, des neurologues, neurochirurgiens, neuroradiologues interventionnels. Ce travail collaboratif est le plus souvent possible au sein des centres de référence dans la prise en charge de cette pathologie. Les recommandations de l’European Society of Cardiology (ESC), publiées en 2023,1 suggèrent que tout patient présentant une EI « compliquée » devrait être traité au sein de ces centres de référence. Pour les autres patients, un avis auprès de ces centres est souhaitable.
Antibiothérapie adaptée : traitement clé pour l’éradication du germe responsable
Le traitement antibiotique a pour but d’éradiquer le germe en cause et doit être débuté rapidement, dès confirmation diagnostique ou en cas de suspicion diagnostique forte. Il repose sur l’emploi de traitements bactéricides pendant une durée prolongée (quatre à six semaines le plus souvent). Ce traitement de longue durée a pour objectif principal d’éviter les rechutes, en partie expliquées par un mécanisme de tolérance des bactéries aux antibiotiques. La stérilisation des tissus valvulaires cardiaques, et plus particulièrement du matériel prothétique intracardiaque, est ainsi difficile mais indispensable à la guérison de la maladie. Le premier jour de traitement correspond au début de l’antibiothérapie efficace contre le germe responsable et de la négativation des hémocultures. En cas de chirurgie cardiaque, le traitement antibiotique est poursuivi sans modification. Lorsque les cultures de la valve se révèlent positives, un nouveau cycle de traitement doit alors débuter.
Les recommandations de l’ESC1 pour l’antibiothérapie en fonction de chaque germe ont été mises à jour en 2023 (tableau 1 ).
Les recommandations de l’ESC1 pour l’antibiothérapie en fonction de chaque germe ont été mises à jour en 2023 (
Traitement probabiliste et cas des EI à hémocultures négatives
Deux situations sont à différencier (tableau 2 ) :
– les infections communautaires sur valves natives ou infections tardives sur prothèses pour lesquelles l’antibiothérapie doit couvrir les staphylocoques, les streptocoques et les entérocoques ;
– les infections associées aux soins ou infections précoces sur prothèses où l’antibiothérapie doit être efficace contre les staphylocoques résistants à la méticilline, les entérocoques et les bacilles à Gram négatif non HACEK (Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae). Dans les cas où les hémocultures restent négatives et en l’absence d’amélioration clinique, les autres causes d’endocardite infectieuse à hémocultures négatives (EIHN) sont à considérer et le traitement antibiotique doit être adapté.
– les infections communautaires sur valves natives ou infections tardives sur prothèses pour lesquelles l’antibiothérapie doit couvrir les staphylocoques, les streptocoques et les entérocoques ;
– les infections associées aux soins ou infections précoces sur prothèses où l’antibiothérapie doit être efficace contre les staphylocoques résistants à la méticilline, les entérocoques et les bacilles à Gram négatif non HACEK (Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae). Dans les cas où les hémocultures restent négatives et en l’absence d’amélioration clinique, les autres causes d’endocardite infectieuse à hémocultures négatives (EIHN) sont à considérer et le traitement antibiotique doit être adapté.
Quelques cas spécifiques
• Le traitement optimal des EI à staphylocoques reste encore débattu. Des alternatives aux traitements de référence sont disponibles, notamment dans les infections à staphylocoques résistants à la méticilline, pour lesquels la daptomycine en combinaison avec une autre molécule a montré son efficacité, notamment pour les souches hautement résistantes à la vancomycine.2
• Dans les infections à bactéries à Gram négatif du groupe HACEK, le traitement de référence est la ceftriaxone pour une durée de quatre semaines sur valves natives et six semaines sur valves prothétiques.
• Un avis d’expert en infectiologie est nécessaire pour le traitement des EIHN liées à Brucella, Coxiella burnetii, Bartonella, Legionella, Mycoplasma, Tropheryma whipplei. Le traitement antibiotique adapté doit être parfois poursuivi pendant plusieurs mois, sous surveillance régulière.
• En cas d’infection fongique (mortalité supérieure à 50 %), le traitement de référence est l’amphotéricine B liposomale pour les EI à Candida et le voriconazole pour les EI à Aspergillus. Un traitement oral prolongé est souvent nécessaire par la suite.
• Dans les infections à bactéries à Gram négatif du groupe HACEK, le traitement de référence est la ceftriaxone pour une durée de quatre semaines sur valves natives et six semaines sur valves prothétiques.
• Un avis d’expert en infectiologie est nécessaire pour le traitement des EIHN liées à Brucella, Coxiella burnetii, Bartonella, Legionella, Mycoplasma, Tropheryma whipplei. Le traitement antibiotique adapté doit être parfois poursuivi pendant plusieurs mois, sous surveillance régulière.
• En cas d’infection fongique (mortalité supérieure à 50 %), le traitement de référence est l’amphotéricine B liposomale pour les EI à Candida et le voriconazole pour les EI à Aspergillus. Un traitement oral prolongé est souvent nécessaire par la suite.
Antibiothérapie parentérale ambulatoire
La durée prolongée de l’antibiothérapie par voie intraveineuse nécessitait historiquement de longues hospitalisations (plusieurs semaines). Depuis plusieurs années, la poursuite du traitement en dehors de l’hôpital a permis de raccourcir les durées d’hospitalisation mais nécessite une sélection rigoureuse des patients éligibles. Le traitement d’une EI peut être divisé en deux parties : les deux premières semaines pendant lesquelles survient la majorité des complications ; et une deuxième phase durant laquelle la poursuite du traitement en dehors de l’hôpital est envisageable. Ce traitement peut alors être réalisé à domicile, le plus souvent en « hospitalisation à domicile » ou en centre de convalescence. Des critères initialement restrictifs (absence d’insuffisance cardiaque, de signes neurologiques, d’insuffisance rénale, de complications périvalvulaires en échographie) ont été proposés par certains auteurs3 et repris en partie dans les recommandations européennes de 2015. D’autres études plus récentes4 proposent des critères moins sévères, sans augmentation significative de la mortalité des patients.
Le traitement ambulatoire nécessite néanmoins toujours une éducation des professionnels de santé et du patient et une réévaluation fréquente (infirmier une fois par jour, médecin une ou deux fois par semaine).
Le traitement ambulatoire nécessite néanmoins toujours une éducation des professionnels de santé et du patient et une réévaluation fréquente (infirmier une fois par jour, médecin une ou deux fois par semaine).
Place de la voie orale pour le traitement antibiotique
Une étude randomisée5 a montré la non-infériorité d’un traitement antibiotique en partie par voie orale par rapport à un traitement conventionnel intraveineux, sur un critère de jugement composite comprenant la mortalité toutes causes confondues, une chirurgie cardiaque non planifiée, les événements emboliques ou la récidive de bactériémie au germe en cause, à six mois de la fin de l’antibiothérapie. Les patients randomisés présentaient une EI à streptocoque, Enterococcus faecalis, Staphylococcus aureus ou à staphylocoque à coagulase négative, et étaient dits stables (réponse clinique satisfaisante à un traitement antibiotique intraveineux d’au moins dix jours, absence de signes d’abcès ou d’atteinte valvulaire nécessitant une chirurgie au moment de la randomisation).
Traitement antibiotique en deux étapes
Les recommandations européennes de 20231 mettent en avant les deux phases du traitement antibiotique :
– phase « critique » (les deux premières semaines) durant laquelle un traitement antibiotique intraveineux bactéricide est introduit et doit être associé aux autres mesures (chirurgie, extraction de matériel, drainage des abcès périphériques) ;
– phase de consolidation (après la deuxième semaine) durant laquelle un traitement intraveineux ambulatoire ou un relais per os peut être envisagé dans les cas d’EI non compliquées (poursuite en intraveineux en hospitalisation dans les autres cas). La poursuite du traitement per os ne peut s’envisager que dans les EI à S. aureus, streptocoques, staphylocoques à coagulase négative et E. faecalis, lorsque l’infection est contrôlée (au moins dix jours d’antibiotiques intraveineux et plus de sept jours après une chirurgie cardiaque, avec un contrôle satisfaisant du syndrome inflammatoire biologique).
Dans tous les cas, une échographie transœsophagienne de réévaluation doit être réalisée avant d’envisager un traitement ambulatoire ou un relais per os afin de s’assurer de l’absence d’évolution péjorative.
– phase « critique » (les deux premières semaines) durant laquelle un traitement antibiotique intraveineux bactéricide est introduit et doit être associé aux autres mesures (chirurgie, extraction de matériel, drainage des abcès périphériques) ;
– phase de consolidation (après la deuxième semaine) durant laquelle un traitement intraveineux ambulatoire ou un relais per os peut être envisagé dans les cas d’EI non compliquées (poursuite en intraveineux en hospitalisation dans les autres cas). La poursuite du traitement per os ne peut s’envisager que dans les EI à S. aureus, streptocoques, staphylocoques à coagulase négative et E. faecalis, lorsque l’infection est contrôlée (au moins dix jours d’antibiotiques intraveineux et plus de sept jours après une chirurgie cardiaque, avec un contrôle satisfaisant du syndrome inflammatoire biologique).
Dans tous les cas, une échographie transœsophagienne de réévaluation doit être réalisée avant d’envisager un traitement ambulatoire ou un relais per os afin de s’assurer de l’absence d’évolution péjorative.
Traitement chirurgical pour la moitié des patients
La chirurgie cardiaque est le second élément clé de la prise en charge thérapeutique des EI. Elle concerne 50 à 60 % des patients. Les principaux objectifs du traitement chirurgical sont de réaliser à la fois une exérèse complète des tissus infectés et une restauration de l’intégrité des tissus cardiaques et de la fonction des valves cardiaques.
En parallèle, l’éradication de tout foyer infectieux extracardiaque responsable de l’EI doit être réalisée avant la chirurgie cardiaque, lorsque celle-ci n’est pas urgente, sinon avant la fin du traitement antibiotique.
En parallèle, l’éradication de tout foyer infectieux extracardiaque responsable de l’EI doit être réalisée avant la chirurgie cardiaque, lorsque celle-ci n’est pas urgente, sinon avant la fin du traitement antibiotique.
Évaluation du risque opératoire
La réalisation d’une chirurgie cardiaque dans un contexte d’EI, en particulier pendant la phase active de la maladie, a des spécificités par rapport aux chirurgies cardiaques programmées. Néanmoins, peu d’études se sont intéressées au risque opératoire dans ce contexte particulier d’EI. Des scores de risque non spécifiques tels que l’EuroSCORE II6 restent fréquemment utilisés. Certains scores de risque spécifiques de l’EI ont été proposés, la majorité élaborée à partir de cohortes de petite taille.7,8 Il n’existe donc actuellement pas de score de risque faisant référence, mais l’évaluation du risque opératoire reste primordiale, en prenant en compte l’état clinique du patient, ses comorbidités et le type de chirurgie. Les derniers registres, comme EURO-ENDO,9 montrent qu’une partie non négligeable des patients avec une indication chirurgicale théorique ne sont finalement pas opérés, en partie en raison d’une estimation d’un risque opératoire trop important. Cependant, ces études mettent en avant que ce groupe de patients avec indication chirurgicale théorique et non opérés a une mortalité supérieure à celle des autres patients.
Concernant les patients les plus âgés (plus de 80 ans), la mortalité opératoire n’est pas supérieure à celle des patients plus jeunes. En revanche, dans cette population, moins de patients présentent une indication chirurgicale, et davantage de patients avec indication opératoire ne sont pas opérés. Il est ainsi important, dans cette tranche d’âge, de bien reconnaître les indications chirurgicales.
Concernant les patients les plus âgés (plus de 80 ans), la mortalité opératoire n’est pas supérieure à celle des patients plus jeunes. En revanche, dans cette population, moins de patients présentent une indication chirurgicale, et davantage de patients avec indication opératoire ne sont pas opérés. Il est ainsi important, dans cette tranche d’âge, de bien reconnaître les indications chirurgicales.
Savoir reconnaître les indications chirurgicales
Trois types d’indication opératoire sont actuellement reconnus dans la prise en charge des EI (tableau 3 ) :
– l’insuffisance cardiaque (indication chirurgicale la plus fréquente) ;
– les infections non contrôlées ;
– la prévention du risque embolique.
Les recommandations européennes1 orientent vers une prise en charge chirurgicale rapide des patients, la plupart du temps dans les jours qui suivent l’indication opératoire. Le délai optimal de la prise en charge chirurgicale des patients reste néanmoins incertain. En effet, retarder la chirurgie peut permettre un meilleur contrôle sur le plan infectieux avec une durée de l’antibiothérapie prolongée avant la chirurgie, mais, a contrario, expose au risque de progression de la maladie, avec des dégâts valvulaires plus importants, la formation d’abcès et des embolies. Une étude randomisée10 a comparé chirurgie précoce (dans les quarante-huit heures après randomisation) versus prise en charge conventionnelle. La chirurgie précoce était associée à une diminution du critère composite décès intrahospitalier et embolie. Cependant, la population de l’étude était jeune avec peu de comorbidités. L’applicabilité des résultats à une population plus âgée reste donc incertaine.
– l’insuffisance cardiaque (indication chirurgicale la plus fréquente) ;
– les infections non contrôlées ;
– la prévention du risque embolique.
Les recommandations européennes1 orientent vers une prise en charge chirurgicale rapide des patients, la plupart du temps dans les jours qui suivent l’indication opératoire. Le délai optimal de la prise en charge chirurgicale des patients reste néanmoins incertain. En effet, retarder la chirurgie peut permettre un meilleur contrôle sur le plan infectieux avec une durée de l’antibiothérapie prolongée avant la chirurgie, mais, a contrario, expose au risque de progression de la maladie, avec des dégâts valvulaires plus importants, la formation d’abcès et des embolies. Une étude randomisée10 a comparé chirurgie précoce (dans les quarante-huit heures après randomisation) versus prise en charge conventionnelle. La chirurgie précoce était associée à une diminution du critère composite décès intrahospitalier et embolie. Cependant, la population de l’étude était jeune avec peu de comorbidités. L’applicabilité des résultats à une population plus âgée reste donc incertaine.
Quelle technique chirurgicale ?
Concernant les atteintes valvulaires, toutes les techniques de plastie ou remplacement valvulaire peuvent être utilisées. La réparation valvulaire est néanmoins privilégiée, en particulier dans l’atteinte des valves mitrale et tricuspide lorsque celle-ci n’est pas trop étendue.
Des techniques telles que l’utilisation de patchs péricardiques ou de néocordages permettent de prendre en charge des perforations valvulaires ou des ruptures de cordage. En cas de remplacement valvulaire, les recommandations européennes1 ne privilégient pas un type de prothèse par rapport à un autre. Toutefois, l’utilisation de prothèses mécaniques imposant une anticoagulation curative expose les patients au risque de saignements, notamment intracrâniens, fréquents dans les EI. En cas d’atteinte plus étendue (abcès notamment), l’exérèse complète des tissus infectés est la règle et peut nécessiter, par la suite, l’utilisation de techniques de réparation annulaire en plus du remplacement valvulaire afin d’éviter l’apparition de fuites paraprothétiques.
Dans les atteintes aortiques, le remplacement valvulaire par prothèse reste la technique la plus utilisée. Une plastie aortique peut être réalisée dans certains cas au sein des centres ayant une grande expertise de ce geste chirurgical. En cas d’atteinte annulaire et notamment d’abcès, l’utilisation d’homogreffes est à envisager, en particulier afin de diminuer le risque d’infection persistante ou récidivante.
En cas d’atteinte mitrale, une plastie peut être réalisée tant que les dégâts valvulaires ne sont pas trop importants. Des taux de plastie mitrale jusqu’à 80 % peuvent être atteints par des équipes expertes dans ce type de chirurgie.11
En cas de nécessité d’implantation d’un stimulateur cardiaque (bloc atrioventriculaire complet, par exemple), la mise en place d’un pacemaker par voie épicardique au cours de la chirurgie cardiaque est privilégiée, afin d’éviter le risque d’infection de matériel en cas d’implantation endocavitaire.
Des techniques telles que l’utilisation de patchs péricardiques ou de néocordages permettent de prendre en charge des perforations valvulaires ou des ruptures de cordage. En cas de remplacement valvulaire, les recommandations européennes1 ne privilégient pas un type de prothèse par rapport à un autre. Toutefois, l’utilisation de prothèses mécaniques imposant une anticoagulation curative expose les patients au risque de saignements, notamment intracrâniens, fréquents dans les EI. En cas d’atteinte plus étendue (abcès notamment), l’exérèse complète des tissus infectés est la règle et peut nécessiter, par la suite, l’utilisation de techniques de réparation annulaire en plus du remplacement valvulaire afin d’éviter l’apparition de fuites paraprothétiques.
Dans les atteintes aortiques, le remplacement valvulaire par prothèse reste la technique la plus utilisée. Une plastie aortique peut être réalisée dans certains cas au sein des centres ayant une grande expertise de ce geste chirurgical. En cas d’atteinte annulaire et notamment d’abcès, l’utilisation d’homogreffes est à envisager, en particulier afin de diminuer le risque d’infection persistante ou récidivante.
En cas d’atteinte mitrale, une plastie peut être réalisée tant que les dégâts valvulaires ne sont pas trop importants. Des taux de plastie mitrale jusqu’à 80 % peuvent être atteints par des équipes expertes dans ce type de chirurgie.11
En cas de nécessité d’implantation d’un stimulateur cardiaque (bloc atrioventriculaire complet, par exemple), la mise en place d’un pacemaker par voie épicardique au cours de la chirurgie cardiaque est privilégiée, afin d’éviter le risque d’infection de matériel en cas d’implantation endocavitaire.
Cas particuliers
EI sur prothèses valvulaires
Une prise en charge agressive est indiquée en cas d’EI à Staphylococcus sur prothèse valvulaire ou lorsqu’il existe une complication (insuffisance cardiaque, dysfonction valvulaire sévère, abcès, fièvre persistante), consistant en une antibiothérapie adaptée et une prise en charge chirurgicale précoce.
La chirurgie valvulaire dans les atteintes prothétiques consiste en une exérèse complète des tissus infectés, y compris de la prothèse valvulaire, et à son remplacement par une nouvelle prothèse, homogreffe ou autogreffe.
À l’inverse, dans les cas d’EI sur prothèse qui ne sont pas liées à une infection à Staphylococcus ou à une infection fungique et en l’absence de complication, une prise en charge médicamenteuse seule peut être envisagée. Une surveillance clinique, biologique et échographique rapprochée est néanmoins nécessaire dans ces cas.
La chirurgie valvulaire dans les atteintes prothétiques consiste en une exérèse complète des tissus infectés, y compris de la prothèse valvulaire, et à son remplacement par une nouvelle prothèse, homogreffe ou autogreffe.
À l’inverse, dans les cas d’EI sur prothèse qui ne sont pas liées à une infection à Staphylococcus ou à une infection fungique et en l’absence de complication, une prise en charge médicamenteuse seule peut être envisagée. Une surveillance clinique, biologique et échographique rapprochée est néanmoins nécessaire dans ces cas.
EI sur sonde de pacemaker ou défibrillateur
La prise en charge de ces EI consiste en l’administration d’une antibiothérapie adaptée au germe associée à l’extraction complète du matériel endocavitaire.
Une antibiothérapie prolongée d’une durée de quatre à six semaines est indiquée. Dans l’attente d’une documentation bactériologique, la vancomycine est le traitement de référence, compte tenu de la fréquence des infections à Staphylococcus aureus résistant à la méticilline (SARM). Cette antibiothérapie doit être poursuivie au moins deux semaines après l’extraction du matériel intracardiaque.
Afin de réduire le risque d’infection non contrôlée et de récidive, l’extraction de la totalité du matériel intracardiaque infecté est indiquée. Cette extraction peut se réaliser de deux manières : par voie percutanée (voie veineuse) ou par voie chirurgicale. Il est actuellement recommandé de réaliser une extraction percutanée en première intention, même lorsque les végétations sont de taille importante. L’approche chirurgicale garde une place en cas d’extraction incomplète du matériel par voie percutanée ou en cas d’atteinte valvulaire tricuspide sévère associée et peut se discuter en cas de végétations très volumineuses (supérieures à 20 mm). La principale complication de ces procédures d’extraction est l’embolisation de végétations au niveau pulmonaire, qui reste dans la majorité des cas asymptomatique.
L’implantation d’un nouveau matériel, lorsqu’elle est indiquée, est réalisée après un délai d’au moins quelques jours après l’extraction ; les hémocultures devant être stériles depuis au moins soixante-douze heures. Une nouvelle échographie transœsophagienne doit être réalisée avant l’implantation afin de s’assurer de l’absence de lésions infectieuses résiduelles (« fantômes »).
Une antibiothérapie prolongée d’une durée de quatre à six semaines est indiquée. Dans l’attente d’une documentation bactériologique, la vancomycine est le traitement de référence, compte tenu de la fréquence des infections à Staphylococcus aureus résistant à la méticilline (SARM). Cette antibiothérapie doit être poursuivie au moins deux semaines après l’extraction du matériel intracardiaque.
Afin de réduire le risque d’infection non contrôlée et de récidive, l’extraction de la totalité du matériel intracardiaque infecté est indiquée. Cette extraction peut se réaliser de deux manières : par voie percutanée (voie veineuse) ou par voie chirurgicale. Il est actuellement recommandé de réaliser une extraction percutanée en première intention, même lorsque les végétations sont de taille importante. L’approche chirurgicale garde une place en cas d’extraction incomplète du matériel par voie percutanée ou en cas d’atteinte valvulaire tricuspide sévère associée et peut se discuter en cas de végétations très volumineuses (supérieures à 20 mm). La principale complication de ces procédures d’extraction est l’embolisation de végétations au niveau pulmonaire, qui reste dans la majorité des cas asymptomatique.
L’implantation d’un nouveau matériel, lorsqu’elle est indiquée, est réalisée après un délai d’au moins quelques jours après l’extraction ; les hémocultures devant être stériles depuis au moins soixante-douze heures. Une nouvelle échographie transœsophagienne doit être réalisée avant l’implantation afin de s’assurer de l’absence de lésions infectieuses résiduelles (« fantômes »).
EI du cœur droit
Dans les atteintes valvulaires tricuspides, la chirurgie cardiaque est peu réalisée, d’autant que les patients concernés présentent souvent une toxicomanie intraveineuse responsable de récidives d’EI fréquentes.
Néanmoins, la chirurgie doit être considérée dans quatre situations : insuffisance cardiaque droite en lien avec une insuffisance tricuspide sévère et non maîtrisée par le traitement diurétique ; végétations tricuspidiennes de plus de 20 mm persistantes avec embolies pulmonaires récidivantes ; végétations persistantes avec insuffisance respiratoire nécessitant un support ventilatoire après des embolies récidivantes ; EI causée par des micro-organismes difficiles à éradiquer (par exemple des champignons) ou bactériémie persistante à sept jours d’une antibiothérapie adaptée.
Les options thérapeutiques chirurgicales sont le remplacement valvulaire (le plus souvent par bioprothèse), la plastie tricuspide ou, dans les cas les plus extrêmes, la valvectomie.
Néanmoins, la chirurgie doit être considérée dans quatre situations : insuffisance cardiaque droite en lien avec une insuffisance tricuspide sévère et non maîtrisée par le traitement diurétique ; végétations tricuspidiennes de plus de 20 mm persistantes avec embolies pulmonaires récidivantes ; végétations persistantes avec insuffisance respiratoire nécessitant un support ventilatoire après des embolies récidivantes ; EI causée par des micro-organismes difficiles à éradiquer (par exemple des champignons) ou bactériémie persistante à sept jours d’une antibiothérapie adaptée.
Les options thérapeutiques chirurgicales sont le remplacement valvulaire (le plus souvent par bioprothèse), la plastie tricuspide ou, dans les cas les plus extrêmes, la valvectomie.
Références
1. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis: The task force for the management of endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2023;44(39):3948-4042.
2. Murray KP, Zhao JJ, Davis SL, Kullar R, Kaye KS, Lephart P, et al. Early use of daptomycin versus vancomycin for methicillin-resistant Staphylococcus aureus bacteremia with vancomycin minimum inhibitory concentration > 1 mg/L: A matched cohort study. Clin Infect Dis 2013;56(11):1562-9.
3. Andrews MM, von Reyn CF. Patient selection criteria and management guidelines for outpatient parenteral antibiotic therapy for native valve infective endocarditis. Clin Infect Dis 2001;33(2):203-9.
4. Pericà S JM, Llopis J, González-Ramallo V, Goenaga MÁ, Muñoz P, García-Leoni ME, et al. Outpatient parenteral antibiotic treatment for infective endocarditis: A prospective cohort study from the GAMES cohort. Clin Infect Dis 2019;69(10):1690-700.
5. Iversen K, Ihlemann N, Gill SU, Madsen T, Elming H, Jensen KT, et al. Partial oral versus intravenous antibiotic treatment of endocarditis. N Engl J Med 2019;380(5):415-24.
6. Nashef SAM, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al. EuroSCORE II. Eur J Cardiothorac Surg 2012;41(4):734-44; discussion 744-5.
7. De Feo M, Cotrufo M, Carozza A, De Santo LS, Amendolara F, Giordano S, et al. The need for a specific risk prediction system in native valve infective endocarditis surgery. ScientificWorldJournal 2012;2012:307571.
8. Martínez-Sellés M, Muñoz P, Arnáiz A, Moreno M, Gálvez J, Rodríguez-Roda J, et al. Valve surgery in active infective endocarditis: A simple score to predict in-hospital prognosis. Int J Cardiol 2014;175(1):133-7.
9. Habib G, Erba PA, Iung B, Donal E, Cosyns B, Laroche C, et al. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: A prospective cohort study. Eur Heart J 2019;40(39):3222-32.
10. Kang D-H, Kim Y-J, Kim S-H, Sun BJ, Kim D-H, Yun S-C, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012;366(26):2466-73.
11. Oliver L, Leauthier M, Jamme M, Arregle F, Martel H, Philip M, et al. Mitral valve repair is better than mitral valve replacement in native mitral valve endocarditis: Results from a prospective matched cohort. Arch Cardiovasc Dis 2022;115(3):160-8.
2. Murray KP, Zhao JJ, Davis SL, Kullar R, Kaye KS, Lephart P, et al. Early use of daptomycin versus vancomycin for methicillin-resistant Staphylococcus aureus bacteremia with vancomycin minimum inhibitory concentration > 1 mg/L: A matched cohort study. Clin Infect Dis 2013;56(11):1562-9.
3. Andrews MM, von Reyn CF. Patient selection criteria and management guidelines for outpatient parenteral antibiotic therapy for native valve infective endocarditis. Clin Infect Dis 2001;33(2):203-9.
4. Pericà S JM, Llopis J, González-Ramallo V, Goenaga MÁ, Muñoz P, García-Leoni ME, et al. Outpatient parenteral antibiotic treatment for infective endocarditis: A prospective cohort study from the GAMES cohort. Clin Infect Dis 2019;69(10):1690-700.
5. Iversen K, Ihlemann N, Gill SU, Madsen T, Elming H, Jensen KT, et al. Partial oral versus intravenous antibiotic treatment of endocarditis. N Engl J Med 2019;380(5):415-24.
6. Nashef SAM, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al. EuroSCORE II. Eur J Cardiothorac Surg 2012;41(4):734-44; discussion 744-5.
7. De Feo M, Cotrufo M, Carozza A, De Santo LS, Amendolara F, Giordano S, et al. The need for a specific risk prediction system in native valve infective endocarditis surgery. ScientificWorldJournal 2012;2012:307571.
8. Martínez-Sellés M, Muñoz P, Arnáiz A, Moreno M, Gálvez J, Rodríguez-Roda J, et al. Valve surgery in active infective endocarditis: A simple score to predict in-hospital prognosis. Int J Cardiol 2014;175(1):133-7.
9. Habib G, Erba PA, Iung B, Donal E, Cosyns B, Laroche C, et al. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: A prospective cohort study. Eur Heart J 2019;40(39):3222-32.
10. Kang D-H, Kim Y-J, Kim S-H, Sun BJ, Kim D-H, Yun S-C, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012;366(26):2466-73.
11. Oliver L, Leauthier M, Jamme M, Arregle F, Martel H, Philip M, et al. Mitral valve repair is better than mitral valve replacement in native mitral valve endocarditis: Results from a prospective matched cohort. Arch Cardiovasc Dis 2022;115(3):160-8.