Le surpoids et l’obésité représentent des problèmes de santé publique mondiale avec une incidence qui a triplé depuis 1975. Ce phénomène, qui concerne 1,9 milliard d’adultes et 340 millions d’enfants et d’adolescents de 5 à 19 ans, est d’autant plus préoccupant que l’on compte aussi 38 millions d’enfants de moins de 5 ans en surpoids ou obèses, qui risquent de le rester à l’âge adulte.1 Selon l’Organisation de coopération et de développement économique (OCDE), ces pathologies généreraient un coût sanitaire de 425 milliards de dollars par an, dans 52 pays étudiés.2 En effet, elles prédisposent à d’autres maladies comme la stéatose hépatique non alcoolique, le diabète de type 2 et des maladies cardiovasculaires, dont la prévalence a fortement progressé ces dernières décennies. Surpoids et obésité sont également associés à divers cancers (estomac, côlon, foie, pancréas) et à une plus forte susceptibilité aux infections de la peau, du tractus urinaire et nosocomiales.3, 4
Si la recrudescence de l’obésité et des maladies métaboliques peut s’expliquer par une prise alimentaire excessive, un manque d’activité physique ou des facteurs génétiques, le rôle de facteurs environnementaux, comme les perturbateurs endocriniens, dont la fabrication et l’utilisation ont fortement augmenté ces dernières décennies, est également suspecté.5 Les perturbateurs endocriniens favorisant l’obésité, qualifiés d’obésogènes6, augmentent l’engagement des cellules précurseurs vers la lignée adipocytaire, le nombre et la taille des adipocytes matures (adipogenèse). Ils perturbent l’homéostasie glucido-lipidique, la balance énergétique, le microbiote intestinal ou encore le contrôle de l’appétit.7 Les altérations métaboliques induites par ces perturbateurs endocriniens favoriseraient également l’apparition du diabète de type 2, des maladies du foie et, par conséquent, du syndrome métabolique.
L’étude des effets métaboliques des perturbateurs endocriniens est complexe. Le millier de molécules actuellement suspectées d’être des perturbateurs endocriniens, d’origine naturelle ou issues de l’industrie, est présent dans de nombreux types de produits (
Certains perturbateurs sont très lipophiles et résistants à la dégradation. Ils s’accumulent dans les tissus gras, ont une demi-vie dans l’organisme qui peut atteindre 5-8 ans et, le cas échéant, sont relargués lors de l’amaigrissement ou de l’allaitement.8 Classés comme polluants organiques persistants (POP) par la convention de Stockholm, l’objectif est de les réduire, contrôler et éliminer. Malgré cela, ils sont encore présents dans de nombreux écosystèmes et détectés dans les tissus et dans le sang des organismes. Les perturbateurs endocriniens non lipophiles, métabolisés et/ou rapidement éliminés, y sont également détectables, du fait de leur présence dans de nombreux produits de grande consommation.9 La population générale est ainsi exposée, de manière chronique, à un ensemble de perturbateurs endocriniens dont des substances qui ne sont plus sur le marché.
Établir un lien entre l’exposition et l’apparition des pathologies nécessite donc de combiner des études épidémiologiques, expérimentales (in vivo et in vitro) et computationnelles, qui intègrent les données obtenues par des approches de biologie des systèmes et de bio-informatique.10
Des études épidémiologiques et in vivo pour identifier des obésogènes ou perturbateurs métaboliques
Les expositions commencent dès la période intra-utérine et se poursuivent toute la vie. En termes d’effets, on distingue les perturbateurs endocriniens persistants et non persistants.
Les effets d’une exposition in utero
Les périodes fœtale et postnatale précoce sont des fenêtres de sensibilité accrue, notamment aux perturbateurs endocriniens qui sont associés à un plus grand risque d’obésité et de maladies métaboliques à l’âge adulte.11
Perturbateurs endocriniens non persistants
Chez les rongeurs, des études ont montré qu’une exposition in utero et/ou périnatale à des perturbateurs endocriniens non persistants (distilbène, glyphosate, vinclozoline, bisphénol A) est associée à un poids de naissance plus faible et à une obésité infantile ou à l’âge adulte.7, 12 Le bisphénol A, le dioctyl sulfosuccinate de sodium (DOSS) et le dibutylétain (DBT) provoquent chez des souris mâles une hyperinsulinémie, une intolérance au glucose et/ou une résistance à l’insuline.6, 7 Par contre, l’exposition in utero et périnatale de di-[2-éthylhexyle] phtalate (DEHP) est associée à une hyperglycémie et une diminution de l’insulinémie chez les rates,7 laissant supposer un effet nocif différent selon le sexe. Chez l’homme, des études épidémiologiques rapportent une association positive entre l’exposition maternelle à certains perturbateurs endocriniens (bisphénol A, distilbène, phtalates, parabènes) et l’obésité chez les enfants. Néanmoins, une absence de preuve, voire une association négative, ont également été observées, différentes entre filles et garçons.7, 12, 13
Perturbateurs endocriniens persistants
L’exposition in utero des rongeurs aux perturbateurs endocriniens organochlorés : dichlorodiphényltrichloroéthane (DDT), polychlorobiphényl (PCB), hexachlorobenzène (HCB) et hydrocarbures aromatiques polycycliques (HAP), s’accompagne d’une augmentation de masse grasse et de poids, surtout chez les femelles.7, 8, 12 Dans certaines études, les effets obésogènes des hydrocarbures aromatiques polycycliques et du DDT ne s’observent que chez les animaux sous régime hyperlipidique. Pour le DDT, une intolérance au glucose, une hyperinsulinémie et une dyslipidémie sont également observées. Chez l’homme, de nombreuses données, provenant de cohortes mères-enfants, montrent une corrélation positive entre les concentrations sériques chez la mère ou dans le cordon ombilical de polluants organiques persistants [DDT, dichlorodiphényldichloroéthylène (DDE), HCB, PCB, acide perfluorooctanoïque (PFOA) et perfluorooctane sulfonate (PFOS)] d’une part, et l’indice de masse corporelle (IMC), la masse grasse, le tour de taille ou l’insulinémie chez l’enfant, à différents âges, d’autre part7, 8, 14 ; un plus faible poids de naissance a également été observé. Un dimorphisme sexuel a été rapporté avec une corrélation chez les filles ou les garçons, selon les études.
Les effets d’une exposition directe
Différentes données ont été recueillies chez les rongeurs et chez l’homme.
Perturbateurs endocriniens non persistants
Chez le rongeur adulte, une exposition au tributylétain (TBT) ou à l’imidaclopride est associée à une augmentation du poids et de la masse grasse.6, 12 Des souris mâles exposées au bisphénol A développent une hyperinsulinémie et une hypercholestérolémie, alors que le TBT provoque une hyperglycémie, une hypo-insulinémie et une stéatose hépatique.7 En plus des effets obésogènes, des additifs alimentaires comme la carboxyméthylcellulose (CMC) et le Span 80 favorisent l’hyperglycémie, l’intolérance au glucose et la résistance à l’insuline ; le glutamate monosodique (MSG) favorise quant à lui une hypercholestérolémie et une hypertriglycéridémie.12 Des études épidémiologiques montrent également une association entre le bisphénol A, ses substituants, bisphénols F et S (BPF et BPS), les phtalates et le TBT avec une obésité, une hyperinsulinémie, une résistance à l’insuline et/ou le diabète, toujours avec un dimorphisme sexuel.7, 12
Perturbateurs endocriniens persistants
L’exposition à certains PCB, au DDT et à l’hexachlorobenzène est associée à une augmentation de l’IMC chez les rongeurs9 et chez l’homme.8, 14 L’exposition aux polluants organiques persistants [2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD), PCB, PFOA et PFOS], associée ou non à un régime hyperlipidique, est également liée à l’apparition d’une stéatose hépatique chez les rongeurs7, 15 ainsi qu’à une hyperlipidémie et à l’augmentation de l’alanine aminotransférase (ALAT), dans des études épidémiologiques.8 L’exposition au DDT, aux PCB, seuls ou en mélange, est également positivement associée à l’incidence du diabète, mais une association négative ou une absence d’association ont également été observées.8, 14
Les limites des études épidémiologiques
Les perturbateurs endocriniens, persistants ou non, exercent donc des effets obésogènes et induisent des altérations métaboliques, pendant la phase développementale et chez les adultes, toujours avec un dimorphisme sexuel. Du fait des limites des études épidémiologiques et in vivo, leurs conclusions sont parfois divergentes. Le poids corporel ou l’IMC, utilisé comme seul indicateur d’obésité, est inapproprié dans certaines populations humaines et modèles animaux. Le tour de taille est désormais reconnu comme un meilleur indicateur de l’embonpoint et de l’obésité. De plus, les études épidémiologiques se fondent sur un dosage simple pour estimer l’exposition aux perturbateurs endocriniens. Or il ne permet de tenir compte ni des fluctuations de l’exposition à long terme, à l’origine des maladies métaboliques, ni des différences interindividuelles (exposition, métabolisme), ni, enfin, des interactions avec d’autres perturbateurs endocriniens (effets additif, synergique ou antagoniste).
Afin de consolider les hypothèses issues d’études épidémiologiques, des analyses complémentaires doivent être réalisées, comme des études expérimentales, permettant de comprendre les mécanismes d’action moléculaires.
Les études expérimentales
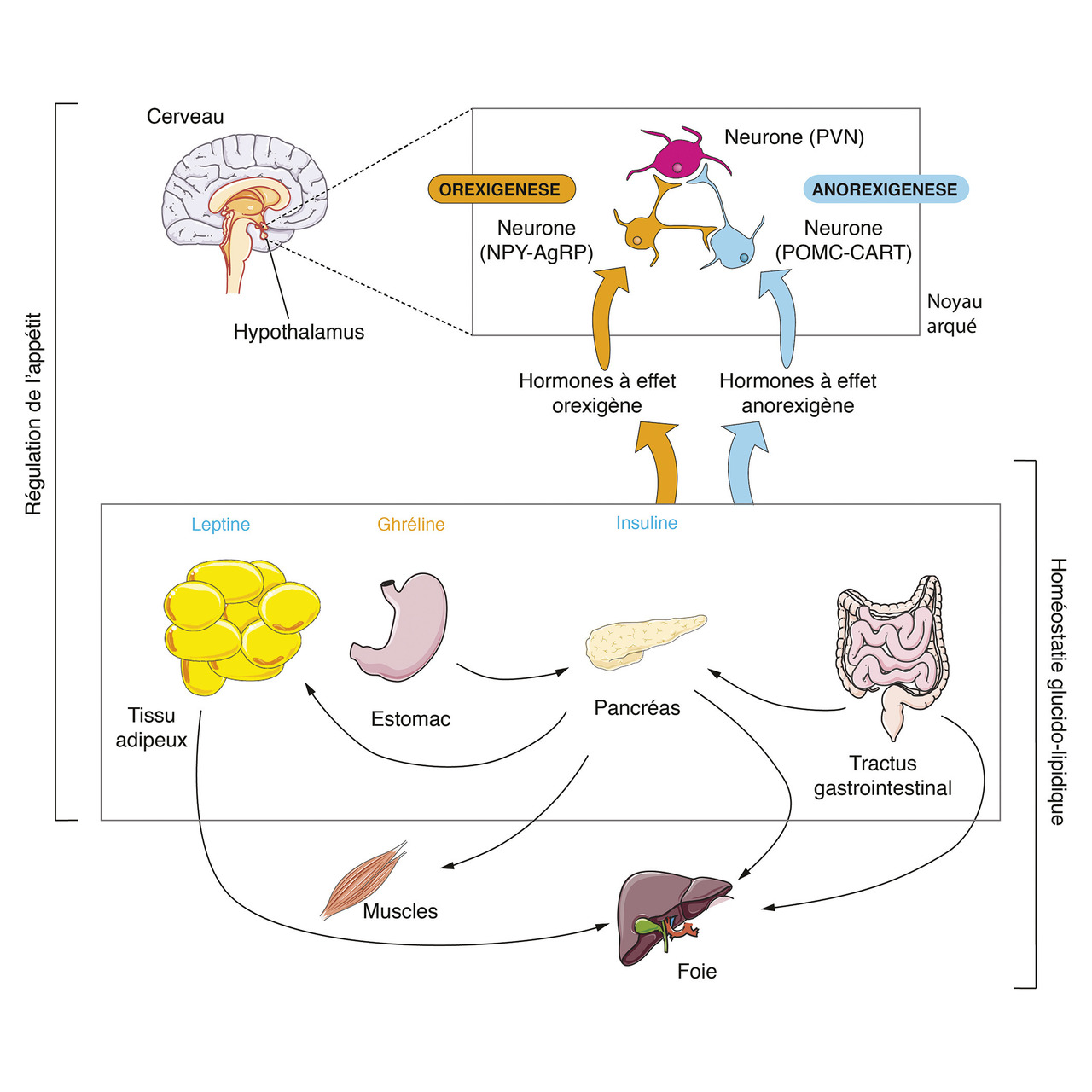
L’étude des mécanismes d’action des perturbateurs endocriniens obésogènes se focalise sur les organes impliqués dans l’homéostasie glucido-lipidique et dans la régulation de l’appétit (tissu adipeux, foie, muscle squelettique, pancréas, intestin et hypothalamus) [
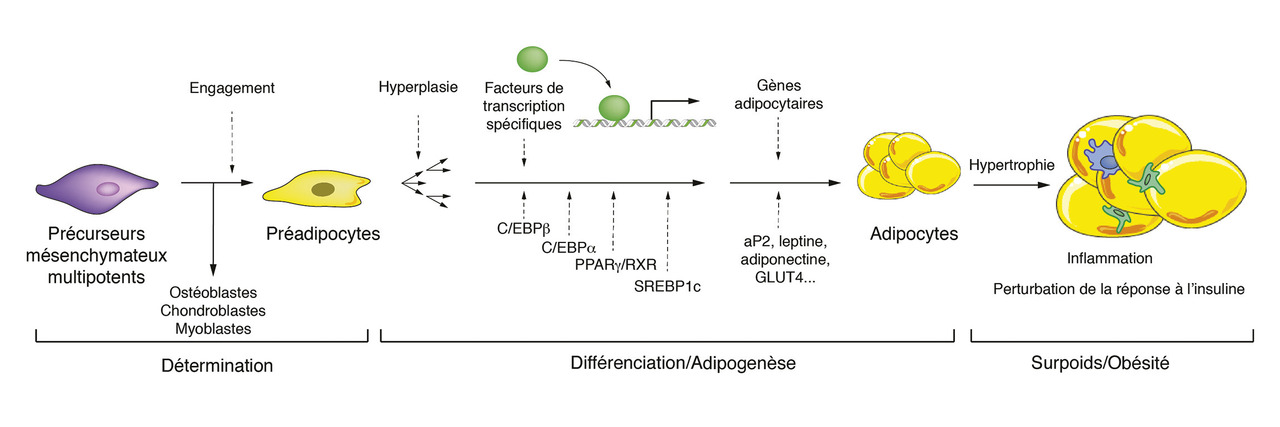
Altération de l’adipogenèse et des fonctions adipocytaires
L’obésité se traduit à la fois par une hyperplasie, une hypertrophie et une inflammation chronique de bas grade du tissu adipeux, conduisant à une résistance à l’insuline16 (
Le tissu adipeux n’est pas un simple organe cible des perturbateurs endocriniens. Il contribue à réguler leurs concentrations circulantes, notamment celles des polluants organiques persistants. En effet, en plus d’être un lieu de stockage des lipides, il constitue un réservoir des polluants organiques persistants lipophiles qui se logent dans les gouttelettes lipidiques.17 Il protège ainsi les autres organes des effets toxiques de ces molécules mais en devient par conséquent une cible privilégiée.8 En parallèle, le relargage des polluants organiques persistants du tissu adipeux vers la circulation sanguine par la lipolyse, un phénomène accentué lors de l’amaigrissement, peut provoquer, à l’inverse, une exposition chronique de l’organisme à ces polluants. Si les bénéfices de l’amaigrissement sur les paramètres métaboliques et cardiovasculaires ne peuvent être remis en cause, les effets néfastes sur les autres organes d’une telle remobilisation des polluants organiques persistants pourraient les atténuer, voire les masquer.8, 18
Modifications de la sécrétion et de la réponse à l’insuline
Les perturbateurs endocriniens peuvent altérer l’action de l’insuline via différents mécanismes : perturbation de la sécrétion de l’insuline stimulée par le glucose (GSIS) dans le pancréas, modification de l’entrée du glucose dans les cellules musculaires lisses et adipocytaires (l’adressage du transporteur GLUT4 à la membrane est stimulé par l’insuline) et altération de la voie de signalisation de l’insuline dans les tissus insulino-sensibles. La TCDD, le DDT, le DEHP et le TBT diminuent la sécrétion de l’insuline stimulée par le glucose, avec des altérations de l’ultrastructure des cellules β, leur apoptose et une réduction de leur nombre.7 L’altération de l’expression des transporteurs du glucose ou de la voie de signalisation de l’insuline expliquerait la diminution de l’entrée du glucose dans le muscle squelettique, observée in vivo pour le bisphénol A ou les PCB, associés ou non à un régime hyperlipidique, et in vitro pour le DEHP.7, 15
Impacts sur le métabolisme glucido-lipidique dans le foie
Le foie est l’organe clé dans le maintien de l’homéostasie glucidique via la glycogénolyse et la néoglucogenèse, deux voies sous le contrôle des hormones insuline et glucagon. Celles-ci régulent également la lipogenèse (synthèse), la β-oxydation des lipides (dégradation) et la formation des corps cétoniques. Un excès de glucose conduit ainsi à la formation des acides gras hépatiques, précurseurs des triglycérides. La stéatose (accumulation de triglycérides) hépatique et l’hypercholestérolémie, observées après exposition à certains perturbateurs endocriniens, pourraient donc s’expliquer par l’altération de l’expression des gènes impliqués dans la biosynthèse des lipides et du cholestérol, via l’activation de PPARα. Ainsi, le bisphénol A et le PCB153 augmentent l’expression des gènes de la lipogenèse mais diminuent celle des gènes de la β-oxydation.15 En revanche, le PCB126 et la TCDD diminuent l’expression des gènes de la lipogenèse, de la néoglucogenèse et de la glycogénolyse.15
Régulation de l’appétit : des effets orexigènes ou anorexigènes
L’hypothalamus participe à la régulation du poids via le contrôle de la prise alimentaire. Cela implique le noyau arqué, composé de neurones exprimant, soit le neuropeptide Y (NPY) et l’agouti-related peptide (AgRP), orexigènes, soit la proopiomélanocortine (POMC) et le cocaine-and amphetamine-regulated transcript (CART), anorexigènes. Ce circuit de régulation de l’appétit est contrôlé par des hormones. Par exemple, la leptine, l’insuline et l’œstradiol augmentent l’activité de la proopiomélanocortine et inhibent celle du neuropeptide Y et de l’AgRP.7 La ghréline produit l’effet inverse (
Des conséquences sur le microbiote intestinal
La modification de la composition du microbiote intestinal représente un mécanisme supplémentaire par lequel les perturbateurs endocriniens exerceraient leurs effets obésogènes.6 Le microbiote peut interagir avec l’organisme en participant à la digestion, en produisant lui-même des métabolites actifs, en fragilisant ou renforçant la membrane intestinale. Sa composition est donc déterminante. Ainsi, l’exposition de souris aux obésogènes bisphénol A et TBT entraîne un changement du microbiote intestinal, comparable à celui d’un régime hyperlipidique (augmentation des protéobactéries Helicobacter et diminution des Firmicutes, Clostridia).6 Les dérivés indoles du tryptophane, ligands de l’AhR, produits par le microbiote intestinal, pourraient aussi participer aux effets obésogènes des perturbateurs endocriniens.
Explorer les modifications épigénétiques pour comprendre les effets transgénérationnels
L’étude des marqueurs épigénétiques permet, en particulier, d’expliquer les potentiels effets intergénérationnels des perturbateurs endocriniens. Il s’agit de modifications non génétiques, réversibles et transmissibles, comme la méthylation de l’ADN, les modifications post-traductionnelles des histones, le remodelage de la chromatine, l’expression des ARN non codants. Des changements dans les modifications des histones, dans la structure de la chromatine, dans la méthylation de l’ADN et dans les ARN non codants ont été observés pour le DDT, le TBT, le DEHP et la vinclozoline.7, 8, 19 Les recherches dans ce domaine sont encore limitées mais les efforts se poursuivent pour explorer ces mécanismes.
Bio-informatique et biologie intégrative des systèmes, approches complémentaires
Les études épidémiologiques et expérimentales, notamment issues de criblages à haut débit et d’omiques (transcriptomique, protéomique, lipidomique, métabolomique…), génèrent une quantité importante de données nécessitant une analyse automatisée, ce qui est possible grâce à la bio-informatique, ou biologie computationnelle. Par exemple, les études multi-omiques permettent d’investiguer des modifications à différents niveaux moléculaires, apportant des connaissances sur les cibles des perturbateurs endocriniens et donc sur les mécanismes qui pourraient les relier aux maladies métaboliques.20
De plus, la bio-informatique structurale, comme les études de docking et les modèles QSAR (quantitative structure activity relationship) se fondent sur les structures chimiques des composés pour comprendre ou prédire un effet biologique. Ces outils ont par exemple été utilisés pour prédire l’activité anti-androgénique des bisphénols.21
La biologie intégrative des systèmes est une approche multidisciplinaire qui permet de modéliser un système biologique, par des analyses mathématiques et statistiques, en utilisant divers types de données non structurales, dans le but d’améliorer la compréhension des processus biologiques et de développer des modèles prédictifs. Elle lie des données expérimentales aux informations issues de bases de données d’interactions moléculaires (CompTox, CTD…), de voies de signalisation (KEGG, Reactome …) ou de pathologies (DisGeNET, GeneCards…). Ainsi, elle permet de comprendre comment le système métabolique pourrait être perturbé par des perturbateurs endocriniens présents dans l’environnement.22 Par exemple, une approche intégrée de biologie des systèmes a montré un lien potentiel entre des perturbateurs endocriniens (TCDD, PFOA…) et le diabète de type 2.10
D’autres approches computationnelles existent, comme le développement de modèles PBTK (physiologically based toxicokinetic) qui évaluent quantitativement les flux des perturbateurs endocriniens dans un organisme.
Des efforts internationaux pour mieux identifier et caractériser des perturbateurs endocriniens obésogènes et métaboliques
Aucun test d’identification réglementaire n’est à l’heure actuelle validé par l’OCDE et l’European Center for the Validation of Alternative Methods (ECVAM) pour détecter les effets obésogènes et métaboliques des perturbateurs endocriniens. Afin de combler ce manque, l’Union européenne a financé en 2019 un ensemble de 8 projets,23 dont l’objectif est de développer des méthodes afin de caractériser les modes d’action des perturbateurs endocriniens. Trois de ces projets, EDCMET, GOLIATH et OBERON, ont pour but de créer des tests (in vitro, in vivo et in silico) pour l’identification de perturbateurs endocriniens impliqués dans les perturbations métaboliques. Le projet OBERON, dirigé par la France,22 utilise des données épidémiologiques de cohortes humaines, des résultats expérimentaux et in silico pour développer des tests, qui seront proposés à l’OCDE afin d’être validés comme tests réglementaires. Pour faciliter ce travail, la France a lancé en 2019 la plateforme public-privé PEPPER24 qui soutient la priorisation de tests (dont les tests associés aux perturbations métaboliques).
Si la caractérisation exhaustive et l’identification complète des composés envisagés individuellement sont importantes, il est crucial de se rapprocher des conditions réelles d’exposition humaine aux perturbateurs endocriniens. De plus en plus d’études toxicologiques s’attachent donc à étudier leurs effets « cocktails ». Il est également important de développer de nouveaux modèles cellulaires qui permettront de prendre en compte le micro-environnement tissulaire et une exposition sur plusieurs semaines, voire plusieurs mois, pour reproduire l’exposition de longue durée chez l’homme. Le développement des modèles en 3D, de co-culture, l’utilisation d’une matrice extracellulaire, sont des approches innovantes en développement afin de répondre à ces besoins.13
1. OMS. Obésité et surpoids [Internet]. 2020 [cité le 1er juin 2021]. Disponible sur https://www.who.int/fr/news-room/fact-sheets/detail/obesity-and-overweight
2. OECD. Heavy Burden of Obesity: The Economics of Prevention. A quick guide for policy makers [Internet]. 2019 [cité le 1er juin 2021]. Disponible sur https://www.oecd.org/health/health-systems/Heavy-burden-of-obesity-Policy-Brief-2019.pdf
3. Dobner J, Kaser S. Body mass index and the risk of infection - from underweight to obesity. Clin Microbiol Infect. 2018 Jan;24(1):24‑8.
4. Gallagher EJ, LeRoith D. Obesity and diabetes: The increased risk of cancer and cancer-related mortality. Physiol Rev. 2015 Jul;95(3):727‑48.
5. Baillie-Hamilton PF. Chemical toxins: a hypothesis to explain the global obesity epidemic. J Altern Complement Med. 2002 Apr;8(2):185‑92.
6. Egusquiza RJ, Blumberg B. Environmental Obesogens and their impact on susceptibility to obesity: new mechanisms and chemicals. Endocrinology. 2020 Mar 1;161(3).
7. Heindel JJ, Blumberg B, Cave M, Machtinger R, Mantovani A, et al. Metabolism disrupting chemicals and metabolic disorders. Reprod Toxicol. 2017 Mar;68:3‑33.
8. La Merrill M, Emond C, Kim MJ, Antignac J-P, Le Bizec B, et al. Toxicological function of adipose tissue: focus on persistent organic pollutants. Environ Health Perspect. 2013 Feb;121(2):162‑9.
9. Papalou O, Kandaraki EA, Papadakis G, Diamanti-Kandarakis E. Endocrine disrupting chemicals: An occult mediator of metabolic disease. Front Endocrinol. 2019 Mar 1;10:112.
10. Audouze K, Brunak S, Grandjean P. A computational approach to chemical etiologies of diabetes. Sci Rep. 2013;3:2712.
11. Barker DJP. The origins of the developmental origins theory. J Intern Med. 2007 May;261(5):412‑7.
12. Amato AA, Wheeler HB, Blumberg B. Obesity and endocrine-disrupting chemicals. Endocr Connect. 2021 Feb;10(2):R87‑105.
13. Griffin MD, Pereira SR, DeBari MK, Abbott RD. Mechanisms of action, chemical characteristics, and model systems of obesogens. BMC Biomed Eng. 2020 Apr;2:6.
14. Tang-Péronard JL, Andersen HR, Jensen TK, Heitmann BL. Endocrine-disrupting chemicals and obesity development in humans: a review. Obes Rev. 2011 Aug;12(8):622‑36.
15. Nadal A, Quesada I, Tudurí E, Nogueiras R, Alonso-Magdalena P. Endocrine-disrupting chemicals and the regulation of energy balance. Nat Rev Endocrinol. 2017 Sep;13(9):536‑46.
16. Longo M, Zatterale F, Naderi J, Parrillo L, Formisano P, et al. Adipose tissue dysfunction as determinant of obesity-associated metabolic complications. Int J Mol Sci. 2019 May 13;20(9):2358.
17. Bourez S, Le Lay S, Van den Daelen C, Louis C, Larondelle Y, et al. Accumulation of polychlorinated biphenyls in adipocytes: selective targeting to lipid droplets and role of caveolin-1. PloS One. 2012;7(2):e31834.
18. Lee DH, Jacobs DR, Lind L, Lind PM. Lipophilic environmental chemical mixtures released during weight-loss: the need to consider dynamics. Bioessays. 2020 Jun;42(6):e1900237.
19. King SE, Skinner MK. Epigenetic transgenerational inheritance of obesity susceptibility. Trends Endocrinol Metab. 2020 Jul;31(7):478‑94.
20. Paczkowska-Abdulsalam M, Kretowski A. Obesity, metabolic health and omics: Current status and future directions. World J Diabetes. 2021 Apr 15;12(4):420‑36.
21. Yang X, Liu H, Yang Q, Liu J, Chen J, Shi L. Predicting anti-androgenic activity of bisphenols using molecular docking and quantitative structure-activity relationships. Chemosphere. 2016 Nov;163:373‑81.
22. Audouze K, Sarigiannis D, Alonso-Magdalena P, Brochot C, Casas M, et al. Integrative strategy of testing systems for identification of endocrine disruptors inducing metabolic disorders - An introduction to the OBERON project. Int J Mol Sci. 2020 Apr 23;21(8):2988.
23. EURION. European cluster to improve identification of endocrine disruptors. New testing and screening methods to identify endocrine disruption chemicals (EDCS) [Internet]. 2019 [cité le 1er juin 2021]. Disponible sur https://eurion-cluster.eu/
24. Zgheib E, Kim MJ, Jornod F, Bernal K, Tomkiewicz C, et al. Identification of non-validated endocrine disrupting chemical characterization methods by screening of the literature using artificial intelligence and by database exploration. Environ Int. 2021 Sep;154:106574.
Dans cet article
- Des études épidémiologiques et in vivo pour identifier des obésogènes ou perturbateurs métaboliques
- Les études expérimentales
- Bio-informatique et biologie intégrative des systèmes, approches complémentaires
- Des efforts internationaux pour mieux identifier et caractériser des perturbateurs endocriniens obésogènes et métaboliques