De nombreuses molécules chimiques sont détectées dans les compartiments fœtaux et maternels, le sang du cordon ou encore dans le liquide amniotique. L’hypothèse de perturbations endocriniennes, et particulièrement thyroïdiennes et/ou stéroïdiennes, dues à la présence d’une ou plusieurs de ces molécules durant le développement, est non seulement fondée mais fondamentale.
Mise en place des axes hypothalamo-hypophysaires thyroïdien et gonadique
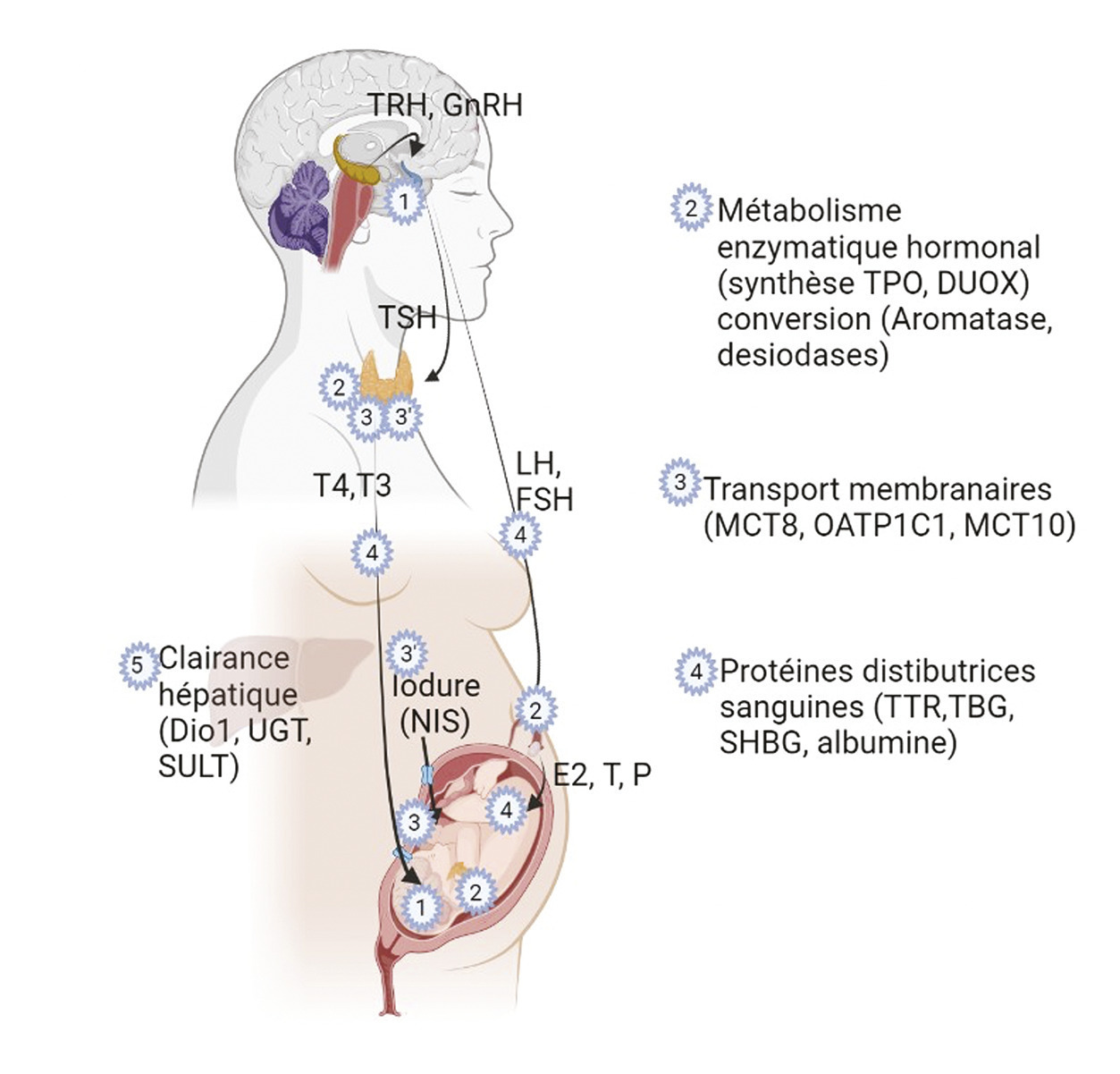
La synthèse et la sécrétion des hormones thyroïdiennes et sexuelles résultent d’un dialogue étroit entre le cerveau et les organes périphériques. Les structures hypothalamiques et hypophysaires qui composent les axes thyroïdien ou gonadotrope commencent à se développer très tôt, lors de l’embryogenèse, bien avant les glandes ou organes qu’elles réguleront.
L’hypothalamus est visible à compter de la 5e semaine de gestation et se développe à partir de la partie ventrale du diencéphale1. Les noyaux hypothalamiques sont décelables dès la 12e semaine et subissent une maturation jusqu’à la 35e semaine de grossesse. L’hypophyse antérieure est visible dès la 4e semaine, avant de se lier, lors de la 5e semaine, à une structure qui formera l’hypophyse postérieure. La différenciation cellulaire dans l’hypophyse débute pendant les 7-8es semaines de grossesse, au cours desquelles les cellules thyréotropes (sécrétant la thyrotropine TSH – thyroid-stimulating hormone) et les cellules gonadotropes (cellules sécrétant les gonadotrophines FSH – follicle stimulating hormone et LH – luteinizing hormone) sont détectées.
Le système vasculaire reliant l'hypothalamus à l’hypophyse, via l’éminence médiane, est observé chez le fœtus humain dès la 11e semaine de grossesse. Ce système circulatoire, nommé système porte primaire, se ramifie ensuite jusqu’à la fin de la grossesse.
Développement et maturation des neurones : action excitatrice puis inhibitrice du GABA
Le système nerveux central est l’un des systèmes les plus complexes mis en place lors de l’évolution. Il est maintenant largement établi que les neurones n’en sont pas les seuls et principaux acteurs puisque les cellules gliales, comme les oligodendrocytes et les astrocytes, historiquement considérées comme des cellules isolantes ou nourricières, jouent également un rôle clé dans les fonctions centrales.
Différents types de neurones, libérant, entre autres, le glutamate, l’acide gamma-aminobutyrique (neurotransmetteur GABA) ou la dopamine, se forment et entrent dans des processus de maturation pendant le développement, grâce à des signaux chimiques, locaux et périphériques. La régulation de leur concentration intracellulaire en chlorure, déterminée par le rapport d’expression de deux transporteurs potassium/chlorure NKCC1 et KCC2, est une caractéristique importante de la maturation des neurones. Quels que soient les types de neurones, la concentration intracellulaire en chlorure des neurones immatures est plus faible que celle des neurones jeunes ou adultes. Cette étape de maturation, documentée dans de nombreuses structures cérébrales, est régulée par de multiples facteurs, dont des neurotransmetteurs, comme le GABA, des hormones (telles que les stéroïdes sexuels et les hormones thyroïdiennes), des neuropeptides, comme l’ocytocine, ou encore des facteurs neurotrophiques comme le BDNF (brain derived neurofactor), ou de croissance tel que l’IGF-1 (insulin growth factor-1).2, 3, 4
L’action du GABA est excitatrice sur un neurone immature mais inhibitrice sur un neurone mature, notamment en permettant l’expression de la parvalbumine, qui induit une activité rythmique rapide dans les interneurones (types de neurones inhibiteurs). La fonction inhibitrice du GABA se met en place pendant la période postnatale, par un changement de l’expression des canaux chlorure à la surface des neurones. Ce « switch » excitateur vers l’inhibiteur est assez bien décrit chez les mammifères et corrélé avec le pic d’ocytocine qui a lieu à la naissance.5 Le GABA est produit à partir d’un nombre relativement faible d’interneurones, qui projettent leurs axones sur un grand nombre de neurones glutamatergiques, principalement excitateurs. La perturbation sélective de la maturation des interneurones GABAergiques entrave le développement des circuits neuronaux : elle est documentée dans de nombreux troubles du développement neurologique.6
Les hormones thyroïdiennes, essentielles au développement harmonieux du cerveau
Les hormones thyroïdiennes (HTs) exercent des rôles pendant des fenêtres temporelles caractéristiques de la neurogenèse, la migration neuronale, la différenciation des neurones et des cellules gliales, ou encore de la myélinisation. Concernant ce dernier aspect, elles favorisent la maturation des oligodendrocytes mais il a été montré récemment, sur des souris adultes, que des mécanismes bloquant leur action sont nécessaires pour générer les précurseurs des oligodendrocytes à partir des cellules souches.7
Cette importance des hormones thyroïdiennes dans la mise en place des processus cognitifs justifie le dépistage systématique de l’hypothyroïdie congénitale chez les nouveau-nés. Par-contre, il n’existe encore à l’heure actuelle aucune mesure systématique permettant de vérifier les niveaux hormonaux ou en iode maternels, en pré-conceptuel ou durant la grossesse. Pourtant, de plus en plus d’études montrent l’impact fondamental de ces niveaux sur les capacités cognitives futures de l’enfant.8 Ceci s’explique en partie par le fait que les hormones maternelles sont la seule source d’HT pendant le premier trimestre de grossesse.9
Les hormones thyroïdiennes peuvent aussi influencer des processus développementaux cruciaux, comme la migration radiale normale des neuroblastes, impliquant les progéniteurs de la glie radiaire ou l’expression des transporteurs NKCC1 et KCC2. Par exemple, dans les neurones corticaux, la T3 (hormone tri-iodothyronine) régule directement l’IGF-1, qui favorise le passage de l’effet excitateur à l'effet inhibiteur du GABA3, définissant ainsi une période critique de la plasticité développementale du néocortex. D’autres facteurs tels que le BDNF, sous contrôle des hormones thyroïdiennes, peuvent être influencés par le PTU (propylthio-uracile) ou le méthimazole.10, 11
Importance des stéroïdes sexuels dans la différenciation de structures nerveuses
Les stéroïdes sexuels, tels que les androgènes et les œstrogènes, jouent un rôle important dans la différenciation sexuelle d’un certain nombre de structures nerveuses impliquées dans la reproduction. Pour exemple, l’axe hypothalamo-hypophyso-gonadique est régulé de manière sexuellement dimorphique. L’âge d’initiation de la puberté est plus précoce chez les filles que chez les garçons. La capacité de l’hypothalamus à intégrer les signaux positifs véhiculés par l’œstradiol et responsables de la décharge ovulante de LH est restreinte aux femelles chez les mammifères, alors que le rétrocontrôle négatif exercé par l’œstradiol ou la testostérone peut être observé chez les deux sexes. Les neurones à GnRH (gonadotropin-releasing hormone) reçoivent des projections de neurones excitateurs (glutamatergiques, kisspeptine…) ou inhibiteurs (GABAergiques). Il est notamment démontré que la régulation sexe-dépendante de l’axe gonadotrope est due au dimorphisme sexuel d’une population de neurones exprimant le neuropeptide kisspeptine. Chez plusieurs espèces de mammifères, la mise en place de ces neurones pendant la période périnatale est régulée par les stéroïdes sexuels.12 Chez l’humain, le système kisspeptine semble également sexuellement dimorphique13, bien que la période critique (développementale, postnatale, pubertaire) pendant laquelle ce dimorphisme se met en place ne soit pas encore bien définie. Par ailleurs, il est à présent largement établi que l’action des stéroïdes sexuels dépasse la simple régulation de la reproduction. Les œstrogènes et les androgènes influencent un large éventail de comportements sociaux, émotionnels et cognitifs.14, 15 Du développement à la puberté, l’action de la testostérone ou de l’œstradiol passe également par des régulations : de la prolifération et de la migration cellulaires, de la neurogenèse, de la différenciation cellulaire et de la plasticité synaptique. Les androgènes et les oestrogènes régulent bien l’expression du BDNF dans plusieurs structures cérébrales16, avec une implication dans des processus cognitifs, neuroprotecteurs ou encore antidépresseurs.
Perturbations au cours du développement : exemples de xénobiotiques
Il existe des fenêtres de vulnérabilité aux perturbateurs endocriniens. En perturbant le développement in utero, où les hormones jouent des rôles cruciaux sur la migration, la prolifération et la différenciation cellulaires, les xénobiotiques peuvent engendrer des effets immédiats ou retardés et donc visibles bien plus tard, voire à l’âge adulte. La période des 1 000 premiers jours de vie, de la conception jusqu’à 2 ans, est une période cruciale qui influence la santé future de l’individu.17 La théorie de l’origine développementale de la santé et des maladies (Developmental origin of Health and diseases ou DoHad), énoncée par Barker18, trouve un écho particulier dans ce contexte.
En considérant les axes dans leur globalité, de nombreux niveaux d’action des molécules chimiques doivent être pris en considération (
Phénols : le bisphénol A objet de nombreuses études
Une des molécules les plus étudiées, pour ses effets de perturbation des systèmes hormonaux, est le bisphénol A (BPA). Utilisé dans la fabrication du plastique de type polycarbonate, il a été interdit en 2015 dans tous les contenants de denrées alimentaires en France et classé en 2017 comme substance hautement préoccupante par l’Agence européenne des produits chimiques19, sur la base d’effets néfastes avérés, notamment sur le cycle œstrien, l’apprentissage et la mémoire. Les altérations du cycle œstrien, ou encore des processus d’apprentissage et de mémoire, impliquaient une perturbation de la voie de signalisation oestrogénique.20, 21 Dans le premier cas, il s’agissait d’effets visant tant le niveau ovarien (stéroïdogenèse et production d’œstrogènes), que le niveau hypothalamique, comprenant le système GnRH/kisspeptine.20 Dans le deuxième cas, l’exposition au bisphénol A affectait la mémoire spatiale et non spatiale, via des modifications de la neuroplasticité dépendante des œstrogènes.21
Sur le plan cellulaire, les modifications induites par ce mode de perturbation endocrinienne affectent différents processus clés au cours du développement. Par exemple, l’exposition au bisphénol A retarde la maturation des neurones corticaux via des modifications de l’expression du gène codant le co-transporteur potassium-chlore KCC2.22
Les perturbateurs endocriniens peuvent agir sur le système nerveux central de deux manières : en altérant les niveaux hormonaux et/ou en modifiant l’expression des voies de signalisation hormonales au niveau central. En ce qui concerne ces effets directs au niveau cérébral, plusieurs études ont décrit des changements dans l’expression des récepteurs des œstrogènes et des androgènes. Pour exemple, une étude chez la souris a montré que l’exposition développementale au bisphénol A entraînait des changements dans les niveaux d’expression du récepteur des œstrogènes α, dépendants du sexe et de la région cérébrale considérée (cortex, hippocampe ou hypothalamus), via probablement une méthylation de la région promotrice de ce gène. Cette étude a également montré que le bisphénol A modifiait les niveaux des ARNm des méthyltransférases DNMT1 et DNMT3A23, 24, sachant que l’expression du gène dnmt3a est également régulée par les hormones thyroïdiennes chez les amphibiens.25
Une équipe a intégré les interactions entre les différentes voies hormonales au niveau moléculaire selon la méthode des réseaux d’AOPs (Adverse Outcome Pathways).26, 27 Trois AOPs liant des événements moléculaires distincts et une perte de fonction cognitive ont été sélectionnés. La baisse de la production de BDNF par l’hippocampe apparaît comme un événement convergent de ces trois AOPs. Le facteur BDNF joue un rôle clé dans l'arborisation dendritique et la plasticité synaptique.28 L’altération de l’expression du BDNF a été associée à des déficits d'attention, à un déclin des compétences cognitives et à des troubles du comportement chez les enfants.29 Les bisphénols pourraient donc entraîner une altération de la fonction du BDNF via au moins deux modes d’action : la perturbation des voies thyroïdiennes et œstrogéniques. L’exposition prénatale au bisphénol A a également été associée à des problèmes de comportement chez les enfants.30 Par conséquent, le rôle des neurotrophines, en tant que médiateurs potentiels des actions liées aux bisphénols sur les problèmes comportementaux et émotionnels, devrait également être pris en compte dans les futures études épidémiologiques et des dosages de BDNF circulant devraient être envisagés.26
PCB : des effets développementaux comportementaux et neurologiques, et reprotoxiques
Ces dérivés chlorés du biphényle ont été produits et utilisés jusqu’à la fin des années 1980, pour leur propriété d’isolants électriques. Ils sont peu biodégradables, donc extrêmement persistants dans l’environnement et chez les êtres vivants, contrairement aux phénols. Ce groupe de polluants comporte 209 molécules, et des récepteurs hormonaux comme les récepteurs des œstrogènes, des androgènes, des hormones thyroïdiennes ou encore l’AhR peuvent être la cible des polychlorobiphényles (PCB).31
En 1991, des effets néfastes sur la faune, consécutifs à la pollution aux PCB des Grands Lacs, avaient été rapportés.32 Lors de cet épisode de pollution, une corrélation inverse a été établie entre les taux de PCB circulants et les niveaux de T4 (thyroxine) libre maternels chez l’humain. Le suivi des enfants à l’âge de 8 ans a pu montrer une perte de 4 à 5 points de quotient intellectuel (QI) chez ceux dont les mères avaient les taux circulants de PCB les plus élevés pendant la grossesse.33 En accord avec ces observations, une récente étude belge34 a montré que les concentrations les plus élevées de polluants organochlorés, dont les PCBs, mesurées à la naissance dans le sang de cordon, étaient associées à des retards de la marche à quatre pattes ou des premiers pas. À 36 mois, un défaut de compréhension du langage était corrélé aux PCBs et à l’hexachlorobenzène. Une diminution des comportements de jeu a été associée avec des concentrations plus élevées en PCBs et, chez les garçons, des scores de QI non verbal plus faibles ont été liés au PCB118.
De nombreux changements sexuellement dimorphiques suivant l’exposition gestationnelle aux PCB ont été rapportés. Des souris femelles exposées aux PCB pendant la gestation ont un poids de naissance supérieur, une activité accrue et des concentrations plus élevées de corticostérone, alors que les mâles affichent une distance anogénitale réduite (féminisation).35 Certains métabolites de PCB interagissent, comme agonistes ou antagonistes, avec les récepteurs des œstrogènes humains. Enfin, certains PCB empêchent le développement neuroendocrine dans l’hypothalamus des rats, en inhibant l'absorption de GABA par les neurones.35
L’évaluation de ces substances a notamment permis de retenir, parmi les effets critiques, des effets développementaux comportementaux et neurologiques, ainsi que des effets reprotoxiques.36, 37
De nombreux perturbateurs endocriniens potentiels non encore évalués au plan sanitaire
Si l’utilisation de certaines substances, comme le bisphénol A ou les PCBs, dont les effets de perturbation endocrinienne et de neurotoxicité sont établis, a été limitée voire interdite en France, plusieurs centaines de molécules susceptibles d’agir comme des perturbateurs endocriniens échappent encore à l’évaluation du risque sanitaire. Il s’agit par exemple des substituts du bisphénol A, comme le bisphénol S ou le bisphénol F, qui seraient, selon de récentes études, aussi problématiques que le bisphénol A.38 Pour certaines substances, seuls les effets d’exposition à fortes doses ont été analysés, selon les bases de la toxicologie traditionnelle. Pour d’autres, encore émergentes, un long travail de recherche reste encore à effectuer. C’est le cas des molécules pharmaceutiques (anti-inflammatoires, antibiotiques, antalgiques…) qui sont de plus en plus détectées dans l’environnement. De plus, les évaluations de ces substances sont réalisées séparément, alors que l’individu est exposé, dans son environnement, à un mélange de substances.
Comprendre les effets et les mécanismes d’action de ces molécules pour interférer avec les systèmes neuroendocriniens sont autant de défis à relever par les chercheurs, en attendant des tests plus appropriés, pour limiter la mise sur le marché de ces substances, dont la dose ne fait pas nécessairement le poison.
1. Fisher DA, Dussault JH, Sack J, Chopra IJ. Ontogenesis of hypothalamic--pituitary--thyroid function and metabolism in man, sheep, and rat. Recent Prog Horm Res. 1976;33:59-116. doi: 10.1016/b978-0-12-571133-3.50010-6. PMID: 829552.
2. Ben-Ari Y, Khalilov I, Kahle KT, Cherubini E. The GABA excitatory/inhibitory shift in brain maturation and neurological disorders. Neuroscientist. 2012 Oct;18(5):467-86. doi: 10.1177/1073858412438697. PMID: 22547529.
3. Baroncelli L, Cenni MC, Melani R, Deidda G, Landi S, et al. Early IGF-1 primes visual cortex maturation and accelerates developmental switch between NKCC1 and KCC2 chloride transporters in enriched animals. Neuropharmacology. 2017 Feb;113(Pt A):167-177. doi: 10.1016/j.neuropharm.2016.02.034. PMID: 26924708.
4. Perrot-Sinal TS, Sinal CJ, Reader JC, Speert DB, McCarthy MM. Sex differences in the chloride cotransporters, NKCC1 and KCC2, in the developing hypothalamus. J Neuroendocrinol. 2007 Apr;19(4):302-8. doi: 10.1111/j.1365-2826.2007.01530.x. PMID: 17355320.
5. Leonzino M, Busnelli M, Antonucci F, Verderio C, Mazzanti M, Chini B. The Timing of the Excitatory-to-Inhibitory GABA Switch Is Regulated by the Oxytocin Receptor via KCC2. Cell Rep. 2016 Apr 5;15(1):96-103. doi:10.1016/j.celrep.2016.03.013
6. Marín O. Interneuron dysfunction in psychiatric disorders. Nat Rev Neurosci. 2012 Jan 18;13(2):107-20. doi: 10.1038/nrn3155. PMID: 22251963.
7. Remaud S, Ortiz FC, Perret-Jeanneret M, Aigrot MS, Gothié JD, et al. Transient hypothyroidism favors oligodendrocyte generation providing functional remyelination in the adult mouse brain. Elife. 2017 Sep 6;6:e29996. doi: 10.7554/eLife.29996. PMID: 28875931.
8. Korevaar TI, Muetzel R, Medici M, Chaker L, Jaddoe VW, et al. Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood: a population-based prospective cohort study. Lancet Diabetes Endocrinol. 2016 Jan;4(1):35-43. doi: 10.1016/S2213-8587(15)00327-7. PMID: 26497402
9. Korevaar TIM, Tiemeier H, Peeters RP. Clinical associations of maternal thyroid function with foetal brain development: Epidemiological interpretation and overview of available evidence. Clin Endocrinol (Oxf). 2018 Aug;89(2):129-138. doi: 10.1111/cen.13724. PMID: 29693263.
10. Kobayashi K, Tsuji R, Yoshioka T, Mino T, Seki T. Perinatal exposure to PTU delays switching from NR2B to NR2A subunits of the NMDA receptor in the rat cerebellum. Neurotoxicology. 2006 Mar;27(2):284-90. doi: 10.1016/j.neuro.2005.11.008. PMID: 16386794.
11. Salazar P, Villaseca P, Cisternas P, Inestrosa NC. Neurodevelopmental impact of the offspring by thyroid hormone system-disrupting environmental chemicals during pregnancy. Environ Res. 2021 Jun 1;200:111345. doi: 10.1016/j.envres.2021.111345. PMID: 34087190
12. Kauffman AS. Sexual differentiation and the Kiss1 system: hormonal and developmental considerations. Peptides. 2009 Jan;30(1):83-93. doi: 10.1016/j.peptides.2008.06.014. Epub 2008 Jul 3. PMID: 18644414.
13. Hrabovszky E, Ciofi P, Vida B, Horvath MC, Keller E, et al. The kisspeptin system of the human hypothalamus: sexual dimorphism and relationship with gonadotropin- releasing hormone and neurokinin B neurons. Eur J Neurosci. 2010 Jun;31(11):1984-98. doi: 10.1111/j.1460-9568.2010.07239.x. PMID: 20529119
14. Mhaouty-Kodja S. Role of the androgen receptor in the central nervous system. Mol Cell Endocrinol. 2018 Apr 15;465:103-112. doi: 10.1016/j.mce.2017.08.001. PMID: 28826929
15. Naulé L, Hardin-Pouzet H, Mhaouty-Kodja S. Estrogens and social and emotional related behaviors: role of estrogen receptor beta. Med Sci (Paris). 2021 Feb;37(2):117-119. doi: 10.1051/medsci/2020272. PMID: 33591251
16. Chan CB, Ye K. Sex differences in brain-derived neurotrophic factor signaling and functions. J Neurosci Res. 2017 Jan 2;95(1-2):328-335. doi: 10.1002/jnr.23863. PMID: 27870419
17. Brumana L, Arroyo A, Schwalbe NR, Lehtimaki S, Hipgrave DB. Maternal and child health services and an integrated, life-cycle approach to the prevention of non-communicable diseases. BMJ Glob Health. 2017 Aug 19;2(3):e000295. doi: 10.1136/bmjgh-2017-000295. PMID: 29082005
18. Barker DJP. Programming the baby. Mothers, babies and healt in later life. Edinburgh : Churchill Livingstone, 1998 : 13–42.
19. ECHA. Agreement of the member state committee on the identification of 4,4’-isopropylidenediphenol (Bisphenol A) as a substance of very high concern [Internet]. 2017. Disponible sur : https://echa.europa.eu/documents/10162/1c8a321c-7b59-7fe8-69f4-bfcce6de5cfe
20. Viguié C, Mhaouty-Kodja S, Habert R, Chevrier C, Michel C, Pasquier E. Evidence-based adverse outcome pathway approach for the identification of BPA as en endocrine disruptor in relation to its effect on the estrous cycle. Mol Cell Endocrinol 2018 Nov 5; 475:10-28. doi: 10.1016/j.mce.2018.02.007. PMID: 29577943
21. Mhaouty-Kodja S, Belzunces LP, Canivenc MC, Schroeder H, Chevrier C, Pasquier E. Impairment of learning and memory performances induced by BPA: Evidences from the literature of a MoA mediated through an ED. Mol Cell Endocrinol 2018 Nov 5; 475:54-73. doi: 10.1016/j.mce.2018.03.017. PMID: 29605460
22. Yeo M, Berglund K, Hanna M, Guo JU, Kittur J, et al. Bisphenol A delays the perinatal chloride shift in cortical neurons by epigenetic effects on the Kcc2 promoter. Proc Natl Acad Sci U S A. 2013 Mar 12;110(11):4315-20. doi: 10.1073/pnas.1300959110. PMID: 23440186
23. Kundakovic M, Gudsnuk K, Franks B, Madrid J, Miller RL, et al. Sex-specific epigenetic disruption and behavioral changes following low-dose in utero bisphenol A exposure. Proc Natl Acad Sci U S A. 2013 Jun 11 ;110 (24), 9956–61. doi: 10.1073/pnas.1214056110. PMID: 23716699
24. Jorgensen EM, Alderman MH,Taylor HS. Preferential epigenetic programming of estrogen response after in utero xenoestrogen (bisphenol-A) exposure. FASEB J. 2016 Sep ; 30(9):3194-201. doi: 10.1096/fj.201500089R. PMID: 27312807
25. Kyono Y, Sachs LM, Bilesimo P, Wen L & Denver RJ. Developmental and thyroid hormone regulation of the DNA methyltransferase 3a gene in xenopus tadpoles. Endocrinology 2016 Dec;157(12):4961–72. doi :10.1210/en.2016-1465. PMID: 27779916
26. Mustieles V, D'Cruz SC, Couderq S, Rodríguez-Carrillo A, Fini JB, et al. Bisphenol A and its analogues: A comprehensive review to identify and prioritize effect biomarkers for human biomonitoring. Environ Int. 2020 Nov;144:105811. doi: 10.1016/j.envint.2020.105811. PMID: 32866736.
27. Welcome to the Collaborative Adverse Outcome Pathway Wiki (AOP-Wiki) [Internet]. Disponible sur : AOPwiki.org
28. Kowiański P, Lietzau G, Czuba E, Waśkow M, Steliga A, Moryś J. BDNF: A Key Factor with Multipotent Impact on Brain Signaling and Synaptic Plasticity. Cell Mol Neurobiol. 2018 Apr;38(3):579-93. doi: 10.1007/s10571-017-0510-4. PMID: 28623429
29. Cubero-Millán I, Ruiz-Ramos MJ, Molina-Carballo A, Martínez-Serrano S, Fernández-López L, et al A. BDNF concentrations and daily fluctuations differ among ADHD children and respond differently to methylphenidate with no relationship with depressive symptomatology. Psychopharmacology (Berl). 2017 Jan;234(2):267-79. doi: 10.1007/s00213-016-4460-1. PMID: 27807606
30. Rodríguez-Carrillo A, Mustieles V, Pérez-Lobato R, Molina-Molina JM, Reina-Pérez I, et al. Bisphenol A and cognitive function in school-age boys: Is BPA predominantly related to behavior? Neurotoxicology. 2019 Sep;74:162-171. doi:10.1016/j.neuro.2019.06.006. PMID: 31238050
31. McKinney JD, Waller CL. Polychlorinated biphenyls as hormonally active structural analogues. Environ Health Perspect. 1994 Mar;102(3):290-7. doi: 10.1289/ehp.94102290. PMID: 8033869
32. Colborn T. Epidemiology of Great Lakes bald eagles. J Toxicol Environ Health. 1991 Aug;33(4):395-453. doi: 10.1080/15287399109531537. PMID: 1875429
33. Jacobson JL, Jacobson SW. Dose-response in perinatal exposure to polychlorinated biphenyls (PCBs): the Michigan and North Carolina cohort studies. Toxicol Ind Health. 1996 May-Aug;12(3-4):435-45. doi: 10.1177/074823379601200315. PMID: 8843560
34. Vermeir G, Covaci A, Van Larebeke N, Schoeters G, Nelen V, et al. Neurobehavioural and cognitive effects of prenatal exposure to organochlorine compounds in three year old children. BMC Pediatr. 2021 Feb 26;21(1):99. doi: 10.1186/s12887-021-02533-2. PMID: 33637059
35. Dickerson SM, Cunningham SL, Patisaul HB, Woller MJ, Gore AC. Endocrine disruption of brain sexual differentiation by developmental PCB exposure. Endocrinology. 2011 Feb;152(2):581-94. doi: 10.1210/en.2010-1103. PMID: 21190954
36. OMS. Polychlorinated biphenyls : human health aspects [Internet]. 2003. Disponible sur : www.who.int/ipcs/publications/cicad/en/cicad55.pdf?ua=1
37. AFSSA. Avis de l’Agence française de sécurité sanitaire des aliments relatif à l'établissement de teneurs maximales pertinentes en polychlorobiphényles qui ne sont pas de type dioxine (PCB « non dioxin-like », PCB-NDL) dans divers aliments [Internet]. 2007. Disponible sur : https://www.anses.fr/fr/system/files/RCCP2006sa0305b.pdf
38. Catenza CJ, Farooq A, Shubear NS, Donkor KK. A targeted review on fate, occurrence, risk and health implications of bisphenol analogues. Chemosphere. 2021 Apr;268:129273. doi: 10.1016/j.chemosphere.2020.129273. PMID: 33352513
Dans cet article
- Mise en place des axes hypothalamo-hypophysaires thyroïdien et gonadique
- Développement et maturation des neurones : action excitatrice puis inhibitrice du GABA
- Les hormones thyroïdiennes, essentielles au développement harmonieux du cerveau
- Importance des stéroïdes sexuels dans la différenciation de structures nerveuses
- Perturbations au cours du développement : exemples de xénobiotiques
- De nombreux perturbateurs endocriniens potentiels non encore évalués au plan sanitaire