L’être humain a développé au cours de l’évolution des stratégies toujours plus élaborées pour lutter contre les microbes. Toutefois, sa première défense est physique puisque la peau et les muqueuses sont les premières barrières exposées quotidiennement. Elles sont par ailleurs couvertes d’une flore microbienne, qui contribue également à cette défense. En 2e ligne, les défenses de l’hôte se rassemblent au sein du système immunitaire, qui contribue aussi à l’homéostasie d’autres systèmes (cardiovasculaire, nerveux et endocrinien) avec lesquels il interagit. Ainsi, les macrophages jouent un rôle important dans tous les tissus endocriniens de l’organisme, tant du point de vue physiologique que physiopathologique.1 Le fonctionnement du système immunitaire dépend de l’immunité innée et de l’immunité adaptative. Au cours de ce processus, des facteurs solubles (comme des hormones) et membranaires (récepteurs) permettent à de nombreux types cellulaires de communiquer entre eux. En outre, cette réponse s’articule avec la flore microbienne cutanée, pulmonaire ou intestinale. Si le XXe siècle a été celui de la compréhension des mécanismes physiologiques et physiopathologiques associés à la réponse immunitaire, le XXIe sera certainement celui de la prise en considération de l’environnement sur la santé humaine et de son impact sur les défenses de l’hôte.
Si la notion d’immunotoxicité est apparue dans les années 1970, l’impact de l’environnement sur la réponse immunitaire de l’hôte a été décrit dès les années 1930.2, 3 Ces travaux faisaient échos aux premières descriptions de Ramazzini, De morbis artificum diatriba (1713), et de Salter (1866), rapportant l’impact de particules atmosphériques sur l’irritation du poumon.4 De nombreuses substances ont depuis été classées comme immunotoxiques. L’immunotoxicité peut être observée dans plusieurs situations : environnementale, professionnelle et potentiellement thérapeutique, et se traduire par différentes manifestations qui vont de l’immunosuppression (à l’origine de tumeurs ou d’infections) à l’immunostimulation (à l’origine de maladies auto-immunes ou d’allergies). L’immunotoxicologie s’enrichit des découvertes en immunologie, comme celle de nouveaux types cellulaires ou d’immunomodulateurs tels que des hormones, constituant de nouvelles cibles potentielles pour les polluants environnementaux.
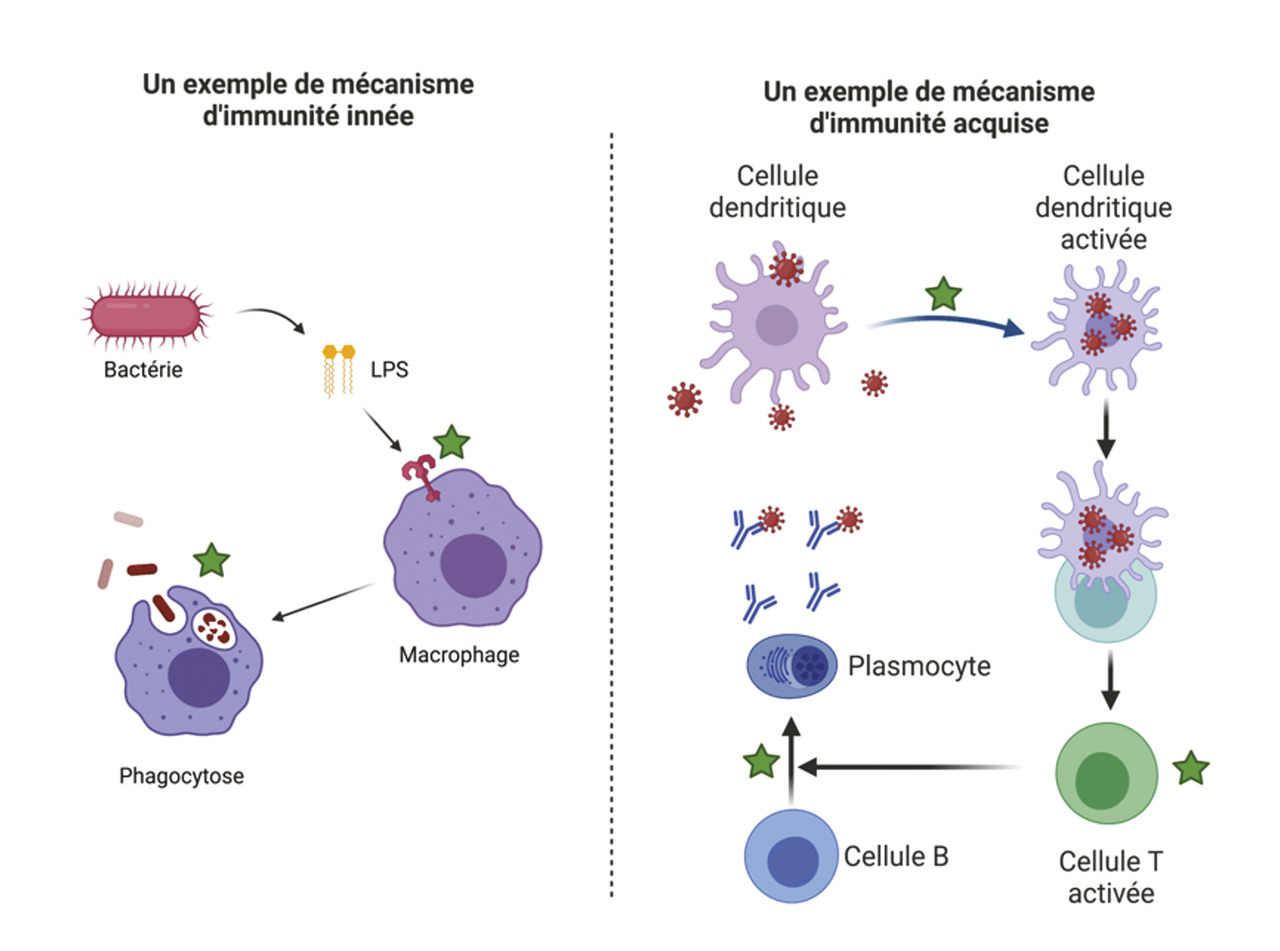
Immunités innée et adaptative
Ces deux composantes du système immunitaire possèdent des caractéristiques différentes (
L’immunité innée apparaît assez tôt dans l’évolution
Elle se caractérise par sa réactivité et une certaine forme de non-spécificité. Plusieurs cellules sentinelles, présentes au niveau des barrières de l’organisme (macrophages) ou du sang/de la lymphe (monocytes, polynucléaires neutrophiles, cellules NK, natural killer), détectent des structures particulières sur les microorganismes, les « pathogen associated molecular patterns » (PAMP), et des structures endogènes, les « damage-associated molecular patterns » (DAMP). Ainsi, les bactéries à Gram négatif expriment, à leur surface, des lipopolysaccharides détectés par le « toll-like receptor 4 » (TLR4) ; certains champignons portent des motifs polysaccharidiques détectés par les lectines (C-type lectin receptors, CLR). Les acides nucléiques étrangers sont, eux aussi, détectés à l’intérieur des cellules par des « RIG-I-like » récepteurs (RLR) pour l’ARN viral ou les TLR dans les endosomes. Les molécules du complément, sériques, participent à ces processus. Les signaux en aval de tous ces récepteurs déclenchent l’élimination de l’agent étranger : inflammation, phagocytose (capture des microbes ou des débris tissulaires), cytolyse (cellules NK).
L’immunité adaptative est apparue plus tard, avec les vertébrés
Elle relaie l’immunité innée et se caractérise par une spécificité et une mémoire. Cette réponse nécessite d’abord la présence de cellules de l’immunité innée, comme les cellules dendritiques, localisées au niveau des barrières. Elles présentent aux lymphocytes T des motifs issus des agents infectieux, grâce aux protéines du complexe majeur d’histocompatibilité ; ces lymphocytes T helper ou auxiliaires déclenchent l’activation des cellules effectrices (par exemple les lymphocytes T cytotoxiques). Des cellules mémoires sont aussi produites. Une catégorie de ces cellules T mémoires, les cellules T folliculaires auxiliaires (Tfh), joue un rôle important dans l’aide aux cellules B (lymphocytes B/plasmocytes), au niveau des follicules B des organes lymphoïdes, permettant la production d’immunoglobulines (Ig) ou anticorps. Un dérèglement de ces cellules Tfh peut conduire, dans le cadre d’une exacerbation, à des maladies auto-immunes ou, lors d’un déficit, à l’absence d’anticorps.5
L’organisme produit l’ensemble des répertoires T et B susceptibles de reconnaître les agents infectieux, mais seule la partie nécessaire du répertoire est amplifiée. Enfin, ces processus, tout comme ceux de l’immunité innée, sont régulés par des molécules solubles et des interactions cellulaires.
Des cibles pour des agents immunotoxiques
Toutes les cellules impliquées dans la réponse immunitaire possèdent des caractéristiques communes en termes de composition (ADN, membranes, organites). Leurs processus cellulaires (prolifération, différentiation, sécrétion) sont des cibles pour les agents immunotoxiques (
De l’immunosuppression à l’immunostimulation
Les immunotoxiques peuvent induire toute une gamme d’effets (
Immunosuppression
Les organochlorés sont des molécules organiques synthétisées volontairement (pesticides) ou involontairement (dioxine de Seveso ou 2,3,7,8-tétrachlorodibenzo-p-dioxine) au cours de processus industriels. L’exposition à ces composés a été associée (chez l’être humain) et liée (chez l’animal) à une immunosuppression. La dioxine, comme certains polychlorobiphényles (PCB, isolants interdits), sont des molécules persistantes car difficilement dégradées, présentes dans notre alimentation à faible concentration. Les dioxines et les PCB sont détectés par un récepteur appelé AhR (aryl hydrocarbon receptor).6 Celui-ci est exprimé, entre autres, dans les cellules dendritiques, les macrophages, les lymphocytes B et certains sous-types de cellules T, comme les cellules Th17 et Treg.7 Chez l’être humain, l’exposition à ces substances à haute dose conduit à une diminution de la concentration d’anticorps (IgA, IgM) et des lymphocytes T cytotoxiques, ce qui favoriserait les épisodes infectieux (otite, bronchite, pneumonie). Les enfants semblent particulièrement sensibles, selon ces études.8 Ces organochlorés pourraient aussi affecter la sécrétion de cytokines comme l’IL-10 et le TNF-alpha. En général, l’exposition à ces molécules se fait à bas bruit via l’alimentation, mais, au regard de leur persistance dans certains tissus (tissu adipeux, foie, cerveau), elles peuvent être libérées progressivement avec le temps.
Les métaux (plomb, mercure) tuent certaines cellules du système immunitaire par un processus d’apoptose ou de nécrose.9 Ils sont parfois associés aux pesticides organochlorés et revêtent ainsi différentes formes, comme le méthylmercure, particulièrement toxique pour les lymphocytes T et les monocytes.10 L’une des propriétés chimiques des formes ioniques du plomb, du mercure ou du cadmium est leur électrophilie, tout comme certaines molécules organiques (1,2-naphthoquinone, composant des gaz d’échappement des moteurs Diesel, formaldéhyde, crotonaldéhyde, un polluant de l’air intérieur, acroléine de la fumée de cigarette).11 Ces électrophiles provoquent un stress oxydant dans les cellules, capable de les endommager, voire de les tuer. Les travailleurs exposés au plomb sont plus sensibles aux infections grippales et expriment des taux sanguins d’immunoglobulines plus faibles que des personnes non exposées.12 L’étude d’une cohorte d’enfants du Bangladesh exposés à l’arsenic (à des niveaux dépassant la limite maximale de l’Organisation mondiale de la santé [OMS])13 a révélé une augmentation du taux de mortalité infantile et de l’incidence d’infections respiratoires, ainsi qu’une réduction du volume thymique.14, 15
L’immunostimulation peut se traduire par l’hypersensibilité ou l’auto-immunité
Ainsi, le nickel ou des dérivés du platine sont des agents hypersensibilisants à l’origine d’une production d’une sous-classe d’immunoglobulines, les IgE, associée aux maladies atopiques (rhinites allergiques, asthme, dermatites) et détectée par les mastocytes. Ceux-ci libèrent, par dégranulation, des molécules comme l’histamine et l’héparine, qui peuvent déclencher des rhinites et de l’asthme. Cette hypersensibilité peut être retardée, comme dans le cas du nickel, du chrome, du mercure et du cobalt, qui déclenchent des dermatoses de contact.11 Cette activation des mastocytes conduit au recrutement de cellules T cytotoxiques.16 Incontrôlée, elle pourrait aussi avoir une incidence sur les fonctions cérébrales.17
Le déclenchement d’une auto-immunité a aussi été rapporté. Ainsi, le mercure et l’or induisent des glomérulonéphrites.18 Le mercure, le cadmium ou le plomb peuvent aussi induire une pathologie proche du lupus érythémateux systémique chez les souris et les rats, caractérisé par la production d’auto-anticorps.11 L’effet du mercure pourrait sembler paradoxal car il interfère avec la réponse lymphocytaire19 en entraînant la mort des cellules. Néanmoins, à de faibles concentrations, ce métal favorise non seulement la survie de certaines cellules T mais aussi l’activation de l’inflammasome, s’accompagnant ultérieurement d’une forme de mort lytique, la pyroptose.9, 20 La dose d’exposition est donc un paramètre toxicologique clé qu’il est important de considérer en immunotoxicologie.
L’activation du récepteur AhR par des composés organiques peut aussi être associée à une immunostimulation aberrante et ainsi à des maladies auto-immunes, notamment la polyarthrite rhumatoïde, le lupus érythémateux disséminé, la sclérose en plaques, le diabète de type 1, la maladie de Behçet ou la myasthénie. L’activité de ce récepteur dépend de son ligand ; ainsi, un polluant comme la dioxine de Seveso peut avoir des effets totalement opposés à ceux d’un ligand endogène comme le 6-formylindolo[3,2-b]carbazole (FICZ), un dérivé du tryptophane. L’expansion des lymphocytes Treg (immunomodulateurs) et Th17 (immunostimulateurs favorisant l’auto-immunité) est régulée par l’AhR.21 En conséquence, l’administration de ligands ou de médicaments AhR s’est avérée efficace dans certaines maladies ou modèles auto-immuns.
D’inquiétantes pollutions émergentes
Les molécules citées sont des polluants de l’environnement connus depuis de nombreuses années et des PE pour la plupart d’entre elles. Elles font l’objet de réglementations (dioxines, métaux, pesticides), voire d’interdictions (PCB, bisphénol A, phtalates), permettant de réduire l’exposition humaine. Certaines pollutions apparaissent au contraire comme émergentes, du fait de l’intensification des activités anthropiques (industrie, moteurs à combustion) ou de la prise de conscience récente des populations et pouvoirs politiques. Leurs effets sur le système immunitaire commencent à faire l’objet d’études.
Les particules fines produites par les moteurs à combustion
Elles véhiculent des hydrocarbures aromatiques polycycliques (HAP) qui sont aussi des ligands de l’AhR. Les particules sont connues pour exacerber les maladies allergiques, l’état d'immunodépression et les maladies auto-immunes11 ; l’exposition prénatale aux HAP est associée à un risque accru de sensibilisation allergique et de respiration sifflante dans la petite enfance. L’étude d’une cohorte récente suggère que l’exposition aux particules est un facteur de risque de sclérose en plaques et d’accident vasculaire cérébral. À l’appui de ces observations cliniques, l’application chronique de 7,12-diméthylbenz[a]anthracène (DMBA), un HAP, induit des lésions cutanées de type atopique sur la peau de souris et impacte la réponse immune, in utero et chez les nouveau-nés.22 L’âge des individus est aussi un élément clé.23 Outre le rôle de l’AhR, la voie KEAP1 (Kelch-like ECH-associated protein 1), un inhibiteur du NRF2 (nuclear factor erythroid 2-related factor 2), est impliquée dans la détoxification des polluants environnementaux ; NRF2 est un facteur sensible à la production des espèces réactives de l’oxygène11, rapporté comme important pour la réponse immunitaire, innée comme adaptative.24
Les micro- et nanoplastiques
Ils provoquent une immunosuppression chez les organismes marins tels que les phoques, les dauphins et les cétacés. Les nanoplastiques se composent essentiellement de polystyrène, de polyéthylène de faible et haute densité, de polypropylène, de polyéthylène téréphtalate, de polyamide, ou encore de polyméthacrylate de méthyle (PMMA, polymethyl methacrylate). L’être humain ingère chaque semaine l’équivalent d’une carte de crédit (5 g) de ces éléments, qui adsorbent à leur surface des polluants comme le bisphénol A, qui peuvent accroître l’inflammation (être humain, animaux).25 Cette différence (immunosuppression ou inflammation) s’explique par la diversité des formes de micro- et nanoplastiques auxquelles les organismes sont exposés et par la variété de polluants que ces particules sont susceptibles de porter et de libérer.26 Les microparticules de petite taille auraient plus d’impact que celles de grande taille, entraînant la production de radicaux oxygénés, diminuant les fonctions phagocytaires27 ou induisant l’apoptose.28
Les organofluorés également incriminés dans les dérèglements immunologiques
Ces substances, per- et polyfluoroalkylées, sont parfois surnommées « forever chemicals » du fait de leur persistance dans l’environnement. Elles sont absorbées par ingestion, par l’air et par contact. Il s’agit de composés comme l’acide perfluorooctanesulfonique et l’acide perfluorooctanoïque, qui sont présents dans le sang, malgré leur interdiction. Ils ont des effets potentiels chez l’adulte et les enfants. Ils entraîneraient une inflammation29 à travers une atteinte mitochondriale et l’activation d’un « senseur » (« sensor »), la protéine AIM2 (« absent in melanoma 2, or interferon-inducible protein »).30 En outre, ces organofluorés affecteraient les réponses vaccinales,31, 32 et favoriseraient des infections pulmonaires comme celles du SARS-CoV-2.33
Des interactions complexes entre exposome et immunité
Les agents immunotoxiques peuvent, en cas de forte exposition ou imprégnation, conduire à des pathologies en lien avec le système immunitaire, à travers des processus inflammatoires chroniques ou des immunodéficiences, favorisant certaines infections. L’exposition aux polluants atmosphériques a déjà été associée à l’apparition de pathologies respiratoires, comme la grippe ou la rougeole. Des études épidémiologiques ont également associé exposition à la pollution atmosphérique et augmentation des cas d’infection par le SARS-CoV-2. Dioxyde d’azote (NO2), ozone (O3) et particules (véhiculant des composants organiques comme les hydrocarbures aromatiques polycycliques), pourraient affecter des paramètres clés de la pathologie (production de cytokines) ou la phagocytose macrophagique. L’exposition de la population générale aux polluants, à bas bruit, n’explique probablement pas tout, mais elle sensibilise les organismes et augmente le risque de développer certaines pathologies, en contribuant à fragiliser certains processus clés du système immunitaire. La prise en compte de l’ensemble de l’exposome* revêt donc une importance certaine dans ce champ disciplinaire complexe, que les pouvoirs publics devront prendre en compte pour décider des orientations à venir.
* Exposome : ensemble des expositions qui peuvent influencer la santé humaine tout au long de la vie.
1. Rehman A, Pacher P, Haskó G. Role of macrophages in the endocrine system. Trends Endocrinol Metab. 2021 Apr;32(4):238-56.
2. Campbell JM. Acute Symptoms following Work with Hay. Br Med J. 1932;2:1143-4.
3. Cooke WE. Pulmonary Asbestosis. Br Med J. 1927 Dec 3;2(3491):1024-5.
4. Salter H. An analysis of a hundred and fifty unpublished cases of asthma. Lancet 1866.
5. Moukambi F, Rodrigues V, Fortier Y, Rabezanahary H, Borde C, et al. CD4 T follicular helper cells and HIV infection: friends or enemies? Front Immunol. 2017 Feb 20;8:135.
6. Juricek L, Coumoul X. The aryl hydrocarbon receptor and the nervous system. Int J Mol Sci [Internet]. 2018 [cité 4 avril 2021];19(9). Disponible sur : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6163841/
7. Vogel CFA, Van Winkle LS, Esser C, Haarmann-Stemmann T. The aryl hydrocarbon receptor as a target of environmental stressors – Implications for pollution mediated stress and inflammatory responses. Redox Biol. 2020 Jul;34:101530.
8. Dietert RR. Developmental immunotoxicity, perinatal programming, and noncommunicable diseases: focus on human studies. Adv Med. 2014;2014:867805.
9. Estaquier J, Vallette F, Vayssiere J-L, Mignotte B. The mitochondrial pathways of apoptosis. Adv Exp Med Biol. 2012;942:157‑83.
10. Shenker BJ, Datar S, Mansfield K, Shapiro IM. Induction of apoptosis in human T-cells by organomercuric compounds: a flow cytometric analysis. Toxicol Appl Pharmacol. 1997 Apr;143(2):397‑406.
11. Suzuki T, Hidaka T, Kumagai Y, Yamamoto M. Environmental pollutants and the immune response. Nat Immunol. 2020 Dec;21(12):1486‑95.
12. Ewers U, Stiller-Winkler R, Idel H. Serum immunoglobulin, complement C3, and salivary IgA levels in lead workers. Environ Res. 1982 Dec;29(2):351‑7.
13. Hughes MF, Beck BD, Chen Y, Lewis AS, Thomas DJ. Arsenic exposure and toxicology: a historical perspective. Toxicol Sci. 2011 Oct;123(2):305‑32.
14. Moore SE, Prentice AM, Wagatsuma Y, Fulford AJC, Collinson AC, et al. Early-life nutritional and environmental determinants of thymic size in infants born in rural Bangladesh. Acta Paediatr. 2009 Jul;98(7):1168‑75.
15. Rahman A, Vahter M, Ekström EC, Rahman M, Golam Mustafa AH, et al. Association of arsenic exposure during pregnancy with fetal loss and infant death: a cohort study in Bangladesh. Am J Epidemiol. 2007 Jun 15;165(12):1389‑96.
16. Villani AP, Rozieres A, Bensaid B, Eriksson KK, Mosnier A, et al. Massive clonal expansion of polycytotoxic skin and blood CD8 + T cells in patients with toxic epidermal necrolysis. Sci Adv. 2021 Mar;7(12):eabe0013.
17. Ocak U, Ocak PE, Wang A, Zhang JH, Boling W, et al. Targeting mast cell as a neuroprotective strategy. Brain Inj. 2019;33(6):723‑33.
18. Druet E, Sapin C, Günther E, Feingold N, Druet P. Mercuric chloride-induced anti-glomerular basement membrane antibodies in the rat: genetic control. Eur J Immunol. 1977 Jun;7(6):348‑51.
19. Levin M, Jasperse L, Desforges JP, O’Hara T, Rea L, et al. Methyl mercury (MeHg) in vitro exposure alters mitogen-induced lymphocyte proliferation and cytokine expression in Steller sea lion (Eumetopias jubatus) pups. Sci Total Environ. 2020 Jul 10;725:138308.
20. Spel L, Martinon F. Inflammasomes contributing to inflammation in arthritis. Immunol Rev. 2020 Mar;294(1):48‑62.
21. Quintana FJ. The aryl hydrocarbon receptor: a molecular pathway for the environmental control of the immune response. Immunology. 2013 Mar;138(3):183‑9.
22. Rychlik KA, Secrest JR, Lau C, Pulczinski J, Zamora ML, et al. In utero ultrafine particulate matter exposure causes offspring pulmonary immunosuppression. Proc Natl Acad Sci U S A. 2019 Feb 26;116(9):3443‑8.
23. Al Zallouha M, Landkocz Y, Méausoone C, Ledoux F, Visade F, et al. A prospective pilot study of the T-lymphocyte response to fine particulate matter exposure. J Appl Toxicol. 2020 May;40(5):619‑30.
24. Pyaram K, Kumar A, Kim YH, Noel S, Reddy SP, et al. Keap1-Nrf2 system plays an important role in invariant natural killer T cell development and homeostasis. Cell Rep. 2019 Apr 16;27(3):699-707.e4.
25. Prata JC, da Costa JP, Lopes I, Duarte AC, Rocha-Santos T. Environmental exposure to microplastics: An overview on possible human health effects. Sci Total Environ. 2020 Feb 1;702:134455.
26. Sharifinia M, Bahmanbeigloo ZA, Keshavarzifard M, Khanjani MH, Lyons BP. Microplastic pollution as a grand challenge in marine research: A closer look at their adverse impacts on the immune and reproductive systems. Ecotoxicol Environ Saf. 2020 Nov;204:111109.
27. Sendra M, Carrasco-Braganza MI, Yeste PM, Vila M, Blasco J. Immunotoxicity of polystyrene nanoplastics in different hemocyte subpopulations of Mytilus galloprovincialis. Sci Rep. 2020 May 25;10(1):8637.
28. Canesi L, Ciacci C, Bergami E, Monopoli MP, Dawson KA, et al. Evidence for immunomodulation and apoptotic processes induced by cationic polystyrene nanoparticles in the hemocytes of the marine bivalve Mytilus. Mar Environ Res. 2015 Oct;111:34‑40.
29. Han R, Hu M, Zhong Q, Wan C, Liu L, et al. Perfluorooctane sulphonate induces oxidative hepatic damage via mitochondria-dependent and NF-κB/TNF-α-mediated pathway. Chemosphere. 2018 Jan;191:1056‑64.
30. Wang LQ, Liu T, Yang S, Sun L, Zhao ZY, et al. Perfluoroalkyl substance pollutants activate the innate immune system through the AIM2 inflammasome. Nat Commun. 2021 May 18;12(1):2915.
31. Grandjean P, Heilmann C, Weihe P, Nielsen F, Mogensen UB, et al. Estimated exposures to perfluorinated compounds in infancy predict attenuated vaccine antibody concentrations at age 5-years. J Immunotoxicol. 2017 Dec;14(1):188‑95.
32. Grandjean P, Heilmann C, Weihe P, Nielsen F, Mogensen UB, Budtz-Jørgensen E. Serum vaccine antibody concentrations in adolescents exposed to perfluorinated compounds. Environ Health Perspect. 2017 Jul 26;125(7):077018.
33. Grandjean P, Timmermann CAG, Kruse M, Nielsen F, Vinholt PJ, et al. Severity of COVID-19 at elevated exposure to perfluorinated alkylates. Meliker J, ed. PLoS ONE. 2020 Dec 31;15(12):e0244815.