La physiopathologie des maladies inflammatoires chroniques intestinales (MICI) implique une réponse inflammatoire exacerbée de l’intestin en réponse à des facteurs combinés tels que des facteurs environnementaux, génétiques, et le microbiote intestinal. Grâce à l’avènement d’outils nouveaux, on assiste aujourd’hui à une véritable redécouverte de ce monde microbien intestinal. Il s’intègre dans un écosystème digestif extrêmement complexe, et est responsable de fonctions physiologiques importantes. Les MICI restent le champ médical exemplaire pour étudier l’impact du microbiote intestinal en santé humaine. La dysbiose a été initialement décrite au cours de ces maladies et cela a initié des avancées majeures dans la compréhension de ces maladies et des développements thérapeutiques innovants. Répondre à la question du rôle du microbiote intestinal dans les MICI reste donc pertinent.
Dysbiose compositionnelle : bactérienne, fungique, virale
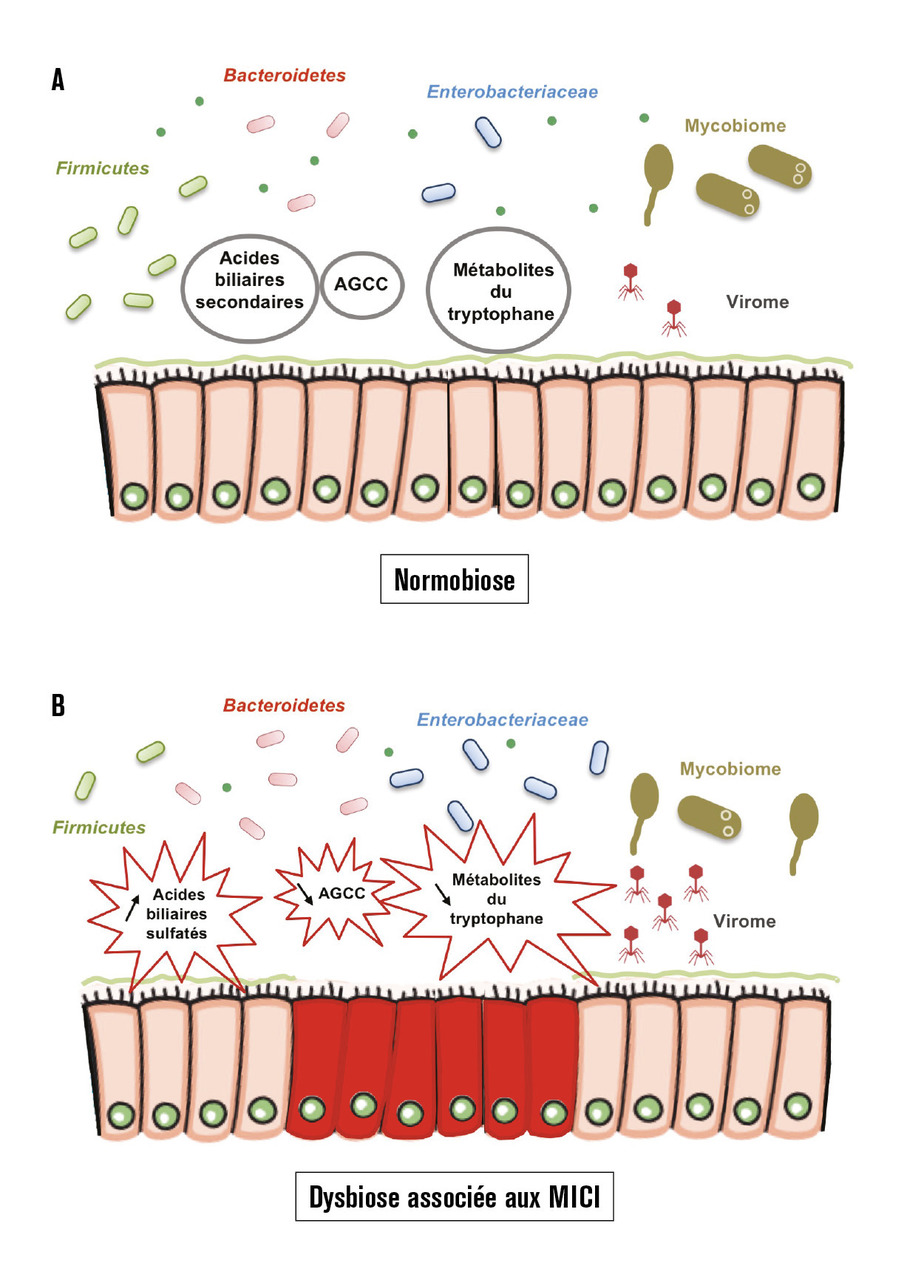
Plutôt que l’identification de bactéries marqueurs, ce sont des profils compositionnels et fonctionnels qui témoignent d’une dysbiose. Chez les patients ayant une MICI, il existe une dysbiose caractérisée par un déséquilibre des populations de micro-organismes composant le microbiote, accompagnée d’une diminution de la diversité (v. tableau ).
Les changements des populations bactériennes ont été très étudiées dans le cadre des MICI. On observe une diminution des bactéries « bénéfiques » telles que celles appartenant au phylum des Firmicutes, tandis que la proportion de bactéries présumées défavorables (pro-inflammatoires), comme les Proteobacteria, est amplifiée. Certaines bactéries retrouvées typiquement au cours des MICI, comme les Escherichia coli adhérents et invasifs (AIEC) – présents chez un tiers des patients atteints de maladie de Crohn iléale – ont été particulièrement étudiées.1 L’inflammation, délétère pour la barrière intestinale, facilite la colonisation par les AIEC, résultant en une réaction pro-inflammatoire exacerbée et témoignant de la rupture de la symbiose hôte-microbiote.
Bien que moins nombreux et moins explorés que les bactéries, les champignons semblent également jouer un rôle au cours des MICI. La composition et la diversité du mycobiome de l’écosystème intestinal sont perturbées. De plus, il existe des interactions spécifiques entre bactéries et champignons illustrant un dialogue inter-règne, avec des différences entre les patients atteints d’une rectocolite hémorragique et ceux atteints de la maladie de Crohn.2
Également présente dans le microbiote, l’impact de la population virale (virus des eucaryotes, bactériophages) est assez peu étudié dans le cadre des MICI. Il a néanmoins été montré une altération du virome intestinal au cours de la maladie de Crohn et de la rectocolite hémorragique, avec une augmentation des bactériophages. Il en émerge donc un modèle où le virome contribue, tout comme les bactéries, à cette dysbiose.3
Les interactions au sein de l’écosystème intestinal, entre micro-organismes (bactérie-bactérie) ainsi qu’entre deux règnes (bactérie-champignon ou bactérie-hôte) sont un point majeur d’étude pour la compréhension des MICI. En effet, le patrimoine génétique de l’hôte agit sur la composition du microbiote. Des polymorphismes de certains gènes impliqués dans ce dialogue hôte-microbiote (NOD2, CARD9, etc.) sont retrouvés chez les patients ayant une MICI. La complexité de ces interactions et leur impact sont à l’étude au cours des MICI.
Les changements des populations bactériennes ont été très étudiées dans le cadre des MICI. On observe une diminution des bactéries « bénéfiques » telles que celles appartenant au phylum des Firmicutes, tandis que la proportion de bactéries présumées défavorables (pro-inflammatoires), comme les Proteobacteria, est amplifiée. Certaines bactéries retrouvées typiquement au cours des MICI, comme les Escherichia coli adhérents et invasifs (AIEC) – présents chez un tiers des patients atteints de maladie de Crohn iléale – ont été particulièrement étudiées.1 L’inflammation, délétère pour la barrière intestinale, facilite la colonisation par les AIEC, résultant en une réaction pro-inflammatoire exacerbée et témoignant de la rupture de la symbiose hôte-microbiote.
Bien que moins nombreux et moins explorés que les bactéries, les champignons semblent également jouer un rôle au cours des MICI. La composition et la diversité du mycobiome de l’écosystème intestinal sont perturbées. De plus, il existe des interactions spécifiques entre bactéries et champignons illustrant un dialogue inter-règne, avec des différences entre les patients atteints d’une rectocolite hémorragique et ceux atteints de la maladie de Crohn.2
Également présente dans le microbiote, l’impact de la population virale (virus des eucaryotes, bactériophages) est assez peu étudié dans le cadre des MICI. Il a néanmoins été montré une altération du virome intestinal au cours de la maladie de Crohn et de la rectocolite hémorragique, avec une augmentation des bactériophages. Il en émerge donc un modèle où le virome contribue, tout comme les bactéries, à cette dysbiose.3
Les interactions au sein de l’écosystème intestinal, entre micro-organismes (bactérie-bactérie) ainsi qu’entre deux règnes (bactérie-champignon ou bactérie-hôte) sont un point majeur d’étude pour la compréhension des MICI. En effet, le patrimoine génétique de l’hôte agit sur la composition du microbiote. Des polymorphismes de certains gènes impliqués dans ce dialogue hôte-microbiote (NOD2, CARD9, etc.) sont retrouvés chez les patients ayant une MICI. La complexité de ces interactions et leur impact sont à l’étude au cours des MICI.
Dysbiose fonctionnelle
Les perturbations écologiques observées au cours des MICI ne se limitent pas à une dysbiose compositionnelle. Il existe aussi une perte de certaines fonctions symbiotiques au cours de l’inflammation intestinale. Les techniques dites « omics » permettent désormais d’obtenir des informations sur les espèces bactériennes (séquençage de nouvelle génération à haut débit) mais aussi sur les fonctions métaboliques du microbiome (métatranscriptomique, métabolomique, peptidomique).
Différentes anomalies métaboliques secondaires à une dysbiose associée aux MICI ont été décrites, et leurs mécanismes d’action sur les voies immunitaires et la réaction inflammatoire sont actuellement à l’étude (v. figure ). Au cours des MICI, des fonctions importantes pour l’homéostasie intestinale sont altérées, voici quelques exemples. Les acides gras à chaîne courte, tels que le butyrate, représentent une source d’énergie pour les cellules et les bactéries et peuvent aussi exercer une modulation de l’expression des gènes et activer la prolifération cellulaire et la réponse immunitaire. Ils sont issus de la fermentation bactérienne des fibres végétales. Les espèces capables de cette digestion sont diminuées en situation inflammatoire. Les métabolites du tryptophane modifient la physiologie de l’hôte non seulement en diminuant le tryptophane disponible mais aussi en produisant les dérivés indoles qui activent le récepteur d’aryl d’hydrocarbone (AhR) qui joue un rôle clé dans l’intestin. Une modification du métabolisme du tryptophane, avec notamment une diminution de la production d’agoniste AhR est observée dans le microbiome des patients atteints de MICI.4, 5 Parmi les molécules rencontrées par le microbiote, les acides biliaires occupent une place primordiale. Synthétisés par le foie, ils subissent des modifications moléculaires importantes portées par le microbiote (déconjugaison, transformation, désulfatation, isomérisation, etc.) et représentent donc le produit emblématique d’un co-métabolisme. Au cours des MICI, les modifications de l’écosystème bactérien entraînent donc de fait une altération du métabolisme des acides biliaires avec une augmentation des acides biliaires conjugués et sulfatés et une diminution des acides biliaires secondaires. Ces profils altérés d’acides biliaires fécaux peuvent être utilisés pour le diagnostic et l’évaluation des patients atteints de MICI. Les acides biliaires secondaires ont des propriétés anti-inflammatoires et les acides biliaires sulfatés peuvent provoquer une colite chez la souris. Faecalibacterium prausnitzii produit une protéine (microbial anti-inflammatory molecule) capable d’inhiber l’activation des voies pro-inflammatoires et de prévenir le développement de la colite chez la souris6 ainsi que d’autres métabolites protecteurs, dont l’acide salicylique. Les acyl-homosérine lactones, molécules du quorum sensing (dialogue inter-bactérien) connues dans les éco-systèmes marins, sont diminuées dans les MICI et ont un effet anti-inflammatoire sur les cellules de la muqueuse intestinale cultivées in vitro. Une étude récente « multi-omics » corrélant la dysbiose aux anomalies métaboliques a permis de confirmer les anomalies sus-citées et met en évidence de façon globale une diminution des métabolites chez les patients atteints de MICI, suggérant une perte de la diversité métabolique chez ces patients.7, 8
Différentes anomalies métaboliques secondaires à une dysbiose associée aux MICI ont été décrites, et leurs mécanismes d’action sur les voies immunitaires et la réaction inflammatoire sont actuellement à l’étude (
Aspects thérapeutiques
L’idée de manipuler le microbiote avec l’objectif de restaurer une normobiose compositionnelle ou fonctionnelle pour contrôler et prévenir l’inflammation intestinale découle naturellement des connaissances acquises sur le microbiote. Les moyens pour y parvenir au-delà des antibiotiques sont l’utilisation de pré- et/ou probiotiques, et, de façon plus pragmatique, la transplantation de microbiote fécal.
Aucun prébiotique (substrats de certaines bactéries) n’a montré d’efficacité dans ces maladies. Des probiotiques, micro-organismes vivants, non pathogènes et qui, lorsqu’ils sont administrés en quantité suffisante, impactent positivement la santé de l’hôte, ont fait l’objet d’essais randomisés. Au cours de la maladie de Crohn, de nombreux essais avec différents probiotiques ont été réalisés sans qu’aucun n’ait été concluant. En revanche, au cours de la rectocolite hémorragique, une souche spécifique d’E. coli, la souche Nissle 1917, est aussi efficace que l’acide 5-aminosalicylique (5-ASA), traitement de première ligne.9 Les résultats les plus probants ont été obtenus au cours de la pochite, une inflammation du réservoir iléal après coloproctectomie totale pour rectocolite hémorragique. Le VSL#3, mélange de 8 souches bactériennes, a montré son efficacité dans la prévention et dans le maintien en rémission de la pochite.10 L’autre grande voie de manipulation du microbiote intestinal est la transplantation de microbiote fécal. Cette procédure commence à être évaluée dans la rectocolite hémorragique à travers des essais cliniques avec quatre essais randomisés contrôlés dont trois sont positifs.11 Au cours de la maladie de Crohn, les essais sont en cours. La place de la transplantation fécale dans les MICI reste bien sûr à préciser dans les années à venir.
D’autres voies telles que l’utilisation de probiotiques génétiquement modifiés pour la production de métabolites actifs,12 l’utilisation de phages, de composés actifs issus du microbiote ou de l’hôte (peptides antimicrobiens, acides biliaires, etc.) restent du domaine de la recherche.13
Aucun prébiotique (substrats de certaines bactéries) n’a montré d’efficacité dans ces maladies. Des probiotiques, micro-organismes vivants, non pathogènes et qui, lorsqu’ils sont administrés en quantité suffisante, impactent positivement la santé de l’hôte, ont fait l’objet d’essais randomisés. Au cours de la maladie de Crohn, de nombreux essais avec différents probiotiques ont été réalisés sans qu’aucun n’ait été concluant. En revanche, au cours de la rectocolite hémorragique, une souche spécifique d’E. coli, la souche Nissle 1917, est aussi efficace que l’acide 5-aminosalicylique (5-ASA), traitement de première ligne.9 Les résultats les plus probants ont été obtenus au cours de la pochite, une inflammation du réservoir iléal après coloproctectomie totale pour rectocolite hémorragique. Le VSL#3, mélange de 8 souches bactériennes, a montré son efficacité dans la prévention et dans le maintien en rémission de la pochite.10 L’autre grande voie de manipulation du microbiote intestinal est la transplantation de microbiote fécal. Cette procédure commence à être évaluée dans la rectocolite hémorragique à travers des essais cliniques avec quatre essais randomisés contrôlés dont trois sont positifs.11 Au cours de la maladie de Crohn, les essais sont en cours. La place de la transplantation fécale dans les MICI reste bien sûr à préciser dans les années à venir.
D’autres voies telles que l’utilisation de probiotiques génétiquement modifiés pour la production de métabolites actifs,12 l’utilisation de phages, de composés actifs issus du microbiote ou de l’hôte (peptides antimicrobiens, acides biliaires, etc.) restent du domaine de la recherche.13
VERS UNE MÉDECINE DE PRÉCISION
La dysbiose initialement décrite au cours des MICI correspond à un déséquilibre de l’écosystème entraînant des anomalies dans la composition du microbiote, avec des conséquences fonctionnelles sur des mécanismes de symbiose entre le microbiote et l’hôte. Parmi ces modifications de l’écosystème, on retient une diminution globale de métabolites d’origine bactérienne avec en particulier une perte d’éléments protecteurs tels que certains acides biliaires, certains métabolites du tryptophane, ou les acides gras à chaîne courte. L’étude du microbiote au cours des MICI a permis des avancées majeures dans la compréhension de ces maladies et des développements thérapeutiques innovants. La modulation du microbiote est à l’étude au cours des MICI et pourrait rapidement trouver sa place dans les stratégies thérapeutiques. À l’heure de la multidisciplinarité, requise pour la prise en charge des maladies chroniques, l’intégration des données du microbiote intestinal incarne parfaitement la pratique de la médecine moderne et la médecine de précision.