Les patients en échec de traitement de première ligne (10 à 15 % des stades localisés et 20 à 30 % des stades avancés) peuvent être guéris par une chimiothérapie de rattrapage suivie d’une intensification thérapeutique et d’une autogreffe de cellules souches hématopoïétiques. Cette stratégie thérapeutique est envisageable chez des patients éligibles sur leur âge, avec une maladie chimiosensible au rattrapage et selon les comorbidités associées.
Quelle est la stratégie actuelle pour les patients éligibles à l’autogreffe ?
La stratégie thérapeutique des patients éligibles à l’autogreffe permet d’aborder l’importance de la réponse sur la tomographie par émission de positons (TEP) prégreffe, le choix du protocole de rattrapage afin d’atteindre une réponse optimale, l’indication d’un traitement d’entretien post-greffe, les nouveaux traitements post-autogreffe et les discussions récentes autour de l’allogreffe.
La biopsie d’un ganglion est indispensable pour confirmer la rechute ou la progression, notamment si la localisation n’était pas un territoire atteint au diagnostic.
Les facteurs pronostiques identifiés chez les patients en rechute sont le caractère réfractaire primaire ou la rechute précoce avant un an, une atteinte extranodale, un stade disséminé à la rechute, un échec du traitement de rattrapage, et l’absence de rémission complète sur la TEP prégreffe.
La biopsie d’un ganglion est indispensable pour confirmer la rechute ou la progression, notamment si la localisation n’était pas un territoire atteint au diagnostic.
Les facteurs pronostiques identifiés chez les patients en rechute sont le caractère réfractaire primaire ou la rechute précoce avant un an, une atteinte extranodale, un stade disséminé à la rechute, un échec du traitement de rattrapage, et l’absence de rémission complète sur la TEP prégreffe.
Pourquoi la réponse complète prégreffe à la TEP est-elle un objectif important dans la prise en charge des patients en rechute ?
La réponse TEP après une chimiothérapie de rattrapage est le facteur pronostique le plus important pour le contrôle de la maladie à long terme. La TEP prégreffe est également prédictive de la survie globale.1,2
Quelle chimiothérapie de rattrapage pour obtenir la réponse prégreffe ?
Différents protocoles de polychimiothérapie (ICE, DHAP, ESHAP, GVD)* sont utilisés comme standard de rattrapage, permettant d’obtenir des taux de réponse comparables (30 à 50 % de réponse complète). Afin d’obtenir de meilleurs taux de réponse complète, de nouveaux médicaments ont été associés à ces protocoles.
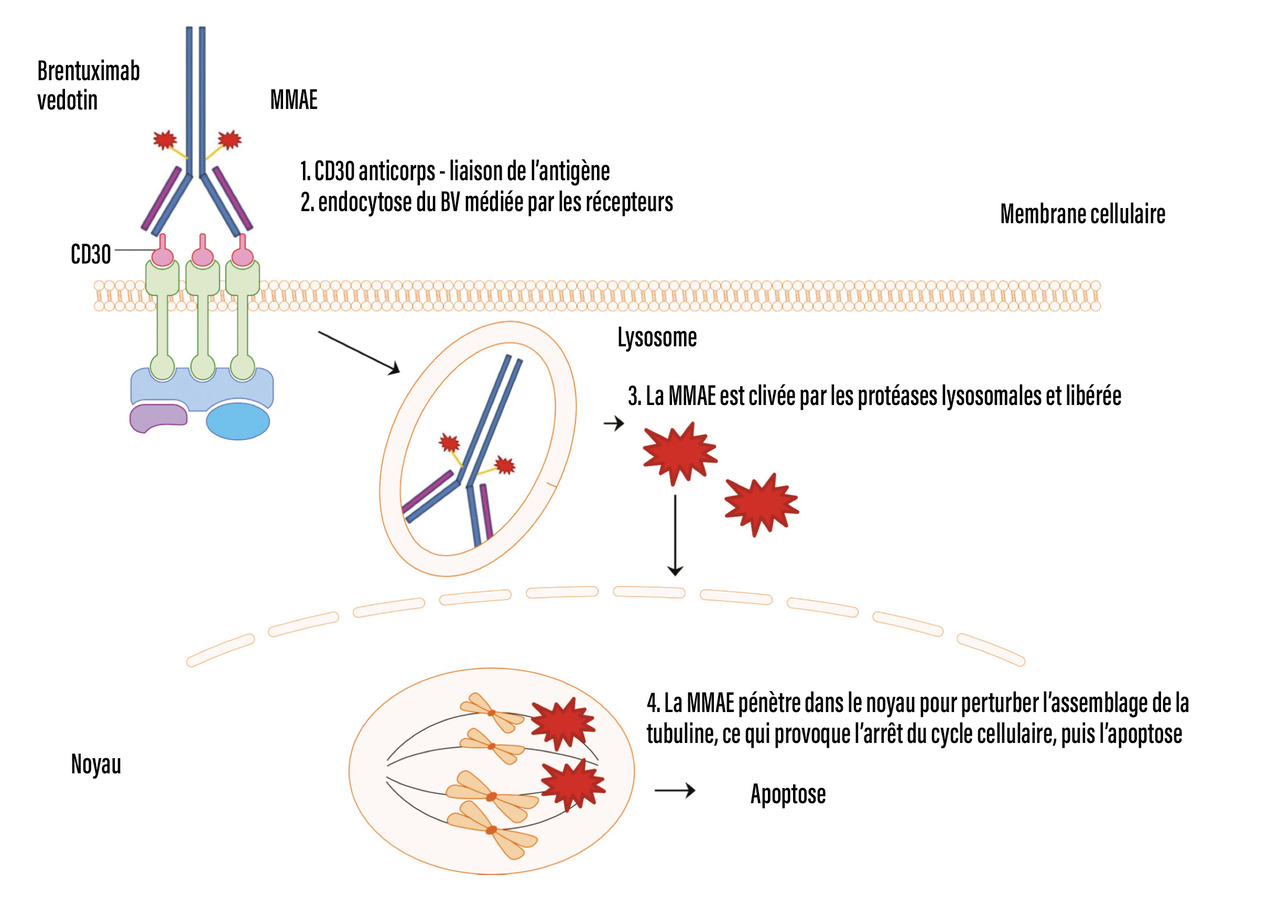
fig. 1 ), apporte 35 % de réponse complète en monothérapie. L’addition de BV au protocole de rattrapage (BV-ICE, BV-DHAP) a amélioré le taux de réponse complète (70-80 %) et n’a pas ajouté de toxicité significative, ni empêché la collecte des cellules souches. La bendamustine a aussi été associée au BV, permettant d’obtenir des taux de rémission complète de 74 %. Une association intéressante en première ligne de rattrapage, n’utilisant pas le BV, est le BeGeV, associant bendamustine, gemcitabine et vinorelbine.3
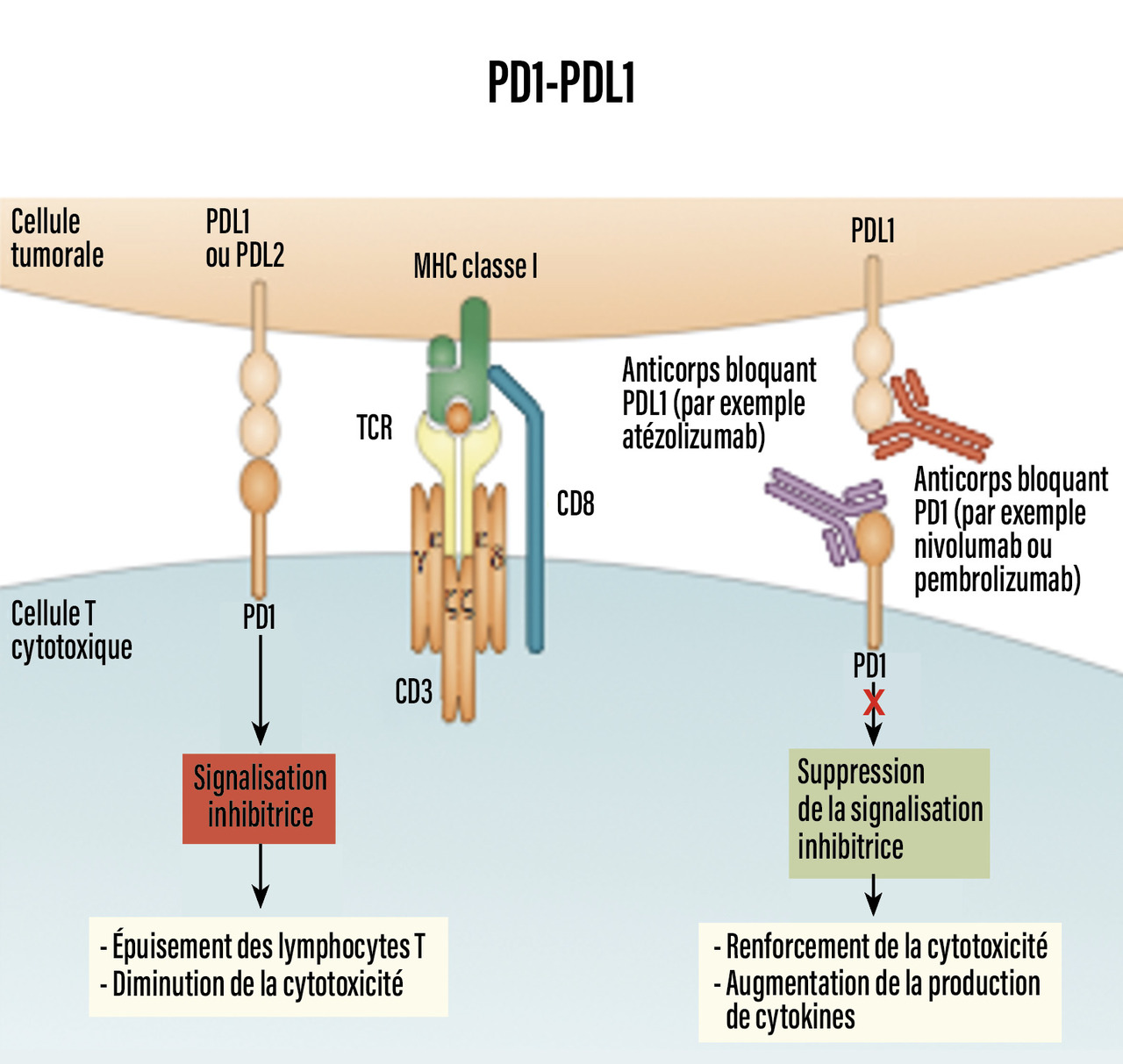
fig. 2 ). Le nivolumab, anticorps anti-PD1, a été associé au BV dans un essai de phase I-II, montrant un taux de rémission complète de 65 %. Les réactions lors de la perfusion sont fréquentes, nécessitant l’utilisation d’une prémédication. L’association nivolumab-ICE a montré des taux de rémission complète de 81 %.
L’ajout de brentuximab vedotin accroît l’efficacité
Le brentuximab vedotin (BV), anticorps anti-CD30 couplé à la monométhylauristatine (poison du fuseau), capable de se fixer à la surface des cellules tumorales qui expriment par définition le CD30 (Les anticorps anti-PD1 restaurent la défense antitumorale
Une autre immunothérapie, les inhibiteurs des points de contrôle immunitaire (ou « inhibiteurs de checkpoints »), a révolutionné la prise en charge des lymphomes de Hodgkin en rechute, en ciblant l’axe PD1-PDL1 : PD1 est exprimé sur les lymphocytes T, son ligand (PDL1) sur les cellules tumorales ; lorsque cet axe est activé, les lymphocytes T sont anergiques et ne jouent plus leur rôle de défense antitumorale. Ainsi, les immunothérapies utilisant les anticorps anti-PD1, en bloquant cet axe de signalisation (d’où leur nom d’inhibiteurs de checkpoints), permettent de restaurer la défense antitumorale (Critères de choix du protocole de rattrapage
Ainsi, en raison des taux de réponse semblables entre les différents protocoles de rattrapage, le choix dépend du profil des effets secondaires, du mode d’administration (ambulatoire ou hospitalisation) et de la possibilité d’accès au BV en deuxième ou troisième ligne (qui est l’indication de l’autorisation de mise sur le marché). Les patients reçoivent deux cycles de rattrapage et sont évalués par une TEP ; si la TEP ne montre pas de rémission complète, une deuxième ligne de rattrapage doit leur être administrée. En cas de rémission complète, une intensification thérapeutique se justifie pour consolider cette réponse et prévenir le risque de rechute.Intensification thérapeutique, radiothérapie et entretien post-autogreffe
Le but de la chimiothérapie intensive par BEAM (carmustine [BiCNU], étoposide, cytosine arabinoside et melphalan, protocole de conditionnement le plus utilisé en France) est de cibler les cellules lymphomateuses résiduelles.
Le patient reçoit par voie intraveineuse cette chimiothérapie qui dure, selon les centres, entre cinq et six jours. La toxicité est hématologique (pancytopénie et aplasie fébrile), digestive avec risque de nausées-vomissements-diarrhées, cutanée (rash maculo-papuleux) et fièvre. La réinjection des cellules souches périphériques est effectuée par voie intraveineuse un jour après la fin de la chimiothérapie (en pratique, le patient a un jour de repos entre la fin de la chimiothérapie intensive et la réinjection de cellules souches périphériques).
Cette procédure nécessite une hospitalisation en unité de soins intensifs d’hématologie, en isolement protecteur, en raison de l’aplasie profonde et durable (plus de 7 jours).
La radiothérapie peut parfois être proposée en post-autogreffe sur le site de la rechute (non irradié antérieurement), à visée de consolidation avec une amélioration de la survie sans progression (SSP) mais sans résultat significatif sur la survie globale (SG) retrouvée dans une étude rétrospective.4
Devant un risque de rechute de 50 % en post-greffe, l’étude AETHERA a randomisé un entretien par BV à la dose de 1,8 mg/kg toutes les trois semaines versus placebo, pour les patients à haut risque de rechute.5 Les critères de haut risque incluaient le caractère réfractaire primaire, la rechute précoce ou une atteinte extranodale. L’effet indésirable le plus fréquent dans le bras BV était une neuropathie périphérique sensitive (56 %) et une neutropénie (35 %). La survie sans progression à trois ans a été de 61 % dans le bras BV versus 43 % avec le placebo. Aucun bénéfice en survie globale n’a été observé.
Les inhibiteurs de checkpoints anti-PD1 constituent également une stratégie d’entretien intéressante en post-autogreffe. Une étude multicentrique évaluant le pembrolizumab en entretien post-greffe a montré récemment des résultats intéressants avec un contrôle durable de la maladie.
Le patient reçoit par voie intraveineuse cette chimiothérapie qui dure, selon les centres, entre cinq et six jours. La toxicité est hématologique (pancytopénie et aplasie fébrile), digestive avec risque de nausées-vomissements-diarrhées, cutanée (rash maculo-papuleux) et fièvre. La réinjection des cellules souches périphériques est effectuée par voie intraveineuse un jour après la fin de la chimiothérapie (en pratique, le patient a un jour de repos entre la fin de la chimiothérapie intensive et la réinjection de cellules souches périphériques).
Cette procédure nécessite une hospitalisation en unité de soins intensifs d’hématologie, en isolement protecteur, en raison de l’aplasie profonde et durable (plus de 7 jours).
La radiothérapie peut parfois être proposée en post-autogreffe sur le site de la rechute (non irradié antérieurement), à visée de consolidation avec une amélioration de la survie sans progression (SSP) mais sans résultat significatif sur la survie globale (SG) retrouvée dans une étude rétrospective.4
Devant un risque de rechute de 50 % en post-greffe, l’étude AETHERA a randomisé un entretien par BV à la dose de 1,8 mg/kg toutes les trois semaines versus placebo, pour les patients à haut risque de rechute.5 Les critères de haut risque incluaient le caractère réfractaire primaire, la rechute précoce ou une atteinte extranodale. L’effet indésirable le plus fréquent dans le bras BV était une neuropathie périphérique sensitive (56 %) et une neutropénie (35 %). La survie sans progression à trois ans a été de 61 % dans le bras BV versus 43 % avec le placebo. Aucun bénéfice en survie globale n’a été observé.
Les inhibiteurs de checkpoints anti-PD1 constituent également une stratégie d’entretien intéressante en post-autogreffe. Une étude multicentrique évaluant le pembrolizumab en entretien post-greffe a montré récemment des résultats intéressants avec un contrôle durable de la maladie.
Quelle stratégie pour les patients en rechute post-autogreffe ou inéligibles à la greffe ?
Ces dernières années, le BV et les anti-PD1 sont les deux nouvelles thérapeutiques qui ont transformé le pronostic des patients en rechute post-autogreffe dont la survie médiane était de deux ans. Ces options thérapeutiques sont également disponibles pour les patients non éligibles à l’autogreffe (à cause de leur âge, de comorbidités ou d’une maladie réfractaire).
Les profils de toxicité sont plutôt favorables. Le traitement est choisi selon la réponse aux lignes antérieures, les comorbidités et le profil de toxicité. Afin de minimiser la toxicité en optimisant les chances de réponses, une monothérapie est souvent privilégiée.
Les profils de toxicité sont plutôt favorables. Le traitement est choisi selon la réponse aux lignes antérieures, les comorbidités et le profil de toxicité. Afin de minimiser la toxicité en optimisant les chances de réponses, une monothérapie est souvent privilégiée.
Place du brentuximab vedotin
Le BV développé initialement dans ce contexte (16 cycles, 1,8 mg/kg/3 semaines) a été approuvé par la Food and Drug Administration en 2011 : la réponse globale était de 75 % comprenant 33 % de réponse complète ; la durée médiane de réponse était de six mois et, pour les patients en rémission complète, de plus de vingt mois. À cinq ans, la survie globale est estimée à 41 % et la survie sans progression à 22 %. Pour les 33 % de patients ayant obtenu une rémission complète, la survie globale à cinq ans est de 64 % et la survie sans progression de 52 %. Treize patients sont toujours en rémission complète après un suivi médian de 69 mois (médiane de 14 cycles de BV reçus), dont 9 patients non allogreffés. 10 % des patients peuvent donc être guéris par le BV en monothérapie ; les caractéristiques retrouvées chez ces patients étaient un âge jeune, une atteinte extranodale et une administration précoce du BV.6
Le traitement est bien toléré. La neuropathie est l’effet indésirable principal qui entraîne l’arrêt du traitement, et impacte significativement la qualité de vie : une réduction de dose à 1,2 puis 0,9 mg/kg est nécessaire dès l’apparition des premiers symptômes. Un espacement des cycles à quatre ou six semaines peut aussi diminuer la toxicité sans compromettre l’efficacité. L’administration de 16 cycles sur un an est empirique. Pour les patients en rémission complète précoce associée à une neuropathie symptomatique ou d’autres effets indésirables, un total de 6 à 8 cycles peut suffire en tenant compte de la possibilité d’un retraitement par BV à la rechute.
Des associations BV-chimiothérapie ont démontré leur efficacité (BV-bendamustine, BV-dacarbazine) mais avec des effets indésirables empêchant des traitements prolongés.
Le traitement est bien toléré. La neuropathie est l’effet indésirable principal qui entraîne l’arrêt du traitement, et impacte significativement la qualité de vie : une réduction de dose à 1,2 puis 0,9 mg/kg est nécessaire dès l’apparition des premiers symptômes. Un espacement des cycles à quatre ou six semaines peut aussi diminuer la toxicité sans compromettre l’efficacité. L’administration de 16 cycles sur un an est empirique. Pour les patients en rémission complète précoce associée à une neuropathie symptomatique ou d’autres effets indésirables, un total de 6 à 8 cycles peut suffire en tenant compte de la possibilité d’un retraitement par BV à la rechute.
Des associations BV-chimiothérapie ont démontré leur efficacité (BV-bendamustine, BV-dacarbazine) mais avec des effets indésirables empêchant des traitements prolongés.
Place des anti-PD1
Les inhibiteurs de checkpoints, les anti-PD1, dont nous avons mentionné l’efficacité dans les protocoles de rattrapage prégreffe, ont des résultats impressionnants dans des lignes thérapeutiques plus avancées : le nivolumab est indiqué chez les patients en rechute post-BV et post-autogreffe ;7 Le pembrolizumab a une indication un peu plus large : LH réfractaire ou en échec de trois lignes de traitement.8
Concernant la toxicité spécifique des anti-PD1, les patients doivent être continuellement surveillés car un effet indésirable peut survenir au début, pendant ou après l’arrêt du traitement. Les effets indésirables les plus fréquents sont une fatigue, un rash, un prurit, des diarrhées et des nausées, des arthralgies.
Concernant la toxicité spécifique des anti-PD1, les patients doivent être continuellement surveillés car un effet indésirable peut survenir au début, pendant ou après l’arrêt du traitement. Les effets indésirables les plus fréquents sont une fatigue, un rash, un prurit, des diarrhées et des nausées, des arthralgies.
Lequel choisir ?
Ainsi pour les patients n’ayant pas reçu de BV antérieurement, le BV reste le premier choix pour les rechutes post-autogreffe en raison d’un taux de réponse complète plus élevé qu’avec les anti-PD1. Pour les autres, les anti-PD1 sont le traitement de choix.
Des études associant BV et anti-PD1 sont en cours avant une utilisation en pratique courante, pour les patients en rechute ou réfractaires.9
Des études associant BV et anti-PD1 sont en cours avant une utilisation en pratique courante, pour les patients en rechute ou réfractaires.9
Amélioration du pronostic des patients en rechute
Grâce aux nouvelles molécules (BV et anti-PD1), le pronostic des patients en rechute s’est nettement amélioré, avec une survie médiane de quarante mois et une survie à cinq ans de 41 % (étude BV). Les données de suivi avec les anti-PD1 ne sont pas encore matures, et affirmer des guérisons sous anti-PD1 nécessite un suivi prolongé : les données récentes de l’étude française rapportant le suivi à cinq ans des patients ayant bénéficié de l’accès précoce aux anti-PD1 rapportent 10 % de patients pouvant possiblement être guéris par des anti-PD1 en monothérapie.10 Concernant les patients éligibles à une allogreffe, d’après les données actuelles, l’allogreffe reste à ce jour le traitement qui a le plus de chance de les guérir. Cependant, son rôle et son timing sont moins bien définis depuis l’avènement des anti-PD1. On ne fait plus qu’exceptionnellement des allogreffes.
Concernant la chimiothérapie conventionnelle dans le contexte de rechute, en l’absence de possibilité d’essais cliniques, et en cas de rechute post-BV ou anti-PD1, un nouveau traitement avec la chimiothérapie conventionnelle est une option, en privilégiant une monothérapie (bendamustine, gemcitabine, vinorelbine, doxorubicine liposomale).
Concernant la chimiothérapie conventionnelle dans le contexte de rechute, en l’absence de possibilité d’essais cliniques, et en cas de rechute post-BV ou anti-PD1, un nouveau traitement avec la chimiothérapie conventionnelle est une option, en privilégiant une monothérapie (bendamustine, gemcitabine, vinorelbine, doxorubicine liposomale).
Les nouvelles molécules améliorent la prise en charge des rechutes
Le LH est un lymphome de bon pronostic. La prise en charge des patients en rechute, grâce au brentuximab vedotin et aux anti-PD1, s’est nettement améliorée, remettant en cause la place de l’allogreffe.
Comme dans d’autres pathologies hématologiques, les progrès de la biologie, de l’imagerie et de l’immunothérapie permettront à l’avenir de limiter les traitements toxiques en adaptant individuellement la stratégie thérapeutique.
Pour en savoir plus
Comme dans d’autres pathologies hématologiques, les progrès de la biologie, de l’imagerie et de l’immunothérapie permettront à l’avenir de limiter les traitements toxiques en adaptant individuellement la stratégie thérapeutique.
Pour en savoir plus
* ICE : ifosfamide, carboplatine et étoposide ; DHAP : dexaméthasone, cytarabine et cisplatine ; ESHAP : étoposide, méthylprednisolone, cytarabine à forte dose et cisplatine ; GVD : gemcitabine, vinorelbine et doxorubicine liposomale pégylée.
Encadre
POUR EN SAVOIR PLUS
Site du groupe LYSA: experts-recherche-lymphome.org
Site de la Haute Autorité de santé : guide du parcours de soins du lymphome de Hodgkin
Références
1. Moskowitz AJ, Yahalom J, Kewalramani T, Maragulia JC, Vanak JM, Zelenetz AD, et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood 2010;116(23):4934-7.
2. Adams HJA, Kwee TC. Prognostic value of pretransplant FDG-PET in refractory/relapsed Hodgkin lymphoma treated with autologous stem cell transplantation: Systematic review and meta-analysis. Ann Hematol 2016;95(5):695-706.
3. Santoro A, Mazza R, Pulsoni A, Re A, Bonfichi M, Zilioli VR, et al. Bendamustine in combination with gemcitabine and vinorelbine is an effective regimen as induction chemotherapy before autologous stem-cell transplantation for relapsed or refractory Hodgkin lymphoma: Final results of a multicenter phase II study. J Clin Oncol 2016;34(27):3293-9.
4. Wilke C, Cao Q, Dusenbery KE, Bachanova V, Lazaryan A, Lee CK, et al. Role of consolidative radiation therapy after autologous hematopoietic cell transplantation for the treatment of relapsed or refractory Hodgkin lymphoma. Int J Radiat Oncol Biol Phys 2017;99(1):94-102.
5. Moskowitz CH, Nademanee A, Masszi T, Agura E, Holowiecki J, Abidi MH, et al, AETHERA Study Group. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapse or progression (AETHERA): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015;385(9980):1853-62.
6. Chen R, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood 2016;128(12):1562-6.
7. Fanale M, Engert A, Younes A, Armand P, Ansell S, Zinzani PL, et al. Nivolumab for relapsed/refractory classical Hodgkin lymphoma after autologous transplant: Full results after extended follow-up of the phase II Checkmate 205 trial. Hematol Oncol 2017;35(suppl 2):135-6.
8. Chen R, Zinzani PL, Fanale MA, Armand P, Johnson NA, Brice P, et al; KEYNOTE-087. Phase II study of the efficacy and safety of pembrolizumab for relapsed/ refractory classic Hodgkin lymphoma. J Clin Oncol 2017;35(19):2125-32.
9. Herrera AF, Moskowitz AJ, Bartlett NL, Vosee JM, Ramchandren R, Feldman TA, et al. Interim results from a phase 1/2 study of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Hematol Oncol 2017;35(suppl 2):85-6.
10. Manson G, Herbaux C, Schiano JM, Casasnovas On Stamatoullas A, Deau B, et al. Can nivolumab alone cure patients with relapse or refractory Hodgkin lymphoma? A 5-year analysis of the French early access program. Br J Haematol 2022;198(1):203-6.
Site du groupe LYSA : experts-recherche-lymphome.org
Site de la Haute Autorité de santé : www.has-sante.fr : guide du parcours de soins du lymphome de Hodgkin
2. Adams HJA, Kwee TC. Prognostic value of pretransplant FDG-PET in refractory/relapsed Hodgkin lymphoma treated with autologous stem cell transplantation: Systematic review and meta-analysis. Ann Hematol 2016;95(5):695-706.
3. Santoro A, Mazza R, Pulsoni A, Re A, Bonfichi M, Zilioli VR, et al. Bendamustine in combination with gemcitabine and vinorelbine is an effective regimen as induction chemotherapy before autologous stem-cell transplantation for relapsed or refractory Hodgkin lymphoma: Final results of a multicenter phase II study. J Clin Oncol 2016;34(27):3293-9.
4. Wilke C, Cao Q, Dusenbery KE, Bachanova V, Lazaryan A, Lee CK, et al. Role of consolidative radiation therapy after autologous hematopoietic cell transplantation for the treatment of relapsed or refractory Hodgkin lymphoma. Int J Radiat Oncol Biol Phys 2017;99(1):94-102.
5. Moskowitz CH, Nademanee A, Masszi T, Agura E, Holowiecki J, Abidi MH, et al, AETHERA Study Group. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapse or progression (AETHERA): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015;385(9980):1853-62.
6. Chen R, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood 2016;128(12):1562-6.
7. Fanale M, Engert A, Younes A, Armand P, Ansell S, Zinzani PL, et al. Nivolumab for relapsed/refractory classical Hodgkin lymphoma after autologous transplant: Full results after extended follow-up of the phase II Checkmate 205 trial. Hematol Oncol 2017;35(suppl 2):135-6.
8. Chen R, Zinzani PL, Fanale MA, Armand P, Johnson NA, Brice P, et al; KEYNOTE-087. Phase II study of the efficacy and safety of pembrolizumab for relapsed/ refractory classic Hodgkin lymphoma. J Clin Oncol 2017;35(19):2125-32.
9. Herrera AF, Moskowitz AJ, Bartlett NL, Vosee JM, Ramchandren R, Feldman TA, et al. Interim results from a phase 1/2 study of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Hematol Oncol 2017;35(suppl 2):85-6.
10. Manson G, Herbaux C, Schiano JM, Casasnovas On Stamatoullas A, Deau B, et al. Can nivolumab alone cure patients with relapse or refractory Hodgkin lymphoma? A 5-year analysis of the French early access program. Br J Haematol 2022;198(1):203-6.
Site du groupe LYSA : experts-recherche-lymphome.org
Site de la Haute Autorité de santé : www.has-sante.fr : guide du parcours de soins du lymphome de Hodgkin

 Encadrés
Encadrés