L’importance des morsures et griffures par des animaux tient à leur nombre, estimé à plus de 500 000 chaque année en France et, indépendamment de leur gravité « mécanique », au risque de transmission d’une infection zoonotique. La grande majorité est le fait des animaux de compagnie (présents dans près d’un foyer sur deux), en particulier un chien ou un chat, parfois des nouveaux animaux de compagnie comme le furet et les rongeurs (rat, souris, hamsters…). Elles peuvent aussi être causées, mais plus rarement, par des animaux en captivité, comme les singes, ou sauvages, notamment lors de la manipulation intempestive d’animaux trouvés malades ou mourants, des chauves-souris par exemple. Outre l’animal mordeur ou griffeur, le risque infectieux découle aussi d’autres facteurs, en particulier la sensibilité spécifique des victimes (par exemple la gravité, composante importante du risque, plus élevé chez les personnes immunodéprimées), ainsi que le type et la localisation de la blessure (prises en compte, par exemple, pour évaluer le risque rabique).
Nous limiterons cette mise au point aux seules zoonoses (qui impliquent une infection, qu’elle soit clinique ou inapparente, de l’animal) pour lesquelles les morsures ou griffures sont le mode de transmission habituel, en insistant sur le risque de contamination au regard de la situation sanitaire en France. Nous ferons abstraction, d’une part, des cas souvent anecdotiques de transmission d’une zoonose, comme le cow-pox, la tularémie, la peste ou la tuberculose par un chat, la leptospirose par un rat, etc., d’autre part, des infections locales par une bactérie pyogène banale ou de la contamination de la plaie par le bacille tétanique (danger potentiel à prendre en compte systématiquement en cas de blessure).
Rage : sensibiliser les voyageurs
La rage est la zoonose la plus grave. Elle provoque, chez l’homme comme chez l’animal, une encéphalite irrémédiablement mortelle lorsque les symptômes apparaissent. Sa transmission s’effectue habituellement par morsure, griffure ou parfois léchage. En effet, la salive est le principal émonctoire du virus, qui y est excrété, en particulier chez les carnivores, au plus dans les 12 jours qui précèdent l’apparition des premiers signes cliniques. De nombreuses espèces animales peuvent transmettre la rage, soit en tant que réservoir (certains carnivores, comme le chien ou le renard en Europe, et des chauves-souris), soit en tant qu’hôte accidentel (singes, par exemple).
Plusieurs espèces virales, toutes du genre Lyssavirus, peuvent occasionner la rage. Néanmoins, le risque d’exposition en France est limité,1 d’une part, au virus rabique proprement dit (RABV, pour Rabies virus), responsable de la quasi-totalité des cas de rage humaine dans le monde) et réunissant notamment les souches responsables de la rage canine et de la rage desmodine (décrite chez la chauve-souris vampire Desmodus rotundus présente en Guyane mais non présente en métropole), d’autre part, aux Lyssavirus de la chauve-souris européenne insectivore (EBLV, pour European bat Lyssavirus).
La France, comme les autres pays de l’Union européenne, est aujourd’hui indemne de rage canine. La rage vulpine, en voie d’éradication, ne persiste aujourd’hui qu’en Bulgarie, Croatie, Grèce, Hongrie, Lituanie, Pologne, Roumanie et Slovaquie. Cette situation sanitaire favorable ne doit pas faire oublier que de nombreux cas humains mortels sont dénombrés quotidiennement dans le monde, notamment en Afrique et en Asie, où le RABV se maintient, en particulier dans les populations de chiens errants de nombreux pays. Cette situation devrait interpeler les voyageurs qui s’exposent inconsidérément en zone d’enzootie rabique (rappelons le décès de rage à Lyon en 2017 d’un jeune patient contaminé par un chien apparemment en bonne santé lors d’un récent séjour avec ses parents au Sri Lanka, et celui d’une résidente britannique en octobre 2018 en Angleterre qui avait été mordue par un chat lors d’un séjour récent au Maroc, aucun n’ayant reçu de prophylaxie post-exposition). En revanche, le risque d’exposition humaine à un mammifère terrestre enragé en France métropolitaine est faible, limité à quelques animaux illégalement introduits en France (non vaccinés et sans garantie sanitaire) depuis des territoires infectés. Depuis 2000, 11 chiens et 1 chat, en bonne santé apparente mais contaminés, la plupart introduits depuis le Maroc, sont morts de la rage en France.
La situation est particulière en Guyane, en raison de la présence euzootique de la rage desmodine, à l’origine d’un cas canin autochtone survenu en 2003 et d’un cas humain en 2008, justifiant notamment la vaccination obligatoire contre la rage de tous les carnivores domestiques dans ce département d’outre-mer.
L’Europe est, en revanche, concernée par la présence des virus EBL dont l’entretien est assuré par des chauves-souris insectivores : l’EBLV-1, isolé chez des sérotines communes (Eptesicus serotinus), le seul identifié en France, et l’EBLV-2, isolé principalement chez le murin de Daubenton (Myosis daubentonii). La cinquantaine de cas d’infection par l’EBLV-1 découverts chez des sérotines ces 10 dernières années en France ne reflète pas la situation de l’infection chez ces animaux, mais les possibilités de recueil et d’analyse des chauves-souris trouvées mortes dans le cadre du réseau de surveillance. Ces chauves-souris insectivores et nocturnes n’ont pas de contact spontané avec l’homme, les personnes exposées sont donc, outre les chiroptéologues, celles qui touchent des chauves-souris gisant sur le sol. L’EBLV-1 n’a pas, cependant, un fort pouvoir pathogène pour les autres espèces animales et l’homme. De très rares cas de contamination ont été néanmoins identifiés (3 cas humains, 4 cas ovins, 1 cas chez une fouine et 2 cas félins), dont l’un observé en France chez un chat non vacciné reconnu cliniquement atteint de rage en novembre 2007 en Vendée.
Toute morsure ou griffure susceptible, en fonction de l’animal en cause et de son origine, de générer une exposition au risque rabique, ce quel que soit le type de virus en cause, est prise en compte par les centres et antennes de traitement antirabique qui statuent sur la nécessité ou non d’initier chez la victime une prophylaxie post-exposition, couplée, lorsque l’animal mordeur ou griffeur est identifié, à sa mise sous surveillance vétérinaire et/ou au transfert de son cadavre dans un laboratoire agréé pour diagnostic de rage afin de définir si l’exposition était contaminante ou non.
Pasteurellose et zoonoses apparentées : aspect inflammatoire de la plaie
En raison du nombre important de morsures et de griffures, le risque infectieux le plus important en termes de fréquence résulte de l’inoculation de bactéries commensales faisant partie de la flore buccale des animaux, lesquels sont en général des porteurs sains.2
Pasteurellose d’inoculation
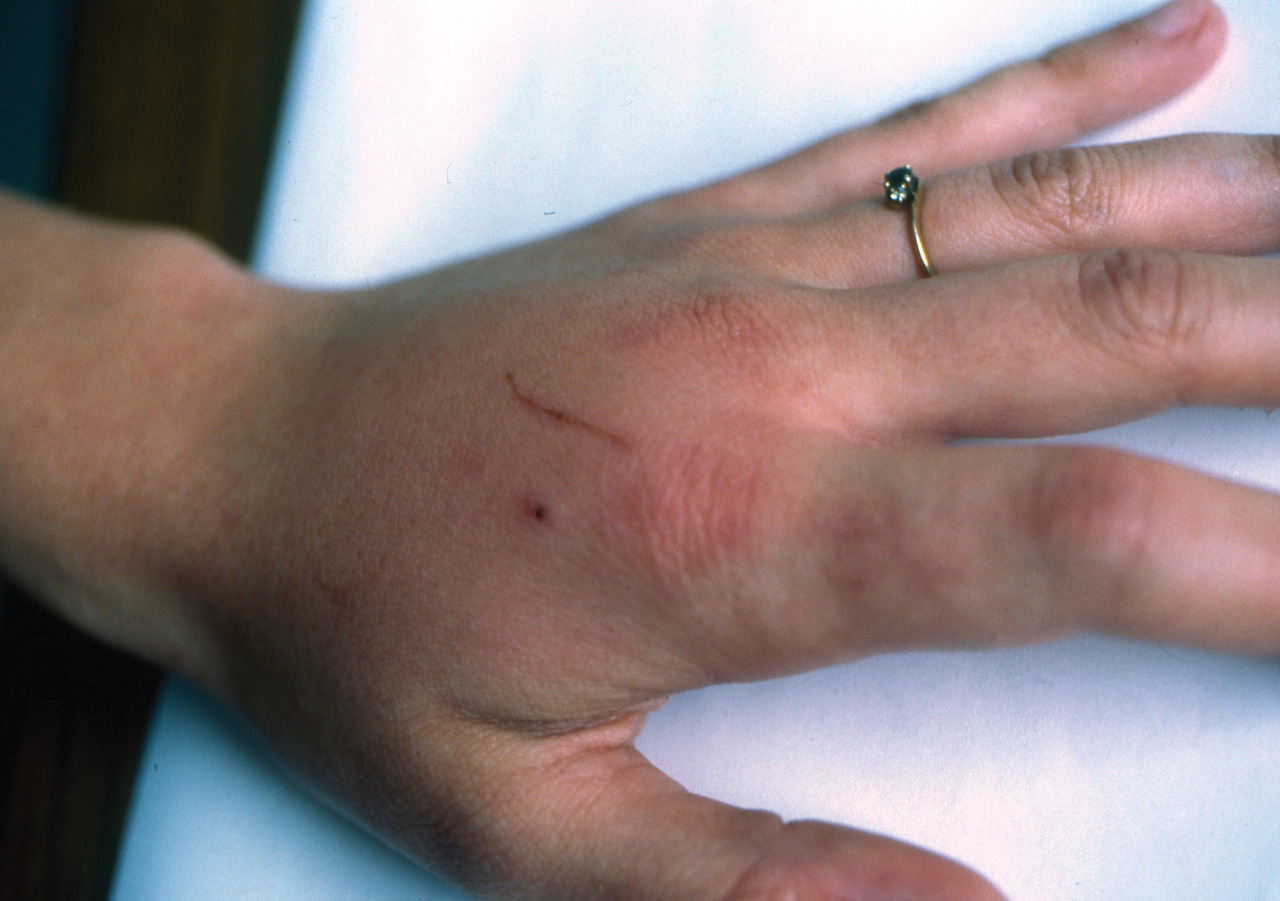
Transmise le plus souvent par des carnivores domestiques, ou parfois des petits rongeurs domestiques, elle est l’une des zoonoses les plus communes.2 À évoquer dans les 24 heures suivant une blessure d’origine animale devant le caractère inflammatoire intense de la plaie
Autres bactéries commensales
Présentes en particulier dans la cavité buccale du chien, telles que Neisseria animaloris et N. zoodegmatis (anciennement, groupes EF-4a et EF-4b), N. weaveri, Weeksella zoohelcum, Capnocytophaga cynodegmi et C. canimorsus, elles peuvent causer des infections localisées (cellulite) évoquant une pasteurellose.
La bactérie C. canimorsus se distingue néanmoins des autres en exposant parfois les sujets, infectés à la suite d’une morsure (ou léchage de plaie) par un chien, à des complications générales graves.3 L’infection locale par C. canimorsus peut en effet se compliquer d’une septicémie foudroyante avec choc septique, détresse respiratoire, insuffisance rénale, coagulation intravasculaire disséminée avec purpura, parfois arthrite, endocardite ou méningite. Ces tableaux, néanmoins assez rares, surviennent en majorité chez des patients immunodéprimés, en particulier des patients splénectomisés (la moitié des cas décrits), leucémiques, éthyliques ou sous corticothérapie.
Maladie des griffes du chat
La maladie des griffes du chat, ou lymphoréticulose bénigne d’inoculation4 est, chez l’homme, une lymphadénopathie subaiguë régionale attribuée à Bartonella henselae, parfois à B. clarridgeiae. Cette zoonose est souvent peu grave mais assez fréquente.
Sept cas sur 10 de maladie des griffes du chat surviennent après une griffade
Le chat est le principal réservoir de l’agent infectieux. Son infection est inapparente et se traduit par une bactériémie persistante ou récurrente durant 2 à 5 mois. L’agent infectieux peut être détecté sur une proportion importante de chats (jusqu’à 53 %). En plus d’une transmission possible par morsure ou griffure, la puce (Ctenocephalides felis) joue un rôle majeur dans la contamination du chat. La puce élimine l’agent dans ses déjections, contaminant le pelage de l’animal. Le chat contamine ses griffes pendant sa toilette.
Fièvre de la morsure du rat
Deux zoonoses bactériennes systémiques, connues sous le nom de « fièvre de la morsure des rats » (rat bite fever)5, sont transmises par des rats qui en constituent le réservoir et sont porteurs asymptomatiques. Elles sont rares ou exceptionnelles en France.
Le sodoku, dû à Spirillum morsus muris, est essentiellement décrit en Asie ; mais aucun cas de contamination humaine autochtone ne semble avoir été rapporté en France, et aucune étude publiée ne témoigne de la colonisation des rats sauvages ou domestiques par cette bactérie.
La streptobacillose, due à Streptobacillus monoliformis, est décrite dans de nombreuses régions du monde, y compris en Europe. L’infection touche en France les rats surmulots (Rattus norvegicus) sauvages et domestiques, et des cas (rares) humains de streptobacillose sont sporadiquement signalés (dont un, récemment en 2018, chez un particulier élevant des rats pour nourrir son boa et atteint d’une forme sévère de la maladie). Notons que les rats et souris livrés aux laboratoires sont régulièrement contrôlés dans les élevages producteurs.
La streptobacillose humaine se déclare quelques jours après le contact infectant (avec un rat, parfois une souris) par une forte fièvre rapidement associée à une éruption cutanée (maculopapuleuse, pétéchiale ou purpurique), des symptômes articulaires et des manifestations pharyngo-laryngées douloureuses. Les cas graves se compliquent de pneumonie, d’abcès métastatiques, voire d’une endocardite. Le taux de mortalité en l’absence de traitement peut atteindre 10 %.
Herpèsvirose B du singe
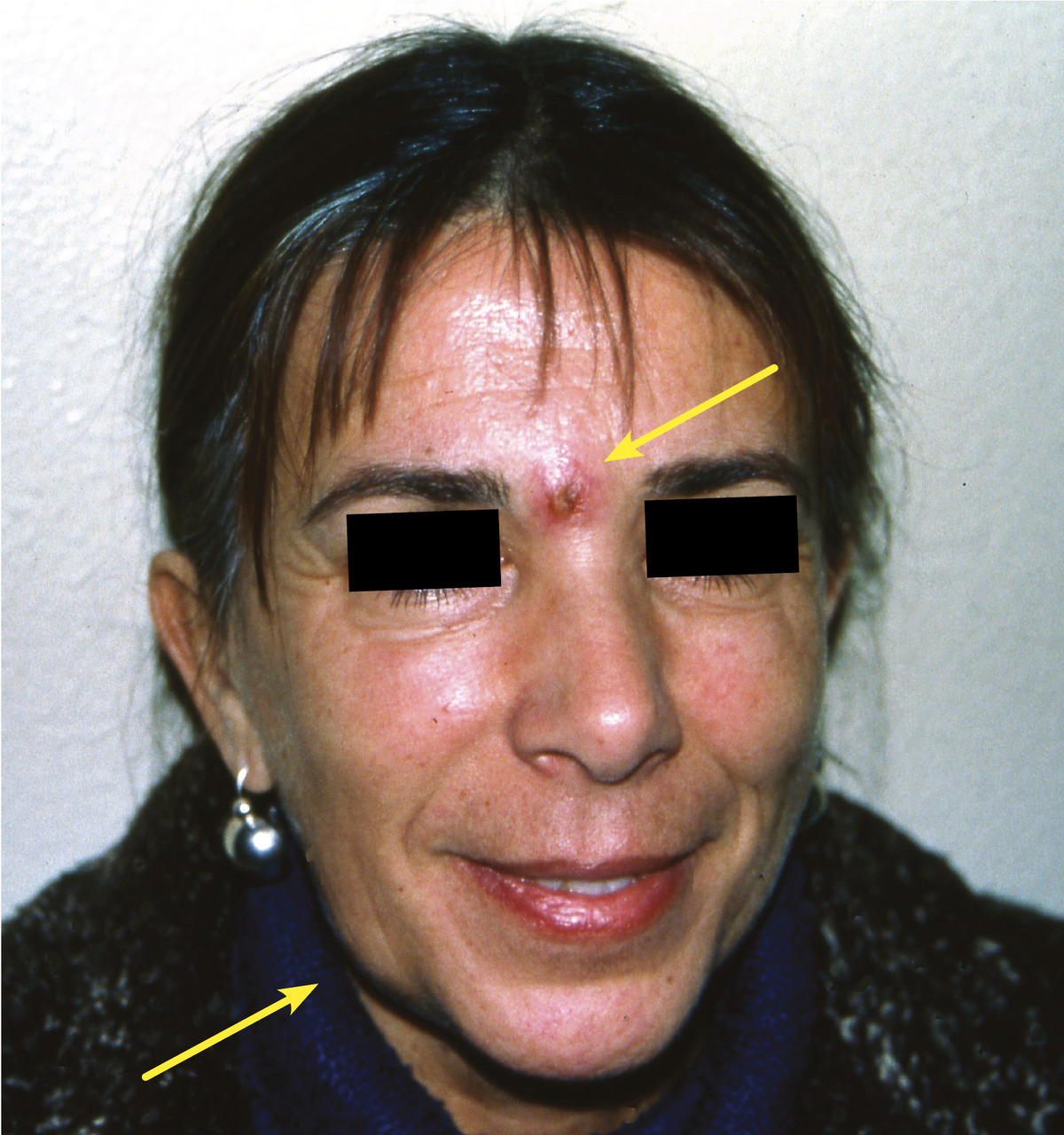
L’herpèsvirose B, causée par Macacine alphaherpesvirus 1 (MaHV1),6 est la seule zoonose hébergée par les singes dont le mode de transmission à l’homme par morsure est prédominant. Elle est enzootique dans les populations de macaques asiatiques, qui en sont les seuls hôtes naturels. Se transmettant par contact direct avec des fluides biologiques (salive, sécrétions génitales et conjonctivales), l’infection, généralement asymptomatique, persiste à l’état latent durant toute la vie des animaux. Elle peut, en revanche, être très grave chez l’homme (ou certaines espèces de singes contaminées à leur contact). Seule une cinquantaine de cas humains ont été recensés dans le monde depuis la caractérisation du virus en 1932. La maladie humaine débute, quelques jours après inoculation, par une inflammation et l’apparition de vésicules autour de la plaie, suivies d’une lymphadénite, puis d’une encéphalite associée à une létalité de 70 à 80 % des cas en l’absence de traitement antiviral très précoce.
Il s’agit en fait d’une maladie très rare chez l’homme, du moins dans sa forme grave, car on ne peut exclure des formes bénignes ou asymptomatiques passant inaperçues. Les seuls cas humains recensés dans le monde l’ont été chez des personnels de laboratoire, et aucun cas n’a été rapporté dans des zoos et en Asie du Sud-Est où la population est fréquemment en contact avec des macaques infectés.
Le risque d’exposition en France s’adresse (hors détention illégale par des particuliers) au personnel des animaleries ou des parcs zoologiques détenant éventuellement des macaques asiatiques infectés (exemple d’un parc zoologique des Landes dans lequel une forte proportion d’animaux positifs fut détectée en 2017), le risque de contamination étant néanmoins réduit par le recours au dépistage sérologique chez les singes, l’élimination des animaux positifs et les mesures de protection individuelles imposées à ce personnel.
Conclusion
Diverses zoonoses habituellement transmises par morsure ou griffure peuvent être contractées en France. Le risque de survenue de cas humains autochtones de rage ou d’herpèsvirose B, zoonoses les plus graves, est minime du fait de leur caractère exceptionnel. En fait, les cas les plus fréquents, habituellement bénins chez les personnes ne souffrant pas d’un déficit immunitaire, sont des infections transmises aux personnes par leurs animaux de compagnie, le plus souvent des chiens et des chats, comme la pasteurellose d’inoculation, la maladie des griffes du chat et diverses bactérioses spécifiques commensales de la cavité buccale de ces espèces. V
1. Centre national de référence de la rage. Analyse des données sur la prophylaxie post-exposition de la rage humaine en France en 2016. Bulletin sur l’épidémiologie et la prophylaxie de la rage humaine en France 2017;36:2-7.
2. Ganière JP, Ruvoen N, André-Fontaine G. Zoonoses infectieuses d’origine canine et féline. Med Mal Infect 2001;31(suppl 2):109-25.
3. Vignon G, Combeau P, Violette J, et al. Infection fulminante fatale à Capnocytophaga canimorsus : à propos d’un cas et revue de la littérature. Rev Med Interne 2018;39:820-3.
4. Chomel B, Boulouis HJ, Maruyama S, Breitschwerdt EB. Bartonella spp. in pets and effect on human health. Emerg Infect Dis 2006;12:389-94.
5. Elliott SP. Rat Bite Fever and Streptobacillus moniliformis. Clin Microbiol Rev 2007;20:13-22.
6. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. Avis relatif à l’évaluation du risque lié à l’infection d’un groupe de macaques (Macaca fascicularis) par le Macacine herpesvirus 1. Anses, avis n° 2017-SA-0065.