Stratégies universelles, indépendantes du niveau de risque
Objectifs ciblés et moyens de prévention cardiovasculaire sont synthétisés dans le tableau 1, qui rapproche ce qui relève d’une prescription médicamenteuse d’une part et de l’approche non médicamenteuse d’autre part, dans une stratégie globale de réduction des risques cardiovasculaires.1-6
Certains objectifs de prévention ne dépendent pas du niveau de risque cardiovasculaire absolu, comme l’hémoglobine glyquée (HbA1c) chez les patients diabétiques, la pression artérielle optimale, l’arrêt du tabagisme, la pratique d’une activité physique suffisante et régulière ou une alimentation équilibrée et diversifiée.7
En ce qui concerne l’activité physique, la lutte contre la sédentarité tout comme l’incitation à la pratique d’une activité physique ont des effets bénéfiques démontrés sur la survenue des maladies liées à l’athérosclérose, mais aussi de certains cancers et du diabète ainsi que sur le vieillissement. La promotion de l’activité physique doit faire partie de la consultation de médecine générale pour les patients atteints de maladie chronique.8 Elle vise l’intégration d’une activité physique à toutes les activités sociales et individuelles, dans tous les contextes de vie (au travail, à la maison, durant les transports, les loisirs, etc.) et à tout âge, tout en adaptant incitation et conseils au contexte et aux caractéristiques des personnes (progressivité, modes d’autosurveillance, risques à prévenir, etc.).5, 6
En ce qui concerne la nutrition, contrairement à une idée reçue solidement ancrée depuis plusieurs décennies, la réduction des apports lipidiques dans l’alimentation n’est pas associée à une réduction de la mortalité cardiovasculaire ou totale, à la fois en raison d’une baisse trop modeste (de l’ordre de 12-15 %) du cholestérol lié aux lipoprotéines de basse densité (LDL-cholestérol) et du remplacement par d’autres nutriments, glucidiques notamment, qui ont leur propre effet athérogène.9 C’est moins la part de graisses qui importe dans l’alimentation que la nature et la transformation industrielle éventuelle des aliments consommés qui en contiennent. Les viandes transformées, celles qui ne le sont pas et les produits laitiers contiennent des acides gras saturés et insaturés trans. Mais la consommation des premières est associée à une augmentation des décès cardiovasculaires, celle des viandes blanches ou rouges non transformées est neutre, tandis que celle des produits laitiers réduit ce risque.6, 10, 11 C’est donc davantage le style d’alimentation et la source des acides gras qui sont à considérer. Il s’agit d’adopter une alimentation équilibrée et diversifiée – par exemple de type méditerranéen7 – et quantitativement adaptée à la dépense physique (tableau 1). Le bénéfice de ce type d’alimentation est également très documenté pour la prévention de nombreux cancers (notamment oro-digestifs, pulmonaires et mammaires).6
Le dépistage et la prise en charge de la vulnérabilité psychosociale et de la réactivité au stress a pris de plus en plus d’importance ces dernières années, à un double titre : ces facteurs de vulnérabilité très prévalents dans la population sont des marqueurs de risque cardiovasculaire à part entière ; ils sont aussi une des barrières les plus notables à l’adoption et au maintien de comportements de santé et d’assiduité thérapeutique sur le long terme.1, 7
Certains objectifs de prévention ne dépendent pas du niveau de risque cardiovasculaire absolu, comme l’hémoglobine glyquée (HbA1c) chez les patients diabétiques, la pression artérielle optimale, l’arrêt du tabagisme, la pratique d’une activité physique suffisante et régulière ou une alimentation équilibrée et diversifiée.7
En ce qui concerne l’activité physique, la lutte contre la sédentarité tout comme l’incitation à la pratique d’une activité physique ont des effets bénéfiques démontrés sur la survenue des maladies liées à l’athérosclérose, mais aussi de certains cancers et du diabète ainsi que sur le vieillissement. La promotion de l’activité physique doit faire partie de la consultation de médecine générale pour les patients atteints de maladie chronique.8 Elle vise l’intégration d’une activité physique à toutes les activités sociales et individuelles, dans tous les contextes de vie (au travail, à la maison, durant les transports, les loisirs, etc.) et à tout âge, tout en adaptant incitation et conseils au contexte et aux caractéristiques des personnes (progressivité, modes d’autosurveillance, risques à prévenir, etc.).5, 6
En ce qui concerne la nutrition, contrairement à une idée reçue solidement ancrée depuis plusieurs décennies, la réduction des apports lipidiques dans l’alimentation n’est pas associée à une réduction de la mortalité cardiovasculaire ou totale, à la fois en raison d’une baisse trop modeste (de l’ordre de 12-15 %) du cholestérol lié aux lipoprotéines de basse densité (LDL-cholestérol) et du remplacement par d’autres nutriments, glucidiques notamment, qui ont leur propre effet athérogène.9 C’est moins la part de graisses qui importe dans l’alimentation que la nature et la transformation industrielle éventuelle des aliments consommés qui en contiennent. Les viandes transformées, celles qui ne le sont pas et les produits laitiers contiennent des acides gras saturés et insaturés trans. Mais la consommation des premières est associée à une augmentation des décès cardiovasculaires, celle des viandes blanches ou rouges non transformées est neutre, tandis que celle des produits laitiers réduit ce risque.6, 10, 11 C’est donc davantage le style d’alimentation et la source des acides gras qui sont à considérer. Il s’agit d’adopter une alimentation équilibrée et diversifiée – par exemple de type méditerranéen7 – et quantitativement adaptée à la dépense physique (tableau 1). Le bénéfice de ce type d’alimentation est également très documenté pour la prévention de nombreux cancers (notamment oro-digestifs, pulmonaires et mammaires).6
Le dépistage et la prise en charge de la vulnérabilité psychosociale et de la réactivité au stress a pris de plus en plus d’importance ces dernières années, à un double titre : ces facteurs de vulnérabilité très prévalents dans la population sont des marqueurs de risque cardiovasculaire à part entière ; ils sont aussi une des barrières les plus notables à l’adoption et au maintien de comportements de santé et d’assiduité thérapeutique sur le long terme.1, 7
Stratégies de prévention conditionnées par l’importance du risque
D’autres cibles de prévention sont d’autant plus contraignantes que le risque cardiovasculaire absolu est élevé. C’est le cas du LDL-cholestérol.
Une cible de LDL-cholestérol ?
Chez les patients à très haut risque cardiovasculaire, un traitement hypocholestérolémiant est instauré quel que soit le taux de cholestérol initial. Le bénéfice sur la réduction des événements cardiovasculaires graves est d’autant plus grand que le LDL-cholestérol initial est élevé et que la réduction obtenue sous traitement est importante, sans effet seuil, puisque le bénéfice persiste avec un LDL-cholestérol abaissé à moins de 0,3 g/L (étude Fourier avec l’évolocumab). La notion de cible chiffrée (par exemple < 1,8 mmol/L) ne correspond pas à un seuil physiologique qui serait idéal, mais seulement à la transposition directe des résultats des essais thérapeutiques déjà publiés. Ainsi, un LDL-cholestérol « presque normal » (entre 0,69 et 1,35 g/L [1,8 et 3,5 mmol/L]) chez un sujet qui a une athérosclérose déjà évoluée ou compliquée (syndrome coronaire aigu, accident vasculaire cérébral [AVC], etc.) signifie que la cible optimale du LDL-cholestérol pour ce sujet est en réalité bien inférieure à 1,8 mmol/L. D’où la recommandation de l’European Society of Cardiology (ESC) d’abaisser d’au moins 50 % le taux de LDL-cholestérol dans cette situation (tableau 1). Cet objectif n’est toutefois pas repris par la Haute Autorité de santé (HAS) en 2017,12 alors que depuis plusieurs années les recommandations britanniques, canadiennes et américaines ne fixent plus de cible chiffrée mais une réduction supérieure ou égale à 50 % du taux initial de LDL-cholestérol. Chez les sujets avec un LDL-cholestérol initial supérieur ou égal à 1,9 g/L (4,9 mmol/L), il y a consensus pour rechercher une hypercholestérolémie familiale hétérozygote.1, 2, 12
Statines : quels effets indésirables ?
Toutes les statines actuellement sur le marché européen permettent une réduction très significative des événements cardiovasculaires graves. En prévention secondaire et en abaissant le LDL-cholestérol de 2 mmol/L (0,77 g/L), 10 patients éviteront un infarctus myocardique ou cérébral, un décès cardiovasculaire ou une revascularisation coronaire pour 100 patients traités pendant 5 ans (soit un bénéfice absolu de 10 %), au prix d’un risque de découvrir un diabète de 0,5 à 1 %, de s’exposer à une myopathie sévère (créatine phosphokinase [CPK] > 10 fois la normale) de 0,05 % ou à une hémorragie cérébrale de 0,05 à 0,1 % durant la même période.13 Il n’y a pas de sur-risque de déclin cognitif, d’ailleurs plus fréquent chez les patients athéromateux, ni d’aucun cancer. Les effets indésirables habituels sont plutôt de type crampes ou faiblesses musculaires, sans élévation des CPK. Dans les essais thérapeutiques (en double aveugle), les effets indésirables musculaires ont eu une incidence très faible (≈ 2 % par an) et strictement comparable au placebo, de même que les taux de retrait pour effet indésirable. Dans les phases d’extension de ces essais après la levée de l’aveugle, cette incidence s’est révélée bien supérieure,14 et jusqu’à 8 à 10 % des patients dans les études en ouvert, indiquant qu’un effet nocebo participe aux plaintes de certains patients, effet qui a largement alimenté la controverse sur les statines des dix dernières années…
Statines : que faire en cas d’effets indésirables ?
En cas d’effets indésirables avec une statine, il faut d’abord vérifier que ceux-ci sont liés à la statine (suspendre quelques semaines puis reprendre à la résolution des symptômes), éliminer certaines conditions favorisantes (hypothyroïdie, carence en vitamine D, prise cachée d’un fibrate) et évaluer la compréhension des enjeux de prévention et la perception de ce traitement par le patient. Ensuite, il faut discuter avec le patient des différentes stratégies possibles : réduire la dose ou remplacer par une autre statine plus faiblement dosée mais de même intensité et à plus longue durée d’action (par exemple 5 mg de rosuvastatine ou 10 mg d’atorvastatine 2 fois par semaine), quitte à augmenter très progressivement par paliers de 1 mois… En l’absence d’amélioration, prescrire une statine d’intensité inférieure avec l’ézétimibe. L’adjonction de co-enzyme Q10 n’a pas fait ses preuves dans une méta-analyse de 10 essais.15 En dernier recours, il faut solliciter un avis spécialisé sur les options de traitement d’un patient à risque cardiovasculaire très élevé restant intolérant aux statines (< 5 % des patients initialement intolérants). Étant donné le bénéfice obtenu avec les statines et les garanties de sécurité de ces traitements à moyen et long termes documentés chez plus de 170 000 patients suivis au moins 2 ans, tous les efforts de communication et de pédagogie doivent être mis en œuvre pour obtenir l’adhésion du patient.13
Recommandations européennes et HAS : ce qui diffère
Concernant les dyslipidémies, on peut observer quelques différences entre les recommandations européennes1, 2 et celles de la HAS12 :
– la suppression de la nécessité d’être à jeun pour évaluer le profil lipidique n’est pas encore adoptée par la HAS ;
– l’athérome infraclinique coronarien ou carotidien encore asymptomatique n’est pas pour l’instant considéré comme une situation à très haut risque cardiovasculaire et ne requiert pas de stratégie de prévention renforcée pour la HAS ;
– pour suivre la tolérance d’une statine, les enzymes hépatiques sont à doser initialement et après 8 semaines de traitement ou changement de dose, et ensuite annuellement. La CPK n’est dosée qu’en cas de symptôme musculaire, mais régulièrement en cas de contexte à risque (insuffisance rénale chronique, hypothyroïdie, abus d’alcool, sujets ≥ 70 ans, antécédent de myopathie familiale). L’ESC ne conditionne pas cette surveillance de la CPK à ce contexte à risque d’intolérance musculaire. Il y a consensus, en revanche, sur le seuil qui impose l’arrêt du traitement : plus de 3 fois la normale pour l’alanine aminotransférase, plus de 4 fois la normale pour les CPK ;
– pour les sujets diabétiques, l’instauration d’un traitement hypocholestérolémiant est consensuel dès lors que le sujet est au moins à haut risque cardiovasculaire (v. tableau p. 438). La HAS considère que l’âge, supérieur ou inférieur à 40 ans, doit néanmoins être pris en compte pour établir les seuils d’intervention préventive et fixer la cible de LDL-cholestérol. Ainsi, les sujets diabétiques de type 1 ou 2 de moins de 40 ans ayant au moins un facteur de risque cardiovasculaire ou un organe cible atteint, ou de 40 ans et plus sans facteur de risque cardiovasculaire ni atteinte d’organe cible ont-ils un objectif de LDL-cholestérol inférieur à 2,6 mmol/L (1 g/L), tandis qu’après 40 ans avec facteur de risque cardiovasculaire ou atteinte d’organe cible, tous les patients diabétiques doivent être à l’objectif LDL-cholestérol inférieur à 1,8 mmol/L (0,7 g/L) [tableau 1].
– la suppression de la nécessité d’être à jeun pour évaluer le profil lipidique n’est pas encore adoptée par la HAS ;
– l’athérome infraclinique coronarien ou carotidien encore asymptomatique n’est pas pour l’instant considéré comme une situation à très haut risque cardiovasculaire et ne requiert pas de stratégie de prévention renforcée pour la HAS ;
– pour suivre la tolérance d’une statine, les enzymes hépatiques sont à doser initialement et après 8 semaines de traitement ou changement de dose, et ensuite annuellement. La CPK n’est dosée qu’en cas de symptôme musculaire, mais régulièrement en cas de contexte à risque (insuffisance rénale chronique, hypothyroïdie, abus d’alcool, sujets ≥ 70 ans, antécédent de myopathie familiale). L’ESC ne conditionne pas cette surveillance de la CPK à ce contexte à risque d’intolérance musculaire. Il y a consensus, en revanche, sur le seuil qui impose l’arrêt du traitement : plus de 3 fois la normale pour l’alanine aminotransférase, plus de 4 fois la normale pour les CPK ;
– pour les sujets diabétiques, l’instauration d’un traitement hypocholestérolémiant est consensuel dès lors que le sujet est au moins à haut risque cardiovasculaire (v. tableau p. 438). La HAS considère que l’âge, supérieur ou inférieur à 40 ans, doit néanmoins être pris en compte pour établir les seuils d’intervention préventive et fixer la cible de LDL-cholestérol. Ainsi, les sujets diabétiques de type 1 ou 2 de moins de 40 ans ayant au moins un facteur de risque cardiovasculaire ou un organe cible atteint, ou de 40 ans et plus sans facteur de risque cardiovasculaire ni atteinte d’organe cible ont-ils un objectif de LDL-cholestérol inférieur à 2,6 mmol/L (1 g/L), tandis qu’après 40 ans avec facteur de risque cardiovasculaire ou atteinte d’organe cible, tous les patients diabétiques doivent être à l’objectif LDL-cholestérol inférieur à 1,8 mmol/L (0,7 g/L) [tableau 1].
Prévention médicamenteuse : clarifications concernant l’usage des traitements antithrombotiques
En complément de la stratégie hygiéno-diététique et éducative, les patients à très haut risque cardiovasculaire doivent recevoir une polythérapie associant dans la plupart des cas au moins une statine (v. supra), un antiagrégant plaquettaire et un bloqueur du système rénine-angiotensine-aldostérone (tableau 1). Certains contextes cliniques ou liés au profil des patients conduisent à modifier, nuancer ou compléter ce triptyque de base. Depuis 2016, c’est avant tout les stratégies antithrombotiques qui ont connu de notables évolutions.
Maladie coronarienne stable
En cas de maladie coronarienne stable, symptomatique ou non, il n’y a pas de changement notable des recommandations.16
Syndrome coronaire aigu
Après un syndrome coronaire aigu ou la pose d’un stent coronarien, une bithérapie antiplaquettaire est indiquée, incluant obligatoirement un inhibiteur du récepteur P2Y12 à l’adénosine diphosphate (ADP) [clopidogrel, prasugrel et ticagrélor]. Avec l’évolution des stents coronariens de dernière génération et la réduction des thromboses tardives de stent, on observe une simplification des indications4 (tableau 1) :
– disparition de la distinction entre stent actif et stent nu ;
– dans les suites immédiates (< 1 an) d’un syndrome coronaire aigu, les nouveaux inhibiteurs de P2Y12 (ticagrélor et prasugrel) sont préférés au clopidogrel car ils sont à la fois plus efficaces (réduction de 30 à 40 % des récidives ischémiques et de la mortalité cardiovasculaire) et sans excès de risque hémorragique quel que soit l’âge ;
– au-delà de 1 an après la pose d’un stent ou après un syndrome coronaire aigu, c’est la prise en compte des risques ischémiques et hémorragiques (balance bénéfices-risques) qui guide la décision de poursuivre ou non une bithérapie antiagrégante. On peut s’aider des scores de risque hémorragique, comme le score PRECISE-DAPT.17 Un score supérieur à 25 (haut risque de saignement) autorise à réduire la durée de la bithérapie à 6 voire 3 mois de bithérapie après un syndrome coronaire aigu, ou à 3 voire 1 mois chez le patient coronarien stable après la pose d’un stent. Tout au long du suivi, la survenue de tout événement hémorragique « cliniquement significatif » doit bien entendu faire reconsidérer rapidement le type et la durée de cette bithérapie… ;
– toutefois après un syndrome coronaire aigu chez un patient restant à haut risque ischémique (au moins un critère tel que âge > 65 ans, diabète, atteinte coronarienne multitronculaire, insuffisance rénale au moins modérée, etc.) et en l’absence de survenue d’hémorragie depuis l’événement princeps, la bithérapie peut être prolongée jusqu’à 36 mois, en privilégiant cette fois le ticagrélor (60 mg × 2/j) en plus de l’aspirine, y compris en l’absence d’angioplastie et de stent pendant le syndrome coronaire aigu (cas des patients pontés ou non revascularisés). Cette prolongation de la bithérapie réduit non seulement les récidives d’infarctus myocardique mais aussi les AVC ischémiques, conférant une protection sur l’ensemble des axes artériels, sans excès d’AVC hémorragiques (étude PEGASUS ;18 autorisation de mise sur le marché [AMM] européenne mais pas encore française) ;
– dans le cas où une anticoagulation est indiquée (arythmie cardiaque par fibrillation atriale, valve mécanique, thrombus pariétal du ventricule gauche, AVC embolique, etc.), un antagoniste de la vitamine K est associé à l’aspirine en maintenant rigoureusement l’international normalized ratio entre 2 et 3. Toutefois, en cas d’arythmie cardiaque par fibrillation atriale, et seulement dans ce cas, un anticoagulant oral direct peut être une alternative à l’antivitamine-K, le risque hémorragique de l’association étant de même amplitude ou inférieur. La bithérapie dabigatran-inhibiteur de P2Y12 s’est même montrée aussi efficace et plus sûre que la trithérapie antithrombotique actuellement pratiquée (warfarine-aspirine-inhibiteur de P2Y12) chez des patients ayant une arythmie cardiaque par fibrillation atriale qui ont été revascularisés par stents (étude RE-DUAL PCI19) ;
– les inhibiteurs de la pompe à protons ne sont indiqués qu’en cas de risque spécifique de saignement gastro- intestinal sous thérapeutique antiagrégante.
– disparition de la distinction entre stent actif et stent nu ;
– dans les suites immédiates (< 1 an) d’un syndrome coronaire aigu, les nouveaux inhibiteurs de P2Y12 (ticagrélor et prasugrel) sont préférés au clopidogrel car ils sont à la fois plus efficaces (réduction de 30 à 40 % des récidives ischémiques et de la mortalité cardiovasculaire) et sans excès de risque hémorragique quel que soit l’âge ;
– au-delà de 1 an après la pose d’un stent ou après un syndrome coronaire aigu, c’est la prise en compte des risques ischémiques et hémorragiques (balance bénéfices-risques) qui guide la décision de poursuivre ou non une bithérapie antiagrégante. On peut s’aider des scores de risque hémorragique, comme le score PRECISE-DAPT.17 Un score supérieur à 25 (haut risque de saignement) autorise à réduire la durée de la bithérapie à 6 voire 3 mois de bithérapie après un syndrome coronaire aigu, ou à 3 voire 1 mois chez le patient coronarien stable après la pose d’un stent. Tout au long du suivi, la survenue de tout événement hémorragique « cliniquement significatif » doit bien entendu faire reconsidérer rapidement le type et la durée de cette bithérapie… ;
– toutefois après un syndrome coronaire aigu chez un patient restant à haut risque ischémique (au moins un critère tel que âge > 65 ans, diabète, atteinte coronarienne multitronculaire, insuffisance rénale au moins modérée, etc.) et en l’absence de survenue d’hémorragie depuis l’événement princeps, la bithérapie peut être prolongée jusqu’à 36 mois, en privilégiant cette fois le ticagrélor (60 mg × 2/j) en plus de l’aspirine, y compris en l’absence d’angioplastie et de stent pendant le syndrome coronaire aigu (cas des patients pontés ou non revascularisés). Cette prolongation de la bithérapie réduit non seulement les récidives d’infarctus myocardique mais aussi les AVC ischémiques, conférant une protection sur l’ensemble des axes artériels, sans excès d’AVC hémorragiques (étude PEGASUS ;18 autorisation de mise sur le marché [AMM] européenne mais pas encore française) ;
– dans le cas où une anticoagulation est indiquée (arythmie cardiaque par fibrillation atriale, valve mécanique, thrombus pariétal du ventricule gauche, AVC embolique, etc.), un antagoniste de la vitamine K est associé à l’aspirine en maintenant rigoureusement l’international normalized ratio entre 2 et 3. Toutefois, en cas d’arythmie cardiaque par fibrillation atriale, et seulement dans ce cas, un anticoagulant oral direct peut être une alternative à l’antivitamine-K, le risque hémorragique de l’association étant de même amplitude ou inférieur. La bithérapie dabigatran-inhibiteur de P2Y12 s’est même montrée aussi efficace et plus sûre que la trithérapie antithrombotique actuellement pratiquée (warfarine-aspirine-inhibiteur de P2Y12) chez des patients ayant une arythmie cardiaque par fibrillation atriale qui ont été revascularisés par stents (étude RE-DUAL PCI19) ;
– les inhibiteurs de la pompe à protons ne sont indiqués qu’en cas de risque spécifique de saignement gastro- intestinal sous thérapeutique antiagrégante.
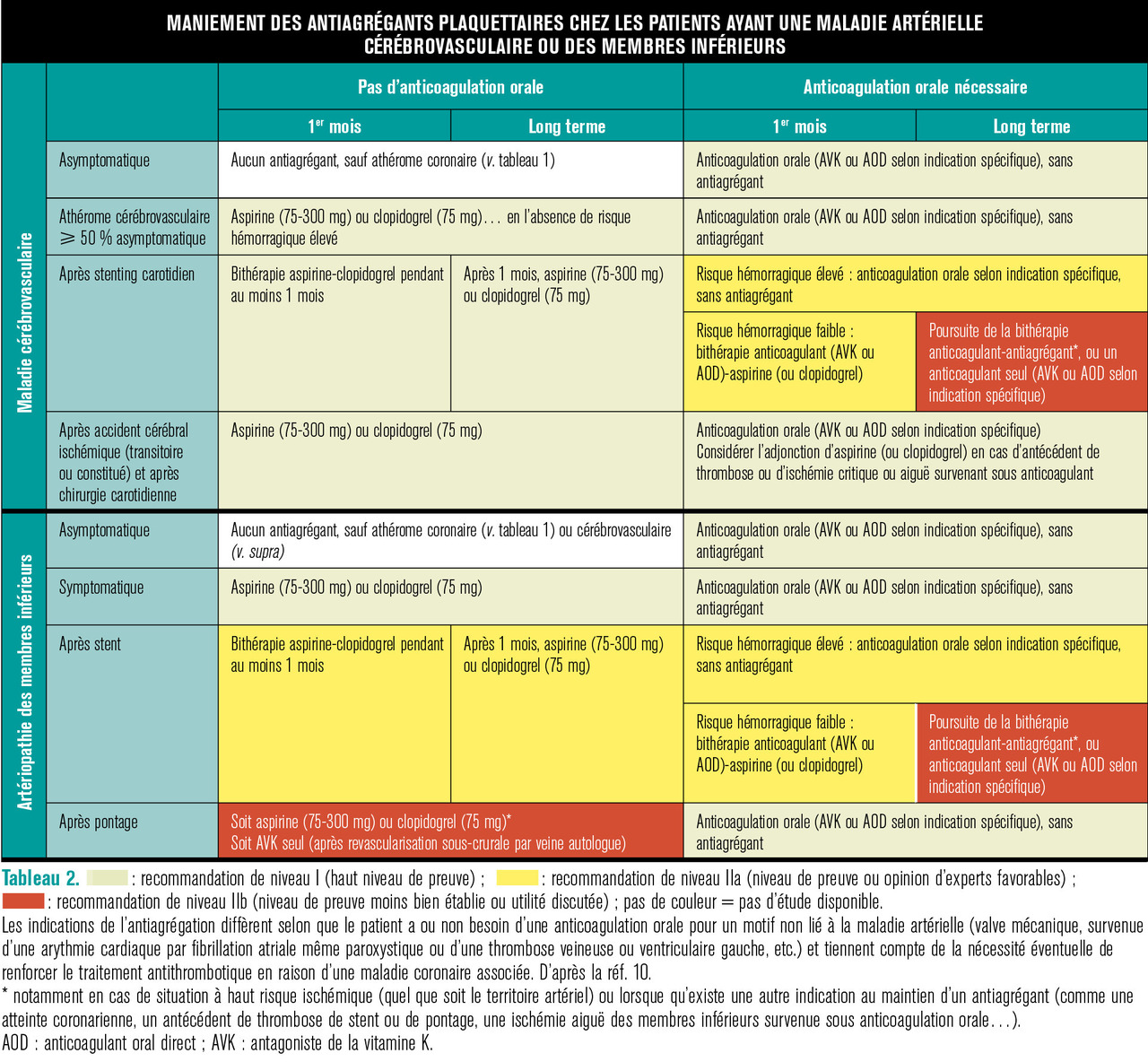
Athérome des artères cérébrovasculaires ou des membres inférieurs
Dans ce cas, la stratégie antithrombotique a été très remaniée,3 variant selon que le patient nécessite ou non un traitement anticoagulant oral pour une autre raison que la maladie artérielle (tableau 2) :
– en cas de nécessité d’une anticoagulation orale, une monothérapie anticoagulante est prescrite si le patient n’a pas eu de stent artériel (percutané ou chirurgical) ou après stent artériel si le patient est à haut risque hémorragique (d’autant plus que cela concerne des patients souvent âgés). En revanche, après un stent artériel en cas de risque hémorragique faible, le choix se porte vers une bithérapie anticoagulant-antiagrégant pendant 1 mois (aspirine 75-100 mg/j ou clopidogrel 75 mg/j) ; au-delà, le choix de poursuivre par une monothérapie (soit par anticoagulant, soit par antiagrégant) est fonction de l’indication du traitement anticoagulant ;
– si le patient ne nécessite pas d’anticoagulant, un antiagrégant seul est prescrit. Cette stratégie pourrait être bientôt modifiée (v. infra).
– en cas de nécessité d’une anticoagulation orale, une monothérapie anticoagulante est prescrite si le patient n’a pas eu de stent artériel (percutané ou chirurgical) ou après stent artériel si le patient est à haut risque hémorragique (d’autant plus que cela concerne des patients souvent âgés). En revanche, après un stent artériel en cas de risque hémorragique faible, le choix se porte vers une bithérapie anticoagulant-antiagrégant pendant 1 mois (aspirine 75-100 mg/j ou clopidogrel 75 mg/j) ; au-delà, le choix de poursuivre par une monothérapie (soit par anticoagulant, soit par antiagrégant) est fonction de l’indication du traitement anticoagulant ;
– si le patient ne nécessite pas d’anticoagulant, un antiagrégant seul est prescrit. Cette stratégie pourrait être bientôt modifiée (v. infra).
De nouvelles stratégies thérapeutiques pourraient modifier les prochaines recommandations…
Deux stratégies paraissent particulièrement prometteuses.
Associer à l’aspirine une anticoagulation orale faible dose
Les patients ayant une maladie artérielle symptomatique mais stable (quel que soit le territoire athéromateux) à haut risque ischémique (âge > 65 ans, atteinte polyartérielle ou un des critères à très haut risque cardiovasculaire [v. tableau p. 438] ) relèvent jusqu’à présent d’une antiagrégation plaquettaire par monothérapie (tableau 1). L’étude COMPASS présentée au dernier congrès de l’ESC (août 2017) montre que l’association à l’aspirine de rivaroxaban (Xarelto) 2,5 mg deux fois par jour réduit de beaucoup (24 %) et significativement la survenue du critère clinique combiné (mortalité cardiovasculaire, AVC et infarctus du myocarde) par comparaison avec 100 mg d’aspirine seul après un suivi moyen de 23 mois, sans augmenter significativement le risque d’hémorragies fatales, intracrâniennes ou touchant un organe critique.20 C’est bien la combinaison des deux qui est bénéfique, la prise de rivaroxaban seul n’apportant rien par rapport à l’aspirine seule. Ce bénéfice touche les patients coronariens comme les patients ayant une maladie artérielle périphérique. Chez ces derniers, le risque d’amputation est également réduit de 70 %. Cette étude de grande envergure tendrait ainsi à faire du rivaroxaban à faible dose un traitement de fond de la maladie athérothrombotique stable, dès que le risque ischémique est élevé.
Mieux réduire le risque cardiovasculaire chez des patients diabétiques
Deux nouvelles classes d’antidiabétiques particulièrement intéressantes chez les patients en prévention cardiovasculaire secondaire sont apparues ces dernières années : les inhibiteurs du cotransporteur sodium-glucose 2 (SGLT2) ou glifozines qui jouent sur l’excrétion rénale du glucose (AMM européenne, mais pas encore française), et surtout les agonistes du glucagon-like peptide-1 (GLP1) qui amplifient la sécrétion d’insuline induite par l’hyperglycémie. Ces nouveaux hypoglycémiants ont un effet protecteur cardiovasculaire, au contraire des autres classes comme les sulfamides, les glinides ou les inhibiteurs de dipeptidyl peptidase-4 (DPP4) où l’impact cardiovasculaire s’est avéré plutôt neutre. Ces données d’efficacité pourraient dans un proche avenir modifier la stratégie médicamenteuse chez les patients à haut risque cardiovasculaire en deuxième ou troisième ligne de traitement, après échec de la metformine.
LE PRINCIPAL ENJEU
La prévention cardiovasculaire continue donc de progresser, devient plus précise et ciblée, et ouvre même de nouvelles voies pour bloquer complètement le processus athéromateux. Il est improbable que les années à venir voient la stratégie actuelle combinant une polythérapie médicamenteuse et l’adoption d’un style de vie favorable à la santé être remise en cause. Côté patient, une fois passée l’annonce de la maladie artérielle et de ses risques imprévisibles, rien n’est moins aisé que de s’engager dans de nouvelles pratiques quotidiennes, de maintenir l’assiduité des efforts sur le long terme, a fortiori quand la personne est fragilisée par l’irruption de sa maladie, son contexte de vie ou son histoire, et que l’observance est suggérée ou imposée de l’extérieur alors que la « maladie » est redevenue asymptomatique. Ainsi, dans la pratique de soin au quotidien, le plus grand enjeu est souvent de parvenir à traduire ces données factuelles bien établies en changements effectifs des modes de vie et de consommation des patients les plus à risque, comme du reste de la population, et à faire maintenir durablement ces nouvelles habitudes.7
Références
1. Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016;37:2315-81.
2. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias. Eur Heart J 2016;37:2999-3058.
3. Aboyans V, Ricco JB, Bartelink MEL, et al. 2017 ESC guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. Endorsed by: the European Stroke Organization (ESO) the task force for the diagnosis and treatment of peripheral arterial diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39:763-816.
4. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018;39:213-60.
5. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. Actualisation des repères du PNNS - Révisions des repères relatifs à l’activité physique et à la sédentarité. Rapport d’expertise collective, Anses 2016. www.anses.fr ou http://bit.ly/1SnJG8N
6. Hercberg S, Margaritis I, Adriouch S. Rôle de la nutrition dans les maladies chroniques. Rev Prat 2017;67:321-39.
7. Ledru F, Lamar-Tanguy A, Feriel M. Prévention non médicamenteuse après un syndrome coronarien aigu. Rev Prat Med Gen 2016;30:199-205.
8. Décret n° 2016-1990 du 30 décembre 2016 relatif aux conditions de dispensation de l'activité physique adaptée prescrite par le médecin traitant à des patients atteints d'une affection de longue durée. JORF no 0304 du 31 décembre 2016.
9. Ramsden CE, Zamora D, Leelarthaepin B, et al. Use of dietary linoleic acid for secondary prevention of coronary heart disease and death: evaluation of recovered data from the Sydney Diet Heart Study and updated meta-analysis. BMJ 2013;346:e8707.
10. O'Sullivan TA, Hafekost K, Mitrou F, Lawrence D. Food sources of saturated fat and the association with mortality: a meta-analysis. Am J Public Health 2013;103:e31-42.
11. Bongard V, Arveiler D, Dallongeville J, et al. Food groups associated with a reduced risk of 15-year all-cause death. Eur J Clin Nutr 2016;70:715-22.
12. Haute Autorité de santé. Principales dyslipidémies : stratégies de prise en charge. Fiche mémo, HAS 2017. www.has-sante.fr ou http://bit.ly/2IqaTqh
13. Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016;388:2532-61.
14. Gupta A, Thompson D, Whitehouse A, et al. Adverse events associated with unblinded, but not with blinded, statin therapy in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA): a randomised double-blind placebo-controlled trial and its non-randomised non-blind extension phase. Lancet 2017;389:2473-81.
15. Banach M, Serban C, Sahebkar A, et al. Effects of coenzyme Q10 on statin-induced myopathy: a meta-analysis of randomized controlled trials. Mayo Clin Proc 2015;90:24-34.
16. Lamar-Tanguy A, Ledru F. Prévention cardiovasculaire secondaire : le point sur le traitement médicamenteux. Rev Prat Med Gen 2014;28:725-30.
17. Costa F, van Klaveren D, James S, et al. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual a ntiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet 2017;389:1025-34.
18. Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791-800.
19. Cannon CP, Bhatt DL, Oldgren J, et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2018;378:485-6.
20. Eikelboom JW, Connolly SJ, Bosch J, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017;377:1319-30.
2. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias. Eur Heart J 2016;37:2999-3058.
3. Aboyans V, Ricco JB, Bartelink MEL, et al. 2017 ESC guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. Endorsed by: the European Stroke Organization (ESO) the task force for the diagnosis and treatment of peripheral arterial diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39:763-816.
4. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018;39:213-60.
5. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. Actualisation des repères du PNNS - Révisions des repères relatifs à l’activité physique et à la sédentarité. Rapport d’expertise collective, Anses 2016. www.anses.fr ou http://bit.ly/1SnJG8N
6. Hercberg S, Margaritis I, Adriouch S. Rôle de la nutrition dans les maladies chroniques. Rev Prat 2017;67:321-39.
7. Ledru F, Lamar-Tanguy A, Feriel M. Prévention non médicamenteuse après un syndrome coronarien aigu. Rev Prat Med Gen 2016;30:199-205.
8. Décret n° 2016-1990 du 30 décembre 2016 relatif aux conditions de dispensation de l'activité physique adaptée prescrite par le médecin traitant à des patients atteints d'une affection de longue durée. JORF no 0304 du 31 décembre 2016.
9. Ramsden CE, Zamora D, Leelarthaepin B, et al. Use of dietary linoleic acid for secondary prevention of coronary heart disease and death: evaluation of recovered data from the Sydney Diet Heart Study and updated meta-analysis. BMJ 2013;346:e8707.
10. O'Sullivan TA, Hafekost K, Mitrou F, Lawrence D. Food sources of saturated fat and the association with mortality: a meta-analysis. Am J Public Health 2013;103:e31-42.
11. Bongard V, Arveiler D, Dallongeville J, et al. Food groups associated with a reduced risk of 15-year all-cause death. Eur J Clin Nutr 2016;70:715-22.
12. Haute Autorité de santé. Principales dyslipidémies : stratégies de prise en charge. Fiche mémo, HAS 2017. www.has-sante.fr ou http://bit.ly/2IqaTqh
13. Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016;388:2532-61.
14. Gupta A, Thompson D, Whitehouse A, et al. Adverse events associated with unblinded, but not with blinded, statin therapy in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA): a randomised double-blind placebo-controlled trial and its non-randomised non-blind extension phase. Lancet 2017;389:2473-81.
15. Banach M, Serban C, Sahebkar A, et al. Effects of coenzyme Q10 on statin-induced myopathy: a meta-analysis of randomized controlled trials. Mayo Clin Proc 2015;90:24-34.
16. Lamar-Tanguy A, Ledru F. Prévention cardiovasculaire secondaire : le point sur le traitement médicamenteux. Rev Prat Med Gen 2014;28:725-30.
17. Costa F, van Klaveren D, James S, et al. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual a ntiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet 2017;389:1025-34.
18. Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791-800.
19. Cannon CP, Bhatt DL, Oldgren J, et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2018;378:485-6.
20. Eikelboom JW, Connolly SJ, Bosch J, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017;377:1319-30.
Dans cet article
- Stratégies universelles, indépendantes du niveau de risque
- Stratégies de prévention conditionnées par l’importance du risque
- Prévention médicamenteuse : clarifications concernant l’usage des traitements antithrombotiques
- De nouvelles stratégies thérapeutiques pourraient modifier les prochaines recommandations…
- LE PRINCIPAL ENJEU