Le lymphome de Hodgkin (LH) est un cancer curable par chimiothérapie et radiothérapie. Les séquelles induites par ces traitements sont de deux ordres : séquelles dites d’organes, directement en lien avec les traitements de chimiothérapie et radiothérapie, et conséquences sur la qualité de vie et psychosociales de la maladie et des traitements.
Les grandes études épidémiologiques permettent de faire un état des lieux du sur-risque de toxicité d’organes. Elles apportent principalement des informations sur le risque de cancer secondaire et la survenue de pathologies cardiovasculaires. L’interprétation des données de ces études peut s’avérer complexe, compte tenu des modifications des schémas thérapeutiques au cours du temps, surtout par rapport aux modalités de la radiothérapie en matière de doses et de taille des champs d’irradiation. Ces études ont cependant l’avantage d’avoir un suivi très long, permettant une meilleure estimation du risque en fonction du temps.
Les grandes études épidémiologiques permettent de faire un état des lieux du sur-risque de toxicité d’organes. Elles apportent principalement des informations sur le risque de cancer secondaire et la survenue de pathologies cardiovasculaires. L’interprétation des données de ces études peut s’avérer complexe, compte tenu des modifications des schémas thérapeutiques au cours du temps, surtout par rapport aux modalités de la radiothérapie en matière de doses et de taille des champs d’irradiation. Ces études ont cependant l’avantage d’avoir un suivi très long, permettant une meilleure estimation du risque en fonction du temps.
Augmentation du risque de second cancer
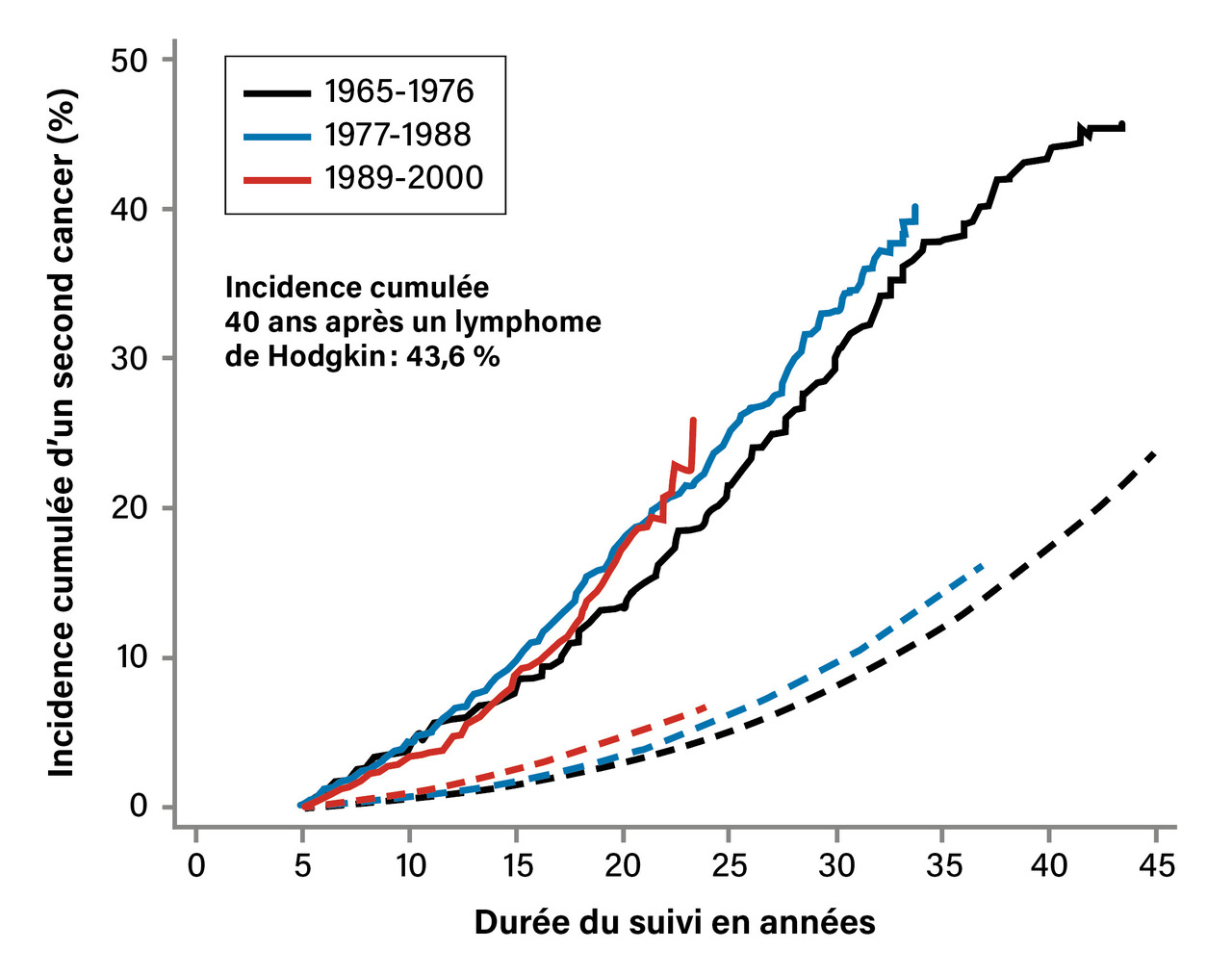
Dans trois études épidémiologiques ayant analysé des patients traités de 1963 à 2001,1-3 le risque relatif de second cancer est de 2,62 à 5 comparé à la population générale, avec une incidence cumulative de 43,6 % de cancer secondaire sur quarante ans de suivi dans l’une de ces études (fig. 1 ).1 Il ne semble pas que ce sur-risque ait diminué pour les périodes les plus récentes de ces études, de 1990 à 2000. Cependant, le risque de cancer secondaire est 60 % moins important lorsque les patients ne reçoivent pas de radiothérapie et de 40 % en cas de radiothérapie avec des champs d’irradiation moins importants qu’une irradiation « en mantelet ». Une étude du LH de stade localisé traité par chimiothérapie et radiothérapie de 1993 à 2003 retrouve une incidence cumulative de cancers secondaires à dix et vingt ans de 5 % et 27 % respectivement.4 Des analyses récentes sont cependant plus encourageantes par rapport à la réduction du risque de cancer secondaire. Une analyse de 1999 à 2005 des registres suédois de patients traités par chimiothérapie de type ABVD, deux à quatre cycles, suivie d’une radiothérapie « moderne » avec des champs d’irradiation limités retrouve un sur-risque limité (hazard ratio : 1,5) mais pas totalement identique à celui de la population générale.5 La limite de cette étude est bien entendu un recul encore peu important.
Quel référentiel de suivi par rapport au sur-risque de cancer secondaire ?
Les référentiels des sociétés savantes sont très différents les uns des autres concernant une spécificité de suivi par rapport aux dépistages proposés en population générale.6 Le dépistage peut concerner les cancers du sein, du poumon, digestifs, cutanés et de la thyroïde. C’est principalement le dépistage des cancers du sein chez la patiente jeune ayant eu un traitement de radiothérapie thoracique qui est relativement commun aux différents référentiels.
Selon les recommandations de la Haute Autorité de santé (HAS), le dépistage réalisé correspond à un examen clinique annuel pour les patientes avant 30 ans et/ou dans les sept années après la radiothérapie. À partir de 30 ans et à partir de huit ans après la fin de la radiothérapie sont préconisés un examen clinique semestriel et un bilan d’imagerie annuel associant imagerie par résonance magnétique (IRM) mammaire, mammographie (une seule incidence par sein) associée à une éventuelle échographie mammaire, à la discrétion du radiologue. À partir de 65 ans et sans limite d’âge sont préconisés un examen clinique semestriel et une mammographie annuelle (deux incidences par sein) éventuellement complétée par une échographie mammaire.
L’ensemble de cette surveillance et ces bilans doivent se faire en concertation avec le radiothérapeute, l’hématologue, une équipe de radiologie spécialisée, le médecin traitant et le gynécologue de la patiente pour donner des recommandations personnalisées et assurer un suivi optimal.
Pour le dépistage des autres cancers, le référentiel du consortium BETER (Better care after Hodgkin lymphoma: Evaluation of long-term Treatment Effect and screening Recommendations), aux Pays-Bas, ne prévoit pas de dépistages spécifiques autres que ceux prévus en population générale, leurs impacts sur la morbidité et la mortalité n’étant pas prouvés.7
Selon les recommandations de la Haute Autorité de santé (HAS), le dépistage réalisé correspond à un examen clinique annuel pour les patientes avant 30 ans et/ou dans les sept années après la radiothérapie. À partir de 30 ans et à partir de huit ans après la fin de la radiothérapie sont préconisés un examen clinique semestriel et un bilan d’imagerie annuel associant imagerie par résonance magnétique (IRM) mammaire, mammographie (une seule incidence par sein) associée à une éventuelle échographie mammaire, à la discrétion du radiologue. À partir de 65 ans et sans limite d’âge sont préconisés un examen clinique semestriel et une mammographie annuelle (deux incidences par sein) éventuellement complétée par une échographie mammaire.
L’ensemble de cette surveillance et ces bilans doivent se faire en concertation avec le radiothérapeute, l’hématologue, une équipe de radiologie spécialisée, le médecin traitant et le gynécologue de la patiente pour donner des recommandations personnalisées et assurer un suivi optimal.
Pour le dépistage des autres cancers, le référentiel du consortium BETER (Better care after Hodgkin lymphoma: Evaluation of long-term Treatment Effect and screening Recommendations), aux Pays-Bas, ne prévoit pas de dépistages spécifiques autres que ceux prévus en population générale, leurs impacts sur la morbidité et la mortalité n’étant pas prouvés.7
Suivi des complications cardiovasculaires
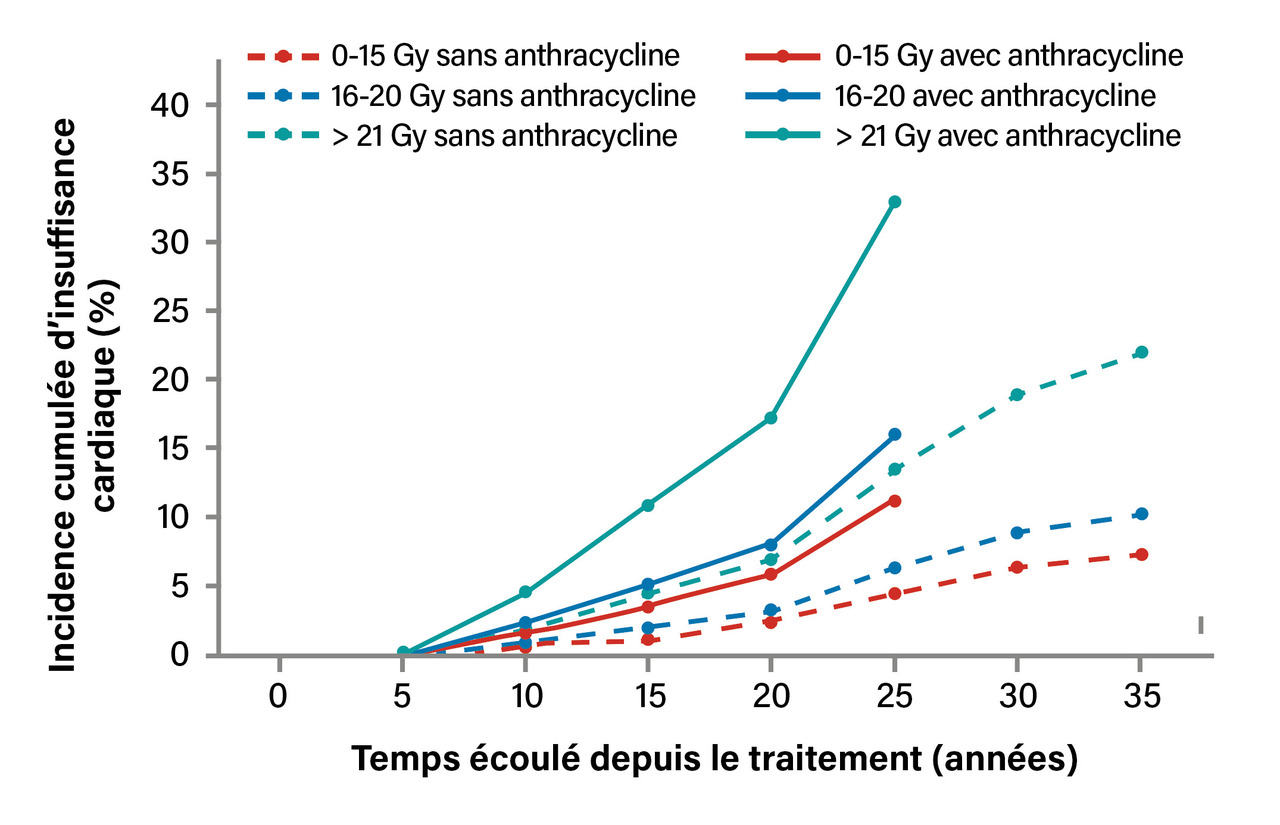
Les complications cardiovasculaires sont également des séquelles au premier plan en matière de morbidité et de mortalité. Les grandes études épidémiologiques confirment l’augmentation du risque de cardiopathie avec l’utilisation d’une chimiothérapie comportant des anthracyclines, avec une augmentation linéaire du risque en fonction des doses reçues.8,9 C’est également le cas pour la radiothérapie médiastinale avec les doses de rayonnement reçues sur le massif cardiaque, avec une augmentation du risque dès la dose de 20 Gy8 et un effet cumulatif lors de l’utilisation d’anthracyclines (fig. 2 ).
Les cardiopathies observées sont le plus souvent des valvulopathies, une arythmie, une insuffisance cardiaque et des cardiopathies ischémiques.9 Les études soulignent l’importance du suivi des patients à long terme mais surtout la nécessité du contrôle des autres facteurs de risque cardiovasculaire (dyslipidémie, diabète, hypertension artérielle, obésité, tabagisme).9 Une étude récente menée en Suède auprès des patients traités de 1999 à 2005 pour des stades localisés (2 à 4 cycles d’ABVD et radiothérapie de champ limité à la dose de 30 Gy) confirme un sur-risque plus limité mais toujours présent de pathologies cardiovasculaires par rapport à une population appariée (20 % versus 16 %).5 Les référentiels de proposition de suivi sont également très différents concernant les risques cardiovasculaires.6 Le référentiel du consortium BETER se rapproche le plus des pratiques cliniques actuelles, avec une évaluation cardiologique en fin de traitement, puis tous les cinq ans.7 La liste des différents examens cardiovasculaires à réaliser doit être discutée avec le cardiologue. En effet, des études de suivi systématiques par coroscanner montrent des anomalies chez 26 % de patients asymptomatiques, avec 15 % d’anomalies dans les cinq premières années.10
Les cardiopathies observées sont le plus souvent des valvulopathies, une arythmie, une insuffisance cardiaque et des cardiopathies ischémiques.9 Les études soulignent l’importance du suivi des patients à long terme mais surtout la nécessité du contrôle des autres facteurs de risque cardiovasculaire (dyslipidémie, diabète, hypertension artérielle, obésité, tabagisme).9 Une étude récente menée en Suède auprès des patients traités de 1999 à 2005 pour des stades localisés (2 à 4 cycles d’ABVD et radiothérapie de champ limité à la dose de 30 Gy) confirme un sur-risque plus limité mais toujours présent de pathologies cardiovasculaires par rapport à une population appariée (20 % versus 16 %).5 Les référentiels de proposition de suivi sont également très différents concernant les risques cardiovasculaires.6 Le référentiel du consortium BETER se rapproche le plus des pratiques cliniques actuelles, avec une évaluation cardiologique en fin de traitement, puis tous les cinq ans.7 La liste des différents examens cardiovasculaires à réaliser doit être discutée avec le cardiologue. En effet, des études de suivi systématiques par coroscanner montrent des anomalies chez 26 % de patients asymptomatiques, avec 15 % d’anomalies dans les cinq premières années.10
Autres conséquences des traitements
L’utilisation de la radiothérapie cervicale impose un suivi du bilan thyroïdien avec un dosage annuel de la thyréostimuline (thyroid-stimulating hormone [TSH]).7
La réduction des champs d’irradiation a permis une diminution de la fréquence des pneumopathies radiques. La fréquence des pathologies respiratoires semble plus importante que celle observée dans la population générale (7 % versus 2 %) avec, dans une étude, plus de cas d’asthme séquellaire.5 En l’absence de signes cliniques ou d’autres facteurs de risque, l’utilité d’un suivi spécifique par des épreuves fonctionnelles respiratoires n’est pas démontrée.7
Letableau résume les principes de la surveillance « d’organes » pour les patients traités pour un LH en prenant en compte le fait que les référentiels sont variables en fonction des pays et des sociétés savantes6,7 et doivent être adaptés à la spécificité de chaque patient.
Une étude très détaillée du registre de Suède confirme une fréquence plus élevée de consommation de soins chez les patients antérieurement traités pour un LH qui se traduit par un doublement des consultations médicales jusqu’à dix ans après le traitement et trois fois plus d’hospitalisation jusqu’à six ans après la fin du traitement.11
La réduction des champs d’irradiation a permis une diminution de la fréquence des pneumopathies radiques. La fréquence des pathologies respiratoires semble plus importante que celle observée dans la population générale (7 % versus 2 %) avec, dans une étude, plus de cas d’asthme séquellaire.5 En l’absence de signes cliniques ou d’autres facteurs de risque, l’utilité d’un suivi spécifique par des épreuves fonctionnelles respiratoires n’est pas démontrée.7
Le
Une étude très détaillée du registre de Suède confirme une fréquence plus élevée de consommation de soins chez les patients antérieurement traités pour un LH qui se traduit par un doublement des consultations médicales jusqu’à dix ans après le traitement et trois fois plus d’hospitalisation jusqu’à six ans après la fin du traitement.11
Problèmes psychosociaux séquellaires : mauvaises et bonnes nouvelles
Il s’agit d’un domaine qui a beaucoup été investi chez les patients avec un antécédent de LH, principalement du fait de la curabilité de ce cancer et de sa survenue majoritairement chez des individus jeunes, avec notamment des suivis à long terme de cohortes de LH pédiatrique.12 Le fait que les grands « fondements » de la personnalité s’établissent chez l’adulte jeune peut avoir, avec le diagnostic de cancer, ses traitements et les éventuelles séquelles, des conséquences psychosociales.
Une étude publiée récemment sur le suivi d’une cohorte pédiatrique de LH traitée il y a plus de cinq ans, avec comme contrôle les membres de la fratrie, montre des troubles neurocognitifs plus importants, des épisodes dépressifs plus fréquents, un effet sur la qualité de vie et un risque plus important de périodes sans emploi.14 Néanmoins, la grande majorité des jeunes patients ayant eu un LH n’ont pas de séquelles psychosociales ! Cette étude démontre que les séquelles sont largement indépendantes du type de traitement réalisé. Il apparaît qu’elles sont corrélées à des facteurs de risque modifiables, comme l’obésité, le tabagisme et le manque d’activité physique. Même s’il est difficile, dans ce type d’études, de bien définir quelles sont les causes et les conséquences des troubles psychosociaux, des pistes d’intervention sont proposées sur le contrôle de facteurs de risque finalement communs à la population générale.
Dans une autre étude, c’est principalement la fatigue sévère post-thérapeutique qui est un facteur de risque majeur de difficulté à trouver un emploi, avec, comme attendu, des difficultés financières et une fréquence plus importante de consommation médicale.15
Une étude publiée récemment sur le suivi d’une cohorte pédiatrique de LH traitée il y a plus de cinq ans, avec comme contrôle les membres de la fratrie, montre des troubles neurocognitifs plus importants, des épisodes dépressifs plus fréquents, un effet sur la qualité de vie et un risque plus important de périodes sans emploi.14 Néanmoins, la grande majorité des jeunes patients ayant eu un LH n’ont pas de séquelles psychosociales ! Cette étude démontre que les séquelles sont largement indépendantes du type de traitement réalisé. Il apparaît qu’elles sont corrélées à des facteurs de risque modifiables, comme l’obésité, le tabagisme et le manque d’activité physique. Même s’il est difficile, dans ce type d’études, de bien définir quelles sont les causes et les conséquences des troubles psychosociaux, des pistes d’intervention sont proposées sur le contrôle de facteurs de risque finalement communs à la population générale.
Dans une autre étude, c’est principalement la fatigue sévère post-thérapeutique qui est un facteur de risque majeur de difficulté à trouver un emploi, avec, comme attendu, des difficultés financières et une fréquence plus importante de consommation médicale.15
Fatigue séquellaire
La présence d’une fatigue séquellaire a principalement été démontrée grâce à des questionnaires spécifiques dans le cadre des études thérapeutiques ou de suivi de cohortes. Leur grand enseignement est la mise en évidence d’une fréquence importante de ce symptôme (environ 20 % des patients), même à distance des traitements, qui est corrélée à l’état de fatigue lors du diagnostic initial et à l’âge.13 En revanche, elle n’est pas corrélée à l’intensité de la chimiothérapie ni au stade du lymphome.13 Cela incite à mieux évaluer les patients avant et après traitement pour mettre en place des actions préventives.
Un suivi prolongé est nécessaire
L’ensemble de ces données montre que le suivi des patients ayant eu un lymphome de Hodgkin doit être multidisciplinaire et prolongé. Lors des premières années et le plus souvent jusqu’à cinq ans après traitement, un suivi est effectué auprès de l’hématologue référent. Il est important que des recommandations soient clairement transmises au médecin traitant pour assurer le suivi à long terme compte tenu du risque de survenue de toxicité très à distance des traitements. Des équipes spécialisées (radiothérapeute, radiologue, gynécologue, cardiologue) doivent être impliquées pour indiquer les examens paracliniques recommandés à réaliser dans le suivi. Il est également important de détecter les conséquences psychosociales et l’impact sur la qualité de vie de la maladie et des traitements.
Références
1. Hodgson DC, Gilbert ES, Dores GM, Schonfeld SJ, Lynch CF, Storm H, et al. Long-term solid cancer risk among 5-year survivors of Hodgkin’s lymphoma. J Clin Oncol 2007;25(12):1489-97.
2. Swerdlow AJ, Higgins CD, Smith P, Cunningham D, Hancock BW, Horwich A, et al. Second cancer risk after chemotherapy for Hodgkin’s lymphoma: A collaborative British cohort study. J Clin Oncol 2011;29(31):4096-104.
3. Schaapveld M, Aleman BM, van Eggermond AM, Janus CP, Krol AD, van der Maazen RW, et al. Second cancer risk up to 40 years after treatment for Hodgkin’s lymphoma. N Engl J Med 2015;373(26):2499-511.
4. Sasse S, Bröckelmann PJ, Goergen H, Plütschow A, Müller H, Kreissl S, et al. Long-term follow-up of contemporary treatment in early-stage Hodgkin lymphoma: Updated analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol 2017;35(18):1999-2007.
5. Lagerlöf I, Fohlin H, Enblad G, Glimelius B, Goldkuhl C, Palma M, et al. Limited, but not eliminated, excess long-term morbidity in stage I-IIA Hodgkin lymphoma treated with doxorubicin, bleomycin, vinblastine, and dacarbazine and limited-field radiotherapy. J Clin Oncol 2022;40(13):1487-96.
6. van Leeuwen FE, Ng AK. Late sequelae in Hodgkin lymphoma survivors. Hematol Oncol 2017;35 Suppl 1:60-66.
7. Nijdam A, Dekker N, Aleman BMP, van ‘t Veer MB, Daniels LA, van der Maazen RW, et al.; BETER consortium. Setting up a national infrastructure for survivorship care after treatment for Hodgkin lymphoma. Br J Haematol 2019;186(4):e103-e108.
8. van Nimwegen FA, Ntentas G, Darby SC, Schaapveld M, Hauptmann M, Lugtenburg PJ, et al. Risk of heart failure in survivors of Hodgkin lymphoma: Effects of cardiac exposure to radiation and anthracyclines. Blood 2017;129(16):2257-65.
9. Maraldo MV, Giusti F, Vogelius IR, Lundemann M, van der Kaaij MA, Ramadan S, et al.; European Organisation for Research and Treatment of Cancer (EORTC) Lymphoma Group. Cardiovascular disease after treatment for Hodgkin’s lymphoma: An analysis of nine collaborative EORTC-LYSA trials. Lancet Haematol 2015;2(11):e492-502.
10. Girinsky T, M’Kacher R, Lessard N, Koscielny S, Elfassy E, Raoux F, et al. Prospective coronary heart disease screening in asymptomatic Hodgkin lymphoma patients using coronary computed tomography angiography: Results and risk factor analysis. Int J Radiat Oncol Biol Phys 2014;89(1):59-66.
11. Glimelius I, Eloranta S, Ekberg S, Chang ET, Neovius M, Smedby KE. Increased healthcare use up to 10 years among relapse-free Hodgkin lymphoma survivors in the era of intensified chemotherapy and limited radiotherapy. Am J Hematol 2017;92(3):251-258.
12. Pálmarsdóttir R, Kiesbye Øvlisen A, Severinsen MT, Glimelius I, Smedby KE, El-Galaly T. Socioeconomic impact of Hodgkin lymphoma in adult patients: A systematic literature review. Leuk Lymphoma 2019;60(13):3116-31.
13. Kreissl S, Mueller H, Goergen H, Mayer A, Brillant C, Behringer K, et al.; German Hodgkin Study Group. Cancer-related fatigue in patients with and survivors of Hodgkin’s lymphoma: A longitudinal study of the German Hodgkin Study Group. Lancet Oncol 2016;17(10):1453-62.
14. Williams AM, Mirzaei Salehabadi S, Xing M, Phillips NS, Ehrhardt MJ, Howell R, et al. Modifiable risk factors for neurocognitive and psychosocial problems after Hodgkin lymphoma. Blood 2022;139(20):3073-86.
15. Behringer K, Goergen H, Müller H, Thielen I, Brillant C, Kreissl S, et al. Cancer-related fatigue in patients with and survivors of Hodgkin lymphoma: The impact on treatment outcome and social reintegration. J Clin Oncol 2016;34(36):4329-37.
2. Swerdlow AJ, Higgins CD, Smith P, Cunningham D, Hancock BW, Horwich A, et al. Second cancer risk after chemotherapy for Hodgkin’s lymphoma: A collaborative British cohort study. J Clin Oncol 2011;29(31):4096-104.
3. Schaapveld M, Aleman BM, van Eggermond AM, Janus CP, Krol AD, van der Maazen RW, et al. Second cancer risk up to 40 years after treatment for Hodgkin’s lymphoma. N Engl J Med 2015;373(26):2499-511.
4. Sasse S, Bröckelmann PJ, Goergen H, Plütschow A, Müller H, Kreissl S, et al. Long-term follow-up of contemporary treatment in early-stage Hodgkin lymphoma: Updated analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol 2017;35(18):1999-2007.
5. Lagerlöf I, Fohlin H, Enblad G, Glimelius B, Goldkuhl C, Palma M, et al. Limited, but not eliminated, excess long-term morbidity in stage I-IIA Hodgkin lymphoma treated with doxorubicin, bleomycin, vinblastine, and dacarbazine and limited-field radiotherapy. J Clin Oncol 2022;40(13):1487-96.
6. van Leeuwen FE, Ng AK. Late sequelae in Hodgkin lymphoma survivors. Hematol Oncol 2017;35 Suppl 1:60-66.
7. Nijdam A, Dekker N, Aleman BMP, van ‘t Veer MB, Daniels LA, van der Maazen RW, et al.; BETER consortium. Setting up a national infrastructure for survivorship care after treatment for Hodgkin lymphoma. Br J Haematol 2019;186(4):e103-e108.
8. van Nimwegen FA, Ntentas G, Darby SC, Schaapveld M, Hauptmann M, Lugtenburg PJ, et al. Risk of heart failure in survivors of Hodgkin lymphoma: Effects of cardiac exposure to radiation and anthracyclines. Blood 2017;129(16):2257-65.
9. Maraldo MV, Giusti F, Vogelius IR, Lundemann M, van der Kaaij MA, Ramadan S, et al.; European Organisation for Research and Treatment of Cancer (EORTC) Lymphoma Group. Cardiovascular disease after treatment for Hodgkin’s lymphoma: An analysis of nine collaborative EORTC-LYSA trials. Lancet Haematol 2015;2(11):e492-502.
10. Girinsky T, M’Kacher R, Lessard N, Koscielny S, Elfassy E, Raoux F, et al. Prospective coronary heart disease screening in asymptomatic Hodgkin lymphoma patients using coronary computed tomography angiography: Results and risk factor analysis. Int J Radiat Oncol Biol Phys 2014;89(1):59-66.
11. Glimelius I, Eloranta S, Ekberg S, Chang ET, Neovius M, Smedby KE. Increased healthcare use up to 10 years among relapse-free Hodgkin lymphoma survivors in the era of intensified chemotherapy and limited radiotherapy. Am J Hematol 2017;92(3):251-258.
12. Pálmarsdóttir R, Kiesbye Øvlisen A, Severinsen MT, Glimelius I, Smedby KE, El-Galaly T. Socioeconomic impact of Hodgkin lymphoma in adult patients: A systematic literature review. Leuk Lymphoma 2019;60(13):3116-31.
13. Kreissl S, Mueller H, Goergen H, Mayer A, Brillant C, Behringer K, et al.; German Hodgkin Study Group. Cancer-related fatigue in patients with and survivors of Hodgkin’s lymphoma: A longitudinal study of the German Hodgkin Study Group. Lancet Oncol 2016;17(10):1453-62.
14. Williams AM, Mirzaei Salehabadi S, Xing M, Phillips NS, Ehrhardt MJ, Howell R, et al. Modifiable risk factors for neurocognitive and psychosocial problems after Hodgkin lymphoma. Blood 2022;139(20):3073-86.
15. Behringer K, Goergen H, Müller H, Thielen I, Brillant C, Kreissl S, et al. Cancer-related fatigue in patients with and survivors of Hodgkin lymphoma: The impact on treatment outcome and social reintegration. J Clin Oncol 2016;34(36):4329-37.
Dans cet article
- Augmentation du risque de second cancer
- Quel référentiel de suivi par rapport au sur-risque de cancer secondaire ?
- Suivi des complications cardiovasculaires
- Autres conséquences des traitements
- Problèmes psychosociaux séquellaires : mauvaises et bonnes nouvelles
- Fatigue séquellaire
- Un suivi prolongé est nécessaire