Les localisations cancéreuses des voies aérodigestives supérieures (VADS) peuvent être multiples (tumeurs synchrones des VADS) et le risque de second cancer primitif pulmonaire ou œsophagien est significativement élevé, ce qui impacte donc le bilan initial (recherche systématique) ainsi que le suivi des patients.
Le médecin généraliste a une place primordiale
Le médecin généraliste joue un rôle essentiel de vigilance devant tout symptôme unilatéral et persistant des VADS ou de la région cervicale et dans l’orientation rapide en milieu spécialisé. Son rôle est fondamental dans le suivi de ces patients avec de lourdes séquelles, à risque élevé de récidive de la tumeur primitive et de second cancer primitif, ainsi que dans l’accompagnement du sevrage alcoolo-tabagique.
Il est indispensable d’encourager et d’accompagner l’arrêt du tabac et la réduction de la consommation d’alcool en prévention primaire, mais également en phase de traitement et après ; en effet, la poursuite de ces consommations majore notamment le risque de complications des traitements, de second cancer, et a un impact sur la survie. Or un fumeur a 80 % plus de chance d’arrêter le tabagisme s’il reçoit de l’aide d’un professionnel de santé.
Quels sont les objectifs du suivi ?
Les objectifs du suivi d’un cancer des VADS sont multiples :1
– déceler les récidives locales (survenant à 90 % au cours des trois premières années) ou à distance ;
– rechercher et traiter les complications tardives liées aux traitements et les séquelles ;
– veiller à la qualité de vie et organiser les soins de support nécessaires ;
– encourager le sevrage alcoolo-tabagique s’il y a lieu ;
– déceler un second cancer primitif lié à l’alcool et/ou au tabac, dont le risque de survenue persiste avec le temps ;
– s’assurer du suivi buccodentaire, de la réhabilitation dentoprothétique et du port des gouttières de fluoration (chirurgien-dentiste) ;
– avoir une approche médicale globale sur les différents risques à prévenir pour la santé du patient ;
– permettre un accompagnement médico-social et une aide à la réinsertion professionnelle si cela est pertinent.
Quelles sont les modalités de la surveillance ?
La récidive est asymptomatique dans près de 40 % des cas. Elle doit être évoquée devant toute perte de poids ou nouvelle douleur exprimée par le patient. Le caractère permanent et/ou progressif de tout symptôme doit être considéré comme suspect.
Indiquer les signes d’alerte au patient
Une éducation du patient sur les signes évocateurs d’une récidive ou d’une deuxième localisation est systématique : réapparition de douleurs, gêne à la déglutition, modification de la voix, gêne à la respiration… De même, le patient doit être informé de la nécessité de consulter rapidement dans ces situations.
Prise en charge pluridisciplinaire
En pratique, le suivi est organisé par le ou les médecin(s) spécialiste(s) référent(s) (ORL, chirurgien maxillo-facial, oncologue médical et/ou oncologue radiothérapeute) de manière conjointe avec le médecin généraliste. Un échange régulier et réciproque d’informations est indispensable.
Le
Le
Le chirurgien-dentiste, le médecin nutritionniste ou gastroentérologue, le pharmacien, l’orthophoniste, l’infirmier(e), etc. sont également impliqués dans le suivi de ces patients.
Suivi au long cours à la recherche d’une deuxième localisation
Passé le délai des trois premières années pendant lesquelles l’attention doit être portée sur le risque de récidive locale, la surveillance doit se focaliser sur le dépistage d’une deuxième localisation, dont le risque persiste avec le temps. Il est important d’informer le patient du risque de seconde localisation et des symptômes d’alerte.
En effet, ces seconds cancers sont fréquents et concernent environ un patient sur cinq (sur-risque le plus élevé). Leur apparition est rapide, avec une incidence cumulée proche de 10 % à cinq ans ; en cas de survenue, le pronostic vital des patients est fortement entaché. Les trois principaux cancers sont ceux du poumon, des VADS et de l’œsophage. Le cancer du poumon est recherché par une tomodensitométrie (TDM) thoracique annuelle chez les patients n’ayant pas arrêté le tabac depuis au moins quinze ans. Une deuxième localisation de cancer des VADS est recherchée par l’examen clinique, complété par l’imagerie (tomodensitométrie/imagerie par résonance magnétique/tomographie par émission de positons [TDM/IRM/TEP]) et l’endoscopie au moindre doute. Le cancer de l’œsophage est dépisté par l’examen clinique, voire une endoscopie tous les deux ans.
Intégrer le suivi dans une démarche globale
Il convient d’intégrer la démarche de suivi dans le cadre d’une approche médicale globale comprenant :
– la lutte contre les facteurs de risque, avec notamment l’aide à l’arrêt du tabagisme et de la consommation d’alcool et l’encouragement à la pratique ou à la poursuite d’une activité physique adaptée à la personne et à ses capacités ;
– les vaccinations. Tous les vaccins vivants atténués sont contre-indiqués pendant la chimiothérapie et au moins six mois après la fin de celle-ci. Les vaccinations doivent être conformes aux recommandations vaccinales spécifiques chez les patients sous chimiothérapie préconisées par le Haut Conseil de la santé publique ;3
– le dépistage organisé des autres cancers et notamment du cancer colorectal chez les patients de 50 à 74 ans, du cancer du sein chez les patientes de 50 à 74 ans et du cancer du col de l’utérus chez les patientes de 25 à 65 ans.
Quels sont les apports de l’imagerie ?
La réalisation d’une imagerie après traitement répond à trois indications : l’évaluation de la réponse au traitement, la recherche d’une poursuite évolutive ou d’une récidive, et l’exploration des complications (ostéonécrose, par exemple).4
TDM et/ou IRM complémentaires du suivi clinique
Environ la moitié des récidives tumorales, soit locales, soit métastatiques, surviennent dans les deux premières années suivant le traitement d’un cancer des VADS. La chirurgie de rattrapage est habituellement proposée aux patients atteints d’une récidive locorégionale potentiellement résécable ; dans les autres cas, une irradiation ou une réirradiation associée ou non à une chimiothérapie peut être retenue, voire une chimiothérapie seule en cas d’évolution métastatique.
L’imagerie post-thérapeutique d’une tumeur maligne par TDM et/ou IRM complète le suivi clinique sans jamais le remplacer. Son objectif premier est d’aider au diagnostic précoce d’une récidive locale ou locorégionale potentiellement curable par un deuxième traitement.
Dans une moindre mesure, l’imagerie peut faire le diagnostic d’une évolution métastatique, conduisant alors habituellement à la mise en place d’un traitement palliatif symptomatique.
Enfin, l’imagerie peut concourir au diagnostic précoce de maladies liées aux mêmes facteurs de risque : deuxième cancer ORL ou thoracique, pathologies cardiovasculaires.
Il est important de rappeler que les aspects post-thérapeutiques en imagerie diffèrent considérablement en fonction du type de traitement réalisé (chirurgie, chimio-radiothérapie).
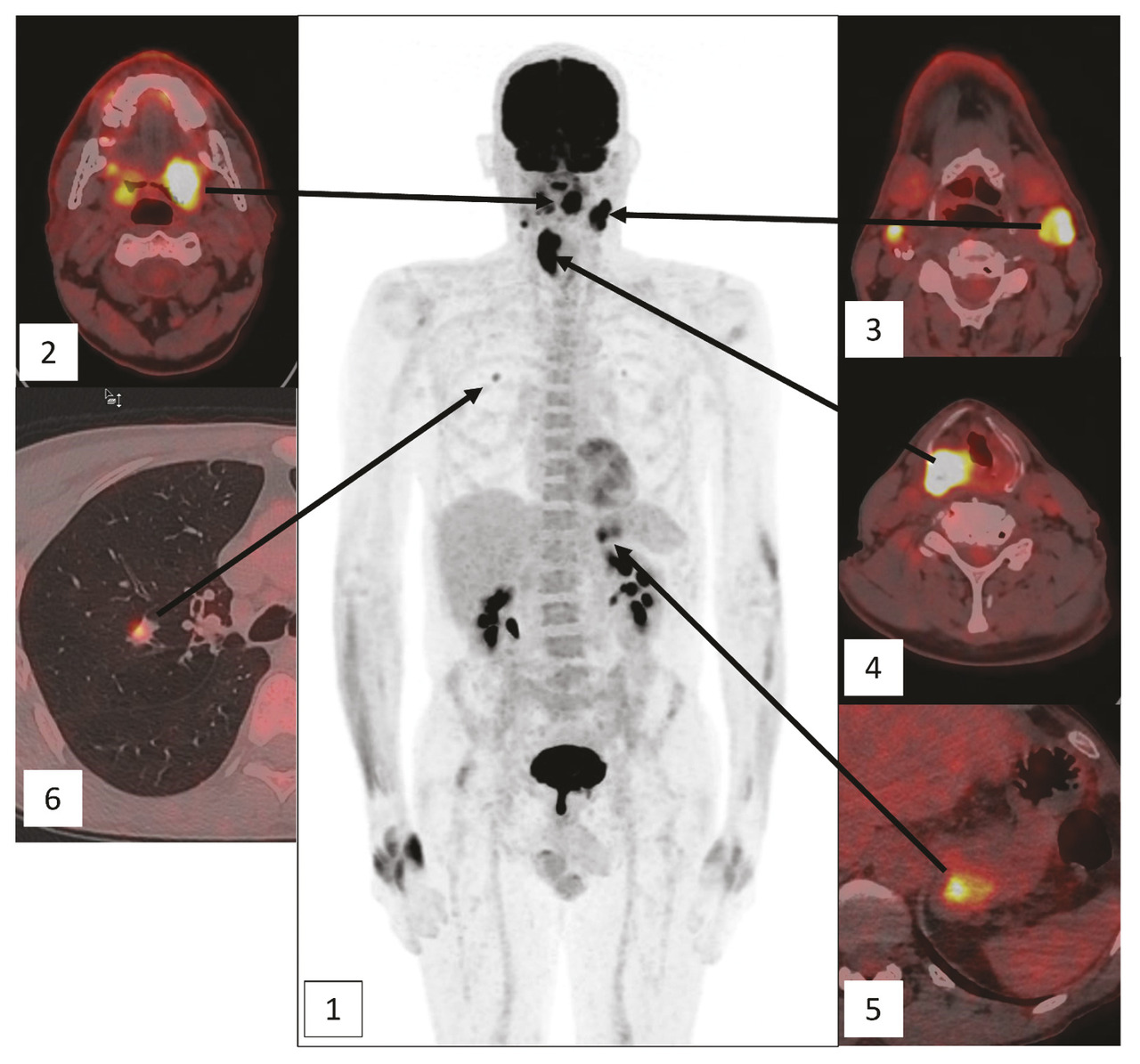
La TEP permet une exploration corps entier
La tomographie par émission de positons (TEP ou TEP-scanner) est une technique d’imagerie nucléaire complémentaire des techniques d’imagerie radiologique, TDM et IRM. Elle repose sur l’imagerie du métabolisme glucidique, le fluorodésoxyglucose (FDG) constituant le principal traceur utilisé en pratique clinique et notamment dans les cancers des VADS.5
Ses performances diagnostiques dans les cancers des VADS s’expliquent par sa capacité à explorer le corps entier, permettant de réaliser, en une seule procédure d’imagerie, le bilan complet de la maladie néoplasique métaboliquement active (
Les lésions épidermoïdes (heureusement les plus fréquentes), les cancers indifférenciés du cavum (UCNT) et les lymphomes agressifs ont un hypermétabolisme intense expliquant également les bonnes performances diagnostiques de la TEP-FDG dans ces indications.
Mais ceci n’est pas le cas pour d’autres lésions, authentiquement malignes, notamment des glandes salivaires ou des lymphomes de bas grade qui ne sont donc pas une bonne indication de la TEP-FDG.
Par ailleurs, la réaction inflammatoire post-radique de même que les lésions de radionécrose constituent une source de faux positifs qui peuvent persister pendant plusieurs mois après la fin de l’irradiation.
En pratique, il convient de s’attacher à la bonne valeur prédictive négative de la technique dans le champ d’irradiation et de rester prudent quant aux fixations résiduelles jusqu’à six mois en post-traitement.
1. Cancers des voies aérodigestives supérieures : du diagnostic au suivi. Outils pour la pratique/Médecins généralistes. Juillet 2018. Institut national du cancer. e-cancer.fr. https://vu.fr/SoXU
2. Recommandations de bonne pratique. Actualisation de la recommandation de 2005 sur le suivi post-thérapeutique des carcinomes épidermoïdes des VADS de l’adulte. 2015. Société française d’ORL. Sommaire : https://www.orlfrance.org/recommandations-de-bonne-pratique/ Recommandations : https://vu.fr/jtMm
3. Vaccination des personnes immunodéprimées ou aspléniques. Recommandations actualisées. Haut Conseil de la santé publique. Décembre 2014. https://vu.fr/mUXg
4. Imagerie post-thérapeutique en oncologie. Chapitre 2. Aspects post-thérapeutiques des carcinomes épidermoïdes de l’oropharynx de la cavité buccale. p. 21-38. Chapitre 3. Imagerie post-thérapeutique des carcinomes épidermoïdes du larynx et de l’hypopharynx p. 39-61. 2014 Elsevier Masson.
5. Bonardel G, Gontier E, Soret M, Foehrenbach H. Apport des techniques de médecine nucléaire dans la prise en charge des affections de la sphère oto-rhino-laryngologique. EMC. Elsevier Masson: Paris. Oto-rhino-laryngologie, 2009.