Le tabagisme est la principale cause de décès évitable dans le monde. En France, en 2015, la mortalité attribuable au tabac était estimée à 75 000 décès. Le tabagisme est reconnu comme un facteur de risque majeur, même des années après son arrêt, pour de nombreuses maladies complexes comme les cancers, les maladies cardiovasculaires et les pathologies respiratoires chroniques. De même, le tabagisme maternel durant la grossesse est un facteur de risque de morbidité, à la fois maternelle et fœtale.
De très nombreux composants chimiques de la cigarette produisent des effets toxiques
Les hydrocarbures aromatiques polycycliques, les N-nitrosamines, les métaux lourds, les alcaloïdes et les amines aromatiques font partie de ces composants. Bien que les effets génotoxiques de beaucoup de ces substances soient bien établis, les mécanismes qui conduisent aux divers effets à long terme du tabagisme sur la santé, tant chez les adultes, du fait de leur consommation personnelle, que chez les nourrissons et les enfants, du fait du tabagisme parental pendant la grossesse ou la petite enfance, sont encore insuffisamment compris. L’implication de mécanismes épigénétiques dans les effets à long terme du tabac a été explorée récemment.
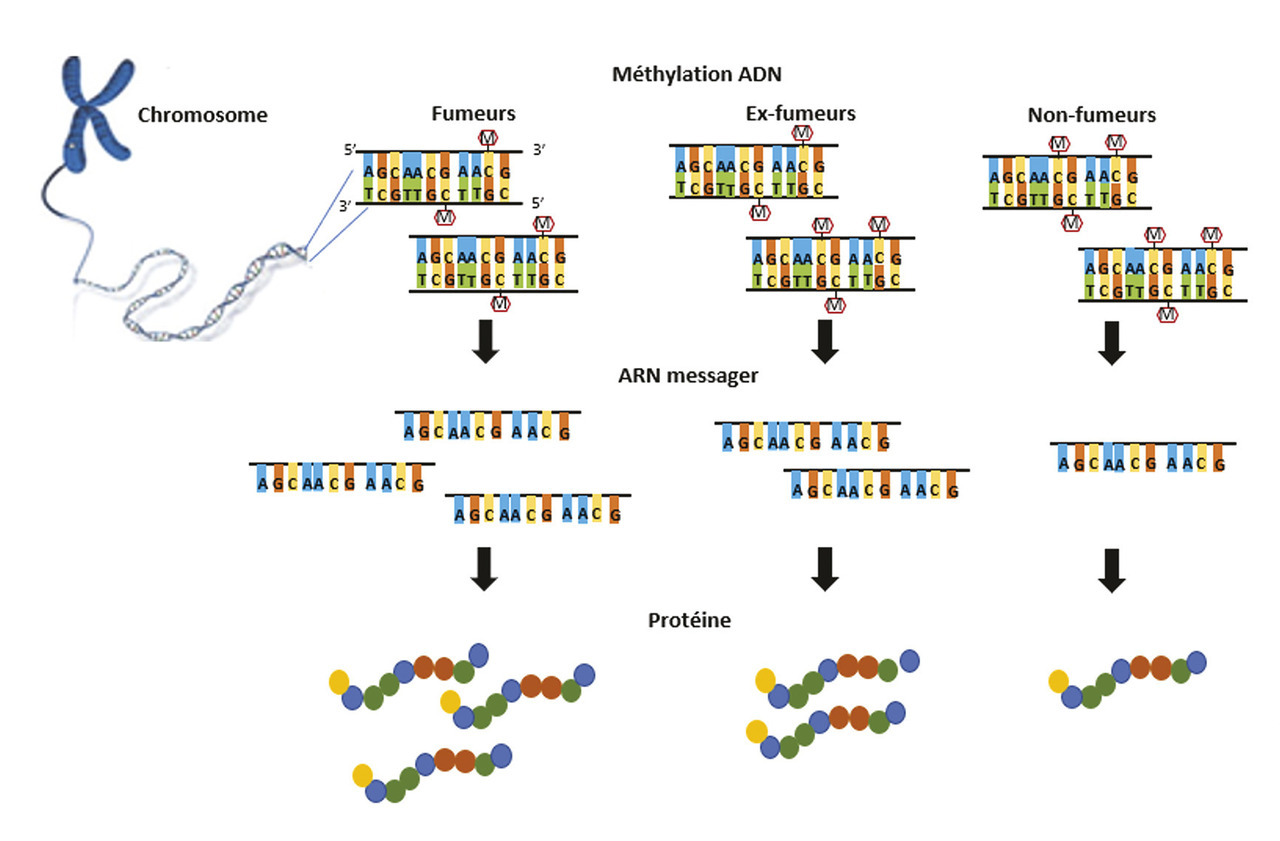
L’épigénétique correspond à l’étude des changements dans l’expression des gènes, n’impliquant pas de modification de la séquence de l’ADN. Ces modifications sont matérialisées par des marques biochimiques apposées sur la chromatine. Parmi elles, la méthylation de l’ADN correspond à l’ajout, par des enzymes spécifiques (les méthyltransférases), d’un groupement méthyl (CH3) sur une cytosine précédant un résidu guanine (site CpG : cytosine-phosphate-guanine) dans la séquence d’ADN (
Exposition au tabagisme maternel pendant la grossesse
Plus de 6 000 sites CpG différentiellement méthylés en fonction de l’exposition au tabagisme maternel pendant la grossesse ont été identifiés, avec une persistance des modifications de la méthylation chez les enfants, de nombreuses années après leur exposition prénatale.1 Ces sites CpG étaient situés au niveau de gènes pertinents pour des maladies liées au tabagisme maternel pendant la grossesse (comme les fentes oro-faciales ou l’asthme) ou associées au tabagisme de l’adulte (comme le cancer colorectal ou le cancer pulmonaire). Ces gènes étaient également enrichis pour plusieurs catégories de processus biologiques cruciaux dans le développement anatomique et du système nerveux. L’un des gènes les plus fréquemment concernés est AHRR (codant le répresseur du récepteur aux hydrocarbures polycycliques aromatiques) qui est impliqué dans la détoxification des xénobiotiques (dont de nombreux composants du tabac), la croissance et la différenciation cellulaire. Cette observation illustre la pertinence biologique de ces marqueurs épigénétiques.
Tabagisme maternel avant/pendant la grossesse et méthylation de l’ADN placentaire
Il a également été montré que le tabagisme maternel, même arrêté avant la grossesse, modifiait la méthylation de l’ADN placentaire. Ainsi, une récente étude portant sur l’impact de la consommation de tabac au cours des trois mois précédant la grossesse et/ou pendant la grossesse, a identifié 203 régions génomiques de l’ADN placentaire différentiellement méthylées.2 Parmi ces régions, 26 étaient altérées chez les anciennes fumeuses qui avaient arrêté de fumer trois mois avant la grossesse et dont le placenta n’avait donc pas été exposé directement à la cigarette. Plusieurs de ces modifications étaient situées au niveau de gènes jouant un rôle dans le développement du fœtus. La persistance d’importantes modifications de la méthylation de l’ADN dans le placenta d’anciennes fumeuses renforce l’hypothèse d’une « mémoire épigénétique » de l’exposition au tabac avant la grossesse.
Exposition au tabagisme actif : nombreuses marques de méthylation de l’ADN
De nombreuses marques de méthylation de l’ADN associées au tabagisme ont été identifiées dans le sang de sujets adultes. La comparaison des niveaux de méthylation de l’ADN des fumeurs actuels à ceux de personnes n’ayant jamais fumé a mis en évidence 2 623 sites CpG, associés à 1 405 gènes, méthylés de manière différentielle.3 Les sites CpG les plus significatifs étaient notamment annotés aux gènes HIVEP3 (facteur de transcription HIVEP zinc finger 3), AHRR, RARA (récepteur alpha de l’acide rétinoïque) et LRRN3 (leucine rich repeat neuronal 3). Il faut préciser que le gène HIVEP3 régule la formation osseuse, un déterminant important de l’ostéoporose. Les gènes associés aux CpG différentiellement méthylés chez les fumeurs étaient enrichis pour les voies biologiques associées aux cancers, à la fonction ventilatoire, aux maladies inflammatoires et cardiovasculaires. Parmi ces sites CpG, 185 différaient également entre les anciens fumeurs et les non-fumeurs, témoignant d’un modèle de méthylation altérée persistant après avoir cessé de fumer.
Comparaison de nouveau-nés exposés au tabac in utero et d’adultes fumeurs
Comparer la méthylation de l’ADN liée au tabagisme entre des nouveau-nés, après exposition prénatale, et des adultes fumeurs a permis d’identifier de très nombreuses signatures présentes uniquement chez les nouveau-nés (> 3 800 sites CpG) ainsi que de nombreuses signatures communes aux nouveau-nés et aux sujets adultes (environ 1 700 sites CpG).4 Les gènes différentiellement méthylés associés uniquement à une exposition au tabac in utero étaient notamment enrichis en voies biologiques liées au métabolisme des xénobiotiques.4
Le tabascore : construction de scores d’exposition
Les sites CpG porteurs d’une méthylation différentielle en fonction du statut tabagique peuvent servir de biomarqueurs de l’exposition au tabagisme au cours de la vie. La construction de scores de méthylation de l’ADN, à partir des sites CpG différentiellement méthylés, permettant de renseigner le comportement tabagique d’un sujet, a ainsi été proposée.5 Le score le plus simple se fonde sur le niveau de méthylation de l’ADN d’un seul site CpG au sein du gène AHRR (cg05575921, site CpG le plus fréquemment cité par les études d’EWAS sur les effets du tabac), qui permet de différencier les fumeurs actuels des non-fumeurs adultes, ainsi que les anciens fumeurs des non-fumeurs. D’autres scores ont été développés pour évaluer l’exposition au tabagisme maternel ou la mortalité liée au tabagisme.
Marqueur ou médiateur ?
Les différentes études épigénétiques ont montré que l’impact du tabagisme sur la méthylation de l’ADN est large et que les niveaux de méthylation altérés peuvent persister des décennies après l’arrêt du tabac. Elles ont fourni de nouvelles informations sur les mécanismes moléculaires qui sous-tendent les effets du tabagisme sur la santé et les maladies humaines. Toutefois, il est nécessaire d’évaluer si la méthylation de sites spécifiques de l’ADN est un médiateur entre le tabac et le développement de certaines pathologies, ou si cette méthylation n’est qu’un marqueur de l’exposition au tabac, indirectement associé au risque de développer une maladie.
1. Joubert BR, Felix JF, Yousefi P, Bakulski KM, Just AC, Breton C, et al. DNA methylation in newborns and maternal smoking in pregnancy: genome-wide consortium meta-analysis. Am J Hum Genet. 2016;98(4):680-96.
2. Rousseaux S, Seyve E, Chuffart F, Bourova-Flin E, Benmerad M, Charles MA, et al. Immediate and durable effects of maternal tobacco consumption alter placental DNA methylation in enhancer and imprinted gene-containing regions. BMC Med. 2020;18(1):306.
3. Joehanes R, Just AC, Marioni RE, Pilling LC, Reynolds LM, Mandaviya PR, et al. Epigenetic signatures of cigarette smoking. Circ Cardiovasc Genet. 2016;9(5):436-47.
4. Sikdar S, Joehanes R, Joubert BR, Xu CJ, Vives-Usano M, Rezwan FI, et al. Comparison of smoking-related DNA methylation between newborns from prenatal exposure and adults from personal smoking. Epigenomics. 2019;11(13):1487-500.
5. Bollepalli S, Korhonen T, Kaprio J, Anders S, Ollikainen M. EpiSmokEr: a robust classifier to determine smoking status from DNA methylation data. Epigenomics. 2019;11(13):1469-86.
Dans cet article
- De très nombreux composants chimiques de la cigarette produisent des effets toxiques
- Exposition au tabagisme maternel pendant la grossesse
- Tabagisme maternel avant/pendant la grossesse et méthylation de l’ADN placentaire
- Exposition au tabagisme actif : nombreuses marques de méthylation de l’ADN
- Comparaison de nouveau-nés exposés au tabac in utero et d’adultes fumeurs
- Le tabascore : construction de scores d’exposition
- Marqueur ou médiateur ?