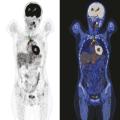
La tomographie par émission de positons (TEP-scan) est une technique d’imagerie nucléaire fonctionnelle non invasive et désormais largement disponible. Elle est fondée sur l’utilisation d’un radiotraceur radioactif ciblant un processus biologique, injecté au patient, dont la distribution peut ainsi être analysée à l’imagerie. Dans le lymphome de Hodgkin, la TEP est réalisée avec le 18-fluorodésoxyglucose (18-FDG), traceur le plus courant en TEP, analogue du glucose permettant une évaluation de l’activité glycolytique des tumeurs.
Le lymphome de Hodgkin est un cas particulier en TEP car l’hyperfixation observée est indirecte, largement portée par les cellules inflammatoires (le contingent tumoral étant très limité dans cette maladie).
La TEP au 18-FDG est devenue l’examen de choix dans le bilan d’extension et l’évaluation thérapeutique, et constitue un examen décisionnel dans des stratégies de traitement TEP-guidées personnalisées. Dans l’avenir, de nouveaux paramètres d’imagerie devraient permettre une meilleure identification des profils à risque, dès le diagnostic de la maladie, ouvrant la voie à de nouvelles optimisations thérapeutiques.
Le lymphome de Hodgkin est un cas particulier en TEP car l’hyperfixation observée est indirecte, largement portée par les cellules inflammatoires (le contingent tumoral étant très limité dans cette maladie).
La TEP au 18-FDG est devenue l’examen de choix dans le bilan d’extension et l’évaluation thérapeutique, et constitue un examen décisionnel dans des stratégies de traitement TEP-guidées personnalisées. Dans l’avenir, de nouveaux paramètres d’imagerie devraient permettre une meilleure identification des profils à risque, dès le diagnostic de la maladie, ouvrant la voie à de nouvelles optimisations thérapeutiques.
Première TEP pour le bilan d’extension et l’identification des cibles à irradier
La TEP initiale permet de réaliser un bilan d’extension du lymphome et constitue surtout une imagerie de référence indispensable pour évaluer correctement la réponse au traitement sur les TEP d’évaluation.
Par rapport au scanner ou tomodensitométrie (TDM) conventionnel(le), la TEP apporte principalement une valeur ajoutée dans le bilan d’extension extraganglionnaire de la maladie, notamment concernant la recherche d’atteinte médullaire, splénique ou celle d’un autre organe (foie, rein…).1,2
La TEP permet notamment de remplacer la biopsie ostéomédullaire (BOM) car elle est plus sensible, avec la même spécificité, en particulier grâce à sa capacité à évaluer l’atteinte médullaire sur l’ensemble du squelette (la BOM étant sujette au biais d’échantillonnage).3
Dans le cadre du lymphome de Hodgkin de stade localisé, la TEP initiale est également une aide précieuse pour les radiothérapeutes afin d'identifier les cibles qui seront irradiées à la fin du traitement de première ligne. Une collaboration entre les services de médecine nucléaire et de radiothérapie est importante pour ces patients, la TEP pouvant avantageusement être réalisée en position de traitement de radiothérapie pour permettre une meilleure planification de dose (acquisition sur le plan de radiothérapie pouvant utiliser le masque de radiothérapie et éventuellement avec injection de produit de contraste iodé).4
Enfin, la TEP peut également, dans des cas plus rares, permettre d’identifier des localisations à risque telles qu’une menace neurologique sur le canal médullaire ou des atteintes transmurales digestives susceptibles d’évoluer en perforation après traitement.
Par rapport au scanner ou tomodensitométrie (TDM) conventionnel(le), la TEP apporte principalement une valeur ajoutée dans le bilan d’extension extraganglionnaire de la maladie, notamment concernant la recherche d’atteinte médullaire, splénique ou celle d’un autre organe (foie, rein…).1,2
La TEP permet notamment de remplacer la biopsie ostéomédullaire (BOM) car elle est plus sensible, avec la même spécificité, en particulier grâce à sa capacité à évaluer l’atteinte médullaire sur l’ensemble du squelette (la BOM étant sujette au biais d’échantillonnage).3
Dans le cadre du lymphome de Hodgkin de stade localisé, la TEP initiale est également une aide précieuse pour les radiothérapeutes afin d'identifier les cibles qui seront irradiées à la fin du traitement de première ligne. Une collaboration entre les services de médecine nucléaire et de radiothérapie est importante pour ces patients, la TEP pouvant avantageusement être réalisée en position de traitement de radiothérapie pour permettre une meilleure planification de dose (acquisition sur le plan de radiothérapie pouvant utiliser le masque de radiothérapie et éventuellement avec injection de produit de contraste iodé).4
Enfin, la TEP peut également, dans des cas plus rares, permettre d’identifier des localisations à risque telles qu’une menace neurologique sur le canal médullaire ou des atteintes transmurales digestives susceptibles d’évoluer en perforation après traitement.
Bilan d’évaluation en deux temps pour guider le traitement
La TEP au 18-FDG est devenue l’examen de référence pour l’évaluation thérapeutique du lymphome de Hodgkin.
Historiquement, elle doit son succès à sa capacité de différencier les masses résiduelles fibrotiques, non hyperfixantes, des maladies résiduelles actives.5 Les évaluations en TDM étaient limitées par l’impossibilité de distinguer les patients en réelle réponse complète du fait de masses résiduelles fréquentes et non spécifiques de la maladie (tissu fibrotique séquellaire) faisant classer jusqu’à 40 % des patients en uCR (unconfirmed complete response, réponse complète non confirmée).
De nos jours, l’évaluation est réalisée en plusieurs temps : précocement au cours de la première ligne de traitement (TEP intermédiaire) et en fin de traitement.
Dans le lymphome de Hodgkin, les critères d’évaluation les plus consensuels sont fondés sur l’analyse visuelle (v. infra). Des approches quantitatives utilisant les standardized uptake values (SUV) ont été proposées dans certains travaux mais sans claire supériorité par rapport aux critères visuels (contrairement à d’autres sous-types de lymphome).
Historiquement, elle doit son succès à sa capacité de différencier les masses résiduelles fibrotiques, non hyperfixantes, des maladies résiduelles actives.5 Les évaluations en TDM étaient limitées par l’impossibilité de distinguer les patients en réelle réponse complète du fait de masses résiduelles fréquentes et non spécifiques de la maladie (tissu fibrotique séquellaire) faisant classer jusqu’à 40 % des patients en uCR (unconfirmed complete response, réponse complète non confirmée).
De nos jours, l’évaluation est réalisée en plusieurs temps : précocement au cours de la première ligne de traitement (TEP intermédiaire) et en fin de traitement.
Dans le lymphome de Hodgkin, les critères d’évaluation les plus consensuels sont fondés sur l’analyse visuelle (v. infra). Des approches quantitatives utilisant les standardized uptake values (SUV) ont été proposées dans certains travaux mais sans claire supériorité par rapport aux critères visuels (contrairement à d’autres sous-types de lymphome).
Deux échelles de gradation
Le critère d’interprétation consensuellement validé est le critère de Deauville, qui est une échelle de gradation visuelle du métabolisme résiduel cotée de 1 à 5.
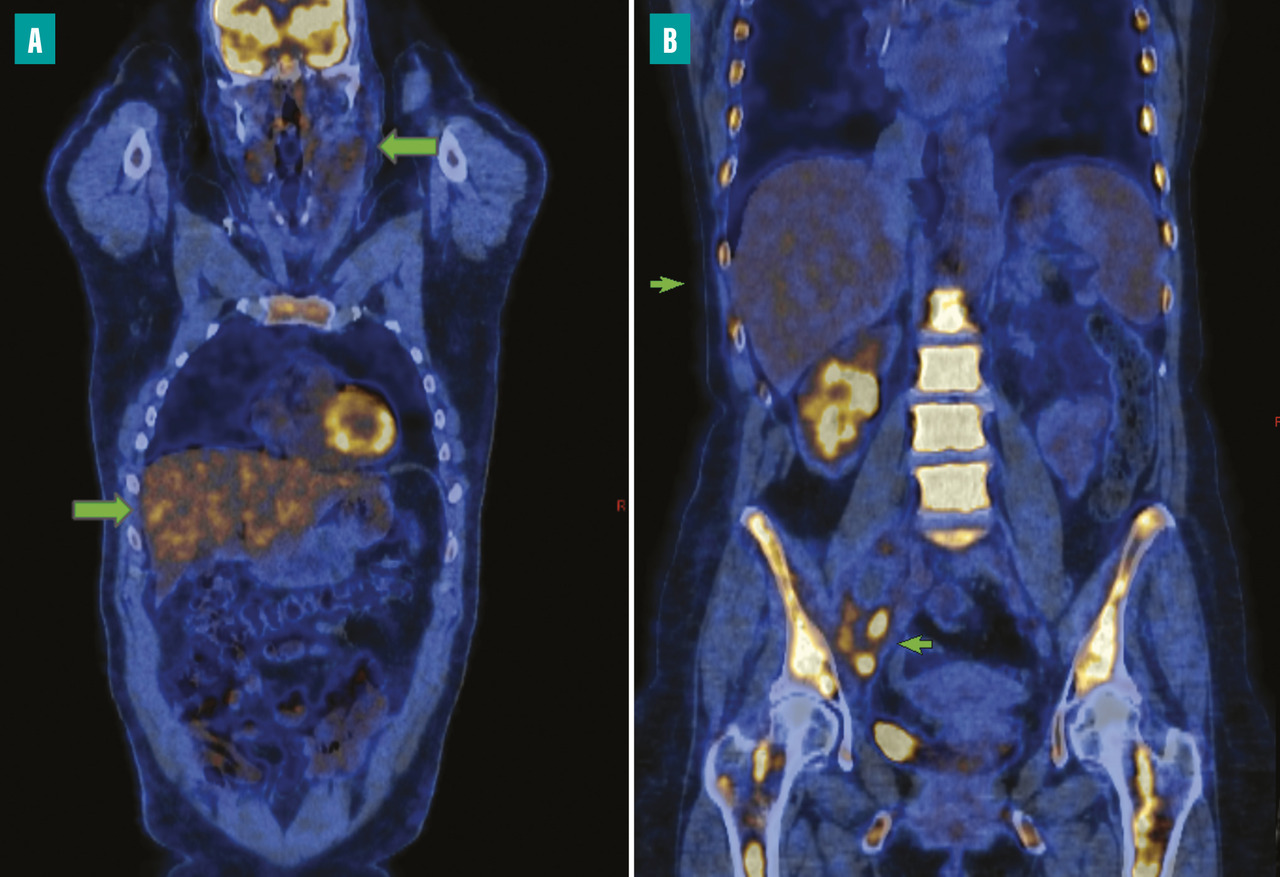
Les scores 1 à 3 correspondent à une réponse métabolique complète (fixation résiduelle non significative) et les scores 4 ou 5 à une maladie persistance (réponse partielle, voire progression) [fig. 1 ]. L’hyperfixation se décrit relativement à la fixation hépatique, qui a habituellement des SUV comprises entre 2 et 4 mais avec une variabilité significative d’un centre à un autre. Pour ces raisons, il n’y a pas de correspondance directe entre les critères de Deauville et les SUV. Ce critère de Deauville a été inclus en 2014 dans la classification de Lugano, qui propose une terminologie clinique habituelle pour l’évaluation de la réponse (réponse métabolique complète, réponse métabolique partielle, absence de réponse métabolique, progression métabolique), mais avec une définition reposant largement sur le critère de Deauville (tableau ). Ces deux classifications de réponses sont donc en réalité les mêmes. Celle de Lugano permet de différencier les nuances de réponse incomplète (en ajoutant les catégories : réponse partielle, stabilité ou progression), mais sans impact à ce jour sur la prise en charge ; l’immense majorité des réponses incomplètes dans le lymphome de Hodgkin en première ligne restant des réponses partielles.
Les comptes-rendus de TEP doivent utiliser une de ces deux échelles pour exprimer explicitement la réponse des patients et établir une claire communication entre médecins nucléaires et hématologues, prérequis indispensable pour pouvoir engager des prises en charge guidées par la TEP (ces évaluations étant de nos jours décisionnelles pour la suite du traitement).
Les scores 1 à 3 correspondent à une réponse métabolique complète (fixation résiduelle non significative) et les scores 4 ou 5 à une maladie persistance (réponse partielle, voire progression) [
Les comptes-rendus de TEP doivent utiliser une de ces deux échelles pour exprimer explicitement la réponse des patients et établir une claire communication entre médecins nucléaires et hématologues, prérequis indispensable pour pouvoir engager des prises en charge guidées par la TEP (ces évaluations étant de nos jours décisionnelles pour la suite du traitement).
Évolution du traitement selon la TEP
Les options thérapeutiques sont désormais multiples (voir l’article « Traitement de première ligne du lymphome de Hodgkin classique », p. 625 ).
Après deux cycles thérapeutiques, la TEP permet notamment d’engager des stratégies d’escalade pour les patients non répondeurs ou de désescalade chez les patients répondeurs. Ces stratégies permettent d’accroître l’efficacité thérapeutique selon l’expérience du protocole H10 dans les formes localisées6 ou de réduire la toxicité selon l’expérience du protocole AHL20117 dans les formes avancées.
À quatre cycles et en fin de traitement, la TEP permet d’identifier les patients en échec thérapeutique pour lesquels un traitement de rattrapage doit être considéré.
En situation de maladie réfractaire, l’évaluation par la TEP a également une force pronostique majeure avant autogreffe, la réponse complète étant associée à un pronostic favorable.8
Après deux cycles thérapeutiques, la TEP permet notamment d’engager des stratégies d’escalade pour les patients non répondeurs ou de désescalade chez les patients répondeurs. Ces stratégies permettent d’accroître l’efficacité thérapeutique selon l’expérience du protocole H10 dans les formes localisées6 ou de réduire la toxicité selon l’expérience du protocole AHL20117 dans les formes avancées.
À quatre cycles et en fin de traitement, la TEP permet d’identifier les patients en échec thérapeutique pour lesquels un traitement de rattrapage doit être considéré.
En situation de maladie réfractaire, l’évaluation par la TEP a également une force pronostique majeure avant autogreffe, la réponse complète étant associée à un pronostic favorable.8
Limites de la TEP
Pour toutes les TEP montrant une hyperfixation pathologique, la question de la spécificité doit être posée, la comparaison à la TEP de référence étant capitale pour s’assurer que l’hyperfixation résiduelle est bien une lésion initiale de la maladie ; il est important d’adresser toujours le patient dans le même centre d’imagerie afin de garantir la disponibilité des images de référence pour un comparatif de qualité.
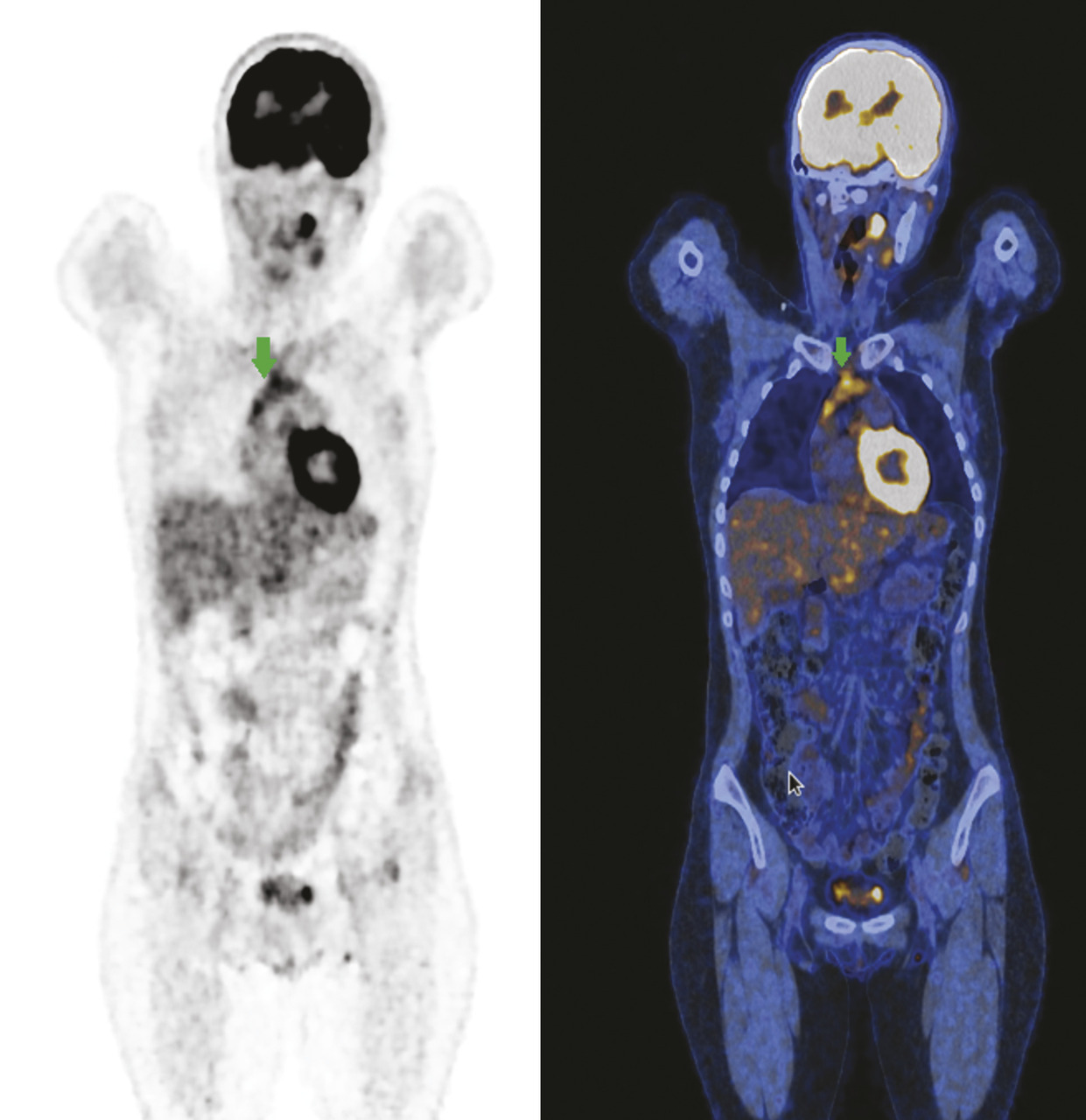
Il faut garder à l’esprit que la fixation à la TEP au 18-FDG est non spécifique du processus tumoral, tout mécanisme inflammatoire étant susceptible de provoquer une hyperfixation à l’imagerie. Il existe de nombreuses situations de faux positifs lors de l’évaluation thérapeutique des lymphomes (rebond thymique, infection concomitante, panniculite mésentérique, maladie inflammatoire telle qu’une sarcoïdose…) [fig. 2 ].
La possibilité d’un faux positif doit être envisagée et évaluée par le médecin nucléaire, notamment du fait de l’impact thérapeutique majeur de ces évaluations (indication d’autogreffe…). En cas de doute, une nouvelle documentation histologique ou une nouvelle TEP de surveillance à distance, à la recherche d’une évolutivité, peuvent être proposées (intérêt de la discussion de ces dossiers en réunion de concertation pluridisciplinaire [RCP] incluant imageurs et cliniciens).
Il faut garder à l’esprit que la fixation à la TEP au 18-FDG est non spécifique du processus tumoral, tout mécanisme inflammatoire étant susceptible de provoquer une hyperfixation à l’imagerie. Il existe de nombreuses situations de faux positifs lors de l’évaluation thérapeutique des lymphomes (rebond thymique, infection concomitante, panniculite mésentérique, maladie inflammatoire telle qu’une sarcoïdose…) [
La possibilité d’un faux positif doit être envisagée et évaluée par le médecin nucléaire, notamment du fait de l’impact thérapeutique majeur de ces évaluations (indication d’autogreffe…). En cas de doute, une nouvelle documentation histologique ou une nouvelle TEP de surveillance à distance, à la recherche d’une évolutivité, peuvent être proposées (intérêt de la discussion de ces dossiers en réunion de concertation pluridisciplinaire [RCP] incluant imageurs et cliniciens).
Nouveaux paramètres d’imagerie prédictifs de survie
Ces dernières années, des travaux ont montré que d’autres informations pronostiques peuvent être extraites des images de TEP, notamment de celles réalisées lors du bilan initial.
Intérêt du volume métabolique tumoral total
La TEP de référence permet le calcul de la masse tumorale appelée volume métabolique tumoral total (TMTV), qui est un facteur pronostique de survie dans les lymphomes de Hodgkin localisés et avancés. Ce facteur est d’autant plus intéressant qu’il est cumulatif avec la réponse métabolique après deux cycles, permettant d’isoler trois groupes pronostiques : très favorable (faible TMTV et réponse complète), très défavorable (TMTV élevé et réponse incomplète) et intermédiaire (avec un des deux facteurs).
L’étude ancillaire du protocole H10 portant sur ces paramètres a ainsi montré la définition de nouveaux groupes pronostiques avec une survie sans progression à cinq ans allant de 95 % pour le groupe pronostique le plus favorable à 25 % pour le groupe le plus défavorable sur cette population de lymphome de Hodgkin localisé.9
Si des règles de standardisation de la mesure sont encore attendues, la détermination du TMTV en tant que facteur décisionnel fait déjà l’objet d’un essai clinique international prospectif décisionnel évaluant la possibilité d’omission de la radiothérapie chez les patients présentant un lymphome de Hodgkin localisé, ayant un faible TMTV initial et une réponse complète à deux cycles (essai RAFTING-NCT04866654).
L’étude ancillaire du protocole H10 portant sur ces paramètres a ainsi montré la définition de nouveaux groupes pronostiques avec une survie sans progression à cinq ans allant de 95 % pour le groupe pronostique le plus favorable à 25 % pour le groupe le plus défavorable sur cette population de lymphome de Hodgkin localisé.9
Si des règles de standardisation de la mesure sont encore attendues, la détermination du TMTV en tant que facteur décisionnel fait déjà l’objet d’un essai clinique international prospectif décisionnel évaluant la possibilité d’omission de la radiothérapie chez les patients présentant un lymphome de Hodgkin localisé, ayant un faible TMTV initial et une réponse complète à deux cycles (essai RAFTING-NCT04866654).
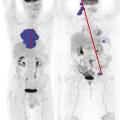
Dmax, un indice pronostique additionnel
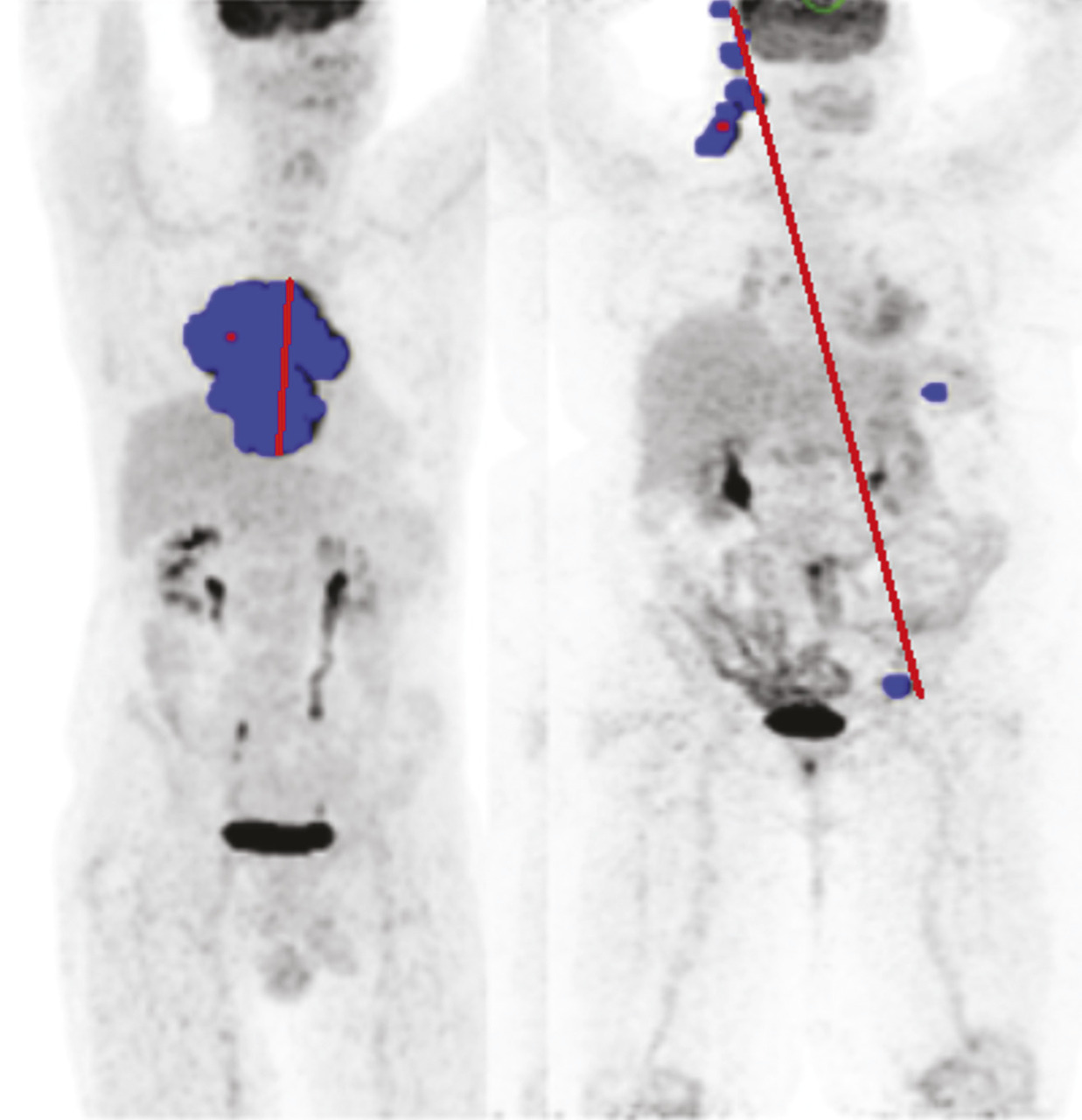
Plus récemment, la mesure de la dispersion des lésions, toujours sur le TEP initial, a été proposée comme facteur pronostique indépendant, en plus du TMTV et de la réponse à deux cycles. Ce nouvel indice appelé Dmax (distance maximale) mesure la distance entre les deux atteintes les plus éloignées. Ce paramètre est, dans l’esprit, une version quantifiée du stade d’Ann Arbor et constitue un indice pronostique additionnel pouvant être extrait des TEP de baseline (fig. 3 ).10
Plus généralement, ces nouveaux paramètres, appelés radiomics, sont des descripteurs quantifiés de la maladie et vont probablement constituer les futurs apports de la TEP pour identifier plus finement les groupes pronostiques de patients et construire des protocoles de traitement de plus en plus personnalisés.
Plus généralement, ces nouveaux paramètres, appelés radiomics, sont des descripteurs quantifiés de la maladie et vont probablement constituer les futurs apports de la TEP pour identifier plus finement les groupes pronostiques de patients et construire des protocoles de traitement de plus en plus personnalisés.
Références
1. Raanani P, Shasha Y, Perry C, Metser U, Naparstek E, Apter S, et al. Is CT scan still necessary for staging in Hodgkin and non-Hodgkin lymphoma patients in the PET/CT era? Ann Oncol Off J Eur Soc Med Oncol 2006;17(1):117-22.
2. Rigacci L, Vitolo U, Nassi L, Merli F, Gallamini A, Pregno P, et al. Positron emission tomography in the staging of patients with Hodgkin’s lymphoma. A prospective multicentric study by the Intergruppo Italiano Linfomi. Ann Hematol 2007;86(12):897-903.
3. Voltin CA, Goergen H, Baues C, Fuchs M, Mettler J, Kreissl S, et al. Value of bone marrow biopsy in Hodgkin lymphoma patients staged by FDG PET: Results from the German Hodgkin Study Group trials HD16, HD17, and HD18. Ann Oncol Off J Eur Soc Med Oncol 2018;29(9):1926-31.
4. Girinsky T, Aupérin A, Ribrag V, Elleuch M, Fermé C, Bonniaud G, et al. Role of FDG-PET in the implementation of involved-node radiation therapy for Hodgkin lymphoma patients. Int J Radiat Oncol Biol Phys 2014;89(5):1047-52.
5. Jerusalem G, Beguin Y, Fassotte MF, Najjar F, Paulus P, Rigo P, et al. Whole-body positron emission tomography using 18F-fluorodeoxyglucose for posttreatment evaluation in Hodgkin’s disease and non-Hodgkin’s lymphoma has higher diagnostic and prognostic value than classical computed tomography scan imaging. Blood 1999;94(2):429-33.
6. André MPE, Girinsky T, Federico M, Reman O, Fortpied C, Gotti M, et al. Early positron emission tomography response-adapted treatment in stage I and II Hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol Off J Am Soc Clin Oncol 2017;35(16):1786-94.
7. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): A randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20(2):202-15.
8. Marouf A, Cottereau AS, Kanoun S, Deschamps P, Meignan M, Franchi P, et al. Outcomes of refractory or relapsed Hodgkin lymphoma patients with post-autologous stem cell transplantation brentuximab vedotin maintenance: A French multicenter observational cohort study. Haematologica 2022;107(7):1681-6.
9. Cottereau AS, Versari A, Loft A, Casasnovas O, Bellei M, Ricci R, et al. Prognostic value of baseline metabolic tumor volume in early-stage Hodgkin lymphoma in the standard arm of the H10 trial. Blood 2018;131(13):1456-63.
10. Kanoun S, Berriolo-Riedinger A, Cottereau AS, Edeline V, Tal I, Brice P, et al. Total metabolic tumor volume and tumor dissemination are independent prognostic factors in advanced Hodgkin lymphoma. Blood 2021;138(Supplement 1):880.
2. Rigacci L, Vitolo U, Nassi L, Merli F, Gallamini A, Pregno P, et al. Positron emission tomography in the staging of patients with Hodgkin’s lymphoma. A prospective multicentric study by the Intergruppo Italiano Linfomi. Ann Hematol 2007;86(12):897-903.
3. Voltin CA, Goergen H, Baues C, Fuchs M, Mettler J, Kreissl S, et al. Value of bone marrow biopsy in Hodgkin lymphoma patients staged by FDG PET: Results from the German Hodgkin Study Group trials HD16, HD17, and HD18. Ann Oncol Off J Eur Soc Med Oncol 2018;29(9):1926-31.
4. Girinsky T, Aupérin A, Ribrag V, Elleuch M, Fermé C, Bonniaud G, et al. Role of FDG-PET in the implementation of involved-node radiation therapy for Hodgkin lymphoma patients. Int J Radiat Oncol Biol Phys 2014;89(5):1047-52.
5. Jerusalem G, Beguin Y, Fassotte MF, Najjar F, Paulus P, Rigo P, et al. Whole-body positron emission tomography using 18F-fluorodeoxyglucose for posttreatment evaluation in Hodgkin’s disease and non-Hodgkin’s lymphoma has higher diagnostic and prognostic value than classical computed tomography scan imaging. Blood 1999;94(2):429-33.
6. André MPE, Girinsky T, Federico M, Reman O, Fortpied C, Gotti M, et al. Early positron emission tomography response-adapted treatment in stage I and II Hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol Off J Am Soc Clin Oncol 2017;35(16):1786-94.
7. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): A randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20(2):202-15.
8. Marouf A, Cottereau AS, Kanoun S, Deschamps P, Meignan M, Franchi P, et al. Outcomes of refractory or relapsed Hodgkin lymphoma patients with post-autologous stem cell transplantation brentuximab vedotin maintenance: A French multicenter observational cohort study. Haematologica 2022;107(7):1681-6.
9. Cottereau AS, Versari A, Loft A, Casasnovas O, Bellei M, Ricci R, et al. Prognostic value of baseline metabolic tumor volume in early-stage Hodgkin lymphoma in the standard arm of the H10 trial. Blood 2018;131(13):1456-63.
10. Kanoun S, Berriolo-Riedinger A, Cottereau AS, Edeline V, Tal I, Brice P, et al. Total metabolic tumor volume and tumor dissemination are independent prognostic factors in advanced Hodgkin lymphoma. Blood 2021;138(Supplement 1):880.