La radiothérapie est actuellement prescrite chez plus de 60 % des patients atteints de cancer, avec une efficacité incontestable. Elle contribue, depuis de nombreuses années, à l’amélioration des taux de survie des patients atteints de cancers du sein, du poumon, des cancers pédiatriques et de la maladie de Hodgkin. Jusque dans les années 1990, les volumes d’irradiation nécessaires à l’éradication des masses tumorales englobaient des volumes significatifs de cœur, et des complications cardiaques pouvaient survenir de manière très tardive, soit 5 à 25 ans après le traitement initial. Depuis l’émergence de la radiothérapie conformationnelle dans les années 2000, et plus récemment de la radiothérapie stéréotaxique (stereotactic body radiation therapy [SBRT]), la dose thérapeutique est délivrée plus précisément, la dose reçue par les organes à risque est moins importante, ce qui permet d’étendre les applications de la radiothérapie (v. encadré). Néanmoins, ces technologies de radiothérapie guidées par l’image permettent de minimiser les effets secondaires sans les éliminer totalement, c’est pourquoi d’autres stratégies de radiothérapie ont été explorées, comme la radiothérapie FLASH (à ultra haut débit de dose) qui minimise les effets toxiques sur les tissus sains et devraient permettre de préserver encore plus efficacement les tissus sains entourant les tumeurs.
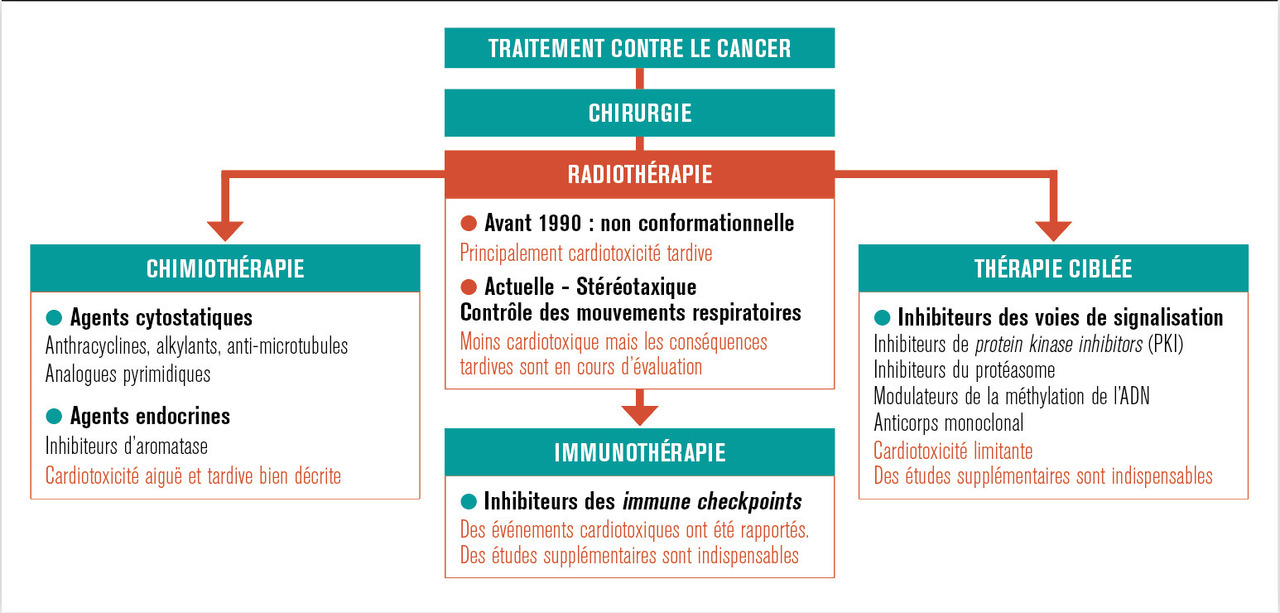
Simultanément, les protocoles standard de traitement du cancer ont évolué, et la radiothérapie est aujourd’hui combinée à diverses molécules (v. figure) de chimiothérapie et/ou de thérapies ciblées et/ou d’immunothérapie (petites molécules pharmacologiques et/ou biomolécules). Ces combinaisons thérapeutiques majorent l’efficacité antitumorale mais augmentent aussi les risques de complications cardiaques ; et si les complications cardiaques induites par la radio- et la chimiothérapie sont maintenant bien connues et caractérisées, les connaissances des complications cardiaques associées aux thérapies combinées restent très partielles. Ainsi, de nos jours, l’étude des phénomènes de toxicité cardiaque chez les patients cancéreux et les patients guéris du cancer demeure un problème clinique majeur qui nécessite la constitution d’équipes multidisciplinaires spécialistes de cardio-oncologie.1-3
Simultanément, les protocoles standard de traitement du cancer ont évolué, et la radiothérapie est aujourd’hui combinée à diverses molécules (v. figure) de chimiothérapie et/ou de thérapies ciblées et/ou d’immunothérapie (petites molécules pharmacologiques et/ou biomolécules). Ces combinaisons thérapeutiques majorent l’efficacité antitumorale mais augmentent aussi les risques de complications cardiaques ; et si les complications cardiaques induites par la radio- et la chimiothérapie sont maintenant bien connues et caractérisées, les connaissances des complications cardiaques associées aux thérapies combinées restent très partielles. Ainsi, de nos jours, l’étude des phénomènes de toxicité cardiaque chez les patients cancéreux et les patients guéris du cancer demeure un problème clinique majeur qui nécessite la constitution d’équipes multidisciplinaires spécialistes de cardio-oncologie.1-3
Des séquelles tardives et chroniques
Au niveau clinique, la principale caractéristique des séquelles cardiovasculaires radio-induites est qu’elles sont tardives et chroniques, avec une phase de latence asymptomatique qui peut durer plusieurs années (5-25 ans). Au moment du traitement de radiothérapie, les lésions radio-induites aiguës sont essentiellement microvasculaires et inflammatoires de type péricardite et/ou myocardite. Ces lésions microcapillaires sont engendrées par la mort des cellules endothéliales et provoquent une perméabilité vasculaire avec une activation locale de cytokines pro-inflammatoires et de molécules prothrombogènes. Elles sont, en règle générale, spontanément résolutives, mais en réalité elles induisent l’activation d’une cascade d’événements moléculaires et cellulaires qui se perpétuent au cours du temps et qui peuvent causer la dégénérescence du myocarde par ischémie et conduire au développement de lésions de fibrose multifocales. Ces lésions de fibrose peuvent affecter toutes les structures cardiaques et sont à l’origine d’une dysfonction diastolique à long terme. Ainsi, les lésions vasculaires (microvasculaires, coronariennes, aortiques), péricardiques, myocardiqueset valvulaires se combinent en une réponse fibrotique complexe aboutissant au développement de l’insuffisance cardiaque.
Leur formation dépend :
– de la dose totale de rayonnement délivrée au cœur ; par exemple chez les patientes irradiées pour un cancer du sein une augmentation linéaire du risque de cardiopathie ischémique de 7,5 % est décrite par gray délivré ;
– de la dose par fraction ; cette notion est particulièrement importante pour les traitements antérieurs à 1990, délivrés avec des technologies non conformation-
nelles ;
– du volume cardiaque irradié ; en effet, des altérations de la perfusion sont observées dès que le volume de ventricule gauche irradié est supérieur à 5 % ; de plus, les différentes structures cardiaquesmontrent une radiosensibilité différente.
À ces facteurs intrinsèques liés à la radiothérapie s’ajoutent, chez de nombreux patients, des facteurs de comorbidité tels que les pathologies cardiovasculaires préexistantes, l’hypertension artérielle, les maladies inflammatoires, le diabète...
Leur formation dépend :
– de la dose totale de rayonnement délivrée au cœur ; par exemple chez les patientes irradiées pour un cancer du sein une augmentation linéaire du risque de cardiopathie ischémique de 7,5 % est décrite par gray délivré ;
– de la dose par fraction ; cette notion est particulièrement importante pour les traitements antérieurs à 1990, délivrés avec des technologies non conformation-
nelles ;
– du volume cardiaque irradié ; en effet, des altérations de la perfusion sont observées dès que le volume de ventricule gauche irradié est supérieur à 5 % ; de plus, les différentes structures cardiaquesmontrent une radiosensibilité différente.
À ces facteurs intrinsèques liés à la radiothérapie s’ajoutent, chez de nombreux patients, des facteurs de comorbidité tels que les pathologies cardiovasculaires préexistantes, l’hypertension artérielle, les maladies inflammatoires, le diabète...
Comment limiter ces complications ?
La première stratégie pour limiter les complications cardiaques de la radiothérapie consiste à diminuer le volume cardiaque irradié et la dose reçue par le cœur en utilisant les nouvelles approches de radiothérapie stéréotaxique associées avec un contrôle des mouvements respiratoires. Pour les patients traités antérieurement et souffrant de séquelles cardiaques radio-induites infracliniques ou constituées, aucun biomarqueur d’atteinte précoce et de sévérité n’est actuellement disponible, et les stratégies thérapeutiques se limitentaux interventions standard. Le diagnostic des troubles de la conduction nécessite un suivi électrocardiographique systématique. Les traitements des myocardiopathies et des valvulopathies radio-induites s’attachent à corriger les signes d’insuffisance cardiaque ; alors que les coronaropathies radio-induites sont prises en charge, comme l’athérosclérose. Des études précliniques suggèrent pourtant une efficacité cardioprotectrice pour certains médicaments utilisés en clinique dans le cadre du traitement de la fibrose radio-induite.4 Leur efficacité en cardio-oncologie reste à confirmer dans le cadre d’essais cliniques, mais ces molécules constituent de nouvelles pistes de traitement des complications cardiaques de la radiothérapie. Ce sont des molécules antiradicalaires comme l’amifostine, la combinaison pentoxifylline-α-tocophérolou -γ-tocotriénol qui possèdent des propriétés antifibrosantes et sont capables de prévenir les dommages vasculaires et cardiomyocytaires. Les inhibiteurs pharmacologiques de l’hydroxyméthylglutaryl-CoA réductase tels que les statines sont aussi capables de moduler l’inflammation chronique et les processus fibrogéniques radio-induits. Enfin, l’efficacité du captopril, un inhibiteur de l’enzyme de conversion, a été montrée sur les dommages cardiopulmonaires radio-induits.
En conclusion, la radiothérapie tient aujourd’hui une place essentielle dans le traitement du cancer, et les nouvelles stratégies anticancéreuses permettent d’envisager à court terme une efficacité antitumorale accrue. Cette efficacité ne sera un succès que si elle est associée à une préservation de la qualité de vie à long terme des patients. Dans ce cadre, une évaluation rationnelle et rigoureuse des séquelles cardiaques induites par les traitements combinés devrait permettre une prise en charge optimale des patients. Nous disposons aujourd’hui de modèles expérimentaux et mécanistiques ainsi que d’outils technologiques et pharmacologiques permettant de relever ce défi dans le cadre d’une approche multisdisciplinaire et coordonnée.
En conclusion, la radiothérapie tient aujourd’hui une place essentielle dans le traitement du cancer, et les nouvelles stratégies anticancéreuses permettent d’envisager à court terme une efficacité antitumorale accrue. Cette efficacité ne sera un succès que si elle est associée à une préservation de la qualité de vie à long terme des patients. Dans ce cadre, une évaluation rationnelle et rigoureuse des séquelles cardiaques induites par les traitements combinés devrait permettre une prise en charge optimale des patients. Nous disposons aujourd’hui de modèles expérimentaux et mécanistiques ainsi que d’outils technologiques et pharmacologiques permettant de relever ce défi dans le cadre d’une approche multisdisciplinaire et coordonnée.
Encadre
Apports de la radiothérapie stéréotaxique en cardiologie
Les progrès des technologies de radiothérapie guidée par l’image permettent d’élargir ces applications en cardiologie. Ainsi, récemment, la combinaison de l’électrocardiographie avec la radiothérapie stéréotaxique (SBRT) a permis la radio-ablation de tachycardies ventriculaires réfractaires par une méthode non invasive.5

 Encadrés
Encadrés