Malgré une amélioration de la prise en charge ces dernières années, la fibrillation atriale (FA) est associée à une morbi-mortalité cardiovasculaire significative, notamment un risque de survenue d’une insuffisance cardiaque (v . p. 915 ) et d’accident vasculaire cérébral (AVC). La gestion du traitement anticoagulant est donc primordiale pour limiter ce dernier.
Balance risque thromboembolique-risque hémorragique
Pendant longtemps, la FA a été envisagée comme étant soit à l’origine de palpitations, et donc comme étant un désagrément fonctionnel, soit comme une complication aggravant une insuffisance cardiaque. C’est essentiellement à partir des années 1980 que plusieurs études ont montré que la FA était associée à une augmentation du risque d’événements thromboemboliques, notamment cérébraux. Ainsi, dans deux travaux issus de l’étude prospective de Framingham, il a été montré que :
– une FA était constatée dans 35 % des cas d’AVC des sujets de plus de 80 ans ;1
– le risque d’AVC était multiplié par 5 en présence d’une FA ;
– et enfin que les AVC ischémiques associés à une FA sont plus sévères que ceux sans FA associée.2
Toutefois, la relation de cause à effet entre FA et AVC était encore contestée et considérée par certains uniquement comme un marqueur de l’âge ou d’anomalies cardiovasculaires associées.3, 4 C’est en démontrant que les anticoagulants pouvaient diminuer le risque embolique, et notamment le risque d’AVC ischémique, qu’il a été établi que la FA est bien, par elle-même, la cause de l’augmentation du risque d’AVC. Cette preuve du bénéfice des anticoagulants n’a été fournie que dans les années 1985-1995 par une série d’essais thérapeutiques contrôlés (6 avec près de 3 000 patients inclus au total) dont l’objectif était d’évaluer si les anticoagulants alors disponibles, les antagonistes de la vitamine K (AVK), pouvaient diminuer le risque embolique et si ce bénéfice clinique contrebalançait le risque hémorragique qu’ils induisaient. C’est par exemple le cas de l’étude SPAF publiée en 1990.5 La grande majorité de ces études a évalué la warfarine (Coumadine). Leurs résultats ont fait l’objet de plusieurs méta-analyses dont la principale a été publiée en 2007,6 démontrant que les AVK permettaient une réduction relative du risque d’AVC de 64 %. La mortalité totale était significativement réduite sous AVK de 26 %, donnée rendant compte du bénéfice clinique net du traitement.
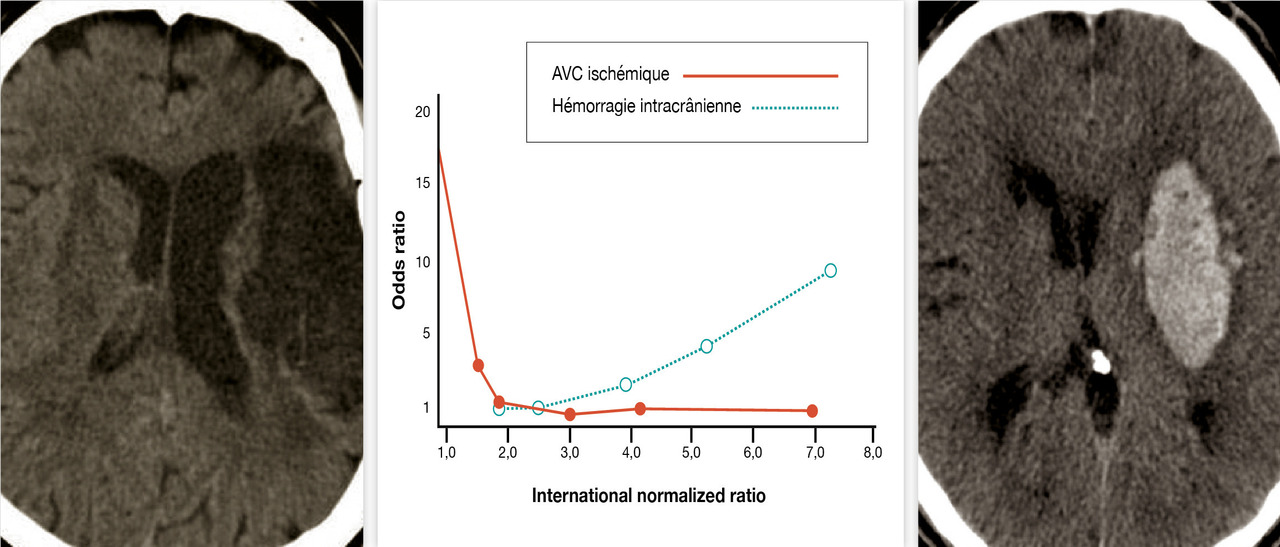
Afin de juger s’il était possible d’obtenir un résultat comparable en termes d’efficacité sur la prévention du risque embolique mais avec un risque hémorragique moindre, quelques études7 ont évalué les effets des AVK à faibles doses (cible d’international normalized ratio [INR] entre 1,2 et 1,5), éventuellement associées à de l’aspirine, soit contre un groupe contrôle sans traitement antithrombotique, soit contre un AVK à des doses permettant d’obtenir un INR au moins égal à 2. À partir de 19 études (80 713 patients), une méta-analyse publiée en 2008 a permis de préciser plus encore la zone d’INR garantissant le meilleur rapport bénéfice-risque des AVK.8 L’incidence, en valeur absolue, des événements hémorragiques et thromboemboliques a été calculée en fonction de différentes zones d’INR. Puis elle a été calculée en valeur relative en prenant comme référence la zone d’INR de 2 à 3 (fig. 1 ).
La zone thérapeutique permettant un rapport bénéfice-risque optimal des AVK dans la prise en charge de la FA dite non valvulaire (FA non associée à une prothèse mécanique et/ou sténose mitrale) [FANV] est relativement étroite et correspond à l’utilisation d’une posologie permettant d’obtenir un INR entre 2 et 3 (fig. 2 ). Le rapport bénéfice-risque des AVK est dépendant du temps passé dans cette zone d’INR.
– une FA était constatée dans 35 % des cas d’AVC des sujets de plus de 80 ans ;1
– le risque d’AVC était multiplié par 5 en présence d’une FA ;
– et enfin que les AVC ischémiques associés à une FA sont plus sévères que ceux sans FA associée.2
Toutefois, la relation de cause à effet entre FA et AVC était encore contestée et considérée par certains uniquement comme un marqueur de l’âge ou d’anomalies cardiovasculaires associées.3, 4 C’est en démontrant que les anticoagulants pouvaient diminuer le risque embolique, et notamment le risque d’AVC ischémique, qu’il a été établi que la FA est bien, par elle-même, la cause de l’augmentation du risque d’AVC. Cette preuve du bénéfice des anticoagulants n’a été fournie que dans les années 1985-1995 par une série d’essais thérapeutiques contrôlés (6 avec près de 3 000 patients inclus au total) dont l’objectif était d’évaluer si les anticoagulants alors disponibles, les antagonistes de la vitamine K (AVK), pouvaient diminuer le risque embolique et si ce bénéfice clinique contrebalançait le risque hémorragique qu’ils induisaient. C’est par exemple le cas de l’étude SPAF publiée en 1990.5 La grande majorité de ces études a évalué la warfarine (Coumadine). Leurs résultats ont fait l’objet de plusieurs méta-analyses dont la principale a été publiée en 2007,6 démontrant que les AVK permettaient une réduction relative du risque d’AVC de 64 %. La mortalité totale était significativement réduite sous AVK de 26 %, donnée rendant compte du bénéfice clinique net du traitement.
Afin de juger s’il était possible d’obtenir un résultat comparable en termes d’efficacité sur la prévention du risque embolique mais avec un risque hémorragique moindre, quelques études7 ont évalué les effets des AVK à faibles doses (cible d’international normalized ratio [INR] entre 1,2 et 1,5), éventuellement associées à de l’aspirine, soit contre un groupe contrôle sans traitement antithrombotique, soit contre un AVK à des doses permettant d’obtenir un INR au moins égal à 2. À partir de 19 études (80 713 patients), une méta-analyse publiée en 2008 a permis de préciser plus encore la zone d’INR garantissant le meilleur rapport bénéfice-risque des AVK.8 L’incidence, en valeur absolue, des événements hémorragiques et thromboemboliques a été calculée en fonction de différentes zones d’INR. Puis elle a été calculée en valeur relative en prenant comme référence la zone d’INR de 2 à 3 (
La zone thérapeutique permettant un rapport bénéfice-risque optimal des AVK dans la prise en charge de la FA dite non valvulaire (FA non associée à une prothèse mécanique et/ou sténose mitrale) [FANV] est relativement étroite et correspond à l’utilisation d’une posologie permettant d’obtenir un INR entre 2 et 3 (
Mieux évaluer les risques
De nombreux marqueurs de risque embolique et hémorragique ont été identifiés et diversement associés dans des scores d’évaluation depuis 1994, et leurs valeurs prédictives ont été comparées.9, 10 Il est apparu qu’en termes de prédictibilité du risque embolique le score CHA2DS2-VASc (tableau 1) était le plus discriminant et que les scores HAS-BLED (patients à haut risque hémorragique si score > 3) [tableau 2]11 et HEMORR2HAGES étaient équivalents pour la prédiction du risque hémorragique sous anticoagulant oral. Le score CHADS2, pour prédire le risque embolique, n’est plus utilisé par manque de discrimination évident… Pour l’illustrer de façon un peu simple, pouvions-nous penser qu’un tennisman de 42 ans avait le même risque thromboembolique qu’un coronarien de 73 ans (CHADS2 = 0) ?
En disposant des marqueurs et de scores de risque, il a été possible de définir, dans des registres et/ou des essais thérapeutiques contrôlés, des sous-groupes afin d’évaluer le rapport bénéfice-risque des anticoagulants. Ainsi, par exemple,7 il a pu être calculé que chez les patients à faible risque embolique (CHADS2 = 0), et par rapport à l’absence de traitement antithrombotique, traiter 1 000 patients par un AVK permettait d’éviter 5 AVC non fatals mais induisait 8 hémorragies majeures non fatales extracrâniennes. Ces patients ne justifient donc pas de traitement anticoagulant (v. infra ).
En disposant des marqueurs et de scores de risque, il a été possible de définir, dans des registres et/ou des essais thérapeutiques contrôlés, des sous-groupes afin d’évaluer le rapport bénéfice-risque des anticoagulants. Ainsi, par exemple,7 il a pu être calculé que chez les patients à faible risque embolique (CHADS2 = 0), et par rapport à l’absence de traitement antithrombotique, traiter 1 000 patients par un AVK permettait d’éviter 5 AVC non fatals mais induisait 8 hémorragies majeures non fatales extracrâniennes. Ces patients ne justifient donc pas de traitement anticoagulant (
Indication à l’anticoagulation
Trois points importants à considérer d’emblée :
– aucune place à l’antiagrégation plaquettaire (aspirine) chez ces patients ayant une FA, pour laquelle il est apparu que, tout en faisant courir un risque hémorragique équivalent à celui des AVK, elle ne semblait pas apporter de bénéfice clinique ;10, 13
– le caractère clinique de la FA (paroxystique ou permanente) ne doit pas conditionner l’indication de la prévention du risque thromboembolique ;10
– le risque thromboembolique et le risque hémorragique doivent être réévalués périodiquement pour guider les décisions de traitement et permettre une réévaluation des risques hémorragiques modifiables.10
Les recommandations européennes de 202010 suggèrent un traitement anticoagulant oral chez tous les patients ayant une FA, à l’exception de ceux à très faible risque, c’est-à-dire ceux ayant un score de risque embolique CHA2DS2-VASc égal à 0 ou 1, c’est-à-dire les patients de moins de 65 ans sans cardiopathie. Dans tous les cas, la décision de prescrire ou non un anticoagulant oral doit être fondée sur une évaluation du rapport bénéfice-risque.
– aucune place à l’antiagrégation plaquettaire (aspirine) chez ces patients ayant une FA, pour laquelle il est apparu que, tout en faisant courir un risque hémorragique équivalent à celui des AVK, elle ne semblait pas apporter de bénéfice clinique ;10, 13
– le caractère clinique de la FA (paroxystique ou permanente) ne doit pas conditionner l’indication de la prévention du risque thromboembolique ;10
– le risque thromboembolique et le risque hémorragique doivent être réévalués périodiquement pour guider les décisions de traitement et permettre une réévaluation des risques hémorragiques modifiables.10
Les recommandations européennes de 202010 suggèrent un traitement anticoagulant oral chez tous les patients ayant une FA, à l’exception de ceux à très faible risque, c’est-à-dire ceux ayant un score de risque embolique CHA2DS2-VASc égal à 0 ou 1, c’est-à-dire les patients de moins de 65 ans sans cardiopathie. Dans tous les cas, la décision de prescrire ou non un anticoagulant oral doit être fondée sur une évaluation du rapport bénéfice-risque.
Nouveaux anticoagulants oraux
Plusieurs anticoagulants oraux ont été développés lors de ces 20 dernières années. Le développement de la première molécule évaluée a été interrompu en 2006, du fait d’effets indésirables graves hépatiques après qu’une étude (SPORTIF V) a toutefois montré qu’elle n’était pas inférieure à la warfarine pour réduire les événements emboliques. Depuis l’arrêt du développement de cette molécule, trois molécules disponibles en France, dénommées nouveaux anticoagulants oraux (NACO) ou anticoagulants oraux directs (AOD) [fig. 2], ont été évaluées dans des essais thérapeutiques les comparant aux AVK. Toutes les études prises individuellement ont été positives sur leur critère primaire, montrant ainsi que les AOD ne sont pas inférieurs à la warfarine, quel que soit le schéma posologique évalué. Certaines études ont aussi pu montrer une supériorité.
Plusieurs méta-analyses ont été publiées à partir des résultats de ces études, et au moins une a pris en compte les résultats des quatre essais ayant comparé des AOD à des AVK.14 Cette méta-analyse a permis de quantifier l’effet respectif des AOD considérés dans leur ensemble par rapport aux AVK. Les quatre essais disponibles ont inclus 71 683 patients dont 42 411 sous AOD et 29 272 sous warfarine. D’après cette méta-analyse, et par rapport aux AVK :
– en termes d’efficacité, les AOD réduisent significativement le risque d’AVC et d’événements emboliques de 19 %, essentiellement par une réduction des AVC hémorragiques de 50% ;
– en termes de sécurité, l’effet sur les événements hémorragiques est variable selon l’événement considéré et selon la qualité du traitement par warfarine, donc selon le TTR (time in therapeutic range).
Ainsi, les AOD :
– réduisent significativement le risque d’hémorragie intracrânienne de 52 % ;
– augmentent significativement le risque d’hémorragie digestive de 25 % ;
– réduisent significativement le risque d’hémorragies majeures de 31 % lorsque la qualité de l’anticoagulation n’est pas optimale sous AVK (TTR < 66 %) et ne modifient pas significativement le risque d’hémorragies majeures lorsque le TTR est au moins de 66 %.
Considérés dans leur ensemble, les AOD réduisent significativement la mortalité totale de 10 % par rapport aux AVK.
Les AOD sont des molécules dont l’effet pharmacodynamique est prévisible. Ils peuvent ainsi être prescrits à posologie fixe, avec un effet anticoagulant prévisible et stable selon la dose, sans nécessité d’utiliser des tests de coagulation pour vérifier leur effet. L’absence de nécessité de contrôle biologique sous AOD est une simplification majeure, source de prescription large, qui améliore l’adhésion des patients au traitement.
Il est cependant très important d’évaluer l’observance des patients, rendue plus difficile étant donné l’absence de test au cours du suivi. Toutefois, leurs caractéristiques, différentes selon les molécules, rendent compte du fait que leurs concentrations plasmatiques peuvent être modifiées par certaines circonstances physiologiques, comme par exemple l’altération de la fonction rénale ou par certaines interactions médicamenteuses via des cytochromes ou la glycoprotéine P. Absence de test d’anticoagulation n’est pas synonyme d’« absence de biologie de contrôle » au cours du suivi. La fonction rénale, hépatique et l’hémogramme doivent être contrôlés tous les ans. Actuellement, la dose optimale proposée pour un AOD est celle qui a été évaluée dans les essais thérapeutiques spécifiques. L’analyse des données des essais thérapeutiques de grande ampleur et des registres permettront potentiellement de mieux évaluer la zone thérapeutique optimale des différents AOD.
Ces dernières années, avec la mise sur le marché des antidotes du dabigatran (idarucizumab) et des anti-Xa (andexanet alfa et aripazine), le risque de saignement sous AOD peut sembler moins préoccupant. Néanmoins, il est utile de rappeler que l’efficacité de ces antidotes n’a été prouvée que sur la concentration sérique de ces derniers (et non sur la mortalité liée aux événements hémorragiques). Par ailleurs, ces antidotes ne sont encore pas disponibles dans tous les centres hospitaliers. En l’absence d’antidote spécifique, les concentrés de complexes prothombiniques, plus faciles d’accès, peuvent être utilisés, avec une efficacité sur l’effet anticoagulant du rivaroxaban principalement. Mais n’oublions pas que le bénéfice de ces molécules par rapport au traitement de référence (AVK) a été testé sans antidote disponible !
Depuis 2016, les recommandations européennes préconisent l’usage des AOD en première intention.10 En France, depuis février 2018,15 l’Agence de sécurité du médicament (ANSM) et la Haute Autorité de santé (HAS) préconisent les AOD comme alternative possible aux AVK. Attention, à cause d’un risque immuno-allergique, l’ANSM contre-indique depuis 2018 l’initiation de fluindione (Previscan), qui ne peut désormais être prescrit qu’en renouvellement d’ordonnance.
Les nouvelles recommandations10 n’emploient plus le terme de « FA valvulaire » qui entraînait une certaine confusion en cas de pathologie valvulaire associé (mais pas stricto sensu FA valvulaire)… La FA valvulaire se définissait comme une FA survenant en présence d’une valve mécanique ou d’un rétrécissement mitral modéré à sévère. En cas de FA valvulaire, seuls les AVK doivent être prescrits.
Plusieurs méta-analyses ont été publiées à partir des résultats de ces études, et au moins une a pris en compte les résultats des quatre essais ayant comparé des AOD à des AVK.14 Cette méta-analyse a permis de quantifier l’effet respectif des AOD considérés dans leur ensemble par rapport aux AVK. Les quatre essais disponibles ont inclus 71 683 patients dont 42 411 sous AOD et 29 272 sous warfarine. D’après cette méta-analyse, et par rapport aux AVK :
– en termes d’efficacité, les AOD réduisent significativement le risque d’AVC et d’événements emboliques de 19 %, essentiellement par une réduction des AVC hémorragiques de 50% ;
– en termes de sécurité, l’effet sur les événements hémorragiques est variable selon l’événement considéré et selon la qualité du traitement par warfarine, donc selon le TTR (time in therapeutic range).
Ainsi, les AOD :
– réduisent significativement le risque d’hémorragie intracrânienne de 52 % ;
– augmentent significativement le risque d’hémorragie digestive de 25 % ;
– réduisent significativement le risque d’hémorragies majeures de 31 % lorsque la qualité de l’anticoagulation n’est pas optimale sous AVK (TTR < 66 %) et ne modifient pas significativement le risque d’hémorragies majeures lorsque le TTR est au moins de 66 %.
Considérés dans leur ensemble, les AOD réduisent significativement la mortalité totale de 10 % par rapport aux AVK.
Les AOD sont des molécules dont l’effet pharmacodynamique est prévisible. Ils peuvent ainsi être prescrits à posologie fixe, avec un effet anticoagulant prévisible et stable selon la dose, sans nécessité d’utiliser des tests de coagulation pour vérifier leur effet. L’absence de nécessité de contrôle biologique sous AOD est une simplification majeure, source de prescription large, qui améliore l’adhésion des patients au traitement.
Il est cependant très important d’évaluer l’observance des patients, rendue plus difficile étant donné l’absence de test au cours du suivi. Toutefois, leurs caractéristiques, différentes selon les molécules, rendent compte du fait que leurs concentrations plasmatiques peuvent être modifiées par certaines circonstances physiologiques, comme par exemple l’altération de la fonction rénale ou par certaines interactions médicamenteuses via des cytochromes ou la glycoprotéine P. Absence de test d’anticoagulation n’est pas synonyme d’« absence de biologie de contrôle » au cours du suivi. La fonction rénale, hépatique et l’hémogramme doivent être contrôlés tous les ans. Actuellement, la dose optimale proposée pour un AOD est celle qui a été évaluée dans les essais thérapeutiques spécifiques. L’analyse des données des essais thérapeutiques de grande ampleur et des registres permettront potentiellement de mieux évaluer la zone thérapeutique optimale des différents AOD.
Ces dernières années, avec la mise sur le marché des antidotes du dabigatran (idarucizumab) et des anti-Xa (andexanet alfa et aripazine), le risque de saignement sous AOD peut sembler moins préoccupant. Néanmoins, il est utile de rappeler que l’efficacité de ces antidotes n’a été prouvée que sur la concentration sérique de ces derniers (et non sur la mortalité liée aux événements hémorragiques). Par ailleurs, ces antidotes ne sont encore pas disponibles dans tous les centres hospitaliers. En l’absence d’antidote spécifique, les concentrés de complexes prothombiniques, plus faciles d’accès, peuvent être utilisés, avec une efficacité sur l’effet anticoagulant du rivaroxaban principalement. Mais n’oublions pas que le bénéfice de ces molécules par rapport au traitement de référence (AVK) a été testé sans antidote disponible !
Depuis 2016, les recommandations européennes préconisent l’usage des AOD en première intention.10 En France, depuis février 2018,15 l’Agence de sécurité du médicament (ANSM) et la Haute Autorité de santé (HAS) préconisent les AOD comme alternative possible aux AVK. Attention, à cause d’un risque immuno-allergique, l’ANSM contre-indique depuis 2018 l’initiation de fluindione (Previscan), qui ne peut désormais être prescrit qu’en renouvellement d’ordonnance.
Les nouvelles recommandations10 n’emploient plus le terme de « FA valvulaire » qui entraînait une certaine confusion en cas de pathologie valvulaire associé (mais pas stricto sensu FA valvulaire)… La FA valvulaire se définissait comme une FA survenant en présence d’une valve mécanique ou d’un rétrécissement mitral modéré à sévère. En cas de FA valvulaire, seuls les AVK doivent être prescrits.
Ce que disent les recommandations européennes de 2020
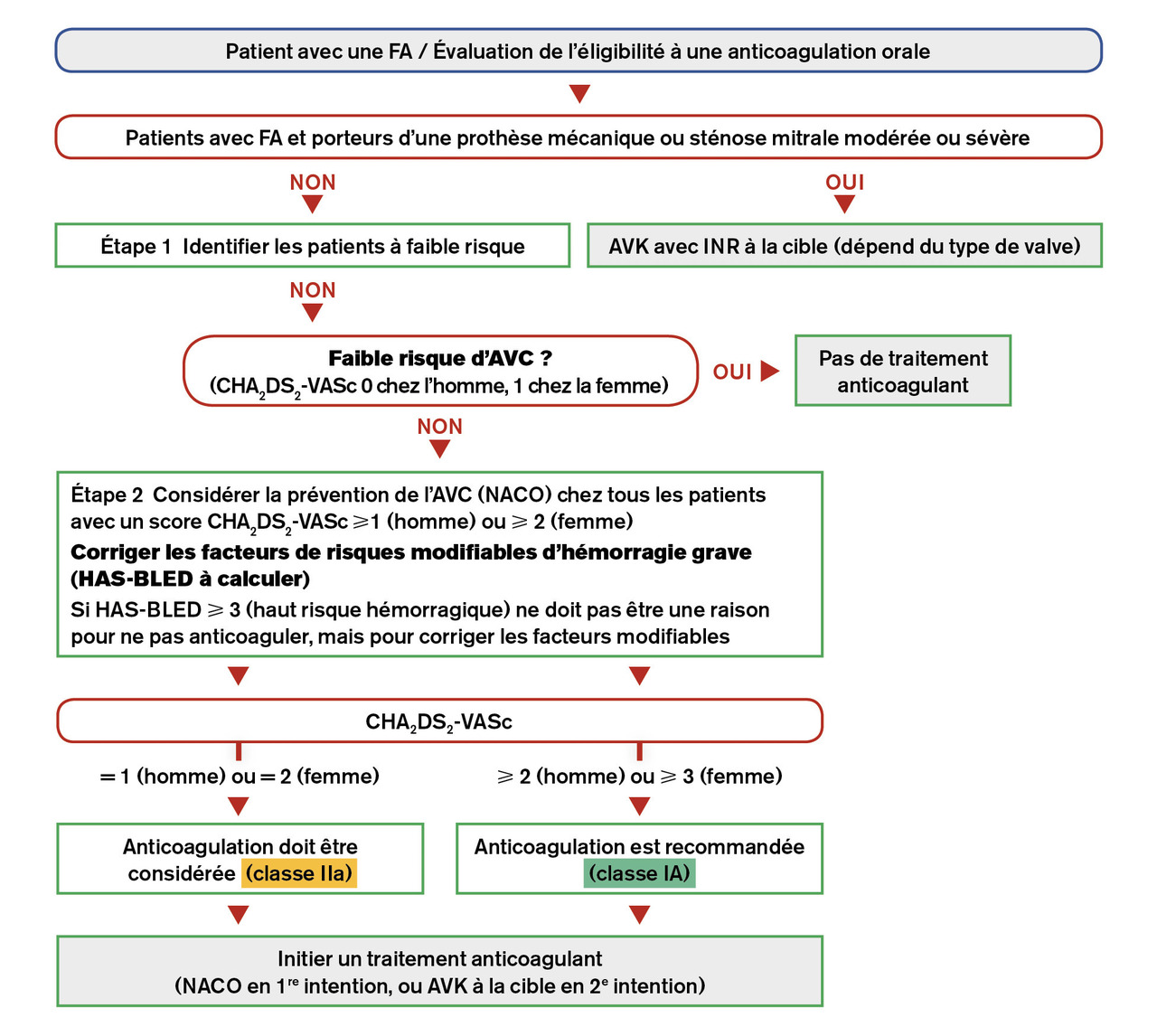
Un algorithme de prise en charge du versant thromboembolique a été présenté dans les dernières recommandations,10 particulièrement bien fait (fig. 3). Un patient avec un score de CHA2DS2-VASc ≥ 1 (sauf si le seul point est relatif au sexe féminin, autrement dit un CHA2DS2-VASc ≥ 1 chez l’homme et ≥ 2 chez la femme) doit bénéficier d’une anticoagulation théorique à vie pour prévenir le risque thromboembolique, à moduler bien entendu avec le risque hémorragique. Cela signifie que le risque thromboembolique d’un patient ayant un CHA2DS2-VASc ≥1 est supérieur au risque d’hémorragie grave sous traitement anticoagulant.
Pour comprendre cela, chez les patients ayant un score CHA2DS2-VASc à 0, cela ne signifie pas qu’ils n’ont pas de risque d’embolie systémique (qui est en fait d’environ 0,5-0,7% par an), mais que ce risque est inférieur au risque d’hémorragie grave sous anticoagulant (environ 1 % par an).
Les points clés concernant l’évaluation des risques thromboembolique et hémorragique et l’introduction (et modalités) d’un traitement anticoagulant sont résumés dans letableau 3 .
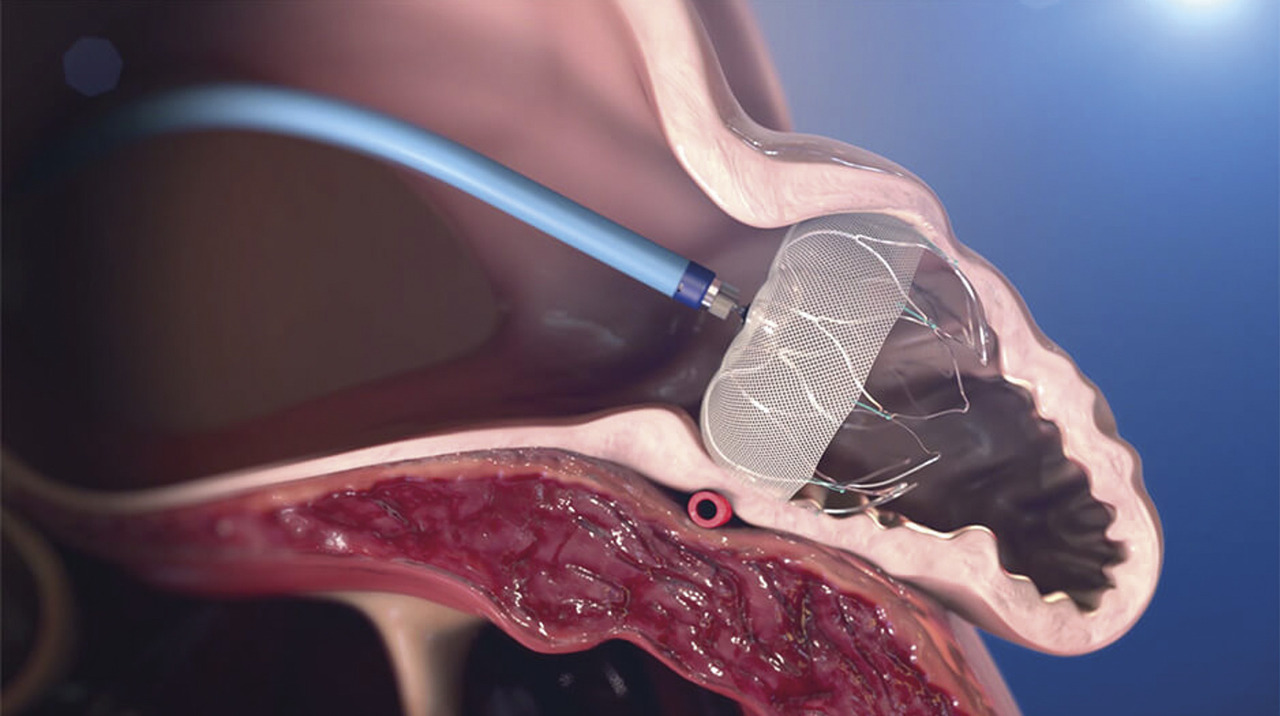
La FA est à risque d’AVC via la formation de thrombus (dans l’auricule gauche dans 90 % des cas) qui peut emboliser dans le système artériel systémique. Si l’occlusion de l’auricule gauche (fig. 4 ) chez les patients ayant une FA est une procédure efficace dans la majorité des cas (98 % de succès immédiat) avec un risque de complications acceptable de 4 % à 30 jours, les recommandations 2020 de l’European Society of Cardiology (ESC) maintiennent l’indication de cette technique en classe IIb avec un niveau de preuve B chez les patients ayant une contre-indication aux anticoagulants à long terme.10 L’accent est d’ailleurs mis sur l’absence d’étude comparant le risque hémorragique sous AOD (qui est moindre que celui des AVK utilisés dans les premières études comparatives) par rapport au risque lié aux prothèses pour le moment. Une autre question qui reste en suspens est celle du traitement antithrombotique à utiliser dans les suites ainsi que sa durée en raison du risque lié à la prothèse elle-même.
Comme indiqué précédemment, tous les patients doivent avoir avant une cardioversion soit une imagerie cardiaque (ETO à privilégier),, soit une anticoagulation d’au moins 3 semaines. Cette anticoagulation doit être poursuivie encore 4 semaines après la cardioversion, et ce n’est qu’à ce moment-là que le score de CHA2DS2-VASc sera calculé pour décider d’une anticoagulation au long cours ou non. Une exception à la règle, d’après les toutes nouvelles recommandations européennes : après une cardioversion, si CHA2DS2-VASc = 0 et < 24 heures après le début de l’événement, on peut ne pas anticoaguler.10
À noter que tout patient chez qui l’on découvre une FA sur l’électrocardiogramme doit être mis sous anticoagulants. L’idée est de commencer les 3 semaines d’anticoagulation en vue d’une éventuelle intervention pour un retour en rythme sinusal (cardioversion ou ablation) en cas de persistance.
Figure 1. Fourchette thérapeutique des antagonistes de la vitamine K*. * Surveillance par international normalized ratio (INR). AVC : accident vasculaire cérébral.
Pour comprendre cela, chez les patients ayant un score CHA2DS2-VASc à 0, cela ne signifie pas qu’ils n’ont pas de risque d’embolie systémique (qui est en fait d’environ 0,5-0,7% par an), mais que ce risque est inférieur au risque d’hémorragie grave sous anticoagulant (environ 1 % par an).
Les points clés concernant l’évaluation des risques thromboembolique et hémorragique et l’introduction (et modalités) d’un traitement anticoagulant sont résumés dans le
La FA est à risque d’AVC via la formation de thrombus (dans l’auricule gauche dans 90 % des cas) qui peut emboliser dans le système artériel systémique. Si l’occlusion de l’auricule gauche (
Comme indiqué précédemment, tous les patients doivent avoir avant une cardioversion soit une imagerie cardiaque (ETO à privilégier),, soit une anticoagulation d’au moins 3 semaines. Cette anticoagulation doit être poursuivie encore 4 semaines après la cardioversion, et ce n’est qu’à ce moment-là que le score de CHA2DS2-VASc sera calculé pour décider d’une anticoagulation au long cours ou non. Une exception à la règle, d’après les toutes nouvelles recommandations européennes : après une cardioversion, si CHA2DS2-VASc = 0 et < 24 heures après le début de l’événement, on peut ne pas anticoaguler.10
À noter que tout patient chez qui l’on découvre une FA sur l’électrocardiogramme doit être mis sous anticoagulants. L’idée est de commencer les 3 semaines d’anticoagulation en vue d’une éventuelle intervention pour un retour en rythme sinusal (cardioversion ou ablation) en cas de persistance.
Figure 1. Fourchette thérapeutique des antagonistes de la vitamine K*. * Surveillance par international normalized ratio (INR). AVC : accident vasculaire cérébral.
Références
1. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147:1561-4.
2. Lin HJ, Wolf PA, Kelly-Hayes M, et al. Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996;27:1760-4.
3. Phillips SJ. Is atrial fibrillation an independent risk factor for stroke? Can J Neurol Sci 1990;17:163-8.
4. Dievart F. Comment a été déterminé le bénéfice de l’anticoagulation orale dans la fibrillation atriale ? Quel est l’index thérapeutique des anticoagulants oraux? Réalités cardiologiques # 300_mars/avril 2014
5. The Stroke Prevention in Atrial Fibrillation investigators. Design of a multicenter randomized trial for the Stroke Prevention in Atrial Fibrillation Study. Stroke 1990;21:538-45.
6. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-67.
7. Singer DE, Albers GW, Dalen JE, et al. Antithrombotic therapy in atrial fibrillation. Chest 2008;133;546S-592S.
8. Oake N, Jennings A, Forster AJ, et al. Anticoagulation intensity and outcomes among patients prescribed oral anticoagulant therapy: a systematic review and meta-analysis. CMAJ 2008;179:235-44.
9. Lip GYH, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach. The Euro Heart Survey on Atrial Fibrillation. Chest 2010;137:263-72.
10. Hindricks G, Potpara T, Dagres N, et al.; ESC scientific document group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J.2020 Aug 29:ehaa612.
11. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138:1093-100.
12. Mant J, Hobbs FD, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007;370:493-503.
13. Sato H, Ishikawa K, Kitabatake A, et al. Low-dose aspirin for prevention of stroke in low-risk patients with atrial fibrillation: Japan Atrial Fibrillation Stroke trial. Stroke 2006;37:447-51.
14. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955-62.
15. Haute Autorité de santé. Les anticoagulants oraux. Synthèse d’avis et fiches bon usage du médicament, HAS 2018. www.has-sante.fr
2. Lin HJ, Wolf PA, Kelly-Hayes M, et al. Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996;27:1760-4.
3. Phillips SJ. Is atrial fibrillation an independent risk factor for stroke? Can J Neurol Sci 1990;17:163-8.
4. Dievart F. Comment a été déterminé le bénéfice de l’anticoagulation orale dans la fibrillation atriale ? Quel est l’index thérapeutique des anticoagulants oraux? Réalités cardiologiques # 300_mars/avril 2014
5. The Stroke Prevention in Atrial Fibrillation investigators. Design of a multicenter randomized trial for the Stroke Prevention in Atrial Fibrillation Study. Stroke 1990;21:538-45.
6. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-67.
7. Singer DE, Albers GW, Dalen JE, et al. Antithrombotic therapy in atrial fibrillation. Chest 2008;133;546S-592S.
8. Oake N, Jennings A, Forster AJ, et al. Anticoagulation intensity and outcomes among patients prescribed oral anticoagulant therapy: a systematic review and meta-analysis. CMAJ 2008;179:235-44.
9. Lip GYH, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach. The Euro Heart Survey on Atrial Fibrillation. Chest 2010;137:263-72.
10. Hindricks G, Potpara T, Dagres N, et al.; ESC scientific document group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J.2020 Aug 29:ehaa612.
11. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138:1093-100.
12. Mant J, Hobbs FD, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007;370:493-503.
13. Sato H, Ishikawa K, Kitabatake A, et al. Low-dose aspirin for prevention of stroke in low-risk patients with atrial fibrillation: Japan Atrial Fibrillation Stroke trial. Stroke 2006;37:447-51.
14. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955-62.
15. Haute Autorité de santé. Les anticoagulants oraux. Synthèse d’avis et fiches bon usage du médicament, HAS 2018. www.has-sante.fr