Le traitement de l’artérite à cellules géantes (ACG) a pour but de soulager les symptômes, d’éviter les complications ischémiques, en particulier neurologiques et ophtalmologiques, tout en provoquant le moins d’effets indésirables possible.
Il repose avant tout sur la corticothérapie par voie générale, qui reste, en 2023, la pierre angulaire du traitement. Celle-ci est constamment efficace sur les symptômes de la maladie, en dehors bien sûr des séquelles neurologiques ou visuelles qui sont définitives et à l’heure actuelle inaccessibles à tout traitement.
Ainsi, toute résistance à la corticothérapie doit faire remettre en cause le diagnostic. De même, une corticodépendance à plus de 15 mg/j d’équivalent prednisone est inhabituelle au cours de l’ACG et doit également faire rediscuter le diagnostic.
Il repose avant tout sur la corticothérapie par voie générale, qui reste, en 2023, la pierre angulaire du traitement. Celle-ci est constamment efficace sur les symptômes de la maladie, en dehors bien sûr des séquelles neurologiques ou visuelles qui sont définitives et à l’heure actuelle inaccessibles à tout traitement.
Ainsi, toute résistance à la corticothérapie doit faire remettre en cause le diagnostic. De même, une corticodépendance à plus de 15 mg/j d’équivalent prednisone est inhabituelle au cours de l’ACG et doit également faire rediscuter le diagnostic.
Corticothérapie par voie générale pour faire disparaître les symptômes
La corticothérapie est habituellement administrée par voie orale. La prednisone est la plus utilisée car elle a une meilleure biodisponibilité et existe sous forme de comprimés de 20, 5 et 1 mg qui permettent une diminution des doses milligramme par milligramme.
Diminution progressive des doses
Au début, la corticothérapie est prescrite à la dose de 0,7 mg/kg/j, voire 1 mg/kg/j en cas de complication ischémique, en une prise matinale. La dose est ensuite diminuée à partir du moment où les symptômes et le syndrome inflammatoire ont disparu, généralement après une à deux semaines. Il faut éviter de donner une corticothérapie trop courte ou sous forme séquentielle, car cela expose au risque de rechute précoce, avec parfois des complications ischémiques visuelles ou neurologiques. La dose doit au contraire être très progressivement diminuée, avec pour objectif d’atteindre 15 à 20 mg après trois mois de traitement, 10 mg après six mois, 5 mg entre neuf et douze mois et un sevrage aux alentours de douze à dix-huit mois de traitement.1
Rechutes fréquentes
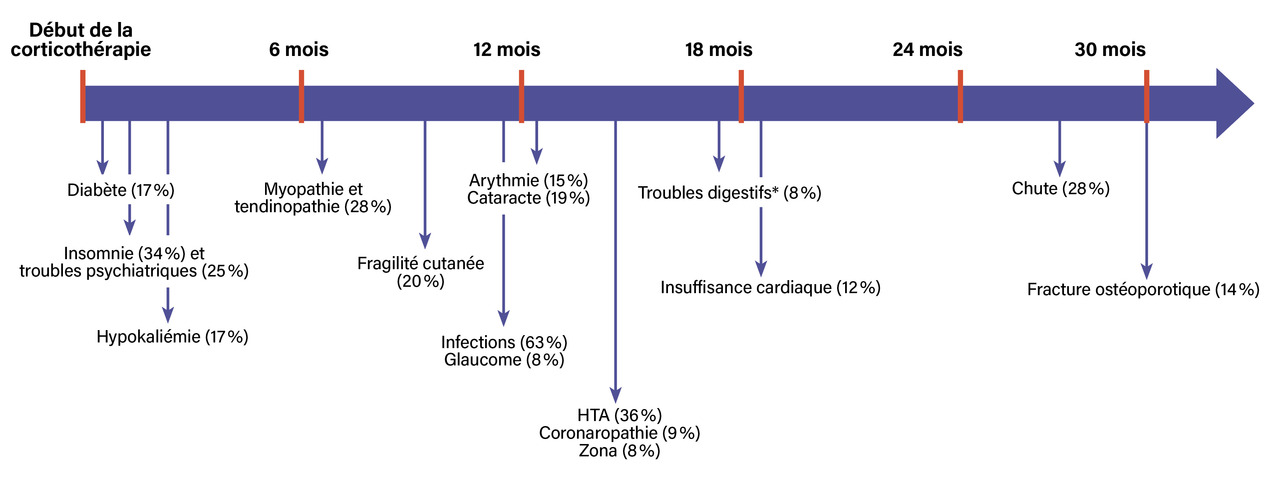
Avec ce traitement, tous les patients entrent en rémission, mais les rechutes sont fréquentes lors de la décroissance des doses. En effet, 47 % des patients rechutent à l’occasion de la décroissance des corticoïdes, généralement à des doses inférieures à 10 mg/j d’équivalent prednisone.2 Ces rechutes sont habituellement mineures, se limitant à des céphalées et/ou des signes de pseudopolyarthrite rhizomélique (PPR) accompagnés d’un syndrome inflammatoire. Il est très rare qu’elles soient sévères, et exceptionnel qu’elles occasionnent des complications ophtalmologiques (moins de 1 % des cas). Cependant, ces rechutes contribuent à prolonger la durée de la corticothérapie, et donc la dose cumulée, ce qui conduit à la survenue d’effets indésirables de la corticothérapie, dont la fréquence est estimée à plus de 80 % dans cette population.3,4 Les principaux effets indésirables de la corticothérapie, leur délai de survenue et leur fréquence sont présentés dans la figure .5
Malgré le traitement, certains patients rechutent plusieurs fois : environ un tiers des patients rechutent deux fois et un patient sur six rechute trois fois ou plus. Chez ces derniers, le sevrage de la corticothérapie s’avère très difficile. Les facteurs associés au risque de rechute ne sont pas clairement identifiés ; ceux qui ressortent des méta-analyses les plus récentes sont la durée de la corticothérapie (plus elle est courte, plus le risque de rechute est élevé), l’atteinte des gros vaisseaux (aorte et ses branches) et le sexe féminin.2,6 C’est la raison pour laquelle il est important de rechercher une atteinte des gros vaisseaux au moment du diagnostic d’ACG puisqu’en plus d’être associée à un sur-risque de rechute, elle est liée à une augmentation de la mortalité due à une élévation des événements cardiovasculaires et des complications aortiques. Il est donc probablement nécessaire, en particulier dans cette population de patients ayant une atteinte des gros vaisseaux qui est généralement moins âgée, d’introduire un traitement d’épargne en corticoïdes assez tôt dans la prise en charge pour éviter la survenue d’effets indésirables de la corticothérapie et en particulier ne pas majorer le risque d’événement cardiovasculaire, augmenté sous corticothérapie, même à des doses inférieures à 5 mg/j.7
Malgré le traitement, certains patients rechutent plusieurs fois : environ un tiers des patients rechutent deux fois et un patient sur six rechute trois fois ou plus. Chez ces derniers, le sevrage de la corticothérapie s’avère très difficile. Les facteurs associés au risque de rechute ne sont pas clairement identifiés ; ceux qui ressortent des méta-analyses les plus récentes sont la durée de la corticothérapie (plus elle est courte, plus le risque de rechute est élevé), l’atteinte des gros vaisseaux (aorte et ses branches) et le sexe féminin.2,6 C’est la raison pour laquelle il est important de rechercher une atteinte des gros vaisseaux au moment du diagnostic d’ACG puisqu’en plus d’être associée à un sur-risque de rechute, elle est liée à une augmentation de la mortalité due à une élévation des événements cardiovasculaires et des complications aortiques. Il est donc probablement nécessaire, en particulier dans cette population de patients ayant une atteinte des gros vaisseaux qui est généralement moins âgée, d’introduire un traitement d’épargne en corticoïdes assez tôt dans la prise en charge pour éviter la survenue d’effets indésirables de la corticothérapie et en particulier ne pas majorer le risque d’événement cardiovasculaire, augmenté sous corticothérapie, même à des doses inférieures à 5 mg/j.7
Deux molécules recommandées en traitement d’épargne en corticoïdes
L’utilisation de stratégies d’épargne en corticoïdes est un point essentiel pour améliorer la prise en charge des patients atteints d’ACG, en particulier ceux chez qui la corticothérapie se prolonge au-delà de douze à dix-huit mois en raison de rechutes. À l’heure actuelle, deux molécules sont utilisées dans cette indication et sont recommandées dans le protocole national de diagnostic et de soins (PNDS) de l’ACG.1
Méthotrexate actif après huit à douze semaines
La première et la plus ancienne est le méthotrexate, qui peut être administré per os ou sous forme injectable sous-cutanée à la dose de 0,2 à 0,3 mg/kg/semaine en une prise hebdomadaire. La prescription s’accompagne d’une prise de 10 mg d’acide folique 24 à 72 heures après l’administration de méthotrexate pour en améliorer la tolérance digestive et hématologique.
Sa prescription doit respecter les contre-indications rappelées dans le résumé des caractéristiques du produit (RCP) du produit. Le méthotrexate étant à élimination rénale, il faut particulièrement être attentif au débit de filtration glomérulaire (DFG), qui est parfois altéré dans la population âgée. Lorsque le DFG est inférieur à 30 mL/min, la prescription de méthotrexate est contre-indiquée.
Le méthotrexate à un délai d’action d’environ huit à douze semaines. Lorsque la maladie est active, il ne peut donc pas être prescrit seul, ce qui nécessite une augmentation transitoire de la corticothérapie. On peut s’attendre à un gain en matière d’épargne en corticoïdes à partir de deux à trois mois de traitement. Son efficacité a été démontrée dans une méta-analyse sur donnée individuelle rassemblant les résultats de trois essais cliniques.8 Cette méta-analyse a montré une diminution du risque de rechute et une épargne d’environ 850 mg de prednisone en quarante-huit mois grâce au traitement par méthotrexate.
Sa prescription doit respecter les contre-indications rappelées dans le résumé des caractéristiques du produit (RCP) du produit. Le méthotrexate étant à élimination rénale, il faut particulièrement être attentif au débit de filtration glomérulaire (DFG), qui est parfois altéré dans la population âgée. Lorsque le DFG est inférieur à 30 mL/min, la prescription de méthotrexate est contre-indiquée.
Le méthotrexate à un délai d’action d’environ huit à douze semaines. Lorsque la maladie est active, il ne peut donc pas être prescrit seul, ce qui nécessite une augmentation transitoire de la corticothérapie. On peut s’attendre à un gain en matière d’épargne en corticoïdes à partir de deux à trois mois de traitement. Son efficacité a été démontrée dans une méta-analyse sur donnée individuelle rassemblant les résultats de trois essais cliniques.8 Cette méta-analyse a montré une diminution du risque de rechute et une épargne d’environ 850 mg de prednisone en quarante-huit mois grâce au traitement par méthotrexate.
Le tocilizumab interfère avec les marqueurs biologiques rendant le suivi plus difficile
L’autre traitement d’épargne en corticoïdes utilisé au cours de l’ACG est le tocilizumab, un anticorps monoclonal ciblant le récepteur de l’IL-6, dont l’efficacité a été clairement démontrée dans un essai randomisé de phase III, contrôlé, contre placebo et en double aveugle.9 Cette publication a permis au tocilizumab d’obtenir une autorisation de mise sur le marché (AMM) pour le traitement de l’ACG sous forme injectable par voie sous-cutanée à la dose de 162 mg/semaine. En septembre 2018, la commission de la transparence a précisé les conditions de remboursement de ce traitement coûteux (environ 900 €/mois) : en cas de corticodépendance à une dose supérieure ou égale à 7,5 mg/j de prednisone entraînant des rechutes itératives et chez les patients pour lesquels une décroissance rapide et précoce de la corticothérapie est rendue nécessaire par une intolérance aux corticoïdes ou des comorbidités sévères (diabète compliqué déséquilibré, troubles thymiques et psychotiques sévères, ostéoporose fracturaire sévère, hypertension artérielle sévère non contrôlée…).
Le tocilizumab semble avoir une efficacité rapide, en tout cas sur les paramètres biologiques du syndrome inflammatoire. Toutefois, les études, réalisées sur de petits effectifs de patients, qui ont évalué une prescription très courte de corticoïdes en association au tocilizumab ont montré que l’effet du tocilizumab sur les manifestations cliniques de l’ACG était plus lent et que ce traitement ne permettait pas de faire l’économie d’une corticothérapie en cas d’ACG active.
L’un des inconvénients majeurs du tocilizumab est que ce traitement, qui bloque la signalisation du récepteur de l’IL-6, bloque la production hépatocytaire de protéine C-réactive (CRP), de fibrinogène et interfère donc aussi avec la vitesse de sédimentation. Ainsi, le suivi de l’activité de l’ACG chez ces patients est très difficile parce qu’on ne peut plus se fier à ces mesures biologiques et aucun autre marqueur biologique n’est fiable ni validé (des travaux de recherche sont en cours). Il est donc nécessaire d’être très attentif aux signes cliniques d’ACG ou de PPR et parfois d’utiliser l’imagerie vasculaire, dont l’interprétation est très délicate pour le suivi de la maladie.
Le tocilizumab semble avoir une efficacité rapide, en tout cas sur les paramètres biologiques du syndrome inflammatoire. Toutefois, les études, réalisées sur de petits effectifs de patients, qui ont évalué une prescription très courte de corticoïdes en association au tocilizumab ont montré que l’effet du tocilizumab sur les manifestations cliniques de l’ACG était plus lent et que ce traitement ne permettait pas de faire l’économie d’une corticothérapie en cas d’ACG active.
L’un des inconvénients majeurs du tocilizumab est que ce traitement, qui bloque la signalisation du récepteur de l’IL-6, bloque la production hépatocytaire de protéine C-réactive (CRP), de fibrinogène et interfère donc aussi avec la vitesse de sédimentation. Ainsi, le suivi de l’activité de l’ACG chez ces patients est très difficile parce qu’on ne peut plus se fier à ces mesures biologiques et aucun autre marqueur biologique n’est fiable ni validé (des travaux de recherche sont en cours). Il est donc nécessaire d’être très attentif aux signes cliniques d’ACG ou de PPR et parfois d’utiliser l’imagerie vasculaire, dont l’interprétation est très délicate pour le suivi de la maladie.
Choix du traitement d’épargne en corticoïdes et suivi
Ces données suggèrent que l’effet d’épargne en corticoïdes apporté par le méthotrexate serait inférieur à celui du tocilizumab. Toutefois, nous ne disposons à l’heure actuelle d’aucune étude ayant comparé directement ces deux traitements. C’est l’objectif du programme hospitalier de recherche clinique (PHRC) national METOGiA (Methotrexate versus tocilizumab for treatment of giant cell arteritis), en cours en France sous la coordination du CHU de Dijon, et dont les inclusions se termineront en 2023, avec des premiers résultats attendus en fin d’année 2024 ou début d’année 2025.
La décision de mise en place d’un traitement d’épargne en corticoïdes puis le suivi de la maladie, en particulier en cas de traitement par tocilizumab, requiert donc une prise en charge spécialisée qui devrait se faire en théorie dans des centres experts de cette vascularite. Lorsqu’un traitement d’épargne en corticoïdes est instauré, l’objectif est d’obtenir un sevrage des corticoïdes ou, au minimum, de diminuer la dose de prednisone à 5 mg/j ou moins. Chez ces patients, la question de la durée du traitement d’épargne en corticoïdes se pose. En l’absence d’études qui se sont spécifiquement intéressées à la question, on recommande habituellement une durée minimale d’un an, mais souvent le traitement est poursuivi au-delà.1 Les modalités d’arrêt, que ce soit pour le méthotrexate ou le tocilizumab, ne sont pas clairement établies.
L’intérêt de la tomographie par émission de positons (TEP) dans le suivi de la maladie est limité, même si de nombreuses équipes l’utilisent ; son interprétation est très délicate car la plupart des études montrent que la persistance d’un hypermétabolisme vasculaire à la TEP n’est pas significativement corrélée à l’activité de la maladie ou à un risque de rechute.
La décision de mise en place d’un traitement d’épargne en corticoïdes puis le suivi de la maladie, en particulier en cas de traitement par tocilizumab, requiert donc une prise en charge spécialisée qui devrait se faire en théorie dans des centres experts de cette vascularite. Lorsqu’un traitement d’épargne en corticoïdes est instauré, l’objectif est d’obtenir un sevrage des corticoïdes ou, au minimum, de diminuer la dose de prednisone à 5 mg/j ou moins. Chez ces patients, la question de la durée du traitement d’épargne en corticoïdes se pose. En l’absence d’études qui se sont spécifiquement intéressées à la question, on recommande habituellement une durée minimale d’un an, mais souvent le traitement est poursuivi au-delà.1 Les modalités d’arrêt, que ce soit pour le méthotrexate ou le tocilizumab, ne sont pas clairement établies.
L’intérêt de la tomographie par émission de positons (TEP) dans le suivi de la maladie est limité, même si de nombreuses équipes l’utilisent ; son interprétation est très délicate car la plupart des études montrent que la persistance d’un hypermétabolisme vasculaire à la TEP n’est pas significativement corrélée à l’activité de la maladie ou à un risque de rechute.
Molécules alternatives en développement
Parfois, aucun des deux traitements d’épargne en corticoïdes n’est efficace, ils sont mal tolérés ou le patient a des contre-indications. C’est la raison pour laquelle il est important que d’autres molécules soient développées. Certaines sont à l’étude :
– le mavrilimumab (anticorps monoclonal ciblant le récepteur du GM-CSF) ; une étude de phase II a suggéré son efficacité ;10
– le sécukinumab (anticorps monoclonal dirigé contre l’IL-17) ; une étude de phase II présentée en congrès a suggéré son efficacité ;11 une étude de phase III internationale est en cours ;
– l’abatacept (protéine de fusion entre la partie extracytoplasmique du CTLA-4 et le fragment Fc d’une immunoglobuline G qui a pour effet de bloquer l’activation lymphocytaire T) ; une étude de phase II a suggéré son efficacité12 et une étude de phase III, randomisée, contrôlée contre placebo, en double aveugle, est en cours ;
– les inhibiteurs de Janus kinases (JAK, protéines impliquées dans la signalisation intracellulaire des cytokines), qui sont utilisés pour le traitement de la polyarthrite rhumatoïde, du rhumatisme psoriasique et des maladies inflammatoires du côlon et de l’intestin, sont également évalués dans l’ACG ; une étude de phase II a récemment suggéré l’efficacité du baricitinib au cours de l’ACG, mais chez un très faible nombre de patients (n = 15) et sans groupe contrôle ;13 une étude de phase III, internationale, randomisée, contrôlée contre placebo, en double aveugle est en cours pour évaluer l’efficacité de l’upadacitinib ; les inclusions sont encore en cours.
D’autres molécules sont en cours de développement ou ont été évaluées dans de précédentes études.14
– le mavrilimumab (anticorps monoclonal ciblant le récepteur du GM-CSF) ; une étude de phase II a suggéré son efficacité ;10
– le sécukinumab (anticorps monoclonal dirigé contre l’IL-17) ; une étude de phase II présentée en congrès a suggéré son efficacité ;11 une étude de phase III internationale est en cours ;
– l’abatacept (protéine de fusion entre la partie extracytoplasmique du CTLA-4 et le fragment Fc d’une immunoglobuline G qui a pour effet de bloquer l’activation lymphocytaire T) ; une étude de phase II a suggéré son efficacité12 et une étude de phase III, randomisée, contrôlée contre placebo, en double aveugle, est en cours ;
– les inhibiteurs de Janus kinases (JAK, protéines impliquées dans la signalisation intracellulaire des cytokines), qui sont utilisés pour le traitement de la polyarthrite rhumatoïde, du rhumatisme psoriasique et des maladies inflammatoires du côlon et de l’intestin, sont également évalués dans l’ACG ; une étude de phase II a récemment suggéré l’efficacité du baricitinib au cours de l’ACG, mais chez un très faible nombre de patients (n = 15) et sans groupe contrôle ;13 une étude de phase III, internationale, randomisée, contrôlée contre placebo, en double aveugle est en cours pour évaluer l’efficacité de l’upadacitinib ; les inclusions sont encore en cours.
D’autres molécules sont en cours de développement ou ont été évaluées dans de précédentes études.14
Mesures associées au traitement anti-inflammatoire
La prise en charge thérapeutique de l’artérite à cellules géantes ne doit pas négliger les mesures associées, et notamment la prévention du risque cardiovasculaire. Ce risque est augmenté d’un facteur 2 au cours de l’ACG et il est encore plus important au cours du premier mois suivant le diagnostic.15
Prescription d’un antiagrégant plaquettaire non systématique
Ainsi se pose la question de prescrire un traitement antiagrégant plaquettaire pour diminuer ce risque. Les études qui ont analysé cette question étaient généralement de qualité méthodologique médiocre et ont montré des résultats contradictoires. Les données ont été rassemblées dans une méta-analyse regroupant 914 patients ; les conclusions ne montrent pas clairement un bénéfice à prescrire de l’aspirine pour la prévention des complications ischémiques de l’ACG.16 Ainsi, le PNDS ne recommande pas la prescription systématique d’aspirine chez tous les patients atteints d’ACG mais la propose en cas de complication ischémique ou en cas de mise en évidence, lors du bilan initial, de lésion vasculaire pour laquelle il existe une indication thérapeutique en tant que telle, par exemple une sténose artérielle.
Pas de recommandations pour les hypolipémiants ni les antihypertenseurs
Concernant les dyslipidémies, il n’y a pas de recommandation spécifique dans l’ACG. La prescription d’un traitement hypolipémiant doit donc suivre les recommandations habituelles éditées par la Haute Autorité de santé.
Il en est de même pour le traitement de l’hypertension artérielle, qui peut apparaître ou être aggravée par la corticothérapie. À ce titre, des données récentes suggèrent un avantage à prescrire des bêtabloquants pour prévenir les dilatations aortiques chez les patients avec une aortite au diagnostic.17
Il en est de même pour le traitement de l’hypertension artérielle, qui peut apparaître ou être aggravée par la corticothérapie. À ce titre, des données récentes suggèrent un avantage à prescrire des bêtabloquants pour prévenir les dilatations aortiques chez les patients avec une aortite au diagnostic.17
Prévention de l’ostéoporose
Concernant l’ostéoporose, sa prévention passe par une utilisation raisonnée des corticoïdes, par une supplémentation vitaminocalcique et parfois un traitement antirésorption osseuse, en particulier un bisphosphonate, en suivant les recommandations du Groupe de recherche et d’information sur les ostéoporoses (GRIO).
Mise à jour du calendrier vaccinal
La prévention du risque infectieux est un point capital puisque ces patients sont immunodéprimés du fait de leur traitement anti-inflammatoire. Il est donc important que le calendrier vaccinal soit à jour. De plus, il faut proposer une vaccination antigrippale annuelle, une vaccination contre le pneumocoque et une vaccination contre le SARS-CoV-2 selon les recommandations en vigueur. Des données récentes ont montré une mortalité particulièrement élevée chez les patients atteints d’ACG et infectés par le SARS-CoV-2, du fait de leur âge et de la corticothérapie prolongée ; en revanche, la prise de méthotrexate ou de tocilizumab n’augmentait pas significativement le risque de décès.18
La réponse vaccinale est parfois altérée chez les patients recevant une corticothérapie et/ou un traitement immunosuppresseur.
La réponse vaccinale est parfois altérée chez les patients recevant une corticothérapie et/ou un traitement immunosuppresseur.
Gestes de revascularisation en milieu expert
Certains patients ont, au diagnostic d’ACG ou au cours de son évolution, des lésions vasculaires à type de sténose, voire d’occlusion, qui nécessitent parfois des gestes de revascularisation. Sauf urgence, ces gestes doivent se faire lorsque la vascularite n’est plus active et par une équipe experte de la maladie, disposant d’un plateau technique avec la présence de chirurgiens vasculaires et de radiologues interventionnels.
Utilisation raisonnée de la corticothérapie et instauration d’un traitement d’épargne sur avis d’expert
Le traitement de l’ACG repose encore en 2023 sur la corticothérapie mais son utilisation doit être raisonnée avec des objectifs ambitieux de sevrage autour de douze à dix-huit mois pour ne pas exposer ces patients à des doses cumulées trop importantes de corticoïdes et majorer leur risque cardiovasculaire, en particulier chez ceux ayant déjà des facteurs de risque cardiovasculaire ou une atteinte des gros vaisseaux. Dans ce cas, il est recommandé d’adresser le patient à un centre expert de la maladie pour discuter de l’instauration d’un traitement d’épargne en corticoïdes et éventuellement envisager l’inclusion dans des essais thérapeutiques.
Le traitement par corticoïdes est toujours efficace sur les symptômes et prévient la survenue de complications ischémiques. Devant tout patient résistant à la corticothérapie ou développant une corticodépendance à dose élevée (plus de 15 mg/j), le diagnostic doit être remis en cause et nécessite là aussi un avis d’expert.
Le traitement par corticoïdes est toujours efficace sur les symptômes et prévient la survenue de complications ischémiques. Devant tout patient résistant à la corticothérapie ou développant une corticodépendance à dose élevée (plus de 15 mg/j), le diagnostic doit être remis en cause et nécessite là aussi un avis d’expert.
Références
1. Protocole national de diagnostic et de soins (PNDS). Artérite à cellules géantes (Horton). 2020. https://vu.fr/SOBs
2. Mainbourg S, Addario A, Samson M, Puechal X, Francois M, Durupt S, et al. Prevalence of giant cell arteritis relapse in patients treated with glucocorticoids: A meta-analysis. arthritis care res (Hoboken) 2020;72:838-49.
3. de Boysson H, Barakat C, Dumont A, Boutemy J, Martin Silva N, Maigne G, et al. Tolerance of glucocorticoids in giant cell arteritis: A study of patient-reported adverse events. Rheumatology (Oxford) 2022;61:3567-75.
4. Proven A, Gabriel SE, Orces C, O’Fallon WM, Hunder GG. Glucocorticoid therapy in giant cell arteritis: Duration and adverse outcomes. Arthritis Rheum 2003;49:703-8.
5. Castan P, Dumont A, Deshayes S, Boutemy J, Martin Silva N, Maigne G, et al. Impact of glucocorticoid cumulative doses in a real-life cohort of patients affected by giant cell arteritis. J Clin Med 2022;11(4):1034.
6. Moreel L, Betrains A, Molenberghs G, Vanderschueren S, Blockmans D. Epidemiology and predictors of relapse in giant cell arteritis: A systematic review and meta-analysis. Joint Bone Spine 2022;90:105494.
7. Pujades-Rodriguez M, Morgan AW, Cubbon RM, Wu J. Dose-dependent oral glucocorticoid cardiovascular risks in people with immune-mediated inflammatory diseases: A population-based cohort study. PLoS Med 2020;17:e1003432.
8. Mahr AD, Jover JA, Spiera RF, Hernandez-Garcia C, Fernandez-Gutierrez B, Lavalley MP, et al. Adjunctive methotrexate for treatment of giant cell arteritis: An individual patient data meta-analysis. Arthritis Rheum 2007;56:2789-97.
9. Stone JH, Tuckwell K, Dimonaco S, Klearman M, Aringer M, Blockmans D, et al. Trial of tocilizumab in giant-cell arteritis. N Engl J Med 2017;377:317-28.
10. Cid MC, Unizony SH, Blockmans D, Brouwer E, Dagna L, Dasgupta B, et al. Efficacy and safety of mavrilimumab in giant cell arteritis: A phase 2, randomised, double-blind, placebo-controlled trial. Ann Rheum Dis 2022;81:653-61.
11. Venhoff N, Schmidt WA, Bergner R, Rech J, Unger L, Tony HP, et al. Secukinumab in giant cell arteritis: A randomized, parallel-group, double-blind, placebo-controlled, multicenter phase 2 trial. Arthritis Rheum 2021;73.
12. Langford CA, Cuthbertson D, Ytterberg SR, Khalidi N, Monach PA, Carette S, et al. A randomized, double-blind trial of abatacept (CTLA4-IG) for the treatment of giant cell arteritis. Arthritis Rheumatol 2017.
13. Koster MJ, Crowson CS, Giblon RE, Jaquith JM, Duarte-Garcia A, Matteson EL, et al. Baricitinib for relapsing giant cell arteritis: A prospective open-label 52-week pilot study. Ann Rheum Dis 2022;81:861-7.
14. Regent A, Mouthon L. Treatment of giant cell arteritis (GCA). J Clin Med 2022;11.
15. Tomasson G, Peloquin C, Mohammad A, Love TJ, Zhang Y, Choi HK, et al. Risk for cardiovascular disease early and late after a diagnosis of giant-cell arteritis: A cohort study. Ann Intern Med 2014;160:73-80.
16. Martinez-Taboada VM, Lopez-Hoyos M, Narvaez J, Munoz-Cacho P. Effect of antiplatelet/anticoagulant therapy on severe ischemic complications in patients with giant cell arteritis: A cumulative meta-analysis. Autoimmun Rev 2014;13:788-94.
17. Dumont A, Labombarda F, Gallou S, Deshayes S, Nguyen A, Boutemy J, et al. Preventive effect of beta-blockers in the development of aortic dilation in giant cell arteritis-related aortitis. Semin Arthritis Rheum 2022;57:152117.
18. Sattui SE, Conway R, Putman MS, Seet AM, Gianfrancesco MA, Beins K, et al. Outcomes of Covid-19 in patients with primary systemic vasculitis or polymyalgia rheumatica from the Covid-19 Global Rheumatology Alliance physician registry: A retrospective cohort study. Lancet Rheumatol 2021;3:e855-e64.
2. Mainbourg S, Addario A, Samson M, Puechal X, Francois M, Durupt S, et al. Prevalence of giant cell arteritis relapse in patients treated with glucocorticoids: A meta-analysis. arthritis care res (Hoboken) 2020;72:838-49.
3. de Boysson H, Barakat C, Dumont A, Boutemy J, Martin Silva N, Maigne G, et al. Tolerance of glucocorticoids in giant cell arteritis: A study of patient-reported adverse events. Rheumatology (Oxford) 2022;61:3567-75.
4. Proven A, Gabriel SE, Orces C, O’Fallon WM, Hunder GG. Glucocorticoid therapy in giant cell arteritis: Duration and adverse outcomes. Arthritis Rheum 2003;49:703-8.
5. Castan P, Dumont A, Deshayes S, Boutemy J, Martin Silva N, Maigne G, et al. Impact of glucocorticoid cumulative doses in a real-life cohort of patients affected by giant cell arteritis. J Clin Med 2022;11(4):1034.
6. Moreel L, Betrains A, Molenberghs G, Vanderschueren S, Blockmans D. Epidemiology and predictors of relapse in giant cell arteritis: A systematic review and meta-analysis. Joint Bone Spine 2022;90:105494.
7. Pujades-Rodriguez M, Morgan AW, Cubbon RM, Wu J. Dose-dependent oral glucocorticoid cardiovascular risks in people with immune-mediated inflammatory diseases: A population-based cohort study. PLoS Med 2020;17:e1003432.
8. Mahr AD, Jover JA, Spiera RF, Hernandez-Garcia C, Fernandez-Gutierrez B, Lavalley MP, et al. Adjunctive methotrexate for treatment of giant cell arteritis: An individual patient data meta-analysis. Arthritis Rheum 2007;56:2789-97.
9. Stone JH, Tuckwell K, Dimonaco S, Klearman M, Aringer M, Blockmans D, et al. Trial of tocilizumab in giant-cell arteritis. N Engl J Med 2017;377:317-28.
10. Cid MC, Unizony SH, Blockmans D, Brouwer E, Dagna L, Dasgupta B, et al. Efficacy and safety of mavrilimumab in giant cell arteritis: A phase 2, randomised, double-blind, placebo-controlled trial. Ann Rheum Dis 2022;81:653-61.
11. Venhoff N, Schmidt WA, Bergner R, Rech J, Unger L, Tony HP, et al. Secukinumab in giant cell arteritis: A randomized, parallel-group, double-blind, placebo-controlled, multicenter phase 2 trial. Arthritis Rheum 2021;73.
12. Langford CA, Cuthbertson D, Ytterberg SR, Khalidi N, Monach PA, Carette S, et al. A randomized, double-blind trial of abatacept (CTLA4-IG) for the treatment of giant cell arteritis. Arthritis Rheumatol 2017.
13. Koster MJ, Crowson CS, Giblon RE, Jaquith JM, Duarte-Garcia A, Matteson EL, et al. Baricitinib for relapsing giant cell arteritis: A prospective open-label 52-week pilot study. Ann Rheum Dis 2022;81:861-7.
14. Regent A, Mouthon L. Treatment of giant cell arteritis (GCA). J Clin Med 2022;11.
15. Tomasson G, Peloquin C, Mohammad A, Love TJ, Zhang Y, Choi HK, et al. Risk for cardiovascular disease early and late after a diagnosis of giant-cell arteritis: A cohort study. Ann Intern Med 2014;160:73-80.
16. Martinez-Taboada VM, Lopez-Hoyos M, Narvaez J, Munoz-Cacho P. Effect of antiplatelet/anticoagulant therapy on severe ischemic complications in patients with giant cell arteritis: A cumulative meta-analysis. Autoimmun Rev 2014;13:788-94.
17. Dumont A, Labombarda F, Gallou S, Deshayes S, Nguyen A, Boutemy J, et al. Preventive effect of beta-blockers in the development of aortic dilation in giant cell arteritis-related aortitis. Semin Arthritis Rheum 2022;57:152117.
18. Sattui SE, Conway R, Putman MS, Seet AM, Gianfrancesco MA, Beins K, et al. Outcomes of Covid-19 in patients with primary systemic vasculitis or polymyalgia rheumatica from the Covid-19 Global Rheumatology Alliance physician registry: A retrospective cohort study. Lancet Rheumatol 2021;3:e855-e64.