La démarche thérapeutique de première ligne a largement évolué ces dernières années, vers une optimisation du rapport bénéfice-risque. Que la présentation du lymphome de Hodgkin (LH) soit localisée ou avancée, le standard de traitement intègre désormais la tomographie par émission de positons (TEP) pour guider la stratégie, en particulier après deux à quatre cycles de chimiothérapie compte tenu de son impact pronostique majeur.1 L’interprétation de la réponse fait appel à des critères internationaux consensuels.2 Le traitement du LH en première ligne est désormais adapté à la fois aux facteurs de risque (FR) et à la réponse précoce à la chimiothérapie. En pratique clinique quotidienne, ces stratégies guidées par la TEP visent à réduire l’incidence et la gravité de la toxicité à long terme en modulant l’intensité des traitements, tout en maintenant le même niveau d’efficacité.
Les stratégies thérapeutiques suivent la stratification pronostique obtenue après le bilan préthérapeutique. Pour les stades localisés (I-II), les patients sont répartis en stade favorable ou défavorable selon les critères de l’European Organisation for Research and Treatment of Cancer (EORTC) et du groupe allemand GHSG (German Hodgkin Study Group) qui correspondent à un consensus européen, fondé sur l’âge, le nombre de territoires ganglionnaires atteints, la taille de l’atteinte médiastinale, la vitesse de sédimentation (VS), la présence d’une atteinte extraganglionnaire de contiguïté. Pour les stades avancés (III-IV), la stratification est fondée sur le score pronostique international (IPS) défini à partir de sept facteurs pronostiques,3 ce qui répartit les patients en niveau de risque standard (IPS 0-2) et haut risque (IPS 3-7). Au vu de la gravité de leur présentation, les patients de stade IIB avec rapport médiastino-thoracique (M/T) supérieur à 0,33 ne sont pas classés par certains groupes coopérateurs comme des stades localisés, mais considérés comme des stades avancés, ce qui retentit sur la stratégie thérapeutique choisie comme discuté ci-dessous dans une section dédiée.
Les stratégies thérapeutiques suivent la stratification pronostique obtenue après le bilan préthérapeutique. Pour les stades localisés (I-II), les patients sont répartis en stade favorable ou défavorable selon les critères de l’European Organisation for Research and Treatment of Cancer (EORTC) et du groupe allemand GHSG (German Hodgkin Study Group) qui correspondent à un consensus européen, fondé sur l’âge, le nombre de territoires ganglionnaires atteints, la taille de l’atteinte médiastinale, la vitesse de sédimentation (VS), la présence d’une atteinte extraganglionnaire de contiguïté. Pour les stades avancés (III-IV), la stratification est fondée sur le score pronostique international (IPS) défini à partir de sept facteurs pronostiques,3 ce qui répartit les patients en niveau de risque standard (IPS 0-2) et haut risque (IPS 3-7). Au vu de la gravité de leur présentation, les patients de stade IIB avec rapport médiastino-thoracique (M/T) supérieur à 0,33 ne sont pas classés par certains groupes coopérateurs comme des stades localisés, mais considérés comme des stades avancés, ce qui retentit sur la stratégie thérapeutique choisie comme discuté ci-dessous dans une section dédiée.
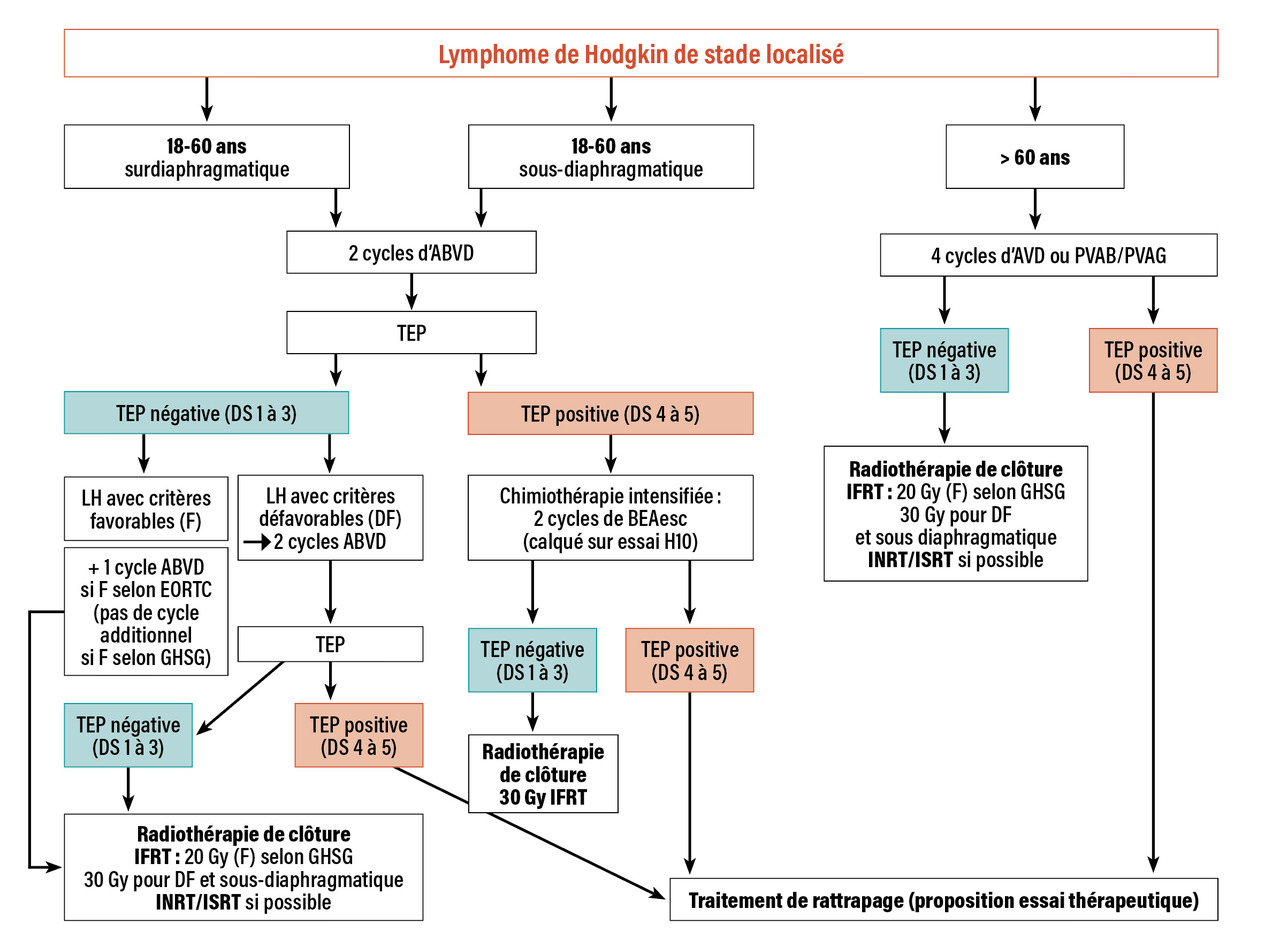
Stades localisés du sujet jeune (18-60 ans) : guérison neuf fois sur dix
Grâce à la combinaison d’une chimiothérapie suivie d’une radiothérapie externe (RTE), la guérison est obtenue dans plus de 90 % des cas. Des progrès sont encore nécessaires, non seulement pour augmenter l’efficacité mais aussi pour diminuer les effets indésirables. C’est pourquoi, au cours de la dernière décennie, nombre d’essais thérapeutiques, outre l’intégration de la TEP pour guider les traitements, ont posé la question de réduire le nombre de cycles de chimiothérapie et les champs et doses de RTE. Pour la RTE, ces progrès ont ainsi permis de passer des modalités d’irradiation utilisant des champs larges et des fortes doses à des irradiations limitées aux territoires atteints, que ce soit sur une aire ganglionnaire en involved-field radiotherapy (IFRT), ou de plus en plus souvent uniquement sur les ganglions atteints en involved-node radiation therapy (INRT). De même, les doses sont désormais limitées entre 20 et 30 Gy selon l’absence ou la présence de FR préthérapeutiques.
Stades localisés favorables : chimiothérapie et radiothérapie
L’essai RAPID a inclus 602 patients atteints de LH localisés sans critères de mauvais pronostic pour poser la question de l’irradiation en cas de réponse métabolique précoce.4 En cas de TEP négative (TEP ) après trois cycles d’ABVD (doxorubicine [Adriamycine], bléomycine, vinblastine, dacarbazine), les patients étaient randomisés entre une irradiation des sites atteints (IFRT) et une surveillance. Les taux de survie sans progression (SSP) à trois ans ont été de 94,6 % dans le groupe avec RTE et de 90,8 % dans le groupe sans RTE, ce qui traduit un excès significatif de rechutes en cas d’omission de la RTE.
Avec un schéma un peu différent, l’étude randomisée H10 a évalué la possibilité d’une adaptation précoce du traitement en fonction des résultats de la TEP après deux cycles d’ABVD (TEP2).5 Dans le groupe favorable, le traitement standard comprenait, quel que soit le résultat de la TEP2, trois cycles d’ABVD-INRT 30 Gy, tandis que dans le bras expérimental les patients avec TEP2 négative recevaient deux cycles supplémentaires d’ABVD sans RTE. Avec un suivi médian de cinq ans, parmi les 465 patients TEP2-, deux rechutes ont été observées dans le bras standard chimiothérapie-RTE, contre 30 dans le bras expérimental sans RTE. Les taux de SSP à cinq ans étaient de 99 % et 87,1 % respectivement. Comme dans l’essai RAPID, l’omission de la RTE est ainsi associée à un risque de rechute significativement plus élevé.
Également à la recherche d’un schéma thérapeutique sans irradiation, l’étude HD16 a comparé, chez 628 patients en réponse métabolique complète après deux cycles d’ABVD, une stratégie standard avec IFRT 20 Gy à l’absence d’irradiation complémentaire.6 Après un suivi médian de 45 mois, le taux de SSP à cinq ans était de 86,1 % sans irradiation, significativement inférieur aux 93,4 % du groupe standard, sans différence de survie globale.
Une excellente réponse métabolique précoce ne permet donc pas d’identifier, parmi les LH localisés favorables, un sous-groupe de patients chez qui on pourrait à coup sûr se passer de la RTE sans préjudice pour le contrôle de la maladie.
Avec un schéma un peu différent, l’étude randomisée H10 a évalué la possibilité d’une adaptation précoce du traitement en fonction des résultats de la TEP après deux cycles d’ABVD (TEP2).5 Dans le groupe favorable, le traitement standard comprenait, quel que soit le résultat de la TEP2, trois cycles d’ABVD-INRT 30 Gy, tandis que dans le bras expérimental les patients avec TEP2 négative recevaient deux cycles supplémentaires d’ABVD sans RTE. Avec un suivi médian de cinq ans, parmi les 465 patients TEP2-, deux rechutes ont été observées dans le bras standard chimiothérapie-RTE, contre 30 dans le bras expérimental sans RTE. Les taux de SSP à cinq ans étaient de 99 % et 87,1 % respectivement. Comme dans l’essai RAPID, l’omission de la RTE est ainsi associée à un risque de rechute significativement plus élevé.
Également à la recherche d’un schéma thérapeutique sans irradiation, l’étude HD16 a comparé, chez 628 patients en réponse métabolique complète après deux cycles d’ABVD, une stratégie standard avec IFRT 20 Gy à l’absence d’irradiation complémentaire.6 Après un suivi médian de 45 mois, le taux de SSP à cinq ans était de 86,1 % sans irradiation, significativement inférieur aux 93,4 % du groupe standard, sans différence de survie globale.
Une excellente réponse métabolique précoce ne permet donc pas d’identifier, parmi les LH localisés favorables, un sous-groupe de patients chez qui on pourrait à coup sûr se passer de la RTE sans préjudice pour le contrôle de la maladie.
Stades localisés défavorables : chimiothérapie intensive
L’essai HD17 a évalué la possibilité d’omettre la radiothérapie en cas de réponse métabolique complète à une chimiothérapie de type « 2 + 2 » (2 BEAesc* puis 2 ABVD).7 Dans le groupe standard, les quatre cures ont été suivies d’une IFRT à la dose de 30 Gy, sans tenir compte de la réponse métabolique. Dans le groupe expérimental, guidé par les résultats de la TEP après quatre cycles (TEP4), seuls les patients qui n’étaient pas en réponse métabolique complète (TEP4+), soit 10 % des patients, ont reçu une irradiation, de type INRT à la dose de 30 Gy. Les autres patients ne recevaient pas d’irradiation complémentaire.
Avec un suivi médian de 46,2 mois, le taux de SSP à cinq ans était de 97,3 % dans le bras standard et de 95,1 % dans le bras TEP-guidé. La différence de 2,2 % étant inférieure au seuil de non-infériorité de 8 %, l’étude a démontré pour la première fois que l’omission de la RTE est possible pour les LH localisés défavorables lorsque la TEP4 est négative après chimiothérapie 2 + 2.
Dans le groupe défavorable de l’essai H10,5 les patients avec une TEP2 négative ont été randomisés entre cycles d’ABVD-INRT (traitement standard) et six cycles d’ABVD. Après un suivi médian de cinq ans, le taux de SSP a été de 92,1 % dans le groupe standard contre 89,6 % dans le groupe ABVD seul, soit une différence trop importante pour que l’on puisse conclure à la non-infériorité du traitement sans irradiation.
L’utilisation d’un traitement selon l’essai HD17 permet donc, dans les stades localisés défavorables, d’éviter la radiothérapie en cas de réponse métabolique après quatre cycles, au prix d’une chimiothérapie plus intensive que l’ABVD.
Avec un suivi médian de 46,2 mois, le taux de SSP à cinq ans était de 97,3 % dans le bras standard et de 95,1 % dans le bras TEP-guidé. La différence de 2,2 % étant inférieure au seuil de non-infériorité de 8 %, l’étude a démontré pour la première fois que l’omission de la RTE est possible pour les LH localisés défavorables lorsque la TEP4 est négative après chimiothérapie 2 + 2.
Dans le groupe défavorable de l’essai H10,5 les patients avec une TEP2 négative ont été randomisés entre cycles d’ABVD-INRT (traitement standard) et six cycles d’ABVD. Après un suivi médian de cinq ans, le taux de SSP a été de 92,1 % dans le groupe standard contre 89,6 % dans le groupe ABVD seul, soit une différence trop importante pour que l’on puisse conclure à la non-infériorité du traitement sans irradiation.
L’utilisation d’un traitement selon l’essai HD17 permet donc, dans les stades localisés défavorables, d’éviter la radiothérapie en cas de réponse métabolique après quatre cycles, au prix d’une chimiothérapie plus intensive que l’ABVD.
Patients avec TEP intermédiaire positive (TEP+) : escalade thérapeutique
Il importe de souligner que les critères de positivité retenus pour la TEP intermédiaire, assez homogènes selon les études, sont très conservateurs, une fixation résiduelle supérieure à celle du médiastin (score 3 de Deauville) suffisant à la faire considérer comme positive.
Dans l’étude RAPID, évoquée ci-avant, 25 % des patients gardaient, après trois cycles ABVD, une TEP positive (score > 2). Le défaut de réponse métabolique était associé à un pronostic péjoratif : le taux de SSP chez ces 145 patients était de 87,6 % (contre 92,3 % et 88,6 % respectivement chez les patients à TEP3 négative irradiés et non irradiés) avec en particulier 15 cas de progression de la maladie, dont 5 décès en rapport avec cette progression.4
L’un des objectifs de l’essai européen H10 était de comparer, chez les patients TEP2+ après deux cycles d’ABVD, deux stratégies : poursuite du traitement par deux cycles d’ABVD suivis d’INRT ou intensification par deux cycles de BEAesc suivis d’INRT.5 Sur 361 patients TEP2+, les taux de SSP à cinq ans étaient respectivement de 77,4 % et de 90,6 % (p = 0,02), nettement en faveur du traitement intensifié.
En cas de TEP2+ après deux cures d’ABVD dans le cadre de lymphome de Hodgkin localisé, il est proposé une escalade thérapeutique par deux cures de BEAesc suivies d’une radiothérapie.
Dans l’étude RAPID, évoquée ci-avant, 25 % des patients gardaient, après trois cycles ABVD, une TEP positive (score > 2). Le défaut de réponse métabolique était associé à un pronostic péjoratif : le taux de SSP chez ces 145 patients était de 87,6 % (contre 92,3 % et 88,6 % respectivement chez les patients à TEP3 négative irradiés et non irradiés) avec en particulier 15 cas de progression de la maladie, dont 5 décès en rapport avec cette progression.4
L’un des objectifs de l’essai européen H10 était de comparer, chez les patients TEP2+ après deux cycles d’ABVD, deux stratégies : poursuite du traitement par deux cycles d’ABVD suivis d’INRT ou intensification par deux cycles de BEAesc suivis d’INRT.5 Sur 361 patients TEP2+, les taux de SSP à cinq ans étaient respectivement de 77,4 % et de 90,6 % (p = 0,02), nettement en faveur du traitement intensifié.
En cas de TEP2+ après deux cures d’ABVD dans le cadre de lymphome de Hodgkin localisé, il est proposé une escalade thérapeutique par deux cures de BEAesc suivies d’une radiothérapie.
LH localisé sous-diaphragmatique : pas de consensus
Pour les formes localisées sous-diaphragmatiques, qui représentent moins de 5 % des formes de l’adulte, il n’y a pas de consensus pour définir clairement des groupes pronostiques. D’après une série rétrospective multicentrique française, le traitement combiné par quatre cycles d’ABVD suivis de RTE, calqué sur le modèle des formes sus-diaphragmatiques, est recommandé et s’est révélé, pour les patients ayant bénéficié de TEP, globalement comparable à celui de formes sus-diaphragmatiques.8
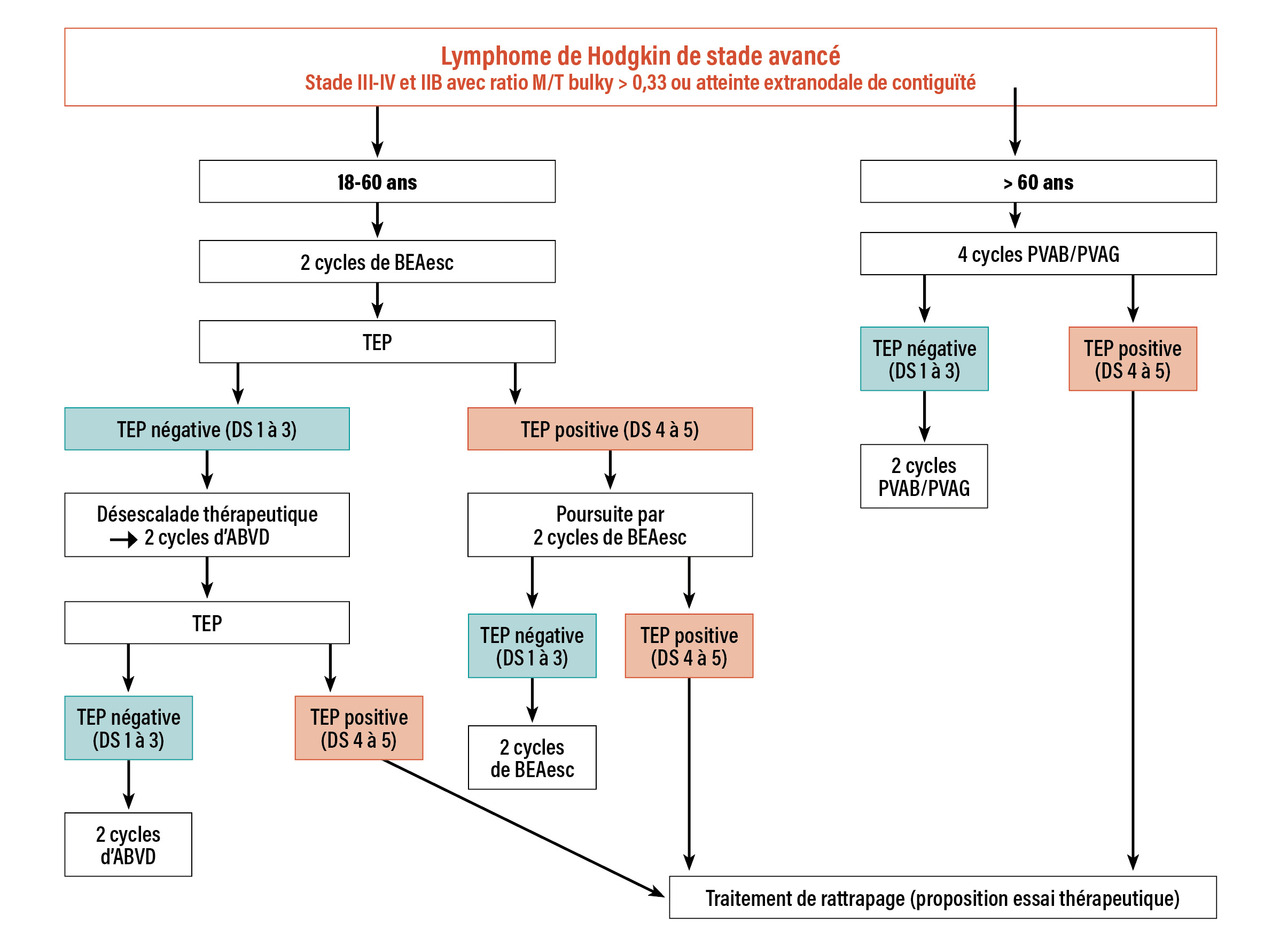
Stades avancés (18-60 ans) : des stratégies thérapeutiques guidées par la TEP
Un avant et un après l’ère de la TEP
L’ABVD (tableau ) est resté le standard de traitement des formes avancées pendant plusieurs décennies, mais associé à un risque d’échec de près de 25 %.
De multiples schémas alternatifs ont été proposés et testés. Seul le BEACOPP (développé par le GHSG) est apparu être une alternative crédible à l’ABVD. La posologie des sept molécules a été déclinée sous deux versions : « standard » (BEAs) et « escaladée » (ou renforcée) [BEAesc]. L’amélioration du contrôle tumoral obtenue grâce au BEAesc a été confirmée de façon concordante par trois études9-11 qui n’ont cependant pas mis en évidence d’amélioration de la survie globale (SG) par rapport à l’ABVD, probablement en raison de l’efficacité du traitement de rattrapage après ABVD. Un bénéfice de SG de faible amplitude, mais significatif, en faveur du BEAesc par comparaison à l’ABVD a été montré par une étude regroupant 1 227 patients issus de quatre essais : à sept ans, 87,7 % versus 84,3 %.10 Le choix entre ces deux régimes de chimiothérapie peut néanmoins se discuter sur des critères individuels (sexe, âge, comorbidités, facteurs de risque liés au LH). En effet, la toxicité hématologique du BEAesc est supérieure à celle de l’ABVD, avec notamment davantage de neutropénies de grade III-IV et d’infections sévères. La toxicité à long terme du BEAesc est également supérieure à celle de l’ABVD.
En réalité, à l’ère de la TEP, le meilleur moyen d’optimiser le rapport efficacité-toxicité est de mieux sélectionner les patients relevant d’un traitement plus intense, grâce au développement de stratégies guidées par la réponse métabolique en cours de traitement.
De multiples schémas alternatifs ont été proposés et testés. Seul le BEACOPP (développé par le GHSG) est apparu être une alternative crédible à l’ABVD. La posologie des sept molécules a été déclinée sous deux versions : « standard » (BEAs) et « escaladée » (ou renforcée) [BEAesc]. L’amélioration du contrôle tumoral obtenue grâce au BEAesc a été confirmée de façon concordante par trois études9-11 qui n’ont cependant pas mis en évidence d’amélioration de la survie globale (SG) par rapport à l’ABVD, probablement en raison de l’efficacité du traitement de rattrapage après ABVD. Un bénéfice de SG de faible amplitude, mais significatif, en faveur du BEAesc par comparaison à l’ABVD a été montré par une étude regroupant 1 227 patients issus de quatre essais : à sept ans, 87,7 % versus 84,3 %.10 Le choix entre ces deux régimes de chimiothérapie peut néanmoins se discuter sur des critères individuels (sexe, âge, comorbidités, facteurs de risque liés au LH). En effet, la toxicité hématologique du BEAesc est supérieure à celle de l’ABVD, avec notamment davantage de neutropénies de grade III-IV et d’infections sévères. La toxicité à long terme du BEAesc est également supérieure à celle de l’ABVD.
En réalité, à l’ère de la TEP, le meilleur moyen d’optimiser le rapport efficacité-toxicité est de mieux sélectionner les patients relevant d’un traitement plus intense, grâce au développement de stratégies guidées par la réponse métabolique en cours de traitement.
La TEP pour évaluer la chimiosensibilité
En permettant d’évaluer la chimiosensibilité précoce, facteur pronostique majeur, la TEP joue désormais un rôle essentiel dans l’identification des patients relevant d’un traitement intensif (voir le focus « Tomographie par émission de positons (TEP), centrale dans le bilan et l’évaluation », p.621 ). Des stratégies thérapeutiques adaptées au risque selon le résultat de la TEP après deux cycles (TEP2) ont été développées et validées comme le nouveau standard de traitement.
tableau ). Plusieurs études12-14 ont montré un taux de positivité de la TEP après deux cycles se situant entre 16 et 20 %, en particulier l’essai britannique RATHL12 ayant inclus plus de 1 000 patients. Ceux qui avaient une TEP2 positive après deux cycles d’ABVD (n = 172) ont reçu trois cycles de BEAesc ou quatre cycles de BEACOPP espacés de quatorze jours. Les répondeurs précoces ont poursuivi l’A(B)VD, avec ou sans bléomycine selon une nouvelle randomisation. L’omission de la bléomycine dès le troisième cycle a été associée à une diminution de la toxicité pulmonaire, sans perte d’efficacité. Le taux de SSP à cinq ans était, respectivement pour les patients TEP2- et TEP2+, de 86 % versus 68 % et le taux de SG de 97 % versus 88 %.
L’essai randomisé multicentrique de non-infériorité de phase III de la Lymphome Study Association (LYSA) AHL 201115 a inclus 823 patients. La stratégie de traitement standard comportait six cycles de BEAesc, quelle que soit la TEP2. Dans le bras expérimental, les deux cycles initiaux de BEAesc étaient suivis de quatre cycles d’ABVD en cas de TEP2 négative, de quatre cycles de BEAesc en cas de TEP2 positive. En outre, une TEP était réalisée pour tous les patients après quatre cycles, et sa positivité était jugée comme le signe d’un échec thérapeutique. Au total, 87 % des patients ont eu une TEP2 négative. Avec un suivi médian de 50 mois, le taux de SSP à cinq ans était de 86,2 % dans le bras standard versus 85,7 % dans le bras expérimental (p = 0,65). Ces résultats permettent de conclure à la non-infériorité de la stratégie guidée par la TEP, avec une réduction significative de la toxicité. Selon les résultats mis à jour,16 le taux de SSP chez les patients avec TEP4+ était seulement de 47 %, contre 92 % pour les TEP2-/TEP4- et 75 % pour les TEP2+/TEP4-. De même, le taux de survie globale était significativement moins favorable chez les patients avec une TEP4+ : respectivement 92 %, 98 % et 94 % (p = 0,038). De plus, la stratégie guidée par la TEP proposée dans AHL 2011 réduit significativement le risque d’infertilité.17
Le German Hodgkin Study Group a testé, dans l’essai HD1818, la possibilité de réduire le traitement à quatre cycles de BEAesc pour les patients à TEP2-, tandis que les patients avec TEP2+ recevaient au total huit cycles de BEAesc (amendés à 6 cycles après 2011). Dans le groupe TEP2-, 1 005 patients ont été randomisés et la SSP à trois ans était similaire dans les deux bras (4 BEAesc : 95,3 % ; 6-8 BEAesc : 91,7 %), mais la survie globale était supérieure dans le groupe allégé à quatre cycles de BEAesc, en raison d’un nombre plus faible de décès d’origine toxique. Ainsi, la stratégie d’allègement guidée par la TEP permet de limiter le traitement d’induction à quatre cycles de BEAesc en cas de TEP2 négative selon les critères définis dans cet essai.
Sans qu’il soit possible de trancher définitivement entre les schémas thérapeutiques commençant par l’ABVD ou par le BEAesc, il est désormais incontournable de mettre en œuvre une stratégie de traitement guidée par la TEP. Avec les réserves qui s’imposent pour des comparaisons directes entre les études, la stratégie débutant par le BEAesc semble améliorer le contrôle tumoral non seulement chez les patients TEP2+ mais aussi chez les TEP2-. En comparant les différents types de stratégie de première ligne sur les plans médico-économique et coût-efficacité, la stratégie TEP-guidée de désescalade calquée sur AHL 2011 serait à privilégier.19
Stratégie d’escalade pour les mauvais répondeurs
La stratégie dite d’escalade consiste à renforcer le traitement pour les patients « mauvais répondeurs » après deux cycles (score de Deauville supérieur à 3), en prenant le relais de l’ABVD par le BEAesc (Stratégie de désescalade pour limiter les effets indésirables
L’analyse d’un grand nombre de séries a montré que la valeur prédictive négative (VPN) de la TEP à deux cycles en matière de SSP est nettement meilleure que sa valeur prédictive positive, et c’est cette VPN élevée visant à minimiser le risque d’allègement inapproprié du traitement initial qui a prévalu pour définir une désescalade thérapeutique chez les répondeurs métaboliques précoces après deux cycles de BEAesc initiaux.L’essai randomisé multicentrique de non-infériorité de phase III de la Lymphome Study Association (LYSA) AHL 201115 a inclus 823 patients. La stratégie de traitement standard comportait six cycles de BEAesc, quelle que soit la TEP2. Dans le bras expérimental, les deux cycles initiaux de BEAesc étaient suivis de quatre cycles d’ABVD en cas de TEP2 négative, de quatre cycles de BEAesc en cas de TEP2 positive. En outre, une TEP était réalisée pour tous les patients après quatre cycles, et sa positivité était jugée comme le signe d’un échec thérapeutique. Au total, 87 % des patients ont eu une TEP2 négative. Avec un suivi médian de 50 mois, le taux de SSP à cinq ans était de 86,2 % dans le bras standard versus 85,7 % dans le bras expérimental (p = 0,65). Ces résultats permettent de conclure à la non-infériorité de la stratégie guidée par la TEP, avec une réduction significative de la toxicité. Selon les résultats mis à jour,16 le taux de SSP chez les patients avec TEP4+ était seulement de 47 %, contre 92 % pour les TEP2-/TEP4- et 75 % pour les TEP2+/TEP4-. De même, le taux de survie globale était significativement moins favorable chez les patients avec une TEP4+ : respectivement 92 %, 98 % et 94 % (p = 0,038). De plus, la stratégie guidée par la TEP proposée dans AHL 2011 réduit significativement le risque d’infertilité.17
Le German Hodgkin Study Group a testé, dans l’essai HD1818, la possibilité de réduire le traitement à quatre cycles de BEAesc pour les patients à TEP2-, tandis que les patients avec TEP2+ recevaient au total huit cycles de BEAesc (amendés à 6 cycles après 2011). Dans le groupe TEP2-, 1 005 patients ont été randomisés et la SSP à trois ans était similaire dans les deux bras (4 BEAesc : 95,3 % ; 6-8 BEAesc : 91,7 %), mais la survie globale était supérieure dans le groupe allégé à quatre cycles de BEAesc, en raison d’un nombre plus faible de décès d’origine toxique. Ainsi, la stratégie d’allègement guidée par la TEP permet de limiter le traitement d’induction à quatre cycles de BEAesc en cas de TEP2 négative selon les critères définis dans cet essai.
Sans qu’il soit possible de trancher définitivement entre les schémas thérapeutiques commençant par l’ABVD ou par le BEAesc, il est désormais incontournable de mettre en œuvre une stratégie de traitement guidée par la TEP. Avec les réserves qui s’imposent pour des comparaisons directes entre les études, la stratégie débutant par le BEAesc semble améliorer le contrôle tumoral non seulement chez les patients TEP2+ mais aussi chez les TEP2-. En comparant les différents types de stratégie de première ligne sur les plans médico-économique et coût-efficacité, la stratégie TEP-guidée de désescalade calquée sur AHL 2011 serait à privilégier.19
Stades IIB de haut risque : pas d’essai spécifique
Le LH de stade IIB de haut risque est défini par un rapport MT (masse médiastinale/diamètre thoracique) supérieur à 0,33 (groupe allemand) ou supérieur à 0,35 (groupe EORTC-LYSA) et/ou par une atteinte extraganglionnaire de contiguïté. Sa prise en charge est identique à celle des stades avancés pour les équipes allemandes et dans l’essai du groupe coopérateur LYSA AHL 2011,15 tandis qu’elle est identique à celle des stades localisés défavorables dans l’étude internationale européenne H105 et dans le reste du monde. Alors qu’aucun essai ne s’est adressé spécifiquement à cette forme de LH, l’analyse regroupée des stades IIB dans les essais H10 et d’AHL 201120 ne montre pas de différence de SSP entre les deux schémas. Elle démontre, en revanche, la valeur pronostique péjorative indépendante pour la SSP de la TEP2 positive (HR = 6,26) mais aussi du volume métabolique préthérapeutique total initial (TMTV0), avec un seuil à 155 cm3 (HR = 3,37). Par analogie avec les résultats de l’essai AHL 2011, le meilleur contrôle tumoral obtenu par BEAesc chez les patients ayant un stade IIB et des facteurs pronostiques défavorables (TMTV0 supérieur à 155 cm3) plaide en faveur d’une attitude similaire. Cela permet également d’éviter la radiothérapie.Intégration de nouvelles molécules en première ligne
Plusieurs types d’anticorps monoclonaux
Plusieurs cibles thérapeutiques d’intérêt ont été identifiées et ont conduit au développement de traitements ciblés innovants.
Parmi ces molécules, le brentuximab vedotin (BV) a été développé pour cibler la cellule tumorale via son récepteur membranaire CD30, hautement exprimé par la cellule tumorale du LH classique. C’est un anticorps anti-CD30 couplé à un agent de chimiothérapie antimicrotubulaire, à savoir la monométhylauristatine E (vcMMAE, vedotin) aboutissant à la mort cellulaire ciblée des cellules exprimant le CD30.
Par ailleurs, le ciblage du micro-environnement a été rendu possible par les inhibiteurs de PD1 dont les chefs de file sont le nivolumab et le pembrolizumab. Ces anticorps bloquent l’axe PD1-PDL1 et restaurent ainsi la cytotoxicité des cellules immunitaires effectrices. Dans le LH, il y a une expression très élevée de PDL1,21 si bien qu’il a été démontré une efficacité spectaculaire de ces anticorps monoclonaux en situation de rechute après de nombreuses lignes et avec un excellent profil de tolérance.
Parmi ces molécules, le brentuximab vedotin (BV) a été développé pour cibler la cellule tumorale via son récepteur membranaire CD30, hautement exprimé par la cellule tumorale du LH classique. C’est un anticorps anti-CD30 couplé à un agent de chimiothérapie antimicrotubulaire, à savoir la monométhylauristatine E (vcMMAE, vedotin) aboutissant à la mort cellulaire ciblée des cellules exprimant le CD30.
Par ailleurs, le ciblage du micro-environnement a été rendu possible par les inhibiteurs de PD1 dont les chefs de file sont le nivolumab et le pembrolizumab. Ces anticorps bloquent l’axe PD1-PDL1 et restaurent ainsi la cytotoxicité des cellules immunitaires effectrices. Dans le LH, il y a une expression très élevée de PDL1,21 si bien qu’il a été démontré une efficacité spectaculaire de ces anticorps monoclonaux en situation de rechute après de nombreuses lignes et avec un excellent profil de tolérance.
Brentuximab vedotin : efficace au prix d’une toxicité accrue
Plusieurs essais thérapeutiques ont testé le BV en polychimiothérapie de première ligne, comme élément d’un schéma dérivé de l’ABVD ou du BEAesc, modifiés en raison de l’incompatibilité du BV avec la bléomycine.
Dans les formes de stade localisé, l’étude randomisée multicentrique européenne BREACH a comparé le taux de réponse métabolique après deux cycles de BV-AVD ou d’ABVD standard.22 Il est plus élevé dans le bras BV-AVD (82 % versus 75 %), mais au prix d’un excès de toxicité (grade 3-4 : 74 % versus 56 %), surtout hématologique.
Dans les formes avancées, l’étude multicentrique randomisée ECHELON-1 a comparé, pour 1 334 patients, six cycles de BV-AVD à six cycles d’ABVD et montré une amélioration significative de la SSP après BV-AVD, confirmée à cinq ans (82 % versus 75 %), au prix d’une nette majoration de la toxicité hématologique et neurologique. Tout récemment, la mise à jour à 73 mois a été présentée (Ansell SM, et al., abstr. 7503, ASCO meeting, 2022), et le résultat principal est l’impact positif sur la SG, qui apparaît supérieure dans le bras utilisant le BV : 93,9 % contre 89,4 %. Alors que jusqu’à présent, le schéma BV-AVD n’était pas une référence de première ligne en Europe, notamment en France où le BV n’est pas remboursé dans cette indication, que ce soit dans les stades localisés ou avancés, cet avantage en SG versus l’ABVD permet de se poser à nouveau la question de l’opportunité de ce schéma pour les stades avancés. Cependant, l’ABVD n’est plus un traitement standard puisque les stratégies guidées par la TEP intensifient les patients TEP2+ par BEAesc (essai RATHL), et aucun essai n’a fait la comparaison avec le standard européen débutant le traitement par BEAesc, suggérant que cet avantage en SG vis-à-vis de l’ABVD ne devrait pas modifier l’absence de remboursement de BV-AVD.
Par ailleurs, la modification du BEACOPP avec introduction du BV a été proposée par le groupe allemand selon deux variantes : BrECAPP (brentuximab vedotin, étoposide, cyclophosphamide, doxorubicine [Adriamycine], procarbazine, prednisone) et BrECADD (brentuximab vedotin, étoposide, cyclophosphamide, doxorubicine [Adriamycine], dacarbazine et dexaméthasone). Ces deux variantes du BEAesc semblent efficaces en première ligne, avec un profil de tolérance hématologique plus favorable pour le BrECADD (tableau A ), qui fait l’objet d’une comparaison randomisée avec le BEAesc (essai HD21) dont les résultats sont attendus.
Dans les formes de stade localisé, l’étude randomisée multicentrique européenne BREACH a comparé le taux de réponse métabolique après deux cycles de BV-AVD ou d’ABVD standard.22 Il est plus élevé dans le bras BV-AVD (82 % versus 75 %), mais au prix d’un excès de toxicité (grade 3-4 : 74 % versus 56 %), surtout hématologique.
Dans les formes avancées, l’étude multicentrique randomisée ECHELON-1 a comparé, pour 1 334 patients, six cycles de BV-AVD à six cycles d’ABVD et montré une amélioration significative de la SSP après BV-AVD, confirmée à cinq ans (82 % versus 75 %), au prix d’une nette majoration de la toxicité hématologique et neurologique. Tout récemment, la mise à jour à 73 mois a été présentée (Ansell SM, et al., abstr. 7503, ASCO meeting, 2022), et le résultat principal est l’impact positif sur la SG, qui apparaît supérieure dans le bras utilisant le BV : 93,9 % contre 89,4 %. Alors que jusqu’à présent, le schéma BV-AVD n’était pas une référence de première ligne en Europe, notamment en France où le BV n’est pas remboursé dans cette indication, que ce soit dans les stades localisés ou avancés, cet avantage en SG versus l’ABVD permet de se poser à nouveau la question de l’opportunité de ce schéma pour les stades avancés. Cependant, l’ABVD n’est plus un traitement standard puisque les stratégies guidées par la TEP intensifient les patients TEP2+ par BEAesc (essai RATHL), et aucun essai n’a fait la comparaison avec le standard européen débutant le traitement par BEAesc, suggérant que cet avantage en SG vis-à-vis de l’ABVD ne devrait pas modifier l’absence de remboursement de BV-AVD.
Par ailleurs, la modification du BEACOPP avec introduction du BV a été proposée par le groupe allemand selon deux variantes : BrECAPP (brentuximab vedotin, étoposide, cyclophosphamide, doxorubicine [Adriamycine], procarbazine, prednisone) et BrECADD (brentuximab vedotin, étoposide, cyclophosphamide, doxorubicine [Adriamycine], dacarbazine et dexaméthasone). Ces deux variantes du BEAesc semblent efficaces en première ligne, avec un profil de tolérance hématologique plus favorable pour le BrECADD (
Anti-PD1 : une place en première ligne à définir
Les anticorps monoclonaux anti-PD1 ont également montré une efficacité spectaculaire chez les patients en rechute et ont logiquement été testés en première ligne. Pour les patients de stade localisé défavorable, l’association de nivolumab et d’AVD, de façon séquentielle ou simultanée, a permis d’obtenir une rémission complète métabolique chez respectivement 94 % et 90 % des patients.23 Dans les stades avancés, une séquence comportant le nivolumab en monothérapie (4 cycles) puis une combinaison nivolumab-AVD (12 doses) a été évaluée en première ligne chez 51 patients.24 Le taux de réponse complète était de 80 % selon les investigateurs et le taux de SSP à neuf mois de 92 %.
Ces résultats restent préliminaires et la place de ces nouvelles molécules en première ligne reste à définir.
Ces résultats restent préliminaires et la place de ces nouvelles molécules en première ligne reste à définir.
Excès de toxicité des schémas habituels chez les sujets âgés de plus de 60 ans
La toxicité des traitements est élevée dans cette tranche d’âge, avec un taux de décès d’origine toxique allant de 5 à 9 %. L’incidence des infections de grade 3-4 et d’une toxicité pulmonaire de la bléomycine est particulièrement élevée. Du fait de cet excès de toxicité, les schémas habituels ABVD ou BEACOPP doivent être reconsidérés dans cette population fragile. Des alternatives à l’ABVD ont ainsi été développées (tableau B ).
Le schéma PVAG (prednisone, vinblastine, doxorubicine, gemcitabine) semble avoir un profil bénéfices-risques acceptable.25 La toxicité pulmonaire est nettement inférieure à celle de l’ABVD, mais le taux d’infection reste important. Le groupe LYSA a conduit une étude de phase II dans les formes avancées chez les sujets de plus de 60 ans avec l’association PVAB (prednisone, vinblastine, doxorubicine, bendamustine), précédée d’une évaluation nutritionnelle après 70 ans (Ghesquières H, et al., abstract 2832, ASH meeting, 2019). Un taux de réponse complète (RC) métabolique de 78 % a été obtenu, au prix d’une toxicité un peu inférieure à celle des études précédentes, mais restant un point de vigilance.
Les nouvelles molécules sont particulièrement attractives chez les sujets âgés. Dans une étude de phase II, une séquence comportant deux doses de BV puis quatre cycles d’AVD puis quatre doses de BV26 a permis d’atteindre un taux de SSP à deux ans de 84 % tout en limitant la toxicité (8 % d’infections de grade 3).
Pour les patients fragiles, inéligibles à une chimiothérapie cytotoxique, le nivolumab (anti-PD1) en monothérapie, renforcé par la vinblastine en l’absence de réponse métabolique complète après six injections, est en cours d’évaluation par le groupe LYSA.
Le schéma PVAG (prednisone, vinblastine, doxorubicine, gemcitabine) semble avoir un profil bénéfices-risques acceptable.25 La toxicité pulmonaire est nettement inférieure à celle de l’ABVD, mais le taux d’infection reste important. Le groupe LYSA a conduit une étude de phase II dans les formes avancées chez les sujets de plus de 60 ans avec l’association PVAB (prednisone, vinblastine, doxorubicine, bendamustine), précédée d’une évaluation nutritionnelle après 70 ans (Ghesquières H, et al., abstract 2832, ASH meeting, 2019). Un taux de réponse complète (RC) métabolique de 78 % a été obtenu, au prix d’une toxicité un peu inférieure à celle des études précédentes, mais restant un point de vigilance.
Les nouvelles molécules sont particulièrement attractives chez les sujets âgés. Dans une étude de phase II, une séquence comportant deux doses de BV puis quatre cycles d’AVD puis quatre doses de BV26 a permis d’atteindre un taux de SSP à deux ans de 84 % tout en limitant la toxicité (8 % d’infections de grade 3).
Pour les patients fragiles, inéligibles à une chimiothérapie cytotoxique, le nivolumab (anti-PD1) en monothérapie, renforcé par la vinblastine en l’absence de réponse métabolique complète après six injections, est en cours d’évaluation par le groupe LYSA.
Compromis entre le contrôle tumoral et les effets indésirables
La prise en charge en première ligne du LH, désormais guidée par la TEP, ne cesse de s’améliorer pour tendre vers des stratégies adaptées à une stratification pronostique précise, et trouver peu à peu le meilleur compromis entre le contrôle tumoral et les effets indésirables à court et long termes. Des propositions d’algorithmes de prise en charge sont présentées dans les figures 1 et 2 . Au-delà des bénéfices de la TEP pour la prise en charge des patients, de nouvelles molécules (BV et anti-PD1) ont permis d’améliorer le contrôle de la maladie, notamment dans les situations d’échec. Leur place exacte en première ligne reste à définir de façon consensuelle. Enfin, de nouveaux outils, tels que le dosage de l’ADN tumoral circulant dans le plasma, pourraient permettre d’adapter les stratégies thérapeutiques de façon encore plus précise, tout en permettant de rechercher des mutations potentiellement actionnables pour les patients en réponse insuffisante.
* BEAesc est la forme « renforcée » de BEACOPP (bléomycine, étoposide, doxorubicine, cyclophosphamide, vincristine [Oncovin], procarbazine, prednisone).
Références
1. Gallamini A, Hutchings M, Rigacci L, Specht L, Merli F, Hansen M, et al. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin’s lymphoma: A report from a joint Italian-Danish study. J Clin Oncol 2007;25(24):3746‑52.
2. Barrington SF, Mikhaeel NG, Kostakoglu L, Meignan M, Hutchings M, Müeller SP, et al. Role of imaging in the staging and response assessment of lymphoma: Consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32(27):3048‑58.
3. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International prognostic factors project on advanced Hodgkin’s disease. N Engl J Med 1998;339(21):1506‑14.
4. Radford J, Illidge T, Counsell N, Hancock B, Pettengell R, Johnson P, et al. Results of a trial of PET-directed therapy for early-stage Hodgkin’s lymphoma. N Engl J Med 2015;372(17):1598‑607.
5. André MPE, Girinsky T, Federico M, Reman O, Fortpied C, Gotti M, et al. Early positron emission tomography response-adapted treatment in stage I and II Hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol Off J Am Soc Clin Oncol 2017;35(16):1786‑94.
6. Fuchs M, Goergen H, Kobe C, Kuhnert G, Lohri A, Greil R, et al. Positron emission tomography-guided treatment in early-stage favorable Hodgkin lymphoma: Final results of the international, randomized phase III HD16 trial by the German Hodgkin Study Group. J Clin Oncol Off J Am Soc Clin Oncol 2019;37(31):2835‑45.
7. Borchmann P, Plütschow A, Kobe C, Greil R, Meissner J, Topp MS, et al. PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17): A multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021;22(2):223‑34.
8. Rossi C, Mounier M, Brice P, Safar V, Nicolas-Virelizier E, Rey P, et al. Infradiaphragmatic Hodgkin lymphoma: A large series of patients staged with PET-CT. Oncotarget 2017;8(49):85110‑9.
9. Carde P, Karrasch M, Fortpied C, Brice P, Khaled H, Casasnovas O, et al. Eight cycles of ABVD versus four cycles of BEACOPP escalated plus four cycles of BEACOPP baseline in stage III to IV, International Prognostic Score ≥ 3, high-risk Hodgkin lymphoma: First results of the Phase III EORTC 20012 Intergroup Trial. J Clin Oncol 2016;34(17):2028‑36.
10. André MPE, Carde P, Viviani S, Bellei M, Fortpied C, Hutchings M, et al. Long-term overall survival and toxicities of ABVD vs BEACOPP in advanced Hodgkin lymphoma: A pooled analysis of four randomized trials. Cancer Med 2020;9(18):6565‑75.
11. Merli F, Luminari S, Gobbi PG, Cascavilla N, Mammi C, Ilariucci F, et al. Long-term results of the HD2000 trial comparing ABVD versus BEACOPP versus COPP-EBV-CAD in untreated patients with advanced Hodgkin lymphoma: A study by fondazione Italiana Linfomi. J Clin Oncol 2016;34(11):1175‑81.
12. Johnson P, Federico M, Kirkwood A, Fosså A, Berkahn L, Carella A, et al. Adapted treatment guided by interim PET-CT Scan in advanced Hodgkin’s lymphoma. N Engl J Med2016;374(25):2419‑29.
13. Press OW, Li H, Schöder H, Straus DJ, Moskowitz CH, LeBlanc M, et al. US intergroup trial of response-adapted therapy for stage III to IV Hodgkin lymphoma using early interim fluorodeoxyglucose-positron emission tomography imaging: Southwest Oncology Group S0816. J Clin Oncol Off J Am Soc Clin Oncol 2016;34(17):2020‑7.
14. Gallamini A, Tarella C, Viviani S, Rossi A, Patti C, Mulé A, et al. Early chemotherapy intensification with escalated BEACOPP in patients with advanced-stage Hodgkin lymphoma with a positive interim positron emission tomography/computed tomography scan after two ABVD cycles: Long-term results of the GITIL/FIL HD 0607 trial. J Clin Oncol 2018;36(5):454‑62.
15. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): A randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20(2):202‑15.
16. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. Positron emission tomography-driven strategy in advanced Hodgkin lymphoma: Prolonged follow-up of the AHL2011 phase III Lymphoma Study Association Study. J Clin Oncol Off J Am Soc Clin Oncol 2022;40(10):1091‑101.
17. Demeestere I, Racape J, Dechene J, Dupuis J, Morschhauser F, De Wilde V, et al. Gonadal function recovery in patients with advanced Hodgkin lymphoma treated with a PET-adapted regimen: Prospective analysis of a randomized phase III trial (AHL2011). J Clin Oncol Off J Am Soc Clin Oncol 2021;JCO2100068.
18. Kreissl S, Goergen H, Buehnen I, Kobe C, Moccia A, Greil R, et al. PET-guided eBEACOPP treatment of advanced-stage Hodgkin lymphoma (HD18): Follow-up analysis of an international, open-label, randomised, phase 3 trial. Lancet Haematol 2021;8(6):e398‑409.
19. Vijenthira A, Chan K, Cheung MC, Prica A. Cost-effectiveness of first-line treatment options for patients with advanced-stage Hodgkin lymphoma: A modelling study. Lancet Haematol 2020;7(2):e146‑56.
20. Rossi C, André M, Joubert C, Fortpied C, Brice P, Deau-Fisher B, et al. Stage IIb high risk Hodgkin lymphoma treated in the H10 and AHL2011 trials: Similar efficacy of both strategies and prognostic impact of baseline Tmtv and PET2 response. Blood 2019;134(Supplement1):128.
21. Roemer mgM, Advani RH, Ligon AH, Natkunam Y, Redd RA, Homer H, et al. PD-L1 and PD-L2 genetic alterations define classical Hodgkin lymphoma and predict outcome. J Clin Oncol Off J Am Soc Clin Oncol 2016;34(23):2690‑7.
22. Fornecker LM, Lazarovici J, Aurer I, Casasnovas RO, Gac AC, Bonnet C, et al. Brentuximab vedotin plus AVD for first-line treatment of early-stage unfavorable Hodgkin lymphoma (BREACH): A multicenter, open-label, randomized, phase II trial. J Clin Oncol Off J Am Soc Clin Oncol 2022;JCO2101281.
23. Connors JM, Jurczak W, Straus DJ, Ansell SM, Kim WS, Gallamini A, et al. Brentuximab vedotin with chemotherapy for stage III or IV Hodgkin’s lymphoma. N Engl J Med 2018;378(4):331‑44.
24. Bröckelmann PJ, Goergen H, Keller U, Meissner J, Ordemann R, Halbsguth TV, et al. Efficacy of nivolumab and AVD in early-stage unfavorable classic Hodgkin lymphoma: The randomized phase 2 German Hodgkin Study Group NIVAHL trial. JAMA Oncol 2020;6(6):872‑80.
25. Böll B, Bredenfeld H, Görgen H, Halbsguth T, Eich HT, Soekler M, et al. Phase 2 study of PVAG (prednisone, vinblastine, doxorubicin, gemcitabine) in elderly patients with early unfavorable or advanced stage Hodgkin lymphoma. Blood 2011;118(24):6292‑8.
2. Barrington SF, Mikhaeel NG, Kostakoglu L, Meignan M, Hutchings M, Müeller SP, et al. Role of imaging in the staging and response assessment of lymphoma: Consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32(27):3048‑58.
3. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International prognostic factors project on advanced Hodgkin’s disease. N Engl J Med 1998;339(21):1506‑14.
4. Radford J, Illidge T, Counsell N, Hancock B, Pettengell R, Johnson P, et al. Results of a trial of PET-directed therapy for early-stage Hodgkin’s lymphoma. N Engl J Med 2015;372(17):1598‑607.
5. André MPE, Girinsky T, Federico M, Reman O, Fortpied C, Gotti M, et al. Early positron emission tomography response-adapted treatment in stage I and II Hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol Off J Am Soc Clin Oncol 2017;35(16):1786‑94.
6. Fuchs M, Goergen H, Kobe C, Kuhnert G, Lohri A, Greil R, et al. Positron emission tomography-guided treatment in early-stage favorable Hodgkin lymphoma: Final results of the international, randomized phase III HD16 trial by the German Hodgkin Study Group. J Clin Oncol Off J Am Soc Clin Oncol 2019;37(31):2835‑45.
7. Borchmann P, Plütschow A, Kobe C, Greil R, Meissner J, Topp MS, et al. PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17): A multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021;22(2):223‑34.
8. Rossi C, Mounier M, Brice P, Safar V, Nicolas-Virelizier E, Rey P, et al. Infradiaphragmatic Hodgkin lymphoma: A large series of patients staged with PET-CT. Oncotarget 2017;8(49):85110‑9.
9. Carde P, Karrasch M, Fortpied C, Brice P, Khaled H, Casasnovas O, et al. Eight cycles of ABVD versus four cycles of BEACOPP escalated plus four cycles of BEACOPP baseline in stage III to IV, International Prognostic Score ≥ 3, high-risk Hodgkin lymphoma: First results of the Phase III EORTC 20012 Intergroup Trial. J Clin Oncol 2016;34(17):2028‑36.
10. André MPE, Carde P, Viviani S, Bellei M, Fortpied C, Hutchings M, et al. Long-term overall survival and toxicities of ABVD vs BEACOPP in advanced Hodgkin lymphoma: A pooled analysis of four randomized trials. Cancer Med 2020;9(18):6565‑75.
11. Merli F, Luminari S, Gobbi PG, Cascavilla N, Mammi C, Ilariucci F, et al. Long-term results of the HD2000 trial comparing ABVD versus BEACOPP versus COPP-EBV-CAD in untreated patients with advanced Hodgkin lymphoma: A study by fondazione Italiana Linfomi. J Clin Oncol 2016;34(11):1175‑81.
12. Johnson P, Federico M, Kirkwood A, Fosså A, Berkahn L, Carella A, et al. Adapted treatment guided by interim PET-CT Scan in advanced Hodgkin’s lymphoma. N Engl J Med2016;374(25):2419‑29.
13. Press OW, Li H, Schöder H, Straus DJ, Moskowitz CH, LeBlanc M, et al. US intergroup trial of response-adapted therapy for stage III to IV Hodgkin lymphoma using early interim fluorodeoxyglucose-positron emission tomography imaging: Southwest Oncology Group S0816. J Clin Oncol Off J Am Soc Clin Oncol 2016;34(17):2020‑7.
14. Gallamini A, Tarella C, Viviani S, Rossi A, Patti C, Mulé A, et al. Early chemotherapy intensification with escalated BEACOPP in patients with advanced-stage Hodgkin lymphoma with a positive interim positron emission tomography/computed tomography scan after two ABVD cycles: Long-term results of the GITIL/FIL HD 0607 trial. J Clin Oncol 2018;36(5):454‑62.
15. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): A randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20(2):202‑15.
16. Casasnovas RO, Bouabdallah R, Brice P, Lazarovici J, Ghesquieres H, Stamatoullas A, et al. Positron emission tomography-driven strategy in advanced Hodgkin lymphoma: Prolonged follow-up of the AHL2011 phase III Lymphoma Study Association Study. J Clin Oncol Off J Am Soc Clin Oncol 2022;40(10):1091‑101.
17. Demeestere I, Racape J, Dechene J, Dupuis J, Morschhauser F, De Wilde V, et al. Gonadal function recovery in patients with advanced Hodgkin lymphoma treated with a PET-adapted regimen: Prospective analysis of a randomized phase III trial (AHL2011). J Clin Oncol Off J Am Soc Clin Oncol 2021;JCO2100068.
18. Kreissl S, Goergen H, Buehnen I, Kobe C, Moccia A, Greil R, et al. PET-guided eBEACOPP treatment of advanced-stage Hodgkin lymphoma (HD18): Follow-up analysis of an international, open-label, randomised, phase 3 trial. Lancet Haematol 2021;8(6):e398‑409.
19. Vijenthira A, Chan K, Cheung MC, Prica A. Cost-effectiveness of first-line treatment options for patients with advanced-stage Hodgkin lymphoma: A modelling study. Lancet Haematol 2020;7(2):e146‑56.
20. Rossi C, André M, Joubert C, Fortpied C, Brice P, Deau-Fisher B, et al. Stage IIb high risk Hodgkin lymphoma treated in the H10 and AHL2011 trials: Similar efficacy of both strategies and prognostic impact of baseline Tmtv and PET2 response. Blood 2019;134(Supplement1):128.
21. Roemer mgM, Advani RH, Ligon AH, Natkunam Y, Redd RA, Homer H, et al. PD-L1 and PD-L2 genetic alterations define classical Hodgkin lymphoma and predict outcome. J Clin Oncol Off J Am Soc Clin Oncol 2016;34(23):2690‑7.
22. Fornecker LM, Lazarovici J, Aurer I, Casasnovas RO, Gac AC, Bonnet C, et al. Brentuximab vedotin plus AVD for first-line treatment of early-stage unfavorable Hodgkin lymphoma (BREACH): A multicenter, open-label, randomized, phase II trial. J Clin Oncol Off J Am Soc Clin Oncol 2022;JCO2101281.
23. Connors JM, Jurczak W, Straus DJ, Ansell SM, Kim WS, Gallamini A, et al. Brentuximab vedotin with chemotherapy for stage III or IV Hodgkin’s lymphoma. N Engl J Med 2018;378(4):331‑44.
24. Bröckelmann PJ, Goergen H, Keller U, Meissner J, Ordemann R, Halbsguth TV, et al. Efficacy of nivolumab and AVD in early-stage unfavorable classic Hodgkin lymphoma: The randomized phase 2 German Hodgkin Study Group NIVAHL trial. JAMA Oncol 2020;6(6):872‑80.
25. Böll B, Bredenfeld H, Görgen H, Halbsguth T, Eich HT, Soekler M, et al. Phase 2 study of PVAG (prednisone, vinblastine, doxorubicin, gemcitabine) in elderly patients with early unfavorable or advanced stage Hodgkin lymphoma. Blood 2011;118(24):6292‑8.
Dans cet article
- Stades localisés du sujet jeune (18-60 ans) : guérison neuf fois sur dix
- Stades avancés (18-60 ans) : des stratégies thérapeutiques guidées par la TEP
- Intégration de nouvelles molécules en première ligne
- Excès de toxicité des schémas habituels chez les sujets âgés de plus de 60 ans
- Compromis entre le contrôle tumoral et les effets indésirables