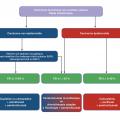
Le cancer du poumon est la première cause de mortalité par cancer, avec plus de 46 000 nouveaux cas en France en 2018 et 33 000 décès.1 Le taux de survie à 5 ans reste un des plus faibles parmi tous les cancers, évalué à 17 %.1 Les cancers bronchopulmonaires non à petites cellules (CBNPC) constituent la forme histologique prédominante tandis que les cancers à petites cellules représentent encore environ 15 % des cancers pulmonaires. Le diagnostic est porté à un stade avancé métastatique dans plus de la moitié des cas, expliquant le pronostic redoutable de la maladie.
Changement de paradigme
À côté du développement des thérapies ciblées transformant l’histoire naturelle de certaines formes de CBNPC dépendant d’une altération génétique spécifique (addiction oncogénique), l’avènement de l’immunothérapie a profondément modifié la prise en charge des carcinomes pulmonaires au cours des cinq dernières années, essentiellement au stade avancé des formes les plus fréquentes de la maladie, non dépendantes d’une addiction oncogénique. L’utilisation des inhibiteurs des points de rétrocontrôle de la réponse immunitaire antitumorale représente un réel changement de paradigme, le traitement ciblant non plus la cellule tumorale mais le système immunitaire de l’hôte, dans l’optique de restaurer une réponse lymphocytaire T cytotoxique spécifique de la tumeur. L’inhibition de l’axe programmed death cell 1 (PD-1)-programmed death-ligand 1 (PD-L1) permet ainsi d’exploiter une réponse immunitaire cellulaire T dans une fraction non négligeable des cancers pulmonaires, riches en mutations du fait de l’exposition chronique au tabagisme, générant ainsi des néo-antigènes susceptibles de déclencher cette réponse immunitaire.
Le développement des anti-PD-L1 a été initialement conduit dans les stades métastatiques des CBNPC sans addiction oncogénique, pour s’élargir ensuite aux stades plus précoces, notamment localement avancés traités par chimioradiothérapie. Le développement dans les cancers à petites cellules est un peu plus récent. Les inhibiteurs du contrôle immunitaire (ICI) utilisés dans le traitement des cancers du poumon en France sont principalement des anti-PD-1 (nivolumab, pembrolizumab, prochainement cémiplimab) ou anti-PD-L1 (durvalumab, atézolizumab) ; l’utilisation de l’ipilimumab (anti-CTLA4) devrait être prochainement possible en combinaison avec le nivolumab et la chimiothérapie. Cet article a pour objectif de préciser les diverses indications des inhibiteurs de contrôle immunitaire dans la stratégie thérapeutique des cancers pulmonaires, leurs limites et leurs perspectives de développement futur.
Le développement des anti-PD-L1 a été initialement conduit dans les stades métastatiques des CBNPC sans addiction oncogénique, pour s’élargir ensuite aux stades plus précoces, notamment localement avancés traités par chimioradiothérapie. Le développement dans les cancers à petites cellules est un peu plus récent. Les inhibiteurs du contrôle immunitaire (ICI) utilisés dans le traitement des cancers du poumon en France sont principalement des anti-PD-1 (nivolumab, pembrolizumab, prochainement cémiplimab) ou anti-PD-L1 (durvalumab, atézolizumab) ; l’utilisation de l’ipilimumab (anti-CTLA4) devrait être prochainement possible en combinaison avec le nivolumab et la chimiothérapie. Cet article a pour objectif de préciser les diverses indications des inhibiteurs de contrôle immunitaire dans la stratégie thérapeutique des cancers pulmonaires, leurs limites et leurs perspectives de développement futur.
Carcinome bronchique non à petites cellules
CBNPC au stade métastatique
Traitement de 2e ligne
Les essais de phase I notamment conduits avec le nivolumab et le pembrolizumab2 ont montré que les anti-PD-1 administrés en monothérapie entraînaient des régressions tumorales chez environ 15 à 20 % des patients atteints de CBNPC avancé prétraités par chimiothérapie, et que la probabilité de réponse était dépendante de la proportion des cellules tumorales exprimant la protéine PD-L1 en immunohistochimie. Le développement initial des anti-PD-L1 a été ensuite effectué en 2e ligne thérapeutique, soit après progression de la maladie après traitement de 1re ligne avec un doublet de chimiothérapie comportant un sel de platine. Le traitement de référence en 2e ligne était le docétaxel en monothérapie, avec des résultats modestes (médiane de survie de l’ordre de 7 à 9 mois).Quatre essais de phase III ont comparé respectivement le nivolumab, l’atézolizumab et le pembrolizumab au docétaxel en situation de 2e ou de 3e ligne chez des patients non sélectionnés sur le niveau d’expression de PD-L1, hormis pour le pembrolizumab (PD-L1 ≥ 1 % des cellules tumorales). Tous ont montré un bénéfice significatif de survie en faveur des inhibiteurs de contrôle immunitaire, essentiellement en raison d’une amélioration de la survie à long terme. Avec un recul de près de 5 ans, ces essais montrent qu’environ 13 à 15 % des patients traités par anti-PD-L1 sont en vie 5 ans après leur entrée dans l’essai ;3 ces patients longs répondeurs ont le plus souvent une qualité de vie préservée et parfois aucune évidence de maladie résiduelle active, permettant d’envisager pour la première fois une optique curative du traitement des CBNPC métastatiques. Parallèlement, le profil de tolérance des anti-PD-L1 s’est avéré plus favorable que celui de la chimiothérapie, avec la survenue d’effets indésirables auto-immuns de grade supérieur ou égal à 3 chez environ 10 % des patients traités, l’apprentissage de la reconnaissance et du traitement de ces effets à médiation auto-immune ayant considérablement amélioré leur prise en charge grâce à des algorithmes spécifiques. Ces essais ont conduit à remplacer le docétaxel par les anti-PD-L1 comme standard de traitement de 2e ligne ; néanmoins, le passage de l’immunothérapie en 1re ligne fait que son utilisation en 2e ligne devient actuellement très marginale.
Ce développement en 2e ligne a également montré que l’expression de PD-L1 par les cellules tumorales constituait le seul biomarqueur prédictif de l’efficacité des anti-PD-L1, avec individuellement une augmentation de la probabilité de réponse au traitement et, au niveau des essais, une corrélation du bénéfice de survie par rapport au docétaxel avec le niveau d’expression de PD-L1.2 L’absence d’expression de PD-L1 concernant environ un tiers des CBNPC n’exclut pas une réponse au traitement mais est associée à un risque de progression précoce plus important, impliquant une évaluation tumorale précoce.
Place de l’immunothérapie dans la stratégie thérapeutique de 1re ligne
Voir laDeux stratégies ont été explorées pour introduire les anti-PD-L1 dans le traitement de 1re ligne des CBNPC métastatiques. La première avait pour but de s’affranchir de la chimiothérapie, nécessitant une sélection des patients ayant une probabilité suffisamment élevée de réponse à l’immunothérapie pour qu’elle s’avère supérieure à un doublet à base de platine constituant le standard thérapeutique. Cette sélection a utilisé deux biomarqueurs : d’une part, le niveau d’expression de PD-L1 par les cellules tumorales, d’autre part, la charge mutationnelle évaluant le nombre de mutations affectant les cellules tumorales. Cette stratégie a utilisé les anti-PD-L1 soit en monothérapie,4 soit en combinaison avec les anti-CTLA4.5 La seconde stratégie a évalué l’association des anti-PD-L1 avec la chimiothérapie cytotoxique, sans nécessité de sélection préalable des patients sur le niveau d’expression de PD-L1.6, 7
Immunothérapie exclusive en 1ère ligne
Plusieurs essais ont comparé les anti-PD-L1 en monothérapie à la chimiothérapie de 1re ligne, sélectionnant les patients sur des niveaux d’expression variables de PD-L1, mettant en évidence le seuil d’expression à plus de 50 % des cellules tumorales comme le meilleur marqueur prédictif d’un bénéfice thérapeutique (v. tableau). Le pembrolizumab (anti-PD-1) est la principale molécule utilisée en monothérapie en 1re ligne après l’essai Keynote 024 montrant un bénéfice de survie à long terme majeur (survie à 5 ans de 31,9 % avec le pembrolizumab contre 16,3 % avec la chimiothérapie).4 Il est ainsi indiqué dans les CBNPC exprimant PD-L1 dans au moins 50 % des cellules tumorales, ce qui représente environ 30 % des patients. Il faut cependant noter que ce seuil élevé d’expression de PD-L1 n’exclut cependant pas la possibilité d’une progression très précoce chez certains patients. Le pembrolizumab s’administre à la dose fixe de 200 mg toutes les 3 semaines. La durée optimale de traitement est encore indéterminée ; le pembrolizumab est généralement prescrit jusqu’à la progression de la maladie ou pour une durée de 2 ans s’il n’existe plus de signes d’activité de la maladie.
L’association anti-CTLA4 et anti-PD-L1 fondée sur la synergie du blocage de ces deux points de rétrocontrôle de la réponse immunitaire a été également testée dans les CBNPC métastatiques.5 L’association ipilimumab-nivolumab s’est avérée supérieure à la chimiothérapie en termes de survie pour les CBNPC exprimant PD-L1 dans au moins 1 % des cellules tumorales ; le design complexe de l’essai n’a pas permis l’enregistrement de cette combinaison en Europe. L’analyse exploratoire de l’effet du traitement pour les patients n’exprimant pas PD-L1 montre en fait un bénéfice de survie d’amplitude comparable, amenant à considérer que le niveau d’expression de PD-L1 ne constitue pas un facteur prédictif du bénéfice de cette association, qui par ailleurs majore significativement le risque de complications auto-immunes par rapport au nivolumab seul.
L’association anti-CTLA4 et anti-PD-L1 fondée sur la synergie du blocage de ces deux points de rétrocontrôle de la réponse immunitaire a été également testée dans les CBNPC métastatiques.5 L’association ipilimumab-nivolumab s’est avérée supérieure à la chimiothérapie en termes de survie pour les CBNPC exprimant PD-L1 dans au moins 1 % des cellules tumorales ; le design complexe de l’essai n’a pas permis l’enregistrement de cette combinaison en Europe. L’analyse exploratoire de l’effet du traitement pour les patients n’exprimant pas PD-L1 montre en fait un bénéfice de survie d’amplitude comparable, amenant à considérer que le niveau d’expression de PD-L1 ne constitue pas un facteur prédictif du bénéfice de cette association, qui par ailleurs majore significativement le risque de complications auto-immunes par rapport au nivolumab seul.
Association chimiothérapie-immunothérapie
Le rationnel de cette association repose sur la capacité de certains agents cytotoxiques de générer une réponse immunitaire souvent initialement absente en déclenchant une mort cellulaire immunogène et en modifiant le micro-environnement immunitaire tumoral au profit des lymphocytes T cytotoxiques. Cette combinaison a pour ambition, en clinique, de diminuer la mortalité précoce liée à la possible progression rapide de la maladie sous immunothérapie seule, notamment en cas de tumeur n’exprimant que peu ou pas PD-L1. De nombreux essais de phase III ont évalué l’addition d’un anti-PD-L1 à un doublet à base de sels de platine sans sélection des patients, souvent de manière distincte dans les cancers épidermoïdes et non épidermoïdes du fait de l’utilisation d’une chimiothérapie différente en fonction du sous-type histologique.6, 7 Ces essais ont globalement montré une amélioration importante de la survie sans progression et de la survie globale par rapport à la chimiothérapie seule, indépendamment du niveau d’expression de PD-L1. Cela a conduit à l’autorisation de mise sur le marché et au remboursement du pembrolizumab pour les carcinomes non épidermoïdes en association au schéma de chimiothérapie cis- ou carboplatine, pémétrexed administré pendant 4 cycles, suivis d’une maintenance par pémétrexed et pembrolizumab6 et pour les carcinomes épidermoïdes, en association au schéma carboplatine, paclitaxel (4 cycles) avec une maintenance par pembrolizumab.7 Ces schémas thérapeutiques peuvent être utilisés quel que soit le niveau d’expression de PD-L1. Leurs profils de tolérance associent les toxicités respectives de chacune des modalités thérapeutiques, chimiothérapie et immunothérapie.
Plus récemment, l’association ipilimumab-nivolumab associé à deux cycles seulement d’un doublet de chimiothérapie comportant un sel de platine a également montré sa supériorité en termes de survie à la chimiothérapie seule, quelle que soit l’expression de PD-L1, et devrait être prochainement accessible, en ayant l’avantage de réduire la durée de la chimiothérapie cytotoxique dans le schéma thérapeutique.8
Plus récemment, l’association ipilimumab-nivolumab associé à deux cycles seulement d’un doublet de chimiothérapie comportant un sel de platine a également montré sa supériorité en termes de survie à la chimiothérapie seule, quelle que soit l’expression de PD-L1, et devrait être prochainement accessible, en ayant l’avantage de réduire la durée de la chimiothérapie cytotoxique dans le schéma thérapeutique.8
Comment choisir entre monothérapie et association chimiothérapie-immunothérapie en 1re ligne métastatique
Les anti-PD-L1 sont ainsi devenus la pierre angulaire de l’algorithme de traitement de 1re ligne des patients atteints de CBNPC métastatiques sans addiction oncogénique ni contre-indication à l’immunothérapie, conservant un bon état général, avec le niveau d’expression de PD-L1 évalué par immunohistochimie comme biomarqueur décisionnel. La recherche d’une altération moléculaire doit être réalisée de façon systématique avant toute décision thérapeutique. En France, seul le pembrolizumab est disponible en 1re ligne, soit en monothérapie en cas d’expression de PD-L1 supérieure ou égale à 50 %, soit associé à un doublet à base de platine indépendamment du degré d’expression de PD-L1. Il existe donc un choix thérapeutique possible chez les 25 à 30 % des patients dont la tumeur exprime fortement PD-L1 (≥ 50 %) entre la monothérapie et l’association avec la chimiothérapie. Celle-ci fait disparaître l’excès de progressions ou de décès précoces observé lorsque l’immunothérapie est utilisée seule mais ne semble pas augmenter la proportion de survivants à long terme.6 Le choix du traitement reste pour la plupart du temps à l’appréciation clinique de l’oncologue thoracique, fondé sur l’agressivité de la maladie et l’importance du volume tumoral, les maladies plus indolentes bénéficiant du pembrolizumab en monothérapie et les formes plus symptomatiques d’une association avec la chimiothérapie.
L’introduction des anti-PD-L1 dans le traitement de 1re ligne, fruit d’une recherche clinique intensive durant ces 5 dernières années, marque une étape majeure dans la prise en charge de ces patients, dont une fraction peut espérer une survie prolongée. Beaucoup de questions demeurent cependant non formellement résolues en pratique courante du fait des critères d’inclusion restrictifs dans les essais thérapeutiques : traitement des patients avec métastases cérébrales, avec altération de l’état général, recevant une corticothérapie à visée symptomatique, durée optimale du traitement.
L’introduction des anti-PD-L1 dans le traitement de 1re ligne, fruit d’une recherche clinique intensive durant ces 5 dernières années, marque une étape majeure dans la prise en charge de ces patients, dont une fraction peut espérer une survie prolongée. Beaucoup de questions demeurent cependant non formellement résolues en pratique courante du fait des critères d’inclusion restrictifs dans les essais thérapeutiques : traitement des patients avec métastases cérébrales, avec altération de l’état général, recevant une corticothérapie à visée symptomatique, durée optimale du traitement.
CBNPC localement avancés en l’absence d’addiction oncogénique
Pour les patients atteints d’un CBNPC localement avancé non opérable, le traitement consiste en une association de radiothérapie et chimiothérapie. Celle-ci peut se faire de façon concomitante ou séquentielle selon l’état général du patient et le volume tumoral. Le durvalumab, anti-PD-L1, a été comparé à un placebo en consolidation après chimioradiothérapie concomitante, démontrant un bénéfice de survie se prolongeant à 4 ans (survie à 49,6 contre 36,3 % pour le placebo).9 La consolidation par immunothérapie agit essentiellement par réduction du risque métastatique lié aux fréquentes métastases occultes. En pratique clinique, le traitement par durvalumab est initié dans les 42 jours suivant la fin de la radiothérapie, si la maladie n’a pas progressé et si le taux de PD-L1 est supérieur ou égal à 1 %. Il est administré toutes les 2 semaines ou toutes les 4 semaines pendant une durée de 12 mois.
Perspectives de l’immunothérapie dans les CBNPC
Immunothérapie et addiction oncogénique
Chez les patients ayant une mutation oncogénique (telle que mutation de l’epidermal growth factor receptor [EGFR], réarrangement de l’anaplastic lymphoma kinase [ALK]), l’immunothérapie a globalement un niveau d’activité plus réduit (tumeurs survenant souvent chez des patients non fumeurs avec une charge mutationnelle faible), inférieur à celui des thérapies ciblées par inhibiteur de tyrosine kinase. Cependant, plusieurs essais ont tenté d’associer traitements ciblés et immunothérapie. Ces associations, bien que prometteuses sur modèle expérimental, ont montré une efficacité modeste au prix d’importants effets indésirables, l’immunothérapie pouvant augmenter la fréquence et la sévérité des effets indésirables liés aux inhibiteurs de tyrosine kinase. Par exemple, l’association durvalumab et osimertinib, inhibiteur de l’EGFR, engendre un fort taux de pneumopathies interstitielles (39 %), menant à l’arrêt précoce de l’essai.10Immunothérapie et stades localisés, opérables
L’utilisation d’un traitement systémique en néoadjuvant et en adjuvant a déjà montré son efficacité dans la prise en charge des CBNPC résécables chirurgicalement, en termes de survie sans récidive et de survie globale. L’adjonction d’un traitement systémique à un traitement local vise à détruire les localisations infracliniques indétectables par les imageries conventionnelles. Inclure les anti-PD-L1 dans cette stratégie est également en cours d’étude avec plusieurs essais plaçant l’immunothérapie comme traitement néoadjuvant et traitement adjuvant des CBNPC opérables.11 Les résultats des premiers essais de faisabilité montrent la capacité des anti-PD-L1 administrés avant la chirurgie à générer une réponse histopathologique majeure (définie par moins de 10 % de cellules tumorales viables sur la pièce opératoire), en monothérapie ou a fortiori en association avec la chimiothérapie.12 Plusieurs essais de phase III sont en cours, testant la stratégie d’une chimio-immunothérapie préopératoire ou d’une immunothérapie adjuvante, qui devraient très probablement constituer une nouvelle étape dans le développement de l’immunothérapie dans les CBNPC.Carcinome bronchique à petites cellules
Les formes métastatiques des carcinomes bronchiques à petites cellules, largement majoritaires au diagnostic, sont traitées en 1re ligne depuis 30 ans par la même chimiothérapie associant cis- ou carboplatine et étoposide, avec une chimiosensibilité initiale mais une durée de réponse courte et un pronostic redoutable à court terme. Les anti-PD-L1 n’ont pas apporté de bénéfice de survie en traitement de maintenance post-chimiothérapie ou en 2e ligne. L’adjonction d’un anti-PD-L1 à la chimiothérapie de 1re ligne améliore significativement la survie, de manière très similaire avec l’atézolizumab13 et le durvalumab,14 ce qui constitue le premier progrès thérapeutique dans cette pathologie depuis 30 ans. Les bénéfices de l’immunothérapie dans cette indication restent modestes à court terme, puisque la médiane de survie n’est améliorée que de quelques semaines avec l’atézolizumab ou le durvalumab. En revanche, au-delà de 18 mois, le recul supplémentaire suggère qu’une fraction de patients (environ 10 %) répondent de façon durable, puisqu’à 18 mois 34 % des patients traités par l’association chimiothérapie-atézolizumab sont en vie, contre seulement 21 % dans le groupe chimiothérapie classique.13 Aucun biomarqueur ne permet actuellement d’identifier a priori ces patients longs répondeurs. Le standard de traitement des carcinomes bronchiques à petites cellules métastatiques repose donc désormais sur l’association de la chimiothérapie cisplatine ou carboplatine-étoposide et d’une immunothérapie par atézolizumab ou durvalumab toutes les 3 semaines pendant 4 cycles suivis d’une maintenance par atézolizumab ou durvalumab.
D’autres essais en cours évaluent l’intérêt d’insérer l’immunothérapie dans les programmes thérapeutiques des carcinomes bronchiques à petites cellules non métastatiques traités par chimioradiothérapie.
D’autres essais en cours évaluent l’intérêt d’insérer l’immunothérapie dans les programmes thérapeutiques des carcinomes bronchiques à petites cellules non métastatiques traités par chimioradiothérapie.
Une modification de l’image péjorative de ce cancer
L’immunothérapie a permis d’obtenir une survie prolongée pour une fraction des patients traités à un stade avancé de la maladie, certains sans évidence de maladie résiduelle, évolution non imaginable auparavant sous traitement conventionnel par chimiothérapie. Elle a ainsi modifié l’image du cancer du poumon, souvent perçu comme une maladie de très mauvais pronostic et incurable. Elle a permis à une fraction des patients d’avoir une qualité de vie correcte, en comparaison avec les chimiothérapies classiques, certains conservant même une activité professionnelle et physique normale.
Les progrès thérapeutiques futurs vont consister à déterminer de nouveaux biomarqueurs au-delà de PD-L1 pour la décision thérapeutique (charge mutationnelle tumorale, signatures mutationnelles tumorales, composition du micro-environnement, intelligence artificielle appliquée à l’imagerie ou à l’histologie), à améliorer la réponse thérapeutique en agissant sur d’autres points de contrôle de la réponse immunitaire ou en initiant une réponse immunitaire antitumorale et à comprendre les mécanismes de résistance au traitement.
Les progrès thérapeutiques futurs vont consister à déterminer de nouveaux biomarqueurs au-delà de PD-L1 pour la décision thérapeutique (charge mutationnelle tumorale, signatures mutationnelles tumorales, composition du micro-environnement, intelligence artificielle appliquée à l’imagerie ou à l’histologie), à améliorer la réponse thérapeutique en agissant sur d’autres points de contrôle de la réponse immunitaire ou en initiant une réponse immunitaire antitumorale et à comprendre les mécanismes de résistance au traitement.
Références
1. Defossez G, Le Guyader‑Peyrou S, Uhry Z, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Synthèse. Saint Maurice : Santé publique France, 2019. http://www.santepubliquefrance.fr/
2. Garon EB, Hellmann MD, Rizvi NA, et al. Five-year overall survival for patients with advanced non-small-cell lung cancer treated with pembrolizumab: results from the phase I KEYNOTE-001 study. J Clin Oncol 2019;37:2518-27.
3. Borghaei H, Gettinger S, Vokes EE, et al. Five-year outcomes from the randomized, phase III trials CheckMate 017 and 057: nivolumab versus docetaxel in previously treated Non-Small-Cell Lung cancer. J Clin Oncol 2021;39:723-33.
4. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced Non-Small-Cell Lung Cancer with PD-L1 tumor proportion score of 50% or greater. J Clin Oncol 2019;37:537-46.
5. Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019;381:2020-31.
6. Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated analysis From KEYNOTE-189: pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic nonsquamous non-small-cell lung cancer. J Clin Oncol 2020;38:1505-17.
7. Paz-Ares L, Vicente D, Tafreshi A, et al. A randomized, placebo-controlled trial of pembrolizumab plus chemotherapy in patients with metastatic squamous non–small-cell lung cancer: protocol-specified final analysis of KEYNOTE-407. J Thorac Oncol 2020;5:1657-69.
8. Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:198-211.
9. Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. N Engl J Med 2017;377:1919‑29.
10. Ahn MJ, Sun JM, Lee SH, Ahn JS, Park K. EGFR TKI combination with immunotherapy in non-small cell lung cancer. Expert Opin Drug Saf 2017;16:465‑9.
11. Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018;378:1976‑86.
12. Provencio M, Nadal E, Insa A, García-Campelo MR, et al. Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer (NADIM): an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol 2020;21:1413-22.
13. Horn L, Mansfield AS, Szczesna A, et al.; IMpower133 study group. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018;379:2220-9.
14. Goldman JW, Dvorkin M, Chen Y, et al.; CASPIAN investigators. Durvalumab, with or without tremelimumab, plus platinum-etoposide versus platinum-etoposide alone in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): updated results from a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2021;22:51-65.
2. Garon EB, Hellmann MD, Rizvi NA, et al. Five-year overall survival for patients with advanced non-small-cell lung cancer treated with pembrolizumab: results from the phase I KEYNOTE-001 study. J Clin Oncol 2019;37:2518-27.
3. Borghaei H, Gettinger S, Vokes EE, et al. Five-year outcomes from the randomized, phase III trials CheckMate 017 and 057: nivolumab versus docetaxel in previously treated Non-Small-Cell Lung cancer. J Clin Oncol 2021;39:723-33.
4. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced Non-Small-Cell Lung Cancer with PD-L1 tumor proportion score of 50% or greater. J Clin Oncol 2019;37:537-46.
5. Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019;381:2020-31.
6. Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated analysis From KEYNOTE-189: pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic nonsquamous non-small-cell lung cancer. J Clin Oncol 2020;38:1505-17.
7. Paz-Ares L, Vicente D, Tafreshi A, et al. A randomized, placebo-controlled trial of pembrolizumab plus chemotherapy in patients with metastatic squamous non–small-cell lung cancer: protocol-specified final analysis of KEYNOTE-407. J Thorac Oncol 2020;5:1657-69.
8. Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:198-211.
9. Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. N Engl J Med 2017;377:1919‑29.
10. Ahn MJ, Sun JM, Lee SH, Ahn JS, Park K. EGFR TKI combination with immunotherapy in non-small cell lung cancer. Expert Opin Drug Saf 2017;16:465‑9.
11. Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018;378:1976‑86.
12. Provencio M, Nadal E, Insa A, García-Campelo MR, et al. Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer (NADIM): an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol 2020;21:1413-22.
13. Horn L, Mansfield AS, Szczesna A, et al.; IMpower133 study group. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018;379:2220-9.
14. Goldman JW, Dvorkin M, Chen Y, et al.; CASPIAN investigators. Durvalumab, with or without tremelimumab, plus platinum-etoposide versus platinum-etoposide alone in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): updated results from a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2021;22:51-65.