Les avancées diagnostiques et thérapeutiques en oncologie ont amélioré considérablement le pronostic des patients. Nombre de cancers, y compris au stade métastatique, sont ainsi devenus des maladies chroniques. L’amélioration de la survie s’est vue accompagnée par l’émergence des effets indésirables liés aux traitements anticancéreux, notamment au niveau cardiaque.1 L’insuffisance cardiaque est l’une des complications les mieux caractérisées, les plus fréquentes et les plus graves pouvant retentir considérablement sur le pronostic.
Concernant l’insuffisance cardiaque induite par les traitements anticancéreux, plusieurs définitions ont été proposées. La plus utilisée actuellement est celle de l’European Society of Cardiology (ESC),2, 3 qui retient une cardiotoxicité devant la baisse de la fonction d’éjection ventriculaire gauche (FEVG) d’au moins 10 points avec une valeur absolue inférieure à 50 %. L’European Society for Medical Oncology (ESMO) inclut la FEVG inférieure à 50 % indépendamment de la valeur préthérapeutique.4 Toutes les sociétés savantes (ESC, ESMO, Société française de cardiologie [SFC]) incluent la notion de cardiotoxicité infraclinique, définie comme une baisse relative de la fonction longitudinale globale évaluée par le strain global longitudinal (SGL) échocardiographique de 15 %, confirmé par un deuxième examen à 2 ou 3 semaines d’intervalle ; ou l’augmentation inexpliquée de la troponine. Ces deux biomarqueurs confèrent un sur-risque d’insuffisance cardiaque ultérieure. Le groupe de cardio-oncologie de la SFC a récemment réalisé une synthèse intégrative des définitions et des recommandations des différentes sociétés savantes.5 Il est intéressant de noter que ces définitions se focalisent particulièrement sur l’insuffisance cardiaque avec altération de la fraction d’éjection, mais il est probable que certains traitements anticancéreux favorisent aussi la survenue d’insuffisance cardiaque à fraction d’éjection préservée.
Il est donc important de connaître les thérapeutiques potentiellement pourvoyeuses d’insuffisance cardiaque, les marqueurs de cardiotoxicité conférant un sur-risque de développement ultérieur d’une insuffisance cardiaque, ainsi que les moyens de prévention et les stratégies de surveillance pour un dépistage et une prise en charge rapide et efficace de l’insuffisance cardiaque induite par les traitements anticancéreux.
Concernant l’insuffisance cardiaque induite par les traitements anticancéreux, plusieurs définitions ont été proposées. La plus utilisée actuellement est celle de l’European Society of Cardiology (ESC),2, 3 qui retient une cardiotoxicité devant la baisse de la fonction d’éjection ventriculaire gauche (FEVG) d’au moins 10 points avec une valeur absolue inférieure à 50 %. L’European Society for Medical Oncology (ESMO) inclut la FEVG inférieure à 50 % indépendamment de la valeur préthérapeutique.4 Toutes les sociétés savantes (ESC, ESMO, Société française de cardiologie [SFC]) incluent la notion de cardiotoxicité infraclinique, définie comme une baisse relative de la fonction longitudinale globale évaluée par le strain global longitudinal (SGL) échocardiographique de 15 %, confirmé par un deuxième examen à 2 ou 3 semaines d’intervalle ; ou l’augmentation inexpliquée de la troponine. Ces deux biomarqueurs confèrent un sur-risque d’insuffisance cardiaque ultérieure. Le groupe de cardio-oncologie de la SFC a récemment réalisé une synthèse intégrative des définitions et des recommandations des différentes sociétés savantes.5 Il est intéressant de noter que ces définitions se focalisent particulièrement sur l’insuffisance cardiaque avec altération de la fraction d’éjection, mais il est probable que certains traitements anticancéreux favorisent aussi la survenue d’insuffisance cardiaque à fraction d’éjection préservée.
Il est donc important de connaître les thérapeutiques potentiellement pourvoyeuses d’insuffisance cardiaque, les marqueurs de cardiotoxicité conférant un sur-risque de développement ultérieur d’une insuffisance cardiaque, ainsi que les moyens de prévention et les stratégies de surveillance pour un dépistage et une prise en charge rapide et efficace de l’insuffisance cardiaque induite par les traitements anticancéreux.
Principaux traitements anticancéreux à l’origine d’insuffisance cardiaque
Les principaux traitements anticancéreux en cause sont les suivants.6
Chimiothérapies classiques
Les anthracyclines (telles que la doxorubicine, épirubicine, idarubicine, daunorubicine) sont les chimiothérapies les plus étudiées et les plus pourvoyeuses d’insuffisance cardiaque. L’incidence de la cardiotoxicité liée aux anthracyclines est dépendante de la dose et peut aller pour la doxorubicine de 3 à 5 % pour une dose totale cumulée à 400 mg/m² à 18, voire 48 % pour une dose de 700 mg/m².3 Plus rarement, les agents alkylants (cyclophosphamide), les antimétabolites (clofarabine), ou encore les antimicrotubules (docétaxel, paclitaxel) ou la mitoxantrone (apparentée aux anthracyclines) peuvent se compliquer d’insuffisance cardiaque.
Thérapies ciblées
Il s’agit de molécules ciblant spécifiquement une voie du métabolisme de la cellule cancéreuse. Cependant, les voies ciblées peuvent aussi être présentes dans les cardiomyocytes, impactant alors le métabolisme cellulaire.
Les anticorps monoclonaux ciblant le récepteur erb2 (ou HER2), comme le trastuzumab et le pertuzumab, ont révolutionné le pronostic des cancers du sein surexprimant erb2. Les thérapies anti-HER2 sont associées à un risque de survenue d’insuffisance cardiaque pouvant aller de 1,7 à 4 %.6 Ce risque est plus élevé chez les patients ayant déjà reçu des anthracyclines (ce qui est souvent le cas dans les protocoles thérapeutiques de prise en charge de ces patientes) et peut atteindre 20 % selon certaines séries. La toxicité des anti-HER2 est cependant, en règle générale, réversible à leur arrêt.
Les inhibiteurs du facteur de croissance vasculaire endothélial (anti-VEGF), que ce soit sous forme d’anticorps monoclonal (bévacizumab) ou d’inhibiteurs de la tyrosine kinase (sunitinib, sorafénib, cabozantinib, pazopanib, axitinib, etc.) peuvent également engendrer une insuffisance cardiaque dans 2 à 6 % des cas.3 Il en est de même pour le carfilzomib, inhibiteur du protéasome, prescrit en dernière ligne du myélome multiple, dont l’incidence de l’insuffisance cardiaque s’élèverait entre 11 et 25 % selon les séries.
Les anticorps monoclonaux ciblant le récepteur erb2 (ou HER2), comme le trastuzumab et le pertuzumab, ont révolutionné le pronostic des cancers du sein surexprimant erb2. Les thérapies anti-HER2 sont associées à un risque de survenue d’insuffisance cardiaque pouvant aller de 1,7 à 4 %.6 Ce risque est plus élevé chez les patients ayant déjà reçu des anthracyclines (ce qui est souvent le cas dans les protocoles thérapeutiques de prise en charge de ces patientes) et peut atteindre 20 % selon certaines séries. La toxicité des anti-HER2 est cependant, en règle générale, réversible à leur arrêt.
Les inhibiteurs du facteur de croissance vasculaire endothélial (anti-VEGF), que ce soit sous forme d’anticorps monoclonal (bévacizumab) ou d’inhibiteurs de la tyrosine kinase (sunitinib, sorafénib, cabozantinib, pazopanib, axitinib, etc.) peuvent également engendrer une insuffisance cardiaque dans 2 à 6 % des cas.3 Il en est de même pour le carfilzomib, inhibiteur du protéasome, prescrit en dernière ligne du myélome multiple, dont l’incidence de l’insuffisance cardiaque s’élèverait entre 11 et 25 % selon les séries.
Radiothérapie
L’insuffisance cardiaque compliquant la radiothérapie se manifeste à distance de celle-ci, conséquence de la fibrose via un mécanisme de stress oxydatif.7 Ce risque est d’autant plus important en cas d’irradiation myocardique importante, de traitement concomitant par anthracyclines ou de présence de facteurs de risque cardiovasculaire. Le phénotype de l’insuffisance cardiaque post-radique est davantage celui d’une insuffisance cardiaque à FEVG conservée ou modérément altérée. Lors des insuffisances cardiaques post-radiques coexistent souvent une valvulopathie, une coronaropathie ou une péricardite post-radique.
Immunothérapie anticancéreuse
Les inhibiteurs des points de contrôle immunitaires (nivolumab, pembrolizumab, cémiplimab, avélumab, atézolizumab, durvalumab, ipilimumab, trémélimumab) ont révolutionné la prise en charge de nombreux cancers avancés au stade métastatique. Cette classe thérapeutique peut se compliquer, rarement, d’insuffisance cardiaque, notamment par le mécanisme d’une myocardite auto-immune.8
Dépistage de l’insuffisance cardiaque induite par les traitements anticancéreux
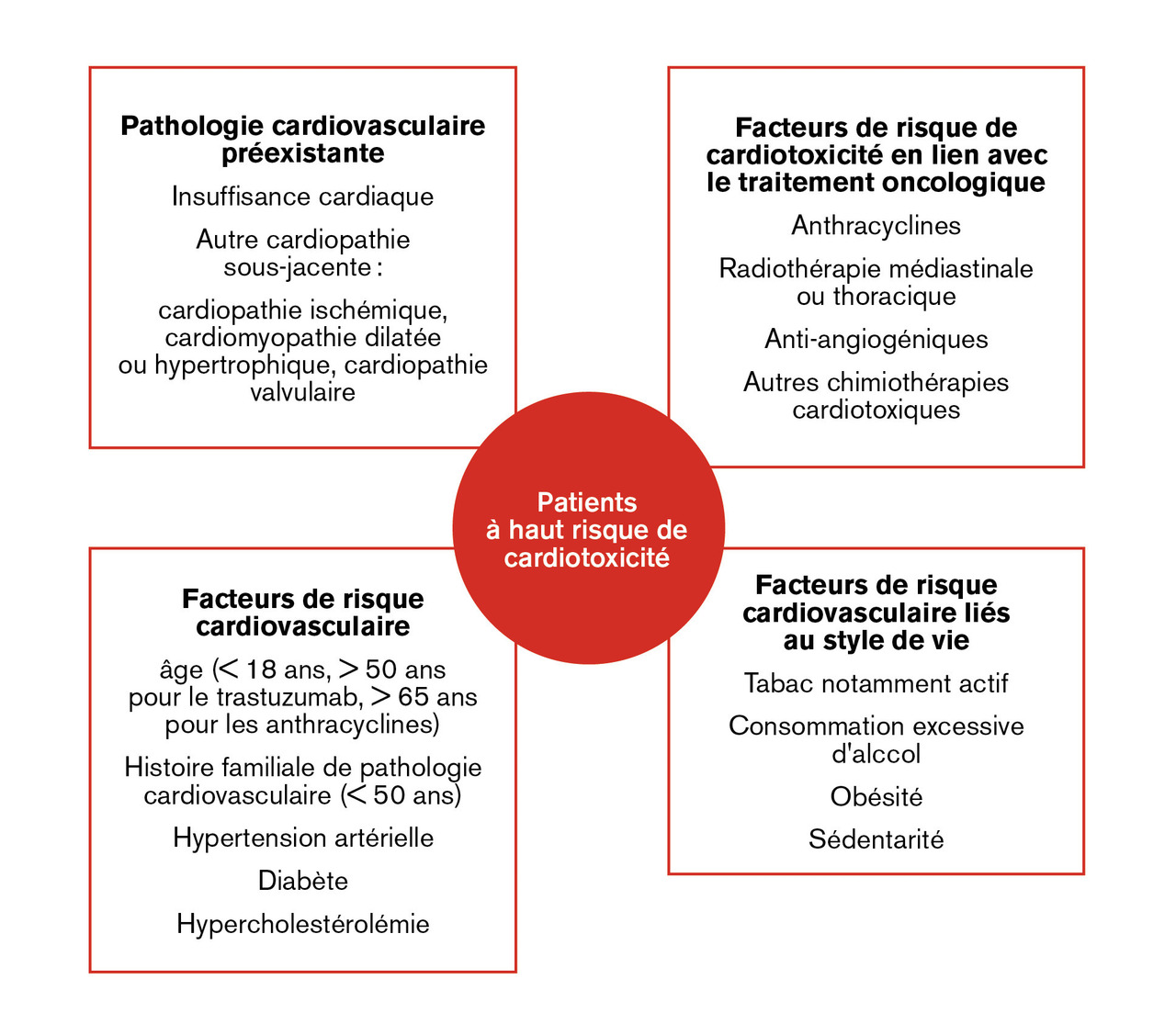
La prévention de l’insuffisance cardiaque induite par ces traitements passe par une identification précoce des patients à haut risque de toxicité cardiaque. Les patients les plus à risque de développer une cardiotoxicité sont ceux ayant déjà une pathologie cardiaque sous-jacente, ceux ayant des facteurs de risque cardiovasculaire, métaboliques ou liés au style de vie, mais également les âges extrêmes au traitement (enfance, adolescence et âge supérieur à 70 ans). Ce risque est potentialisé en cas de co-traitements potentiellement cardiotoxiques (fig. 1 ). L’évaluation cardio-oncologique comprend un examen clinique, un électrocardiogramme, un bilan biologique (fonction rénale, bilan lipidique et glycémie à jeun) avec dosage des enzymes cardiaques (N-terminal prohormone of brain natriuretic peptide [NT-proBNP] pro-BNP et troponine) et une échographie cardiaque transthoracique avec estimation de la FEVG (idéalement tridimensionnelle) et du SGL échographique par la méthode du speckle tracking, dont les valeurs normales sont comprises entre -18 et -22 %.3, 9 Lorsque l’échocardiographie ne permet pas une évaluation reproductible de la FEVG, une imagerie par résonance magnétique (IRM) cardiaque est indiquée et, en cas de non-disponibilité, une scintigraphie myocardique isotopique. En cas de suivi sérié, le même mode d’imagerie et le même manipulateur d’échocardiographie sont préconisés. La consultation chez le cardio-oncologue est également l’occasion d’instaurer les mesures nécessaires au contrôle adéquat des facteurs de risque cardiovasculaires et d’éduquer le patient aux mesures hygiénodiététiques et d’activité physique. D’autres mesures réduisent le risque de cardiotoxicité chez les patients les plus à risque : traitement des comorbidités, réduction de l’irradiation cardiaque, limitation des doses cumulées d’anthracyclines, utilisation de formes liposomales d’anthracyclines, ou prescription du dexrazoxane, chélateur du fer pouvant réduire la production de radicaux libres sous anthracyclines.9
Quels schémas de dépistage ?
Les schémas de dépistage de l’insuffisance cardiaque compliquant le traitement oncologique ne sont pas bien étayés par des études et relèvent de consensus d’experts. Ce dépistage fait appel essentiellement à des méthodes et des biomarqueurs non invasifs et non irradiants : l’échocardiographie transthoracique et la troponine. À noter que les délais et les modalités de surveillance diffèrent en fonction de la nature du traitement anticancéreux.1, 3, 9
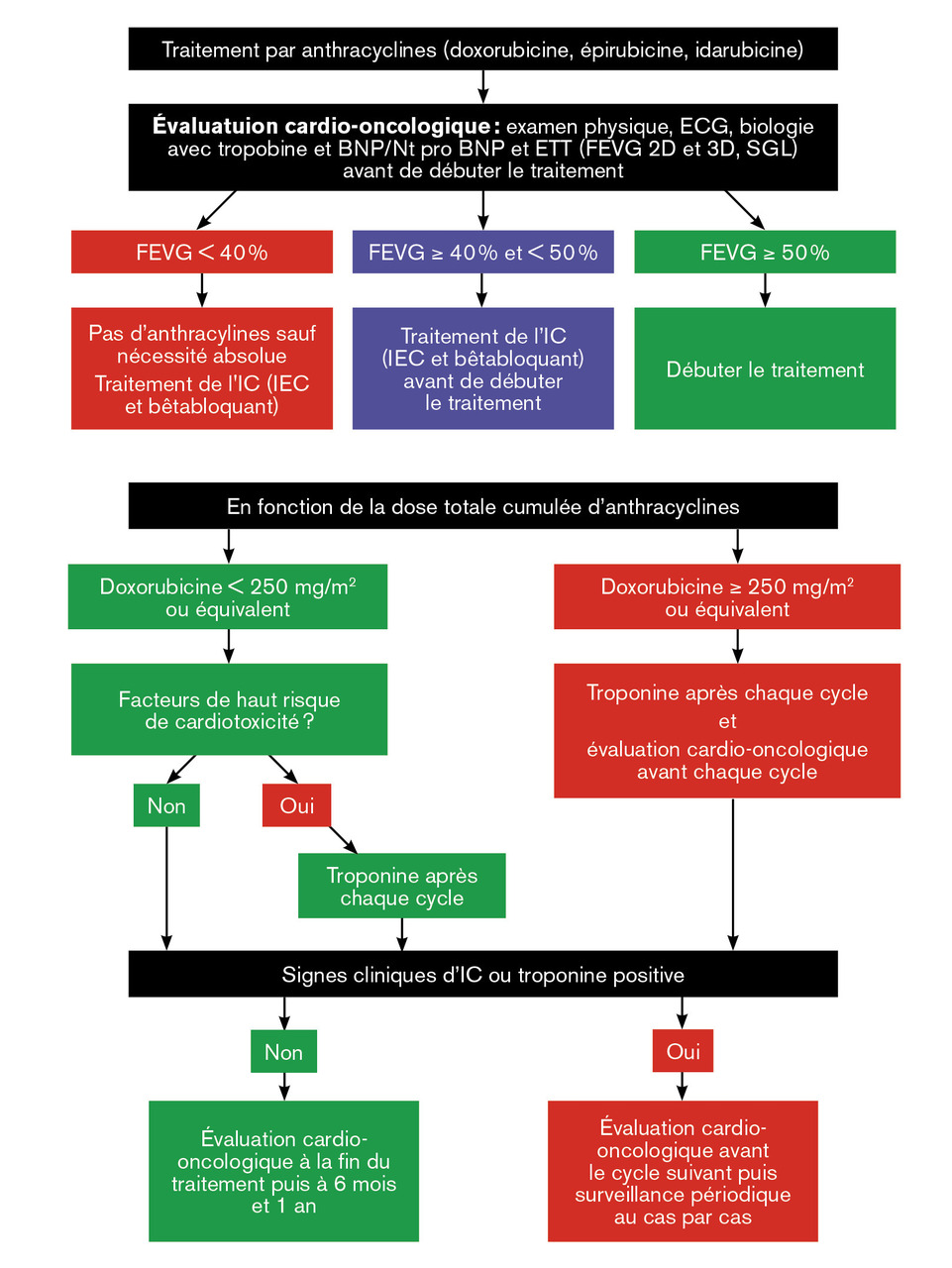
Concernant les anthracyclines, une toxicité cardiaque peut se voir dès la première administration. Un dépistage est réalisé en règle générale à la fin du traitement. Ces modalités sont décrites dans lafigure 2 .4 Une surveillance à vie est désormais indiquée chez les survivants de cancer dans l’enfance et ceux ayant reçu de fortes doses d’anthracyclines (> 300 mg/m² de doxorubicine ou équivalent).3 La survenue d’une insuffisance cardiaque retardée (des années voire des décennies plus tard) est en effet possible.
Pour les thérapies ciblées dirigées contre le récepteur HER2, une évaluation cardio-oncologique systématique tous les 3 mois est indiquée pendant toute la durée du traitement. En cas de risque élevé de cardiotoxicité (notamment chez les patients ayant déjà reçu des anthracyclines ou ayant eu une radiothérapie médiastinale), en plus de l’évaluation cardio-oncologique tous les 3 mois, un dosage de la troponine après chaque cycle est conseillé. En l’absence de signes de cardiotoxicité, une évaluation cardio-oncologique est réalisée à la fin du traitement, à 6 mois puis à 1 an.
Pour tous les autres traitements (inhibiteurs du protéasome, antiangiogéniques, autres chimiothérapies), une évaluation cardio-oncologique (imagerie cardiaque, troponine, BNP) pourrait être réalisée tous les 3 mois pendant la première année de traitement, puis tous les 6 mois tant que le traitement est poursuivi.9 Quant à la radiothérapie, la cardiotoxicité étant souvent retardée, une évaluation cardio-oncologique est réalisée 5 ans après chez les patients à haut risque cardiovasculaire, sinon à 10 ans avec des contrôles périodiques tous les 5 ans.
À noter qu’il n’y a pas de preuve solide quant au bénéfice d’un traitement médicamenteux en prévention primaire de la cardiotoxicité, qu’il s’agisse d’inhibiteurs de l’enzyme de conversion (IEC), de bêtabloquants ou de statines.10
Concernant les anthracyclines, une toxicité cardiaque peut se voir dès la première administration. Un dépistage est réalisé en règle générale à la fin du traitement. Ces modalités sont décrites dans la
Pour les thérapies ciblées dirigées contre le récepteur HER2, une évaluation cardio-oncologique systématique tous les 3 mois est indiquée pendant toute la durée du traitement. En cas de risque élevé de cardiotoxicité (notamment chez les patients ayant déjà reçu des anthracyclines ou ayant eu une radiothérapie médiastinale), en plus de l’évaluation cardio-oncologique tous les 3 mois, un dosage de la troponine après chaque cycle est conseillé. En l’absence de signes de cardiotoxicité, une évaluation cardio-oncologique est réalisée à la fin du traitement, à 6 mois puis à 1 an.
Pour tous les autres traitements (inhibiteurs du protéasome, antiangiogéniques, autres chimiothérapies), une évaluation cardio-oncologique (imagerie cardiaque, troponine, BNP) pourrait être réalisée tous les 3 mois pendant la première année de traitement, puis tous les 6 mois tant que le traitement est poursuivi.9 Quant à la radiothérapie, la cardiotoxicité étant souvent retardée, une évaluation cardio-oncologique est réalisée 5 ans après chez les patients à haut risque cardiovasculaire, sinon à 10 ans avec des contrôles périodiques tous les 5 ans.
À noter qu’il n’y a pas de preuve solide quant au bénéfice d’un traitement médicamenteux en prévention primaire de la cardiotoxicité, qu’il s’agisse d’inhibiteurs de l’enzyme de conversion (IEC), de bêtabloquants ou de statines.10
Conduite à tenir en cas d’insuffisance cardiaque secondaire aux anticancéreux
Prise en charge cardiovasculaire de l’insuffisance cardiaque induite par les anticancéreux
L’insuffisance cardiaque induite par les anticancéreux peut être patente ou infraclinique (asymptomatique). Il existe par ailleurs deux types de cardiotoxicité : le type 1, souvent irréversible, dépendant de la dose, secondaire à une nécrose myocytaire, dont le modèle classique est celui des anthracyclines ; et le type 2, souvent réversible, dose-indépendant, secondaire à une dysfonction myocitaire induite classiquement par les anti-HER2. Cette définition ne reflète cependant plus complétement tous les mécanismes physiopathologiques pouvant lier anticancéreux et insuffisance cardiaque.
La baisse isolée du SGL représente un facteur prédicteur précoce de dysfonction ventriculaire gauche, mais il n’existe pas de consensus ou de recommandations particulières quant à la conduite à tenir dans ce cas. En cas d’élévation isolée de la troponine, sous anthracyclines ou anti-HER2, un traitement par IEC peut être considéré. L’initiation précoce de cette thérapie cardioprotectrice préviendrait l’insuffisance cardiaque ultérieure.
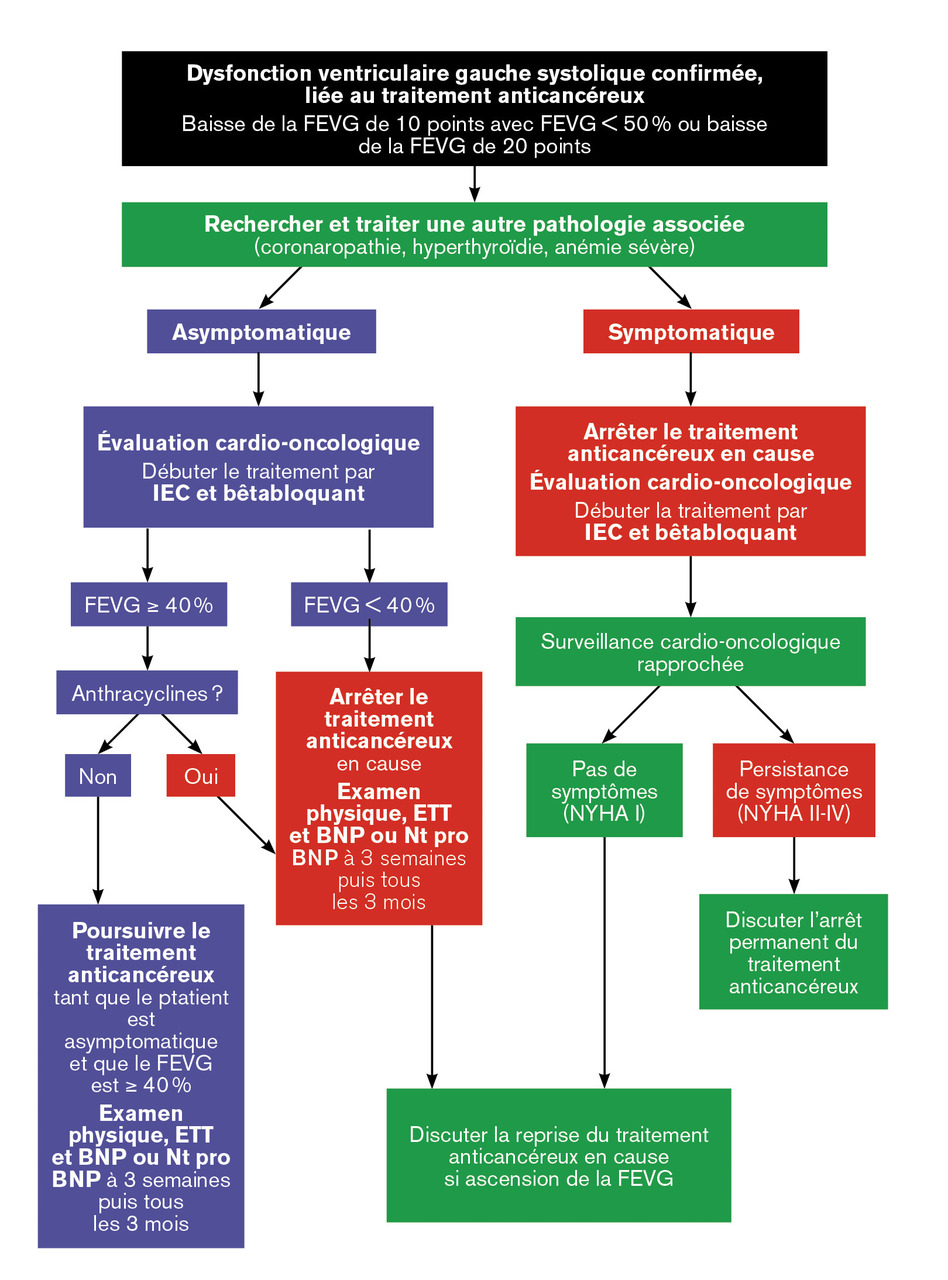
En cas d’insuffisance cardiaque patente avec une altération franche de la FEVG (en règle générale < 40 %), la prise en charge est celle de l’insuffisance cardiaque tant sur le plan diagnostique que thérapeutique. L’arbre décisionnel est décrit sur lafigure 3 . Le recours à des thérapies invasives et la poursuite du traitement oncologique font l’objet d’une discussion en réunion de concertation pluridisciplinaire cardio-oncologie.
La baisse isolée du SGL représente un facteur prédicteur précoce de dysfonction ventriculaire gauche, mais il n’existe pas de consensus ou de recommandations particulières quant à la conduite à tenir dans ce cas. En cas d’élévation isolée de la troponine, sous anthracyclines ou anti-HER2, un traitement par IEC peut être considéré. L’initiation précoce de cette thérapie cardioprotectrice préviendrait l’insuffisance cardiaque ultérieure.
En cas d’insuffisance cardiaque patente avec une altération franche de la FEVG (en règle générale < 40 %), la prise en charge est celle de l’insuffisance cardiaque tant sur le plan diagnostique que thérapeutique. L’arbre décisionnel est décrit sur la
Prise en charge oncologique
La poursuite ou non du traitement anticancéreux et les modalités de surveillance doivent être discutées par une équipe multidisciplinaire incluant oncologues, cardio-oncologues et pharmacologues (fig. 3 ).
Incidence croissante
L’insuffisance cardiaque induite par les traitements anticancéreux est une complication dont l’incidence croît à la faveur de l’amélioration du pronostic oncologique. Elle grève le pronostic des patients et alourdit le bilan de morbimortalité à court et long terme. La cardio-oncologie, spécialité émergente et transversale, est donc née de ce constat. Une bonne connaissance des cardiotoxicités des anticancéreux ainsi qu’une collaboration étroite entre oncologues, hématologues, pharmacologues et cardiologues sont nécessaires afin d’améliorer la prise en charge des patients en termes de prévention cardiovasculaire, dépistage précoce et prise en charge de la cardiotoxicité.
Références
1. Curigliano G, Mayer EL, Burstein HJ, Winer EP, Goldhirsch A . Cardiac toxicity from systemic cancer therapy: a comprehensive review. Prog Cardiovasc Dis 2010;53:94-104.
2. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016;37:2129-200.
3. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC position paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: the task force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768-801.
4. Curigliano G, Lenihan D, Fradley M, et al.; ESMO guidelines committee. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol 2020;31:171-90.
5. Alexandre J, Cautela J, Ederhy S, Ghandi D, et al. Cardiovascular toxicity related to cancer treatment: a pragmatic approach to the American and European Cardio-Oncology guidelines. J Am Heart Assoc 2020;9:e018403.
6. Bloom MW, Hamo CE, Cardinale D, et al. Cancer Therapy-Related Cardiac Dysfonction and Heart Failure. Part 1: Definitions, Pathophysiology, Risk Factors, and Imaging. Circ Heart Fail 2016;9:e002661.
7. Filopei J, Frishman W. Radiation-induced heart disease. Cardiol Rev 2012;20:184-8.
8. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018;378:158-68.
9. Hamo CE, Bloom MW, Cardinale D, et al. Cancer therapy–related cardiac dysfunction and heart failure. Part 2: Prevention, treatment, guidelines, and future directions. Circ Heart Fail 2016;9:e002843.
10. Cardinale D, Ciceri F, Latini R, et al. Anthracycline-induced cardiotoxicity: a multicenter randomised trial comparing two strategies for guiding prevention with enalapril: the International CardioOncology Society-one trial. Eur J Cancer 2018;94:126-37.
2. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016;37:2129-200.
3. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC position paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: the task force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768-801.
4. Curigliano G, Lenihan D, Fradley M, et al.; ESMO guidelines committee. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol 2020;31:171-90.
5. Alexandre J, Cautela J, Ederhy S, Ghandi D, et al. Cardiovascular toxicity related to cancer treatment: a pragmatic approach to the American and European Cardio-Oncology guidelines. J Am Heart Assoc 2020;9:e018403.
6. Bloom MW, Hamo CE, Cardinale D, et al. Cancer Therapy-Related Cardiac Dysfonction and Heart Failure. Part 1: Definitions, Pathophysiology, Risk Factors, and Imaging. Circ Heart Fail 2016;9:e002661.
7. Filopei J, Frishman W. Radiation-induced heart disease. Cardiol Rev 2012;20:184-8.
8. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018;378:158-68.
9. Hamo CE, Bloom MW, Cardinale D, et al. Cancer therapy–related cardiac dysfunction and heart failure. Part 2: Prevention, treatment, guidelines, and future directions. Circ Heart Fail 2016;9:e002843.
10. Cardinale D, Ciceri F, Latini R, et al. Anthracycline-induced cardiotoxicity: a multicenter randomised trial comparing two strategies for guiding prevention with enalapril: the International CardioOncology Society-one trial. Eur J Cancer 2018;94:126-37.