En France, plus de 10 000 nouveaux cas de tumeur de la vessie sont diagnostiqués tous les ans.1 En 2018, ces tumeurs étaient à la 6e place en termes d’incidence (14,3 pour 100 000 personnes-années) et à la 8e place en termes de mortalité (4 112 décès en 2018). Les options thérapeutiques pour les traiter dépendent de leur degré d’infiltration dans la paroi vésicale (stade). S’agissant des tumeurs de la vessie n’infiltrant pas le muscle (TVNIM), une résection endoscopique transurétrale de la tumeur est toujours indiquée, éventuellement associée à des instillations adjuvantes endovésicales (bacille de Calmette et Guérin [BCG] ou chimiothérapie) dans un second temps. En cas de tumeur de la vessie infiltrant le muscle (TVIM) localisée, une exérèse chirurgicale de la vessie est indiquée (cystectomie) combinée à une chimiothérapie néo-adjuvante. Le traitement des formes métastatiques est palliatif et fait appel à une polychimiothérapie systémique. L’immunothérapie et notamment les inhibiteurs du contrôle immunitaire (ou inhibiteurs des points de contrôle [checkpoints]) sont actuellement testés dans les essais thérapeutiques à tous les stades des tumeurs de la vessie. Durant les quatre dernières années, de nombreux inhibiteurs de checkpoints ont été étudiés dans cette indication, avec des résultats prometteurs, certains ont même déjà été approuvés et mis sur le marché dans quelques pays.
Indications dans les tumeurs de la vessie infiltrant le muscle
Tumeurs de la vessie infiltrant le muscle avec métastases
On estime que 10 à 15 % des patients atteints d’une tumeur de la vessie ont des métastases d’emblée au moment du diagnostic.2 Ils justifient d’une première ligne de chimiothérapie à base de sels de platine, selon les recommandations françaises et européennes.3, 4 Cependant, près de la moitié des patients ne sont pas des bons candidats (« unfit ») à une chimiothérapie en raison de leur état général (ECOG performance status > 1) et/ou de leurs comorbidités (insuffisance rénale chronique avec une clairance de la créatinine < 60 mL/min, âge, troubles auditifs ou neurologiques périphériques).3 Les autres chimiothérapies (carboplatine, gemcitabine) ont une toxicité moindre mais sont moins efficaces sur le plan carcinologique.4 Par ailleurs, un nombre non négligeable de patients vont progresser après une première chimiothérapie et auront recours à une seconde ligne de traitement.
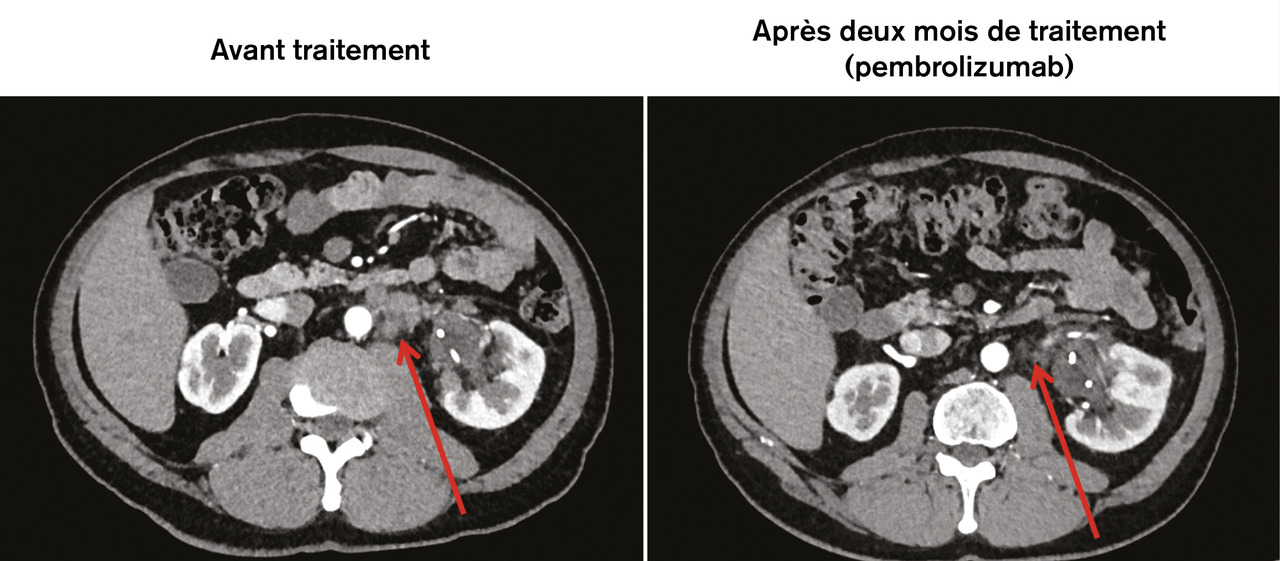
Dans ce contexte, depuis 2016, cinq molécules ciblant le récepteur programmed death 1 (PD-1) [atézolizumab, nivolumab, avélumab) ou son ligand PD-L1 (pembrolizumab, durvalimab)5 ont été testées en cas de TVIM avec métastases en phase I-II en seconde ligne après une chimiothérapie à bases de sels de platine pour les patients unfit, puis deux d’entre elles ont fait l’objet d’études de phase III (tableau 1 ).6, 7 L’étude KEYNOTE-012 (phase Ib) a mis en évidence un taux de réponse globale de 26 % et de réponse complète de 11 % pour l’immunothérapie de seconde ligne dans le cas de TVIM métastatique8 (v . figure ). Un essai clinique de phase III testant le pembrolizumab en seconde ligne des TVIM métastatiques (KEYNOTE-045) a montré une survie globale médiane de 10,3 mois, significativement supérieure à celle des patients traités par une deuxième ligne de chimiothérapie (7,4 mois ; p = 0,0002).6 Aucun impact n’a été rapporté en termes de survie sans progression.
Concernant les patients métastatiques non éligibles pour un traitement de cisplatine d’emblée, un essai de phase II de traitement par inhibiteurs de checkpoints en première ligne (KEYNOTE-052) a montré un taux de réponse globale de 24 %.9 Il convient de souligner que les études de phase III actuelles (IMvigor130, KEYNOTE-361) à ce sujet relèvent une efficacité supérieure de la chimiothérapie pour les tumeurs à faible expression de PD-L1 : cela justifie les recommandations récentes limitant l’indication aux inhibiteurs de checkpoints en première ligne pour les tumeurs métastatiques ayant un statut PD-L1 positif.
Les recommandations européennes d’urologie préconisent donc actuellement un traitement de première ligne par pembrolizumab pour les TVIM métastatiques chez les patients non candidats à une chimiothérapie par cisplatine sous réserve d’un statut PD-L1 positif, et en seconde ligne pour les patients récidivant ou progressant après une thérapie par cisplatine, indépendamment du statut PD-L1.4 Voir lestableaux 1 et 2 .
Dans ce contexte, depuis 2016, cinq molécules ciblant le récepteur programmed death 1 (PD-1) [atézolizumab, nivolumab, avélumab) ou son ligand PD-L1 (pembrolizumab, durvalimab)5 ont été testées en cas de TVIM avec métastases en phase I-II en seconde ligne après une chimiothérapie à bases de sels de platine pour les patients unfit, puis deux d’entre elles ont fait l’objet d’études de phase III (
Concernant les patients métastatiques non éligibles pour un traitement de cisplatine d’emblée, un essai de phase II de traitement par inhibiteurs de checkpoints en première ligne (KEYNOTE-052) a montré un taux de réponse globale de 24 %.9 Il convient de souligner que les études de phase III actuelles (IMvigor130, KEYNOTE-361) à ce sujet relèvent une efficacité supérieure de la chimiothérapie pour les tumeurs à faible expression de PD-L1 : cela justifie les recommandations récentes limitant l’indication aux inhibiteurs de checkpoints en première ligne pour les tumeurs métastatiques ayant un statut PD-L1 positif.
Les recommandations européennes d’urologie préconisent donc actuellement un traitement de première ligne par pembrolizumab pour les TVIM métastatiques chez les patients non candidats à une chimiothérapie par cisplatine sous réserve d’un statut PD-L1 positif, et en seconde ligne pour les patients récidivant ou progressant après une thérapie par cisplatine, indépendamment du statut PD-L1.4 Voir les
Tumeurs de la vessie infiltrant le muscle sans métastases
Le traitement de référence des TVIM localisées est la cystectomie totale combinée à un curage ganglionnaire ilio-obturateur bilatéral. En amont de la chirurgie, une polychimiothérapie néo-adjuvante à base de sels de platine est recommandée lorsque la fonction rénale le permet.4, 10 La chimiothérapie néo-adjuvante a pour objectif d’éliminer d’éventuelles micrométastases, d’optimiser la cystectomie en diminuant le risque de marges chirurgicales positives et, enfin, une prolongation de la survie du patient.10 Néanmoins, certains patients ne sont pas de bons candidats à une chimiothérapie à base de sels de platine, en raison d’une mauvaise fonction rénale ou d’une espérance de vie inférieure à 10 ans. Dans ces indications, les inhibiteurs de checkpoints font l’objet d’essais cliniques dans le contexte périopératoire (tableau 2).5, 11
L’efficacité de l’immunothérapie néo-adjuvante a notamment été évaluée sur l’analyse anatomopathologique de la pièce opératoire après la cystectomie. L’étude de phase II PURE-01, qui utilisait le pembrolizumab, notait 42 % de réponse tumorale complète (pT0) lors de la cystectomie et 54 % de diminution du stade pathologique inférieur à pT2 (i.e. tumeur n’envahissant pas le muscle detrusor).11 Le traitement était plus efficace en cas de tumeurs PD-L1 positives par rapport à celles qui exprimaient moins de 10 % de PD-L1. En ce sens, l’immunothérapie néo-adjuvante semble efficace pour les patients atteints de TVIM non métastatiques avec un statut PD-L1 positif, et paraît plus simple pour la pratique quotidienne qu’une chimiothérapie par cisplatine.
Plusieurs essais thérapeutiques explorent l’hypothèse d’un effet des inhibiteurs de checkpoints comme thérapie adjuvante post-cystectomie (par exemple AMBASSADOR, Checkmate 274, IMvigor010), l’étalon-or consistant en une chimiothérapie par cisplatine pour les patients atteints de TVIM non métastatique, avec comme objectif principal de prolonger la survie des patients.
Aucune donnée n’a permis d’obtenir une autorisation de mise sur le marché d’une immunothérapie dans cette indication à ce jour. L’immunothérapie n’a pas encore fait ses preuves en la matière, mais plusieurs essais sont actuellement en cours (tableau 1 et 2 ).5
L’efficacité de l’immunothérapie néo-adjuvante a notamment été évaluée sur l’analyse anatomopathologique de la pièce opératoire après la cystectomie. L’étude de phase II PURE-01, qui utilisait le pembrolizumab, notait 42 % de réponse tumorale complète (pT0) lors de la cystectomie et 54 % de diminution du stade pathologique inférieur à pT2 (i.e. tumeur n’envahissant pas le muscle detrusor).11 Le traitement était plus efficace en cas de tumeurs PD-L1 positives par rapport à celles qui exprimaient moins de 10 % de PD-L1. En ce sens, l’immunothérapie néo-adjuvante semble efficace pour les patients atteints de TVIM non métastatiques avec un statut PD-L1 positif, et paraît plus simple pour la pratique quotidienne qu’une chimiothérapie par cisplatine.
Plusieurs essais thérapeutiques explorent l’hypothèse d’un effet des inhibiteurs de checkpoints comme thérapie adjuvante post-cystectomie (par exemple AMBASSADOR, Checkmate 274, IMvigor010), l’étalon-or consistant en une chimiothérapie par cisplatine pour les patients atteints de TVIM non métastatique, avec comme objectif principal de prolonger la survie des patients.
Aucune donnée n’a permis d’obtenir une autorisation de mise sur le marché d’une immunothérapie dans cette indication à ce jour. L’immunothérapie n’a pas encore fait ses preuves en la matière, mais plusieurs essais sont actuellement en cours (
Indications dans les tumeurs de la vessie n’infiltrant pas le muscle
On distingue trois groupes à risque de TVNIM (faible, intermédiaire et haut) en fonction de leur capacité de récidive et de progression. Outre la résection transurétrale de la vessie, le traitement adjuvant dépend du groupe à risque avec soit une simple surveillance (faible risque), soit une chimiothérapie intravésicale (risque intermédiaire), soit des instillations de BCG (risque élevé ou intermédiaire). Pour certaines TVNIM à très haut risque, et en cas d’échec du traitement conservateur, une cystectomie totale peut être indiquée.4, 10
La première immunothérapie pour le traitement des TVNIM était en réalité le BCG intravésical. Le mécanisme d’action de ce micro-organisme dans le traitement des TVNIM n’est pas totalement élucidé, mais il semble qu’une exposition répétée au BCG permettrait le déclenchement d’une réaction d’hypersensibilité menant à une réponse immunitaire contre les cellules tumorales.12 Depuis les instillations intravésicales de BCG, les traitements d’immunothérapie dans les TVNIM n’ont que peu évolué jusqu’à l’avènement des inhibiteurs du contrôle immunitaire.13
Plusieurs essais cliniques évaluent actuellement l’efficacité des anticorps anti-PD-1 et anti-PD-L1 pour les TVNIM soit par voie intravésicale, soit par voie systémique, notamment pour les patients réfractaires aux BCG non candidats à une cystectomie d’emblée (tableau 1 ) (KEYNOTE-057, KEYNOTE-676).5, 14 Un taux de réponse complète a été rapporté dans 40,2 % des cas et l’absence de progression de la maladie au muscle détrusor dans une cohorte de 130 patients traités par pembrolizumab.5
Les inhibiteurs de checkpoints sont aussi étudiés dans le cas de TVNIM à haut risque de progression naïf de toute instillation de BCG et/ou combinés au BGC. L’essai ALBAN (AFU-GETUG 37), porté par le comité de cancérologie de l’Association française d’urologie (AFU), est un essai randomisé de phase III incluant les patients atteints d’une TVNIM de haut risque n’ayant pas été préalablement traités par du BCG. Les patients sont tirés au sort entre deux bras de traitement : soit un traitement standard avec des instillations de BCG seul, soit des instillations de BCG combinés à l’atézolizumab en intraveineux pour une durée de 1 an.
Par ailleurs, certains essais cliniques cherchent à explorer le rôle des anti-PD-1 et anti-PD-L1 pour les TVNIM non exposées aux instillations de BCG : leurs résultats pourraient donner des informations sur le timing idéal d’initiation des inhibiteurs de checkpoints pour les TVNIM.
Les inhibiteurs de checkpoints ne sont actuellement pas indiqués dans les TVNIM en dehors des essais thérapeutiques (tableaux 1 et 2 ).
La première immunothérapie pour le traitement des TVNIM était en réalité le BCG intravésical. Le mécanisme d’action de ce micro-organisme dans le traitement des TVNIM n’est pas totalement élucidé, mais il semble qu’une exposition répétée au BCG permettrait le déclenchement d’une réaction d’hypersensibilité menant à une réponse immunitaire contre les cellules tumorales.12 Depuis les instillations intravésicales de BCG, les traitements d’immunothérapie dans les TVNIM n’ont que peu évolué jusqu’à l’avènement des inhibiteurs du contrôle immunitaire.13
Plusieurs essais cliniques évaluent actuellement l’efficacité des anticorps anti-PD-1 et anti-PD-L1 pour les TVNIM soit par voie intravésicale, soit par voie systémique, notamment pour les patients réfractaires aux BCG non candidats à une cystectomie d’emblée (
Les inhibiteurs de checkpoints sont aussi étudiés dans le cas de TVNIM à haut risque de progression naïf de toute instillation de BCG et/ou combinés au BGC. L’essai ALBAN (AFU-GETUG 37), porté par le comité de cancérologie de l’Association française d’urologie (AFU), est un essai randomisé de phase III incluant les patients atteints d’une TVNIM de haut risque n’ayant pas été préalablement traités par du BCG. Les patients sont tirés au sort entre deux bras de traitement : soit un traitement standard avec des instillations de BCG seul, soit des instillations de BCG combinés à l’atézolizumab en intraveineux pour une durée de 1 an.
Par ailleurs, certains essais cliniques cherchent à explorer le rôle des anti-PD-1 et anti-PD-L1 pour les TVNIM non exposées aux instillations de BCG : leurs résultats pourraient donner des informations sur le timing idéal d’initiation des inhibiteurs de checkpoints pour les TVNIM.
Les inhibiteurs de checkpoints ne sont actuellement pas indiqués dans les TVNIM en dehors des essais thérapeutiques (
Limites d’utilisation
Contrairement à la chimiothérapie par cisplatine, l’immunothérapie par inhibiteurs de checkpoints peut être administrée malgré la présence d’une insuffisance rénale et d’un état général diminué (ECOG performance status = 2), ce dont souffrent un nombre non négligeable de patients atteints d’un cancer de la vessie localement avancé ou métastatique. Les critères d’exclusion les plus fréquemment rencontrés dans les essais cliniques sur les inhibiteurs de checkpoints dans le carcinome urothélial sont les suivants : métastases du système nerveux central, méningite carcinomateuse, maladie auto-immune, pneumonie interstitielle, sepsis nécessitant une antibiothérapie intraveineuse, infection virale par les virus des hépatites B et ou celui de l’immunodéficience humaine. Les patients ayant reçu des traitements préalables ciblant PD-1 et PD-L1 ne peuvent pas, également, bénéficier d’un second traitement.
À ce jour, l’expression de PD-L1 semble être le biomarqueur le plus fiable pour prédire l’efficacité de l’immunothérapie ciblant PD-1 et PD-L1 dans le cancer de la vessie.15 La survie globale paraît en effet augmentée chez les patients avec un haut taux d’expression de PD-L1 par les cellules tumorales. Toutefois, les différents essais cliniques en la matière montrent des résultats variables et hétérogènes. Le rôle de l’expression de PD-L1 par les cellules tumorales et leur environnement dans la prédiction de la réponse à l’immunothérapie et de la survie globale demeure donc encore incertain.
À ce jour, l’expression de PD-L1 semble être le biomarqueur le plus fiable pour prédire l’efficacité de l’immunothérapie ciblant PD-1 et PD-L1 dans le cancer de la vessie.15 La survie globale paraît en effet augmentée chez les patients avec un haut taux d’expression de PD-L1 par les cellules tumorales. Toutefois, les différents essais cliniques en la matière montrent des résultats variables et hétérogènes. Le rôle de l’expression de PD-L1 par les cellules tumorales et leur environnement dans la prédiction de la réponse à l’immunothérapie et de la survie globale demeure donc encore incertain.
Une meilleure qualité de vie
Le récent développement des traitements par inhibiteurs de checkpoints, permettant d’augmenter la capacité du système immunitaire à éliminer les cellules tumorales, ouvre un nouvel espoir pour la prise en charge des tumeurs de la vessie. Le traitement par ces inhibiteurs pourrait s’inscrire à terme dans des schémas de thérapies multimodales et devrait toujours s’intégrer dans une prise en charge multidisciplinaire.
Les inhibiteurs du contrôle immunitaire ont un profil de tolérabilité qui semble plus acceptable que la chimiothérapie. Une étude sur la qualité de vie des patients sous traitement de pembrolizumab comparée à ceux sous chimiothérapie a mis en évidence une qualité de vie stable, voire améliorée, avec l’immunothérapie, alors que la chimiothérapie provoquait un déclin de l’état de santé global et de la qualité de vie.16 Si l’objet de cet article n’est pas médico-économique, on ne pourra toutefois pas échapper à la considération légitime concernant le prix de ces molécules, qui risque d’accroître de façon exponentielle le coût de la prise en charge de ces cancers.
Les inhibiteurs du contrôle immunitaire ont un profil de tolérabilité qui semble plus acceptable que la chimiothérapie. Une étude sur la qualité de vie des patients sous traitement de pembrolizumab comparée à ceux sous chimiothérapie a mis en évidence une qualité de vie stable, voire améliorée, avec l’immunothérapie, alors que la chimiothérapie provoquait un déclin de l’état de santé global et de la qualité de vie.16 Si l’objet de cet article n’est pas médico-économique, on ne pourra toutefois pas échapper à la considération légitime concernant le prix de ces molécules, qui risque d’accroître de façon exponentielle le coût de la prise en charge de ces cancers.
Références
1. Données globales d’épidémiologie des cancers - Épidémiologie des cancers [Internet]. https://bit.ly/39AGKnm
2. Rosenberg JE, Carroll PR, Small EJ. Update on chemotherapy for advanced bladder cancer. J Uroll 2005;174:14‑20.
3. Rouprêt M, Pignot G, Masson-Lecomte A, et al. Recommandations françaises du comité de cancérologie de l’AFU – actualisation 2020-2022 : tumeurs de la vessie. Prog Urol 2020;30(12S):S78‑135.
4. Witjes JA, Bruins HM, Cathomas R, et al. European Association of Urology Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2020 Guidelines. Eur Urol 2021;79:82-104.
5. Lenfant L, Aminsharifi A, Seisen T, Rouprêt M. Current status and future directions of the use of novel immunotherapeutic agents in bladder cancer. Curr Opin Urol 2020;30:428‑40.
6. Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015‑26.
7. Powles T, Durán I, van der Heijden MS, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2018;391:748‑57.
8. Plimack ER, Bellmunt J, Gupta S, et al. Safety and activity of pembrolizumab in patients with locally advanced or metastatic urothelial cancer (KEYNOTE-012): a non-randomised, open-label, phase 1b study. Lancet Oncol 2017;18:212‑20.
9. Balar AV, Galsky MD, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 2017;389:67‑76.
10. Rouprêt M, Neuzillet Y, Pignot G, et al. Recommandations françaises du Comité de Cancérologie de l’AFU – Actualisation 2018–2020 : tumeurs de la vessie. Prog Urol 20 2019;28(S1):R48‑80.
11. Necchi A, Anichini A, Raggi D, et al. Pembrolizumab as neoadjuvant therapy before radical cystectomy in patients with muscle-invasive urothelial bladder carcinoma (PURE-01): an open-label, single-arm, phase II study. J Clin Oncol 2018;36:3353-60.
12. Adam SM, Derré L, Jichlinski P, Lucca I. Immunothérapie : une révolution dans la prise en charge du cancer de la vessie ? Rev Med Suisse 2017;13:2074‑8.
13. Farina MS, Lundgren KT, Bellmunt J. Immunotherapy in urothelial cancer: recent results and future perspectives. Drugs 2017;77:1077‑89.
14. Meng MV, Gschwend JE, Shore N, Grossfeld GD, Mostafid H, Black PC. Emerging immunotherapy options for bacillus Calmette-Guérin unresponsive nonmuscle invasive bladder cancer. J Urol 2019;202:1111‑9.
15. Carosella ED, Ploussard G, LeMaoult J, Desgrandchamps F. A systematic review of immunotherapy in urologic cancer: evolving roles for targeting of CTLA-4, PD-1/PD-L1, and HLA-G. Eur Urol 2015;68:267‑79.
16. Vaughn DJ, Bellmunt J, Fradet Y, et al. Health-related quality-of-life analysis from keynote-045: a phase III study of pembrolizumab versus chemotherapy for previously treated advanced urothelial cancer. J Clin Oncol 2018;36:1579‑87.
2. Rosenberg JE, Carroll PR, Small EJ. Update on chemotherapy for advanced bladder cancer. J Uroll 2005;174:14‑20.
3. Rouprêt M, Pignot G, Masson-Lecomte A, et al. Recommandations françaises du comité de cancérologie de l’AFU – actualisation 2020-2022 : tumeurs de la vessie. Prog Urol 2020;30(12S):S78‑135.
4. Witjes JA, Bruins HM, Cathomas R, et al. European Association of Urology Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2020 Guidelines. Eur Urol 2021;79:82-104.
5. Lenfant L, Aminsharifi A, Seisen T, Rouprêt M. Current status and future directions of the use of novel immunotherapeutic agents in bladder cancer. Curr Opin Urol 2020;30:428‑40.
6. Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015‑26.
7. Powles T, Durán I, van der Heijden MS, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2018;391:748‑57.
8. Plimack ER, Bellmunt J, Gupta S, et al. Safety and activity of pembrolizumab in patients with locally advanced or metastatic urothelial cancer (KEYNOTE-012): a non-randomised, open-label, phase 1b study. Lancet Oncol 2017;18:212‑20.
9. Balar AV, Galsky MD, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 2017;389:67‑76.
10. Rouprêt M, Neuzillet Y, Pignot G, et al. Recommandations françaises du Comité de Cancérologie de l’AFU – Actualisation 2018–2020 : tumeurs de la vessie. Prog Urol 20 2019;28(S1):R48‑80.
11. Necchi A, Anichini A, Raggi D, et al. Pembrolizumab as neoadjuvant therapy before radical cystectomy in patients with muscle-invasive urothelial bladder carcinoma (PURE-01): an open-label, single-arm, phase II study. J Clin Oncol 2018;36:3353-60.
12. Adam SM, Derré L, Jichlinski P, Lucca I. Immunothérapie : une révolution dans la prise en charge du cancer de la vessie ? Rev Med Suisse 2017;13:2074‑8.
13. Farina MS, Lundgren KT, Bellmunt J. Immunotherapy in urothelial cancer: recent results and future perspectives. Drugs 2017;77:1077‑89.
14. Meng MV, Gschwend JE, Shore N, Grossfeld GD, Mostafid H, Black PC. Emerging immunotherapy options for bacillus Calmette-Guérin unresponsive nonmuscle invasive bladder cancer. J Urol 2019;202:1111‑9.
15. Carosella ED, Ploussard G, LeMaoult J, Desgrandchamps F. A systematic review of immunotherapy in urologic cancer: evolving roles for targeting of CTLA-4, PD-1/PD-L1, and HLA-G. Eur Urol 2015;68:267‑79.
16. Vaughn DJ, Bellmunt J, Fradet Y, et al. Health-related quality-of-life analysis from keynote-045: a phase III study of pembrolizumab versus chemotherapy for previously treated advanced urothelial cancer. J Clin Oncol 2018;36:1579‑87.