Si le traitement du cancer de l’endomètre est chirurgical dans un premier temps, la majorité des patientes relève d’un traitement adjuvant. Ce traitement a pour objectif à la fois le contrôle locorégional vaginal et pelvien (par la curiethérapie et la radiothérapie externe) et l’amélioration de la survie (par la chimiothérapie). Les traitements antihormonaux, les thérapies ciblées et l’immunothérapie n’ont, à ce jour, pas de place en traitement adjuvant pour les cancers de l’endomètre.1
Des critères histologiques
Pour décider de la mise en œuvre d’un traitement adjuvant, plusieurs critères sur l’examen histologique sont à prendre en compte :
– le type histologique ;
– le grade ;
– le pourcentage d’envahissement myométrial (moins de 50 % [stade IA] ou plus de 50 % [stade IB]) ;
– un envahissement du chorion cervical (signant le stade II) ;
– l’absence d’emboles, ou leur caractère focal ou diffus ;
– l’atteinte des séreuses ou annexes, qu’elle soit ou non par contiguïté (stade IIIA), du vagin ou des paramètres (IIIB) ;
– une atteinte ganglionnaire pelvienne (IIIC1) ou lombo-aortique (IIIC2) ;
– une atteinte vésicale ou rectale (stade IVA) ;
– une instabilité microsatellitaire, les mutations de la polymérase E et les anomalies de p53.1
Des indications variables selon le risque de rechute
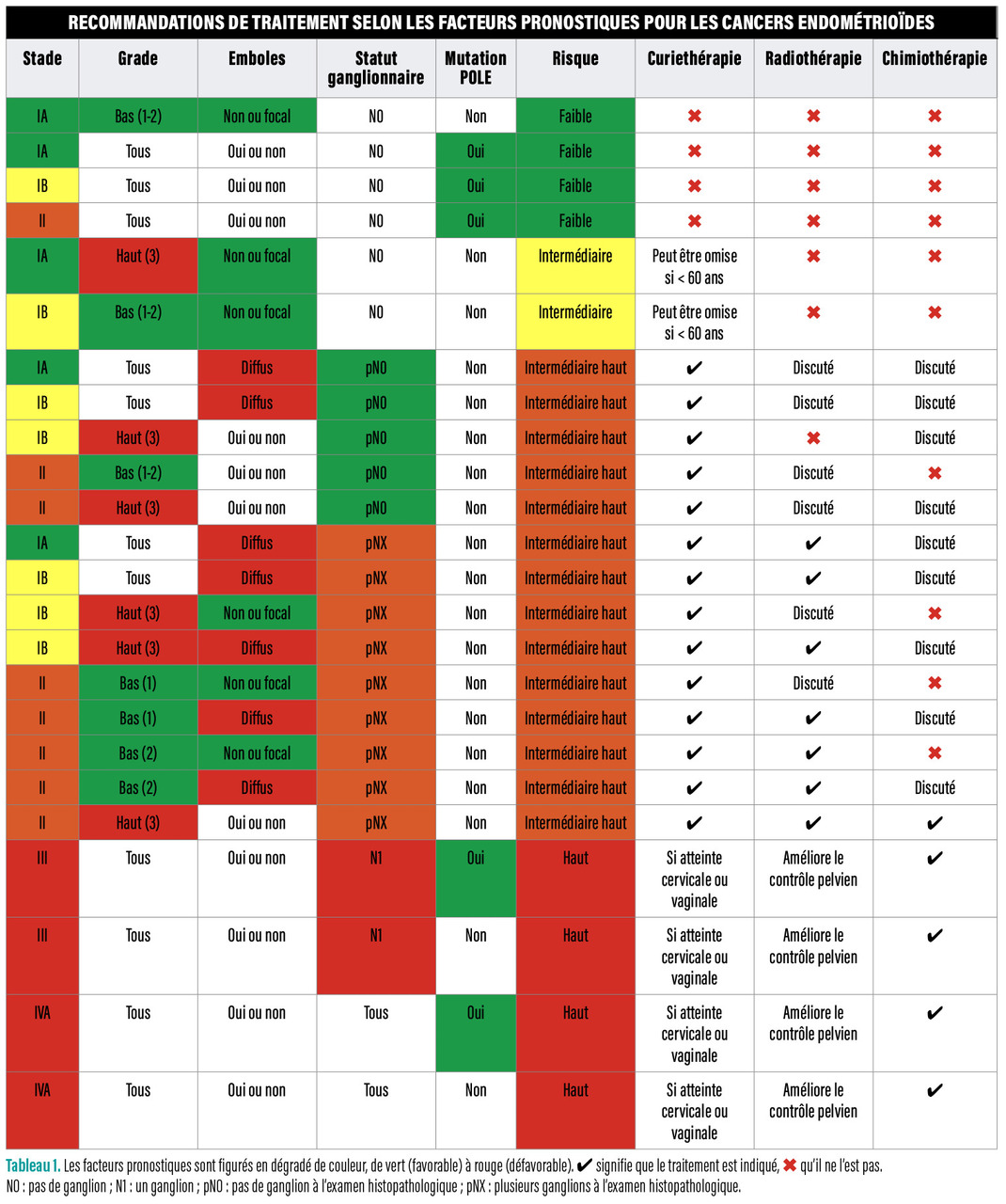
Les indications du traitement adjuvant dépendent du stade du cancer de l’endomètre et donc du niveau de risque. Les
Pas de traitement adjuvant en cas de risque faible
Les patientes ayant tous les critères suivants : cancer de type endométrioïde, stade IA, bas grade et emboles absents ou focaux ont un risque de rechute très faible. Sur la base de plusieurs essais, aucun traitement adjuvant ne leur est recommandé.2
De même, en cas de mutation de la polymérase E et de stade I ou II, le pronostic est excellent ; les patientes sont donc reclassées en risque faible, quels que soient les autres critères histologiques.1
Deux profils à risque intermédiaire
En cas de cancer endométrioïde, pour être considérées à risque intermédiaire, les patientes ne doivent pas avoir d’emboles diffus et ne présenter que l’un des critères suivants : stade IB ou haut grade. Dans cette population, des études comparant la radiothérapie externe à la curiethérapie ont montré un bon contrôle local avec moins de séquelles après curiethérapie seule.3 De ce fait, c’est cette dernière qui est recommandée. Chez les patientes de moins de 60 ans, de pronostic plus favorable que les plus âgées, une abstention de traitement adjuvant peut être proposée pour préserver la qualité de vie, notamment sur le plan sexuel.
Enfin, les patientes avec un cancer de type non endométrioïde purement intramuqueux (c’est-à-dire sans invasion du myomètre) et sans emboles ont également un niveau de risque intermédiaire. Chez ces patientes, le traitement adjuvant est discuté : certains résultats d’études plaident en faveur d’une efficacité de la chimiothérapie et d’autres montrent un pronostic excellent avec un traitement par curiethérapie seule.4
Risque intermédiaire haut : se référer à la stadification ganglionnaire
Les patientes à risque intermédiaire haut sont atteintes soit d’un cancer de stade IA avec emboles diffus, soit d’un cancer de stade IB et de haut grade, soit d’un cancer de stade II (c’est-à-dire avec atteinte cervicale). Elles ont un risque un peu plus élevé d’atteinte ganglionnaire, créant une dichotomie selon que la stadification ganglionnaire chirurgicale a été réalisée ou non :
– si elle a été réalisée, le traitement adjuvant peut le plus souvent se limiter à une curiethérapie seule. Le stade II fait discuter une radiothérapie externe, le haut grade une chimiothérapie et la présence d’emboles les deux ;
– en cas d’absence de stadification ganglionnaire (patiente âgée ou comorbide, par exemple), la radiothérapie est le plus souvent recommandée. On ne peut y surseoir qu’en cas de cancer de haut grade mais sans emboles, ou de stade II de bas grade.1 À nouveau, le haut grade et la présence d’emboles font discuter une chimiothérapie.
La chimiothérapie bénéficie aux patientes à haut risque
Les patientes à haut risque sont celles qui ont soit un cancer de type endométrioïde de stade avancé (III-IVA), soit un cancer de type non endométrioïde s’étendant au-delà de la muqueuse utérine. Dans cette population, des études ont montré le bénéfice de la chimiothérapie.
L’analyse combinée des essais NSGO-EC-9501/EORTC-55991 et MaNGO ILIADE-III a démontré un bénéfice en survie sans rechute à l’adjonction de chimiothérapie ; elle comparait la radiothérapie seule à la chimiothérapie (3 ou 4 cycles) suivie de la radiothérapie (sur un mode séquentiel).5
L’essai PORTEC 3 a comparé la radiothérapie seule à la chimio-radiothérapie concomitante suivie de quatre cycles de chimiothérapie par carboplatine-paclitaxel avec un bénéfice, cette fois-ci, en survie globale.6
Enfin, l’essai GOG-258 a comparé chimio-radiothérapie concomitante suivie de quatre cycles de chimiothérapie par carboplatine-paclitaxel à une chimiothérapie exclusive par six cycles de carboplatine-paclitaxel. Il n’a pas montré de différence en survie, mais le contrôle pelvien était meilleur en cas de radiothérapie.7
Il est donc essentiel de discuter une chimiothérapie chez ces patientes, y compris pour celles d’âge avancé, facteur de risque défavorable.
Les patientes atteintes de carcinosarcomes n’étaient pas incluses dans ces deux derniers essais ; une chimioradiothérapie concomitante ne peut donc pas leur être proposée.6, 7 La curiethérapie est surtout proposée en cas d’atteinte cervicale ou vaginale car ces localisations sont plus à risque de rechute du fond vaginal.
Description des différentes méthodes thérapeutiques
Lorsque l’indication d’un traitement adjuvant est posée, trois options sont possibles : curiethérapie, radiothérapie et chimiothérapie.
Curiethérapie intravaginale en ambulatoire
Il s’agit d’une radiothérapie interne réalisée en plaçant un dispositif dans le vagin de la patiente. Une source radioactive y circule et traite le tiers supérieur du vagin.
La curiethérapie est le plus souvent réalisée en haut débit de dose, ce qui permet des traitements courts en ambulatoire. Il existe divers fractionnements : trois ou quatre séances s’il s’agit d’un traitement par curiethérapie seule ; une ou deux séances en cas de curiethérapie de complément après radiothérapie externe.8 Les principaux effets indésirables sont la sécheresse et les synéchies vaginales ainsi que la cystite et la rectite radiques, le plus souvent peu intenses.
Radiothérapie externe, des recommandations actualisées
Les recommandations françaises de radiothérapie viennent d’être actualisées.8
La radiothérapie externe est réalisée par un accélérateur linéaire produisant des photons de haute énergie qui traversent la patiente et se focalisent sur les volumes à traiter (voûte vaginale, ganglions pelviens et ganglions lombo-aortiques, uniquement si ceux-ci sont envahis). Le traitement est réalisé en 25 à 28 séances sur un rythme de cinq séances par semaine pour un total de 45 à 50,4 Gy. Un complément par curiethérapie peut être envisagé selon les facteurs de risque de rechute vaginale.
Les effets indésirables sont similaires à ceux de la curiethérapie mais sur un volume plus étendu avec, de ce fait, un risque plus élevé de séquelles digestives.
La radiothérapie par modulation d’intensité (qui permet de mieux conformer la dose aux volumes grâce à la multiplication des points d’entrée) a démontré un bénéfice en matière de réduction des effets indésirables. Elle n’est cependant pas, à ce jour, reconnue par la Haute Autorité de santé, ce qui limite son utilisation.
Chimiothérapie, le plus souvent par carboplatine-paclitaxel
Le protocole de chimiothérapie le plus couramment utilisé est celui par carboplatine-paclitaxel, du fait d’une meilleure tolérance que le protocole cisplatine-doxorubicine-paclitaxel, sans perte d’efficacité. Il est réalisé toutes les trois semaines, grâce à une chambre implantable, en hospitalisation de jour.
En cas de chimio-radiothérapie concomitante, le protocole utilisé dans les essais PORTEC 3 et GOG-258 était de deux injections de cisplatine 50 mg/m2 à trois semaines d’intervalle (soit semaines 1 et 4), avec hydratations préalable et ultérieure, pour protéger contre la néphrotoxicité tubulaire.6, 7
Des traitements personnalisés adaptés au stade des lésions et au niveau de risque
Les traitements adjuvants des cancers de l’endomètre sont de plus en plus personnalisés. La tendance est actuellement à la désescalade thérapeutique chez les patientes à risque faible ou intermédiaire de rechute pour limiter les séquelles des traitements ; a contrario, une intensification chez les patientes à risque élevé augmente les chances de guérison.
1. Concin N, Matias-Guiu X, Vergote I, Cibula D, Mirza MR, Marnitz S, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021;31(1):12‑39.
2. Blake P, Swart AM, Orton J, Kitchener H, Whelan T, Lukka H, et al. Adjuvant external beam radiotherapy in the treatment of endometrial cancer (MRC ASTEC and NCIC CTG EN.5 randomised trials): pooled trial results, systematic review, and meta-analysis. The Lancet 2009;373(9658):137‑46.
3. For the PORTEC Study Group, Wortman BG, Creutzberg CL, Putter H, Jürgenliemk-Schulz IM, Jobsen JJ, et al. Ten-year results of the PORTEC-2 trial for high-intermediate risk endometrial carcinoma: improving patient selection for adjuvant therapy. Br J Cancer 2018;119(9):1067‑74.
4. Qu XM, Velker VM, Leung E, Kwon JS, Elshaikh MA, Kong I, et al. The role of adjuvant therapy in stage IA serous and clear cell uterine cancer: A multi-institutional pooled analysis. Gynecol Oncol 2018;149(2):283‑90.
5. Hogberg T, Signorelli M, de Oliveira CF, Fossati R, Lissoni AA, Sorbe B, et al. Sequential adjuvant chemotherapy and radiotherapy in endometrial cancer – Results from two randomised studies. Eur J Cancer 2010;46(13):2422‑31.
6. de Boer SM, Powell ME, Mileshkin L, Katsaros D, Bessette P, Haie-Meder C, et al. Adjuvant chemoradiotherapy versus radiotherapy alone in women with high-risk endometrial cancer (PORTEC-3): patterns of recurrence and post-hoc survival analysis of a randomised phase 3 trial. Lancet Oncol 2019;20(9):1273‑85.
7. Matei D, Filiaci V, Randall ME, Mutch D, Steinhoff MM, DiSilvestro PA, et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. N Engl J Med 2019;380(24):2317‑26.
8. Chargari C, Peignaux K, Escande A, Renard S, Lafond C, Petit A, et al. Radiotherapy for endometrial cancer. Cancer/Radiothérapie 2022;26 (1-2):309-14.