Le cancer de l’endomètre est le cancer gynécologique pelvien féminin le plus fréquent dans les pays développés. L’âge médian au diagnostic est de 65 ans. Toutefois, 5 % des femmes diagnostiquées ont moins de 40 ans. Chez ces patientes, le traitement de référence (supposant une hystérectomie) peut être différé sous certaines conditions, le traitement conservateur du cancer de l’endomètre constituant alors une alternative temporaire à l’hystérectomie.1 Par extension et en raison de la fréquence de l’association avec une hyperplasie atypique, le désir de grossesse étant devenu plus tardif qu’avant, la fréquence des néoplasies endométriales augmente chez les femmes ayant un projet de grossesse. La conservation de la fertilité constitue un enjeu important chez ces patientes. Une approche combinée associant résection hystéroscopique suivie d’un traitement antigonadotrope constitue une option efficace de préservation de la fertilité.
Conditions requises pour un traitement conservateur
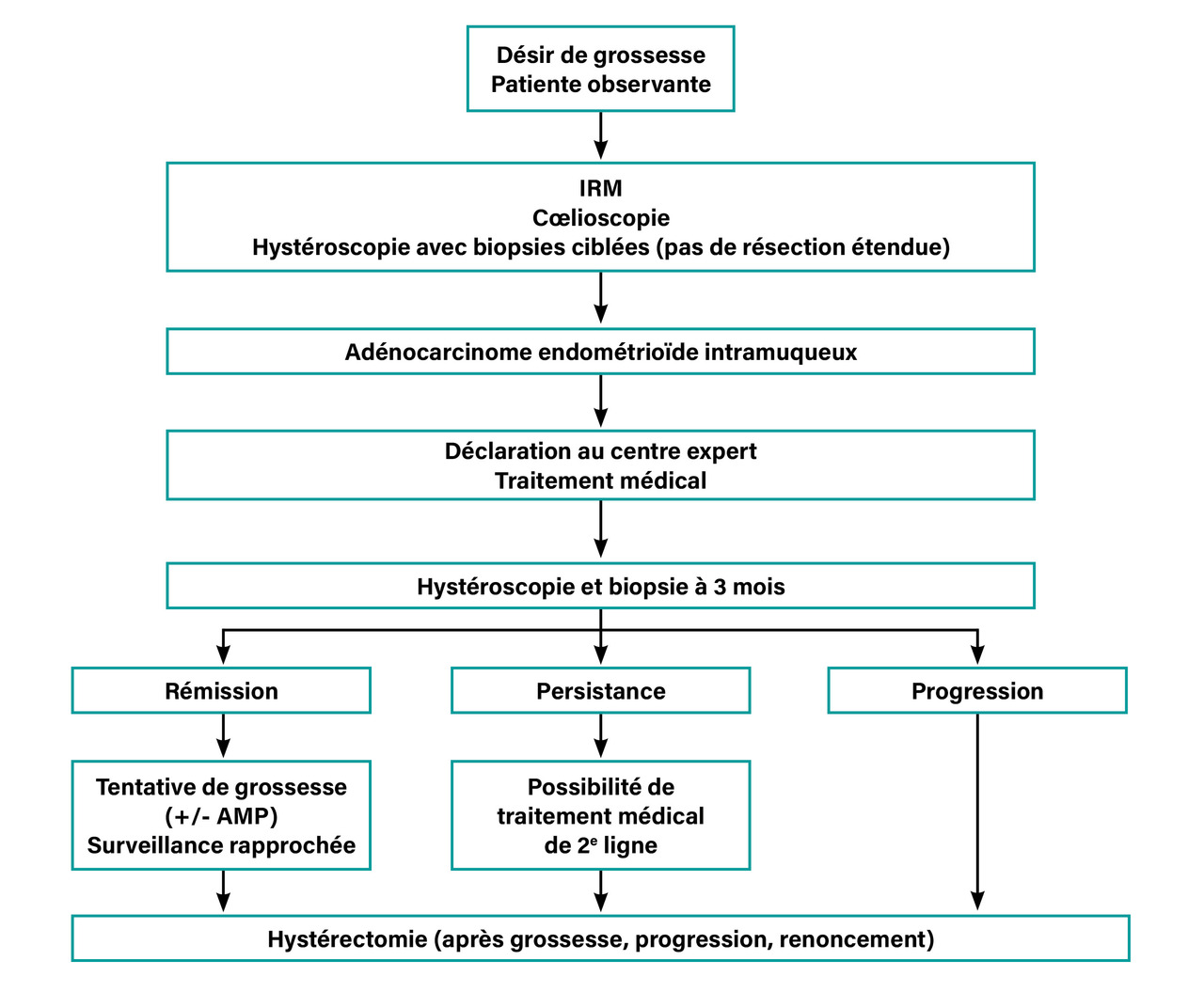
La sécurité du traitement conservateur est bien documentée lorsque deux critères sont réunis.
Histologie bien caractérisée
L’anatomopathologie doit conclure à une hyperplasie atypique ou à un adénocarcinome de type endométrioïde de bas grade. Si un traitement conservateur est envisagé pour un adénocarcinome endométrioïde à lésion de grade 3, le recours à un centre expert avec caractérisation biomoléculaire est indispensable. Lorsque l’échantillonnage endométrial ayant fait le diagnostic de néoplasie endométriale est limité, une hystéroscopie opératoire doit être envisagée.
Extension documentée
La lésion doit correspondre à un stade IA (FIGO 2009) sans envahissement myométrial ni extension loco-régionale constatée sur l’imagerie par résonance magnétique (IRM) pelvienne et lombo-aortique. En cas d’adénocarcinome, une cœlioscopie exploratrice concomitante de l’hystéroscopie opératoire permet une exploration abdominopelvienne attentive ainsi qu’un clampage tubaire temporaire le temps de l’hystéroscopie précédemment évoquée afin d’éviter le passage transtubaire de cellules malignes.
Différents traitements sont disponibles
Si l’hystérectomie avec annexectomie reste le traitement de référence, des alternatives transitoires sont possibles.
Résection endométriale par hystéroscopie suivie d’un traitement progestatif
Les études les plus récentes suggèrent que les patientes ayant subi une résection hystéroscopique suivie d’un traitement progestatif obtiennent le taux de rémission complète le plus élevé par rapport aux autres traitements existants de préservation de la fertilité.2
Plusieurs progestatifs possibles
Si la sécurité du traitement conservateur est bien admise, il n’y a pas de consensus concernant le type de progestatif, sa posologie, son mode d’administration et sa durée.
Les traitements les plus documentés sont l’acétate de mégestrol (MA), l’acétate de médroxyprogestérone (MPA), le stérilet au lévonorgestrel (DIU-LNG) et l’acétate de chlormadinone. Le choix de cette dernière molécule est fondé sur une tolérance satisfaisante et des effets indésirables limités (en particulier l’absence d’effet thromboembolique).3
Agonistes de la GnRH, une alternative ?
En raison de leur action antigonadotrope, les agonistes de la GnRH ont également fait l’objet d’évaluations cliniques. Malgré des taux de rémission semblables à ceux rapportés avec les progestatifs oraux, leur utilisation est peu recommandée en raison du nombre limité de données. De même, l’association DIU-LNG-agoniste de la GnRH peut sembler pertinente, mais elle n’a fait l’objet que de rares études.
Metformine, efficace ?
La metformine ajoutée au traitement progestatif semble associée à un meilleur taux de rémission en cas d’hyperplasie atypique en prise en charge conservatrice. Toutefois, ce bénéfice n’est pas confirmé dans toutes les études l’ayant évaluée, et l’effet préventif de la metformine sur le développement du cancer de l’endomètre n’a pas été démontré.
En revanche, la perte de poids en cas d’obésité (condition ayant pu favoriser le développement de l’adénocarcinome endométrial) constitue un enjeu important puisqu’il a été rapporté un taux de grossesse plus élevé chez les patientes ayant un indice de masse corporelle (IMC) inférieur à 30.4
Hystérectomie avec annexectomie
L’hystérectomie totale avec annexectomie demeure le traitement de référence, quel que soit l’âge de survenue des hyperplasies atypiques et adénocarcinome de l’endomètre.
Les jeunes patientes ayant un désir de grossesse éligibles à un traitement conservateur doivent en être informées.
En raison du risque de récidive, l’hystérectomie peut être nécessaire même en cas de rémission. Elle doit ainsi être envisagée après une naissance vivante, en cas de récidive ou de non-réponse après un suivi de douze mois, en cas de progression tumorale (développement d’un carcinome à partir d’une hyperplasie atypique, extension d’un adénocarcinome) ou si la surveillance endométriale est irrégulière.
Surveillance et risque de récidive après traitement médical
Il n’existe pas de consensus sur les stratégies de surveillance, notamment en ce qui concerne la fréquence du suivi et la méthode de prélèvement histologique. En revanche, il existe un accord unanime sur l’importance d’un suivi attentif (
À l’issue du traitement antigonadotrope, la réponse est évaluée à trois mois par une hystéroscopie avec biopsie endométriale.
Par la suite, une surveillance stricte est recommandée tous les trois mois par hystéroscopie diagnostique avec biopsie endométriale.
Le taux de rémission complète est de 75 % après traitement médical, toutes molécules confondues. Après les trois mois de traitement, lors du premier contrôle hystéroscopique, trois situations sont possibles :
– la rémission est complète (75 %) ; le traitement par progestatif peut alors être interrompu et une grossesse obtenue dès que possible. En l’absence de grossesse, la surveillance par hystéroscopie avec prélèvement endométrial est poursuivie ;
– les lésions progressent ; l’hystérectomie est ici recommandée ;
– les lésions persistent ; l’hystérectomie doit être également envisagée. En cas de refus, un traitement antigonadotrope de deuxième ligne peut être proposé.
En cas de progression ou de non-réponse au traitement médical de deuxième ligne, il faut savoir renoncer au traitement conservateur.
Pronostics oncologique et de fertilité favorables
Le pronostic oncologique de l’hyperplasie atypique, lésion limitée à l’endomètre sans pouvoir métastatique, est excellent. Toutefois, en l’absence d’hystérectomie, son risque d’évolution vers un cancer de l’endomètre est d’environ 30 %. Le cancer de l’endomètre de grade 1 limité à l’endomètre est de très bon pronostic, avec des taux de survie à cinq et dix ans de 100 % et 99 % respectivement en cas d’hystérectomie avec annexectomie bilatérale. En cas de traitement médical conservateur, ce taux de survie ne semble pas altéré. En revanche, plusieurs études suggèrent une augmentation du risque de cancer ovarien simultané (primitif ou métastatique).
La principale indication de traitement conservateur doit demeurer la préservation de la fertilité. Une récente méta-analyse conclut qu’environ un tiers des patientes concernées obtiennent une grossesse, le plus souvent par assistance médicale à la procréation, sans majorer le risque de récidive une fois la rémission obtenue.5
Optimiser la préservation de la fertilité par le recours à un centre expert
L’incidence du cancer de l’endomètre augmente chez les femmes en âge de procréer. De plus, l’âge des femmes lors de leurs grossesses tend à avancer. Ces deux paramètres rendent incontournable une prise en charge permettant la préservation de la fertilité.
L’efficacité de différents traitements médicaux et de leur combinaison (progestatifs, agonistes de la GnRH et metformine sous différentes formulations) est bien documentée.
Toutefois, en France, le recours à une réunion de concertation pluridisciplinaire dédiée (centre PREFERE, https://hupnvs.aphp.fr/centre-prefere/) permet d’optimiser la prise en charge de ces cas parfois difficiles et d’améliorer les connaissances.
1. Rodolakis A, Biliatis I, Morice P, Reed N, Mangler M, Kesic V, Denschlag D. European Society of Gynecological Oncology task force for fertility preservation: Clinical recommendations for fertility-sparing management in young endometrial cancer patients. Int J Gynecol Cancer 2015;25(7):1258-65.
2. Guillon S, Popescu N, Phelippeau J, Koskas M. A systematic review and meta-analysis of prognostic factors for remission in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma. Int J Gynaecol Obstet 2019;146(3):277-88.
3. Koskas M, Uzan J, Luton D, Rouzier R, Daraï E. Prognostic factors of oncologic and reproductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and meta-analysis. Fertil Steril 2014;101(3):785-94.
4. Gonthier C, Walker F, Luton D, Yazbeck C, Madelenat P, Koskas M. Impact of obesity on the results of fertility-sparing management for atypical hyperplasia and grade 1 endometrial cancer. Gynecol Oncol 2014;133(1):33-7.
5. Vaugon M, Peigné M, Phelippeau J, Gonthier C, Koskas M. IVF impact on the risk of recurrence of endometrial adenocarcinoma after fertility-sparing management. Reprod Biomed Online 2021;43(3):495-502.