Environ 30-40 % des patients ayant un cancer du rein développent des métastases, qui peuvent être présentes dès le diagnostic ou survenir au cours de la surveillance après le traitement local de la tumeur primitive. Les métastases métachrones peuvent se développer tardivement, parfois plus de 10 ans après le traitement initial. Les sites anatomiques les plus fréquemment concernés sont les ganglions sous- et sus-diaphragmatiques, les poumons, les os, le foie et le cerveau. Mais les atteintes d’autres organes tels que la thyroïde ou le pancréas ne sont pas rares. À la fin des années 1990, le pronostic des patients ayant un cancer du rein métastatique était très réservé puisque la médiane de survie était d’environ 1 an. Les traitements médicaux étaient alors limités à l’interféron alpha et à l’interleukine 2, aujourd’hui abandonnés. Depuis le début des années 2000, des progrès importants ont été réalisés avec le développement de traitements ciblant le micro- environnement tumoral, à savoir la néo-angiogenèse et plus récemment l’infiltrat immunitaire.
Ciblage thérapeutique de la néo-angiogenèse tumorale
De la biologie …
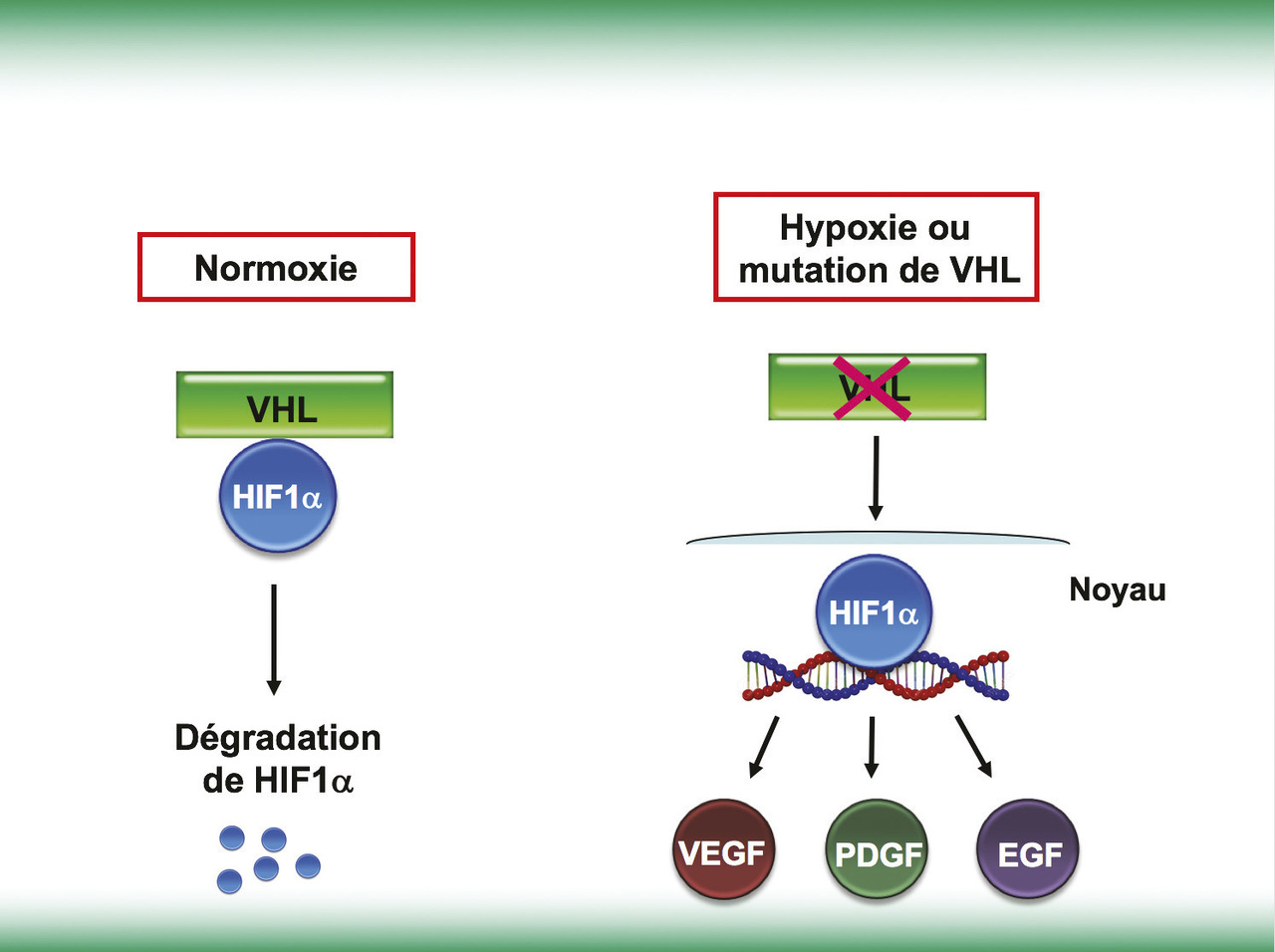
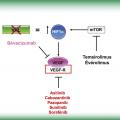
Le cancer du rein à cellules claires est la plus fréquente des variétés histologiques de cancer du rein (80 % des patients). Il est reconnu depuis longtemps comme une tumeur maligne hypervascularisée, suggérant une importante néo-angiogenèse tumorale en son sein. Les mécanismes moléculaires sous-tendant cette observation ont été reliés à la fréquente détection d’une mutation du gène von Hippel-Lindau (VHL), acquise (somatique) chez la majorité des patients. Dans la cellule normale, la protéine pVHL interagit avec un facteur de transcription, l’hypoxia-inducible factor 1α (HIF1α). Dans des conditions de normoxie, l’interaction avec pVHL conduit à l’hydroxylation et la dégradation de la protéine HIF1α (fig. 1). En situation d’hypoxie, ou en cas de mutation de la protéine pVHL dans les cellules tumorales, la protéine HIF1α n’est plus dégradée, migre dans le noyau et initie la transcription de gènes qui codent plusieurs facteurs de croissance impliqués dans l’angiogenèse : le vascular endothelial growth factor (VEGF), le platelet-derived growth factor (PDGF) ou le transforming growth factorα (TGF-α). Par sa liaison au récepteur du VEGF (VEGF-R) sur les cellules endothéliales et les péricytes présentes dans le micro-environnement tumoral, le VEGF représente le principal facteur de croissance impliqué dans les processus de néo-angiogenèse. Parmi les autres voies qui participent également à la néo-angiogenèse, la protéine mTOR (mammalian target of rapamycin) induit également une surexpression de HIF1α et, par son intermédiaire, des facteurs de l’angiogenèse.1
… à la clinique
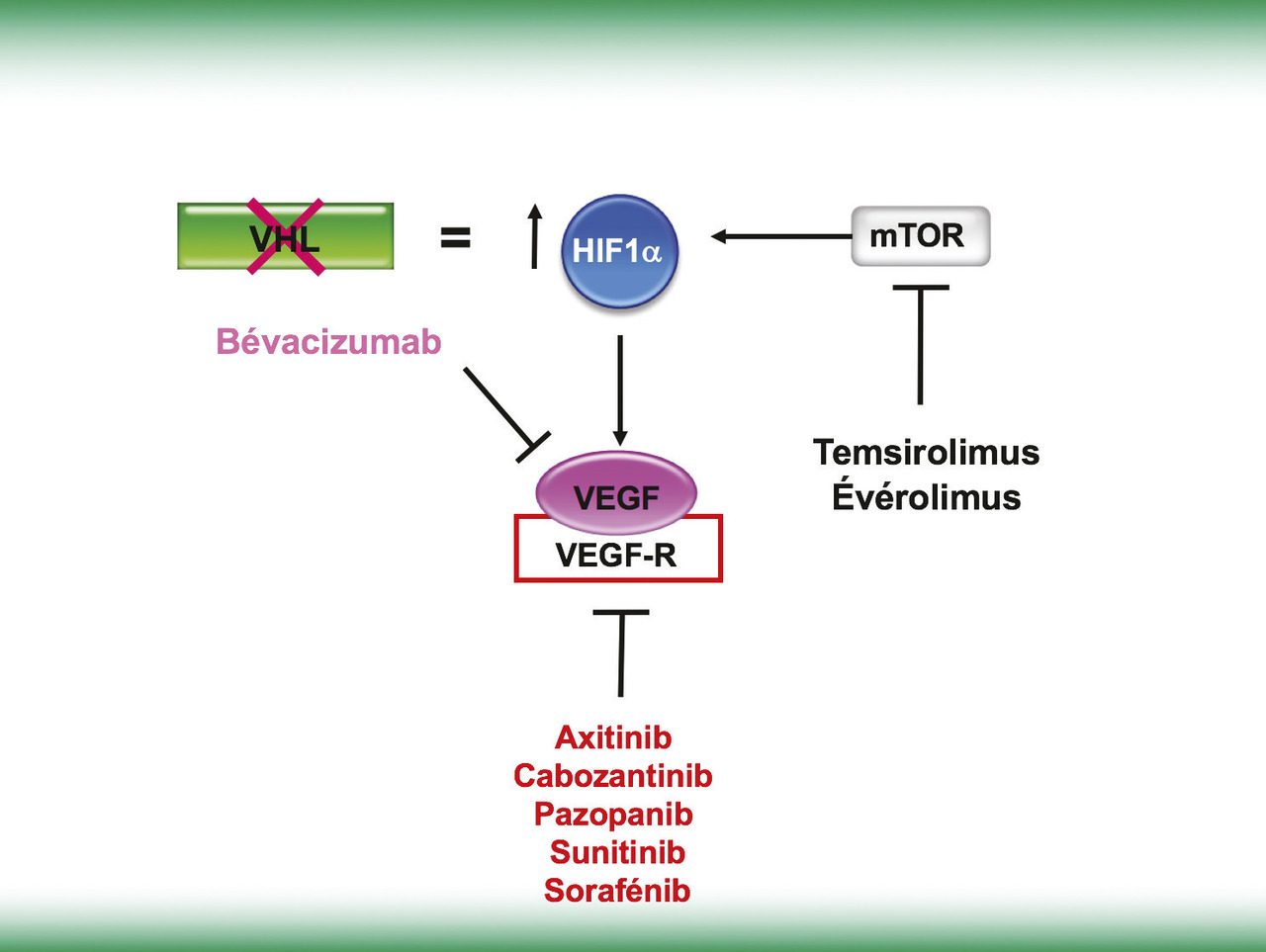
Les trois protéines VEGF, VEGF-R et mTOR sont les cibles des médicaments qui ont été développés et ont obtenu une autorisation de mise sur le marché (AMM) dans le traitement du cancer du rein métastatique (fig. 2). Le bévacizumab (Avastin) est un anticorps monoclonal anti-VEGF administré par voie intraveineuse (IV). Le temsirolimus (Torisel) et l’évérolimus (Afinitor) sont des inhibiteurs enzymatiques de l’activité sérine/thréonine kinase de la protéine mTOR et s’administrent respectivement par voies IV et orale. La cible préférentielle de l’axitinib (Inlyta), du cabozantinib (Cabometyx), du pazopanib (Votrient), du sunitinib (Sutent) et du sorafénib (Nexavar) est l’inhibition de l’activité tyrosine kinase du VEGF-R. D’autres cibles thérapeutiques sont également concernées et peuvent expliquer les différences dans l’efficacité et surtout les toxicités induites par ces traitements (v. tableau). Ils sont administrés par voie orale. Les toxicités observées avec ces traitements sont avant tout générales (asthénie), cutanées (syndrome mains-pieds), muqueuses (épistaxis, mucite buccale, épigastralgies, diarrhées, hémorroïdes…), cardiovasculaires (hypertension artérielle), hormonales (hypothyroïdie) et à moindre degré hématologiques (anémie, neutropénie, thrombopénie). Leur intensité est variable d’une molécule à l’autre et d’un patient à l’autre. Certaines d’entre elles nécessitent un traitement préventif (bains de bouche alcalins, inhibiteurs de la pompe à protons) mais la majorité sont gérées au cas par cas, avec adjonction à la demande d’un traitement antihypertenseur, d’un traitement substitutif thyroïdien... Leur chronicité est parfois plus difficile à supporter pour le patient que leur intensité, et des adaptations posologiques sont fréquemment nécessaires.2
Ciblage thérapeutique de l’infiltrat immunitaire
De la biologie…
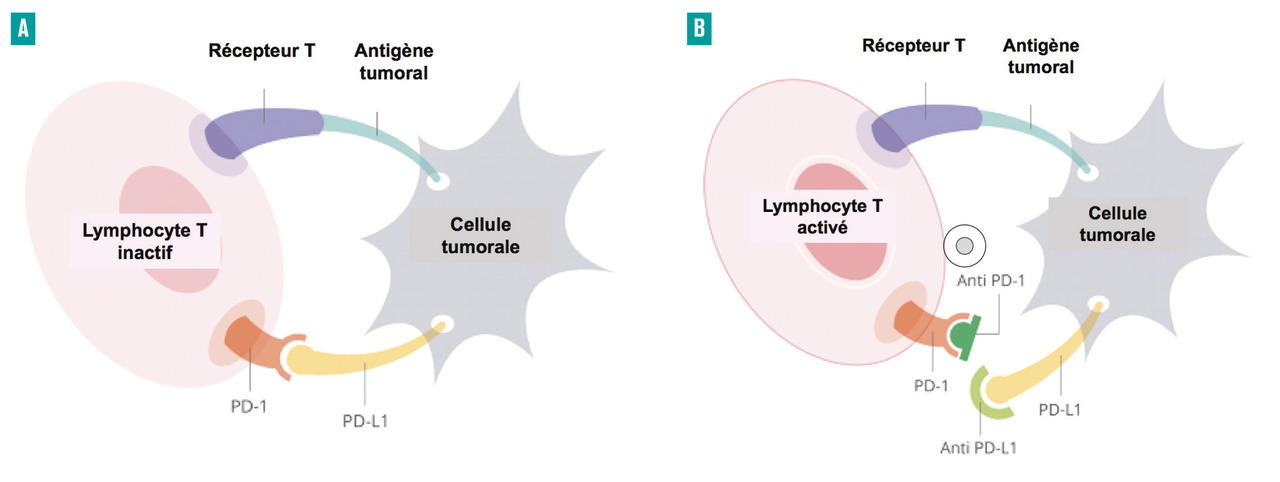
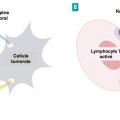
La restauration des défaillances du système immunitaire est une piste thérapeutique envisagée de longue date en cancérologie. L’utilisation de l’interféron alpha et de l’interleukine 2 dans les années 1990 s’inscrivait déjà dans cette perspective, mais avec des résultats décevants. La meilleure compréhension des mécanismes molé- culaires impliqués a permis le développement récent de nouvelles armes thérapeutiques. Les cellules cancéreuses échappent au système immunitaire en inhibant les cellules censées les détruire, et notamment les lymphocytes T. Cette inhibition est réalisée par l’activation de signaux négatifs, physiologiquement présents afin de limiter l’intensité des réactions immunitaires normales mais détournés par les cellules cancéreuses pour induire un état de tolérance à leur égard (fig. 3A). Parmi les nombreux signaux négatifs potentiellement activables par les cellules cancéreuses, la liaison du récepteur PD1 (programmed cell death 1) et de son ligand PD-L1 est responsable d’une inactivation lymphocytaire.3
… à la clinique
Le nivolumab est un anticorps monoclonal humain anti-PD1 qui, en se fixant sur sa cible, interrompt la liaison avec son ligand PD-L1 et permet ainsi de restaurer l’activation du lymphocyte T et de détruire la cellule tumorale (fig. 3B). L’administration est intraveineuse, en perfusion courte d’une heure en hôpital de jour. La tolérance est très bonne, meilleure dans l’ensemble que celle rencontrée avec les médicaments ciblant la néo-angiogenèse.4 Des manifestations générales (fatigue, pics fébriles lors des perfusions) et spécifiques peuvent néanmoins survenir chez environ 10 % des patients, principalement cutanées (éruptions maculo- papuleuses), digestives (colites avec diarrhées), endocriniennes (hypothyroïdie, hyperthyroïdie, hypophysite), hépatiques (élévation asymptomatique des transaminases), pulmonaires (pneumopathie interstitielle) et cardiaques (myocardite). Ces effets indésirables peuvent nécessiter une prise en charge rapide dans la spécialité concernée en cas d’intensité sévère.
Stratégie thérapeutique
Les patients reçoivent successivement une ou plusieurs lignes de traitement, en fonction de la tolérance et du contrôle de la maladie. Chaque ligne de traitement ne comporte qu’un seul médicament dans la mesure où les associations développées jusqu’à présent n’ont pas montré d’augmentation d’efficacité et sont plus toxiques que les monothérapies.5 Le choix du médicament pour une ligne donnée repose sur l’indication de l’AMM (première ligne ou post-première ligne) et la décision du prescripteur (v. tableau). Chaque ligne de traitement est prolongée jusqu’à la progression de la maladie ou l’existence d’une toxicité limitante. En pratique, la première ligne de traitement est, en 2018, fondée sur un inhibiteur du VEGF-R, le pazo- panib ou le sunitinib selon le choix du prescripteur. La durée médiane d’efficacité est d’environ 11 mois. Une immunothérapie par nivolumab ou un autre inhibiteur du VEGF-R (l’axitinib ou le cabozantinib) peuvent être utilisés en deuxième ligne. D’autres médicaments (inhibiteur de mTOR ou inhibiteur du VEGF-R) sont encore disponibles pour les lignes ultérieures, si l’état général le permet. La durée d’efficacité de chaque ligne après l’utilisation du pazopanib et du sunitinib est beaucoup plus courte, de sorte que la médiane de survie globale d’un patient traité pour un cancer du rein métastatique à cellules claires est d’environ 2 ans. Les formes histologiques non à cellules claires (carcinomes papillaires, chromophobes…) sont traitées de manière similaire, mais avec des médianes d’efficacité attendues inférieures.Rappelons enfin que l’exérèse chirurgicale ou la destruction des métastases doivent être réalisées chaque fois que possible à la place ou en complément des traitements médicaux. Les meilleures indications sont représentées par les maladies d’évolution lente et de faible volume métastatique.
OPTIMISER LA PREMIÈRELIGNE DE TRAITEMENT
Le ciblage thérapeutique du microenvironnement tumoral a permis de réaliser des progrès dans la prise en charge puisque la médiane de survie des patients a doublé au cours des 15 dernières années. La recherche clinique se focalise actuellement sur l’optimisation de la première ligne de traitement (inhibiteur du VEGF-R ou immunothérapie ?) et les associations de médicaments ciblant l’infiltrat lymphocytaire.
Références
1. Keefe SM, Nathanson KL, Rathmell WK. The molecular biology of renal cell carcinoma. Semin Oncol 2013;40:412-8.
2. Alasker A, Meskawi M, Sun M, et al. A contemporary update on rates and management of toxicities of targeted therapies for metastatic renal cell carcinoma. Cancer Treat Rev 2013;39:388-401.
3. Atkins MB, Clark JI, Quinn DI. Immune checkpoint inhibitors in advanced renal cell carcinoma: experience to date and future directions. Ann Oncol 2017;28:1484-94.
4. Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 2015;26:2375-91.
5. Albiges L, Choueiri T, Escudier B, et al. A systematic review of sequencing and combinations of systemic therapy in metastatic renal cancer. Eur Urol 2015;67:100-10.
2. Alasker A, Meskawi M, Sun M, et al. A contemporary update on rates and management of toxicities of targeted therapies for metastatic renal cell carcinoma. Cancer Treat Rev 2013;39:388-401.
3. Atkins MB, Clark JI, Quinn DI. Immune checkpoint inhibitors in advanced renal cell carcinoma: experience to date and future directions. Ann Oncol 2017;28:1484-94.
4. Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 2015;26:2375-91.
5. Albiges L, Choueiri T, Escudier B, et al. A systematic review of sequencing and combinations of systemic therapy in metastatic renal cancer. Eur Urol 2015;67:100-10.