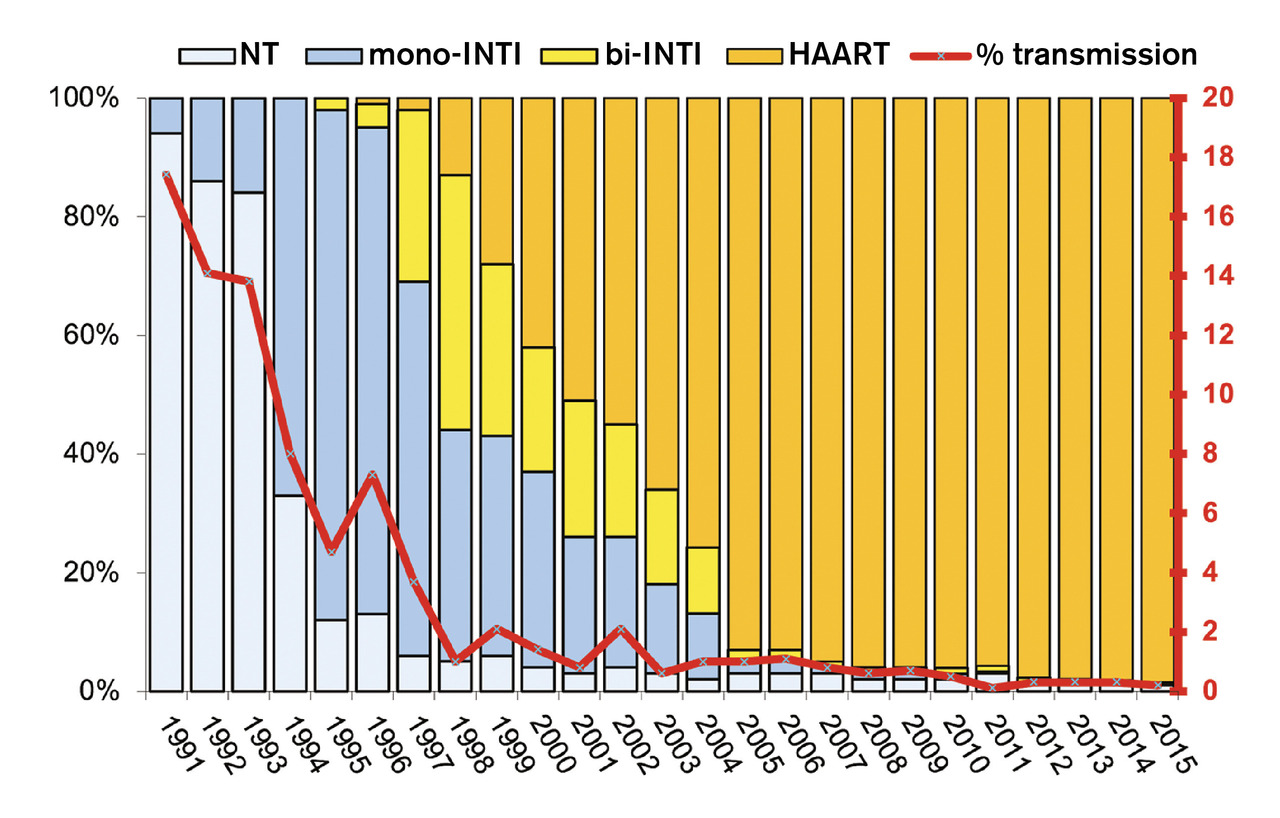
Un taux de transmission mère-enfant du VIH inférieur à 0,3 % en France
L’efficacité de la prévention est liée au succès virologique ; le facteur le plus déterminant pour éviter la TME est l’obtention d’une charge virale indétectable à l’accouchement. Ainsi, il semble qu’en France les échecs de la prévention soient moins des échecs du traitement que des échecs de prise en charge, comme les prises en charge tardives, les primo-infections en cours de grossesse, les refus de traitement (2 % des femmes). Enfin, même chez les femmes suivies et traitées pendant leur grossesse, quelques cas résiduels de transmission persistent. Les principaux facteurs de risque sont alors les défauts d’observance, un début de traitement tardif, un accouchement prématuré.2
Comment prendre en charge une femme enceinte vivant avec le VIH ?
Dans l’idéal, le traitement a été instauré avant la conception
Femmes non traitées avant la grossesse : débuter le traitement au plus vite
Une prise en charge tardive, en milieu de troisième trimestre ou plus tard, est une situation à haut risque, qui impose la mise en route rapide d’un traitement. Celui-ci peut être débuté immédiatement après le dépistage, en informant la patiente et sans attendre les résultats du bilan immuno-virologique. Une courte hospitalisation en maternité est parfois indiquée, non seulement pour accompagner au mieux la patiente mais aussi parce qu’un contexte de précarité sociale ou psychologique est souvent présent. Une trithérapie associant deux INTI et le darunavir/r intensifiée par raltégravir est recommandée. Des données ayant montré la supériorité des anti-intégrases par rapport aux inhibiteurs non nucléosidiques de la transcriptase inverse, en termes de rapidité de la décroissance virologique, on peut aussi envisager une trithérapie composée de deux INTI et du raltégravir ou du dolutégravir4, au-delà du premier trimestre de grossesse.
Modalités de suivi pendant la grossesse : pluridisciplinarité
Il faut surveiller le risque d’échappement virologique, de toxicité des antirétroviraux et d’accouchement prématuré. Des consultations mensuelles sont recommandées avec l’obstétricien, comportant un suivi biologique (
L’accompagnement thérapeutique à l’observance, des consultations avec une sage-femme, une psychologue et une assistante sociale doivent être proposés, selon les situations et les besoins. Les associations de patients peuvent apporter une aide importante. Les professionnels et les associations doivent encourager les femmes qui n’ont pas révélé leur séropositivité vis-à-vis du VIH à leur conjoint à le faire, et les soutenir dans cette démarche.
Que faire en cas de contrôle virologique insuffisant ?
Après évaluation des difficultés psychosociales susceptibles de compromettre la prise du traitement, et des problèmes éventuels de tolérance digestive (diarrhée, vomissements), il faut prescrire des dosages d’antirétroviraux, pour vérifier que leur concentration plasmatique est correcte, ainsi qu’un test génotypique de résistance. En fonction des résultats, le traitement maternel peut être modifié ou intensifié, en privilégiant une anti-intégrase. Le suivi ultérieur de la charge virale doit être rapproché. Si la tolérance orale est très mauvaise, l’ajout de l’enfuvirtide peut être intéressant dans certains cas, notamment pour faire contrôler l’administration par une infirmière.
Césarienne et zidovudine : la charge virale détermine les indications
En France, une césarienne est recommandée dès que la charge virale dépasse 400 copies ARN/mL. Ainsi, au cours du 8e mois, la mesure de la charge virale permet de décider de la conduite à tenir pour l’accouchement, au mieux en réunion de concertation multidisciplinaire.
Si, à 34-36 SA, elle est supérieure à 400 copies ARN/mL la femme doit recevoir une perfusion de zidovudine per partum, et la césarienne est systématique, autour de 38 SA. À l’inverse, une femme dont la charge virale est inférieure à 400 copies ARN/mL peut accoucher par voie basse et sans perfusion de zidovudine, sans augmenter son risque de transmission.
D’autres gestes obstétricaux restent contre-indiqués (pH au scalp, biopsie de trophoblaste) ou doivent être réalisés avec précaution, si possible quand la charge virale est contrôlée (amniocentèse, version par manœuvre externe, déclenchement du travail).
Les sociétés savantes françaises ne conseillent pas l’allaitement maternel
En France, la situation est différente : il n’existe pas de données permettant d’estimer la transmission du VIH par l’allaitement maternel, mais l’allaitement artificiel ne comporte pas de risque pour la santé de l’enfant. Les sociétés savantes françaises ne conseillent donc pas l’allaitement aux femmes infectées par le VIH.
Il est désormais conseillé de poursuivre le traitement antirétroviral après l’accouchement, quel que soit le statut immuno-virologique de la mère.
Adapter la prophylaxie néonatale
Dans certains cas à haut risque de TME (mère n’ayant pas reçu de traitement durant la grossesse, charge virale maternelle supérieure ou égale à 400 copies ARN/mL à l’accouchement), on propose de renforcer cette prophylaxie. Le nouveau-né à terme reçoit alors une association de zidovudine et de lamivudine pendant 4 semaines, combinée à la névirapine pendant 2 semaines.
Une réduction spectaculaire
Suivi biologique d’une femme enceinte infectée par le VIH-1 (rapport Morlat, 2018)
Examens standard de début de grossesse
groupe-Rh, RAI, sérologies hépatite B, hépatite C, syphilis, toxoplasmose et rubéole (si non documentées ou négatives antérieurement), glycémie à jeun.
À retrouver ou à réaliser si le traitement est débuté pendant la grossesse
bilan préthérapeutique complet comportant le nombre de lymphocytes cd4, l’ARN-VIH initial, un génotype de résistance viral aux antirétroviraux et une recherche de HLA-B*5701, dont la positivité contre-indique la prescription d’abacavir.
Suivi du traitement, à adapter selon les ARV, l’évaluation clinique et l’observance
mensuel : charge virale du VIH, NFS-plaquettes, transaminases, créatininémie, bandelette urinaire.
trimestriel : lymphocytes CD4.
au 6e mois (24-28 SA) : hyperglycémie provoquée par voie orale (75 g de glucose).
2. Mandelbrot L, Tubiana R, Le Chenadec J, Dollfus C, Faye A, Pannier E, et al. No perinatal HIV-1 transmission from women with effective antiretroviral therapy starting before conception. Clin Infect Dis. 2015;61(11):1715-25.
3. Morlat P, et al ; CNS, ANRS. Désir d’enfant et grossesse. In : Prise en charge médicale des personnes vivant avec le VIH. Recommandations du groupe d’experts. CNS ; 2018. Disponible sur : https://cns.sante.fr/actualites/prise-en-charge-du-vih-recommandations-du-groupe-dexperts/
4. Kintu K, Malaba TR, Nakibuka J, Papamichael C, Colbers A, Byrne K, et al. Dolutegravir versus efavirenz in women starting HIV therapy in late pregnancy (DolPHIN-2): an open-label, randomised controlled trial. Lancet HIV. 2020;7(5):e332-e9.
5. Briand N, Jasseron C, Sibiude J, Azria E, Pollet J, Hammou Y, et al. Cesarean section for HIV-infected women in the combination antiretroviral therapies era, 2000-2010. Am J Obstet Gynecol. 2013;209(4):335 e1- e12.
6. Nagot N, Kankasa C, Tumwine JK, Meda N, Hofmeyr GJ, Vallo R, et al. Extended pre-exposure prophylaxis with lopinavir-ritonavir versus lamivudine to prevent HIV-1 transmission through breastfeeding up to 50 weeks in infants in Africa (ANRS 12174): a randomized controlled trial. Lancet 2016;387:566-73.
Dans cet article
- Un taux de transmission mère-enfant du VIH inférieur à 0,3 % en France
- Comment prendre en charge une femme enceinte vivant avec le VIH ?
- Césarienne et zidovudine : la charge virale détermine les indications
- Les sociétés savantes françaises ne conseillent pas l’allaitement maternel
- Une réduction spectaculaire

 Encadrés
Encadrés